Гомоароматичность в органической химии относится к особому случаю ароматичности , в котором сопряжение прерывается одним sp 3 гибридизированным атомом углерода. Хотя этот sp 3 центр нарушает непрерывное перекрытие p-орбиталей , традиционно считающееся необходимым условием ароматичности, для таких соединений по-прежнему наблюдаются значительная термодинамическая стабильность и многие спектроскопические, магнитные и химические свойства, связанные с ароматическими соединениями. Этот формальный разрыв, по-видимому, перекрывается перекрытием p-орбиталей, поддерживая непрерывный цикл π-электронов, который отвечает за эту сохраненную химическую стабильность . [1]

Концепция гомоароматичности была впервые предложена Солом Винстейном в 1959 году под влиянием его исследований катиона «трис-гомоциклопропенил». [2] После публикации статьи Винстейна многие исследования были посвящены пониманию и классификации этих молекул, которые представляют собой дополнительный класс ароматических молекул, включенных в постоянно расширяющееся определение ароматичности.
На сегодняшний день известно, что гомоароматические соединения существуют в виде катионных и анионных видов, а некоторые исследования подтверждают существование нейтральных гомоароматических молекул, хотя они встречаются реже. [3] Катион «гомотропилия» (C 8 H 9 + ), возможно, является наиболее изученным примером гомоароматического соединения.
Термин «гомоароматичности» происходит от структурного сходства между гомоароматическими соединениями и аналогичными гомосопряженными алкенами, ранее наблюдавшимися в литературе. [2] Золотая книга ИЮПАК требует, чтобы префиксы бис-, трис- и т. д. использовались для описания гомоароматических соединений, в которых два, три и т. д. sp 3 -центра по отдельности прерывают сопряжение ароматической системы.
Концепция гомоароматичности берет свое начало в дебатах по поводу неклассических карбоний-ионов , которые произошли в 1950-х годах. Сол Винстейн , известный сторонник неклассической ионной модели, впервые описал гомоароматичность, изучая катион 3-бицикло[3.1.0]гексила.
В серии экспериментов по ацетолизу Винстейн и др. наблюдали, что реакция сольволиза эмпирически протекала быстрее, когда тозильная уходящая группа находилась в экваториальном положении. Группа приписала эту разницу в скоростях реакции анхимерной помощи , вызванной «цис»-изомером. Таким образом, этот результат подтвердил неклассическую структуру катиона. [4]
Винстейн впоследствии заметил, что эта неклассическая модель 3-бицикло[3.1.0]гексильного катиона аналогична ранее хорошо изученному ароматическому циклопропенильному катиону. Подобно циклопропенильному катиону, положительный заряд делокализован по трем эквивалентным атомам углерода, содержащим два π-электрона. Таким образом, эта электронная конфигурация удовлетворяет правилу Хюккеля (требующему 4n+2 π-электронов) для ароматичности. Действительно, Винстейн заметил, что единственное фундаментальное различие между этим ароматическим пропенильным катионом и его неклассическим гексильным катионом заключается в том, что в последнем ионе сопряжение прерывается тремя - CH
2- единицы . Таким образом, группа предложила название «трис-гомоциклопропенил» — трис-гомо аналог циклопропенильного катиона.
Критерий ароматичности развивался по мере того, как новые разработки и идеи продолжают вносить вклад в наше понимание этих удивительно стабильных органических молекул . [5] Требуемые характеристики этих молекул, таким образом, оставались предметом некоторых споров. Классически ароматические соединения определялись как плоские молекулы, которые обладают циклически делокализованной системой (4n+2)π электронов, удовлетворяющей правилу Хюккеля . Самое важное, что эти сопряженные кольцевые системы, как известно, демонстрируют огромную термохимическую стабильность относительно предсказаний, основанных на локализованных резонансных структурах. Три важные особенности, по-видимому, характеризуют ароматические соединения: [6]
Однако существует ряд исключений из этих общепринятых правил. Многие молекулы, включая виды электронов Мёбиуса 4nπ, перициклические переходные состояния , молекулы, в которых делокализованные электроны циркулируют в кольцевой плоскости или через σ (а не π ) связи, многие сэндвичевые молекулы переходных металлов и другие, считаются ароматическими, хотя они каким-то образом отклоняются от общепринятых параметров ароматичности. [7]
Следовательно, критерий гомоароматической делокализации остается таким же неоднозначным и несколько спорным. Катион гомотропилия (C 8 H 9 + ), хотя и не первый пример гомоароматического соединения, когда-либо обнаруженного, оказался наиболее изученным из соединений, классифицированных как гомоароматические, и поэтому часто считается классическим примером гомоароматичности. К середине 1980-х годов было сообщено о более чем 40 замещенных производных катиона гомотропилия, что отражает важность этого иона в формулировании нашего понимания гомоароматических соединений. [6]
После того, как Винстейн опубликовал первые сообщения о «гомоароматической» структуре для трис-гомоциклопропенильного катиона, многие группы начали сообщать о наблюдениях подобных соединений. Одной из наиболее изученных из этих молекул является катион гомотропилия, исходное соединение которого было впервые выделено в виде стабильной соли Петтитом и др. в 1962 году, когда группа провела реакцию циклооктатраена с сильными кислотами. [8] Большая часть ранних доказательств гомоароматичности исходит из наблюдений необычных свойств ЯМР, связанных с этой молекулой.
Характеризуя соединение, полученное в результате депротонирования циклооктатриена , с помощью спектроскопии ЯМР 1 H , группа обнаружила, что резонанс, соответствующий двум протонам, связанным с одним и тем же углеродом метиленового мостика, демонстрирует поразительную степень разделения в химическом сдвиге .
Из этого наблюдения Петтит и др. пришли к выводу, что классическая структура циклооктатриенильного катиона должна быть неверной. Вместо этого группа предложила структуру бицикло[5.1.0]октадиенильного соединения, предположив, что циклопропановая связь, расположенная внутри восьмичленного кольца, должна подвергаться значительной делокализации , тем самым объясняя резкое различие в наблюдаемом химическом сдвиге. При дальнейшем рассмотрении Петтит склонился к тому, чтобы представить соединение как «гомотропилиевый ион», который показывает, что «внутренняя циклопропановая» связь полностью заменена электронной делокализацией. Эта структура показывает, как делокализация является циклической и включает 6 π-электронов, что согласуется с правилом Хюккеля для ароматичности. Магнитное поле ЯМР, таким образом, может индуцировать кольцевой ток в ионе, ответственный за значительные различия в резонансе между экзо- и эндо-протонами этого метиленового мостика. Петтит и др. Таким образом, подчеркивается поразительное сходство между этим соединением и ароматическим ионом тропилия, что описывает новый «гомо-аналог» уже известного ароматического вида, как и предсказывал Винстейн.
Последующие исследования ЯМР, предпринятые Винстейном и другими, стремились оценить свойства комплексов карбонила металлов с ионом гомотропилия. Сравнение между комплексом молибдена и комплексом железа оказалось особенно плодотворным. Ожидалось, что трикарбонил молибдена будет координироваться с катионом гомотропилия, принимая 6 π-электронов, тем самым сохраняя гомоароматические особенности комплекса. Напротив, ожидалось, что трикарбонил железа будет координироваться с катионом, принимая только 4 π-электрона от иона гомотропилия, создавая комплекс, в котором электроны катиона локализованы. Исследования этих комплексов с помощью спектроскопии ЯМР 1 H показали большую разницу в значениях химического сдвига для метиленовых протонов комплекса Mo, что согласуется с гомоароматической структурой, но практически не обнаружили сопоставимой разницы в резонансе для тех же протонов в комплексе Fe. [9]
Важным ранним доказательством в поддержку структуры катиона гомотропилия, которая не опиралась на магнитные свойства молекулы, было получение ее УФ-спектра . Винстейн и др. определили, что максимумы поглощения для катиона гомотропилия демонстрируют значительно более короткую длину волны , чем можно было бы предсказать для классического циклооктатриенильного катиона или бицикло[5.1.0]октадиенильного соединения с полностью сформированной внутренней циклопропановой связью (и локализованной электронной структурой). Вместо этого УФ-спектр больше всего напоминал спектр ароматического иона тропилия . Дальнейшие расчеты позволили Винстейну определить, что порядок связи между двумя атомами углерода, соседствующими с внешним метиленовым мостиком, сопоставим с порядком π-связи, разделяющей соответствующие атомы углерода в катионе тропилия. [10] Хотя этот эксперимент оказался весьма информативным, УФ-спектры обычно считаются плохими индикаторами ароматичности или гомоароматичности. [6]
Совсем недавно была проделана работа по исследованию структуры предположительно гомоароматического иона гомотропилия с использованием различных других экспериментальных методов и теоретических расчетов. Одно ключевое экспериментальное исследование включало анализ замещенного иона гомотропилия с помощью рентгеновской кристаллографии . Эти кристаллографические исследования были использованы для демонстрации того, что межъядерное расстояние между атомами в основании структуры циклопропенила действительно больше, чем можно было бы ожидать для нормальной молекулы циклопропана , в то время как внешние связи кажутся короче, что указывает на участие внутренней связи циклопропана в делокализации заряда. [6]
Молекулярно-орбитальное объяснение стабильности гомоароматичности широко обсуждалось с многочисленными разнообразными теориями, в основном сосредоточенными на катионе гомотропенилия в качестве эталона. RC Haddon изначально предложил модель Мёбиуса , в которой внешние электроны sp 3 гибридизированного метиленового мостика углерода (2) отдают обратный донор соседним атомам углерода для стабилизации расстояния C1-C3. [11]
Гомоароматичность можно лучше объяснить с помощью теории молекулярных орбиталей возмущений (PMO), как описано в исследовании Роберта С. Хэддона 1975 года. Катион гомотропенилия можно рассматривать как возмущенную версию катиона тропенилия из-за добавления гомосопряженной связи, мешающей резонансу исходного катиона. [12]
Самым важным фактором, влияющим на гомоароматический характер, является добавление одной гомосопряженной связи в исходное ароматическое соединение. Расположение гомосопряженной связи не имеет значения, поскольку все гомоароматические виды могут быть получены из ароматических соединений, обладающих симметрией и одинаковым порядком связи между всеми атомами углерода. Вставка гомосопряженной связи возмущает π-электронную плотность на величину δβ, которая в зависимости от размера кольца должна быть больше 0 и меньше 1, где 0 представляет отсутствие возмущения, а 1 представляет полную потерю ароматичности (дестабилизация, эквивалентная форме открытой цепи). [12] Считается, что с увеличением размера кольца резонансная стабилизация гомоароматичности компенсируется напряжением при формировании гомосопряженного мостика. Фактически, максимальный размер кольца для гомоароматичности довольно низок, поскольку 16-членное аннулированное кольцо благоприятствует образованию ароматического дикатиона по сравнению с напряженным мостиковым гомокатионом. [13]
Значительным эффектом второго порядка на модель гомоароматичности Perturbation Molecular Orbital является добавление второй гомосопряженной связи и ее влияние на стабильность. Эффект часто заключается в удвоении нестабильности, вызванной добавлением одной гомосопряженной связи, хотя есть дополнительный член, который зависит от близости двух связей. Чтобы минимизировать δβ и, таким образом, свести к минимуму член связи, бисгомоароматические соединения образуются в зависимости от конформации наибольшей стабильности за счет резонанса и наименьшего стерического препятствия. Синтез катиона 1,3-бисгомотропенилия путем протонирования цис-бицикло[6.1.0]нона-2,4,6-триена согласуется с теоретическими расчетами и максимизирует стабильность за счет образования двух метиленовых мостиков на 1-м и 3-м атомах углерода. [12]
Добавление заместителя к гомоароматическому соединению оказывает большое влияние на стабильность соединения. В зависимости от относительного расположения заместителя и гомосопряженной связи заместитель может иметь либо стабилизирующий, либо дестабилизирующий эффект. Это взаимодействие лучше всего продемонстрировать, рассмотрев замещенный катион тропенилия. Если индуктивно электронодонорная группа присоединена к катиону в 1-м или 3-м положении углерода, она оказывает стабилизирующий эффект, улучшая гомоароматический характер соединения. Однако, если этот же заместитель присоединен ко 2-му или 4-му углероду, взаимодействие между заместителем в гомосопряженном мостике оказывает дестабилизирующий эффект. Поэтому протонирование метил- или фенилзамещенных циклооктатетраенов приведет к 1-изомеру катиона гомотропенилия. [12]
После открытия первых гомоароматических соединений исследования были направлены на синтез новых гомоароматических соединений, которые обладают схожей стабильностью с их ароматическими исходными соединениями. Существует несколько классов гомоароматических соединений, каждый из которых был предсказан теоретически и доказан экспериментально.
Наиболее устоявшиеся и известные гомоароматические виды — это катионные гомоароматические соединения. Как было сказано ранее, катион гомотропилия является одним из наиболее изученных гомоароматических соединений. Многие гомоароматические катионные соединения используют в качестве основы циклопропениловый катион, катион тропилия или дикатион циклобутадиена, поскольку эти соединения проявляют сильный ароматический характер. [14]
Помимо катиона гомотропилия, другим хорошо известным катионным гомоароматическим соединением является катион норборнен-7-ила, который, как было показано, является сильно гомоароматическим, что доказано как теоретически, так и экспериментально. [15]
Интригующий случай σ-бисгомоароматичности можно обнаружить в дикатионах пагоданов . В этих 4-центровых-2-электронных системах делокализация происходит в плоскости, которая определяется четырьмя атомами углерода (прототипом явления σ-ароматичности является циклопропан , который приобретает около 11,3 ккал моль −1 стабильности из-за эффекта [16] ). Дикатионы доступны либо через окисление пагодана, либо через окисление соответствующего бис-секо-додекаэдрадиена: [17]
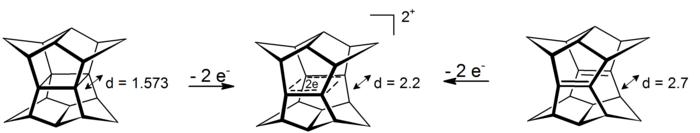
Восстановление соответствующих шестиэлектронных дианионов до сих пор не представлялось возможным.
Существует много классов нейтральных гомоароматических соединений, хотя ведутся жаркие споры о том, действительно ли они проявляют гомоароматический характер или нет.
Один класс нейтральных гомоароматических соединений называется моногомоароматическими соединениями, одним из которых является циклогептатриен, и были синтезированы многочисленные сложные моногомоароматические соединения. Одним из конкретных примеров является производное фуллероида с 60 атомами углерода , имеющее один метиленовый мостик. Анализы УФ и ЯМР показали, что ароматический характер этого модифицированного фуллероида не нарушается добавлением гомосопряженной связи, поэтому это соединение определенно является гомоароматическим. [18]
Замещенные нейтральные производные барбаралана (гомоаннулены) были раскрыты как стабильные гомоароматические молекулы в основном состоянии в 2023 году. Доказательства гомоароматического характера в этом классе молекул вытекают из анализа длины связей ( рентгеноструктурный анализ ), а также сдвигов в спектре ЯМР . [19] [20] Гомоаннулены также действуют как фотопереключатели, с помощью которых локальная 6π гомоароматичность может быть переключена на глобальную 10π гомоароматичность.

Долгое время считалось, что лучшими примерами нейтральных гомоароматических соединений являются бис-гомоароматические соединения, такие как баррелен и семибулвален. Впервые синтезированный в 1966 году [21] , семибулвален имеет структуру, которая должна хорошо подходить для гомоароматичности, хотя было много споров о том, могут ли производные семибулвалена обеспечить истинное делокализованное, нейтральное гомоароматическое соединение в основном состоянии или нет. В попытке дальнейшей стабилизации делокализованной переходной структуры путем замены семибулвалена на группы, отдающие и принимающие электроны , было обнаружено, что активационный барьер для этой перегруппировки может быть снижен, но не устранен. [22] [23] Однако с введением кольцевого напряжения в молекулу, направленного на дестабилизацию локализованных структур основного состояния посредством стратегического добавления циклических аннулирований, действительно может быть достигнута делокализованная гомоароматическая структура основного состояния. [24]
Из нейтральных гомоароматических соединений, соединения, которые, как полагают, лучше всего проявляют нейтральную гомоароматичность, — это борсодержащие соединения 1,2-диборетана и его производных. Показано, что замещенные диборетаны имеют гораздо большую стабилизацию в делокализованном состоянии по сравнению с локализованным, что дает сильные признаки гомоароматичности. [25] Когда электронодонорные группы присоединены к двум атомам бора, соединение предпочитает классическую модель с локализованными связями. Гомоароматический характер лучше всего проявляется, когда электроноакцепторные группы связаны с атомами бора, заставляя соединение принимать неклассическую, делокализованную структуру.
Как следует из названия, тришомоароматические соединения определяются как содержащие один дополнительный метиленовый мостик по сравнению с бишомоароматическими соединениями, следовательно, содержащие три гомосопряженных мостика в общей сложности. Как и в случае с семибулваленом, все еще ведутся споры о степени гомоароматичности тришомоароматических соединений. Хотя теоретически они являются гомоароматическими, эти соединения демонстрируют стабилизацию не более 5% бензола из-за делокализации. [26]
В отличие от нейтральных гомоароматических соединений, анионные гомоароматические соединения широко признаны демонстрирующими «истинную» гомоароматичность. Эти анионные соединения часто получают из их нейтральных исходных соединений путем восстановления металлического лития. Производные 1,2-диборетанида проявляют сильный гомоароматический характер через их трехатомную (бор, бор, углерод), двухэлектронную связь, которая содержит более короткие связи CB, чем в нейтральном классическом аналоге. [27] Эти 1,2-диборетаниды могут быть расширены до более крупных размеров кольца с различными заместителями, и все они содержат некоторую степень гомоароматичности.
Анионная гомоароматичность может также наблюдаться в дианионных бис-диазеновых соединениях, которые содержат четырехатомный (четыре азота) шестиэлектронный центр. Экспериментальные результаты показали сокращение трансаннулярного расстояния азот-азот, тем самым демонстрируя, что дианионный бис-диазен является типом анионного бис-гомоароматического соединения. Особенностью этих систем является то, что циклическая электронная делокализация происходит в σ-плоскости, определяемой четырьмя азотами. Таким образом, эти бис-диазен-дианионы являются первыми примерами 4-центровой-6-электронной σ-бигомоароматичности . [28] [29] Соответствующие 2-электронные σ-бигомоароматические системы были реализованы в форме пагодановых дикатионов (см. выше).
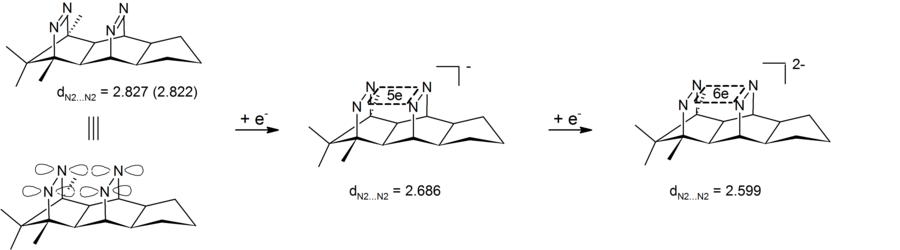
Также имеются сообщения об антигомоароматических соединениях. Так же, как ароматические соединения демонстрируют исключительную стабильность, антиароматические соединения, которые отклоняются от правила Хюккеля и содержат замкнутую петлю из 4n π-электронов, относительно нестабильны. Мостиковый катион бицикло[3.2.1]окта-3,6-диен-2-ил содержит только 4 π-электрона и, следовательно, является «бисгомоантиароматическим». Серия теоретических расчетов подтверждает, что он действительно менее стабилен, чем соответствующий аллильный катион. [30]
Аналогично, замещенный бицикло[3.2.1]окта-3,6-диен-2-ил катион (2-(4'-фторфенил)бицикло[3.2.1]окт-3,6-диен-2-ил катион) также показал себя антиароматом по сравнению с соответствующим ему аллильным катионом, что подтверждено теоретическими расчетами, а также анализом ЯМР. [30]