
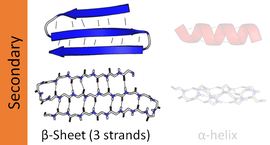

Бета -слой ( β-слой , также β-складчатый слой ) является распространенным мотивом вторичной структуры обычного белка . Бета-слои состоят из бета-нитей ( β-нитей ), соединенных латерально по крайней мере двумя или тремя водородными связями остова , образуя в целом скрученный, складчатый слой. β-нить представляет собой участок полипептидной цепи, обычно длиной от 3 до 10 аминокислот с остовом в расширенной конформации . Супрамолекулярная ассоциация β-слоев участвует в образовании фибрилл и белковых агрегатов, наблюдаемых при амилоидозе , болезни Альцгеймера и других протеинопатиях .

Первая структура β-слоя была предложена Уильямом Эстбери в 1930-х годах. Он предложил идею водородной связи между пептидными связями параллельных или антипараллельных протяженных β-цепей. Однако у Эстбери не было необходимых данных о геометрии связи аминокислот для построения точных моделей, тем более, что он тогда не знал, что пептидная связь является плоской. Усовершенствованная версия была предложена Лайнусом Полингом и Робертом Кори в 1951 году. Их модель включала планарность пептидной связи, которую они ранее объясняли как результат кето-енольной таутомеризации .
Большинство β-нитей расположены рядом с другими нитями и образуют обширную сеть водородных связей со своими соседями, в которой группы N−H в основной цепи одной цепи устанавливают водородные связи с группами C=O в основной цепи соседних нитей. В полностью вытянутой β-ните, последовательные боковые цепи направлены прямо вверх и прямо вниз в чередующемся порядке. Соседние β-нитеи в β-слое выровнены таким образом, что их атомы C α являются смежными, а их боковые цепи направлены в одном направлении. «Складчатый» вид β-нитей возникает из-за тетраэдрической химической связи у атома C α ; например, если боковая цепь направлена прямо вверх, то связи с C′ должны быть направлены немного вниз, поскольку ее угол связи составляет приблизительно 109,5°. Складчатость приводит к тому, что расстояние между Cα
яи Сα
i + 2быть приблизительно 6 Å (0,60 нм ), а не 7,6 Å (0,76 нм), ожидаемых от двух полностью вытянутых транс- пептидов . «Боковое» расстояние между соседними атомами C α в водородно-связанных β-цепях составляет приблизительно 5 Å (0,50 нм).

Однако β-тяжи редко бывают идеально вытянутыми; скорее, они демонстрируют скручивание. Энергетически предпочтительные двугранные углы вблизи ( φ , ψ ) = (–135°, 135°) (в широком смысле, верхняя левая область графика Рамачандрана ) значительно отклоняются от полностью вытянутой конформации ( φ , ψ ) = (–180°, 180°). [1] Скручивание часто связано с чередующимися флуктуациями двугранных углов , чтобы предотвратить расхождение отдельных β-тяжей в большем листе. Хороший пример сильно скрученной β-шпильки можно увидеть в белке BPTI .
Боковые цепи направлены наружу от складок, примерно перпендикулярно плоскости листа; последовательные аминокислотные остатки направлены наружу на чередующихся гранях листа.
Поскольку пептидные цепи имеют направленность, придаваемую их N-концом и C-концом , β-цепи также можно назвать направленными. Обычно они представлены на схемах топологии белка стрелкой, направленной к C-концу. Соседние β-цепи могут образовывать водородные связи в антипараллельном, параллельном или смешанном расположении.
В антипараллельном расположении последовательные β-цепи чередуют направления так, что N-конец одной цепи соседствует с C-концом следующей. Это расположение, которое обеспечивает самую сильную межцепочечную стабильность, поскольку оно позволяет межцепочечным водородным связям между карбонилами и аминами быть плоскими, что является их предпочтительной ориентацией. Двугранные углы пептидного остова ( φ , ψ ) составляют около (–140°, 135°) в антипараллельных листах. В этом случае, если два атома Cα
яи Сα
jсоседствуют в двух водородно-связанных β-цепях, затем они образуют две взаимные водородные связи основной цепи с фланговыми пептидными группами друг друга ; это известно как тесная пара водородных связей.
При параллельном расположении все N-концы последовательных нитей ориентированы в одном направлении; эта ориентация может быть немного менее стабильной, поскольку она вносит непланарность в схему водородных связей между нитями. Двугранные углы ( φ , ψ ) составляют около (–120°, 115°) в параллельных листах. Редко можно найти менее пяти взаимодействующих параллельных нитей в мотиве, что предполагает, что меньшее количество нитей может быть нестабильным, однако также принципиально сложнее образовывать параллельные β-слои, поскольку нити с выровненными N- и C-концами обязательно должны быть очень далеки в последовательности [ требуется ссылка ] . Также есть доказательства того, что параллельный β-слои может быть более стабильным, поскольку небольшие амилоидогенные последовательности, по-видимому, обычно агрегируют в фибриллы β-слоев, состоящие в основном из параллельных нитей β-слоев, где можно было бы ожидать антипараллельных фибрилл, если бы антипараллельные были более стабильны.
В параллельной β-слойной структуре, если два атома Cα
яи Сα
jсоседствуют в двух водородно-связанных β-цепях, то они не образуют водородных связей друг с другом; вместо этого один остаток образует водородные связи с остатками, которые фланкируют другой (но не наоборот). Например, остаток i может образовывать водородные связи с остатками j − 1 и j + 1; это известно как широкая пара водородных связей. Напротив, остаток j может образовывать водородные связи с разными остатками вообще или ни с одним.
Расположение водородных связей в параллельном бета-слое напоминает таковое в мотиве амидного кольца с 11 атомами.
Наконец, отдельная нить может демонстрировать смешанный паттерн связывания, с параллельной нитью с одной стороны и антипараллельной нитью с другой. Такие расположения встречаются реже, чем можно было бы предположить при случайном распределении ориентаций, что говорит о том, что этот паттерн менее стабилен, чем антипараллельное расположение, однако биоинформатический анализ всегда сталкивается с трудностями при извлечении структурной термодинамики, поскольку в целых белках всегда присутствуют многочисленные другие структурные особенности. Кроме того, белки по своей природе ограничены кинетикой сворачивания, а также термодинамикой сворачивания, поэтому всегда следует быть осторожным при выводе о стабильности из биоинформатического анализа.
Водородные связи β-цепей не обязательно должны быть идеальными, но могут иметь локальные нарушения, известные как β-выпуклости .
Водородные связи лежат примерно в плоскости листа, при этом карбонильные группы пептида направлены в чередующихся направлениях с последовательными остатками; для сравнения, последовательные карбонилы направлены в одном и том же направлении в альфа-спирали .
Крупные ароматические остатки ( тирозин , фенилаланин , триптофан ) и β-разветвленные аминокислоты ( треонин , валин , изолейцин ) предпочитают находиться в β-тяжах в середине β -слоев. Различные типы остатков (такие как пролин ) вероятно будут находиться в краевых тяжах β-слоев, предположительно, чтобы избежать ассоциации «край-к-краю» между белками, которая может привести к агрегации и образованию амилоида . [2]


Очень простой структурный мотив, включающий β-слои, — это β-шпилька , в которой две антипараллельные нити связаны короткой петлей из двух-пяти остатков, один из которых часто является глицином или пролином , оба из которых могут принимать двугранно-угловые конформации, необходимые для плотного поворота или петли β-выпуклости . Отдельные нити также могут быть связаны более сложными способами с более длинными петлями, которые могут содержать α-спирали .
Греческий ключевой мотив состоит из четырех соседних антипараллельных нитей и их соединительных петель. Он состоит из трех антипараллельных нитей, соединенных шпильками, в то время как четвертая примыкает к первой и связана с третьей более длинной петлей. Этот тип структуры легко образуется в процессе сворачивания белка . [3] [4] Он был назван в честь узора, распространенного в греческом орнаментальном искусстве (см. меандр ).
Из-за хиральности их составляющих аминокислот все нити демонстрируют правостороннюю закрутку, очевидную в большинстве структур β-слоя более высокого порядка. В частности, связующая петля между двумя параллельными нитями почти всегда имеет правостороннюю кроссоверную хиральность, которая в значительной степени поддерживается присущим ей закручиванием слоя. [5] Эта связующая петля часто содержит спиральную область, в этом случае она называется мотивом β-α-β. Близкородственный мотив, называемый мотивом β-α-β-α, образует основной компонент наиболее часто наблюдаемой третичной структуры белка , бочки TIM .


Простая супервторичная белковая топология, состоящая из двух или более последовательных антипараллельных β-нитей, связанных вместе шпильковыми петлями. [7] [8] Этот мотив распространен в β-слоях и может быть обнаружен в нескольких структурных архитектурах, включая β-бочки и β-пропеллеры .
Подавляющее большинство областей β-меандра в белках обнаружено упакованными против других мотивов или участков полипептидной цепи, образуя части гидрофобного ядра, которое канонически управляет образованием складчатой структуры. [9] Однако несколько заметных исключений включают варианты внешнего поверхностного белка A (OspA) [6] и однослойные белки β-листа (SLBP) [10] , которые содержат однослойные β-листы при отсутствии традиционного гидрофобного ядра. Эти богатые β белки характеризуются расширенными однослойными β-меандровыми β-листами, которые в первую очередь стабилизируются посредством межцепочечных взаимодействий и гидрофобных взаимодействий, присутствующих в областях поворота, соединяющих отдельные цепи.
Мотив пси-петли (Ψ-петля) состоит из двух антипараллельных нитей с одной нитью между ними, которая соединена с обеими водородными связями. [11] Существует четыре возможных топологии нитей для одиночных Ψ-петель. [12] Этот мотив встречается редко, поскольку процесс, приводящий к его образованию, вряд ли происходит во время сворачивания белка. Ψ-петля была впервые обнаружена в семействе аспарагиновых протеаз . [12]
β-слои присутствуют в доменах all-β , α+β и α/β , а также во многих пептидах или небольших белках с плохо определенной общей архитектурой. [13] [14] Домены all-β могут образовывать β-бочки , β-сэндвичи , β-призмы, β-пропеллеры и β-спирали .
Топология β-слоя описывает порядок водородно-связанных β-нитей вдоль остова. Например, флаводоксиновая складка имеет пятицепочечный параллельный β-слой с топологией 21345; таким образом , краевые нити — это β-нить 2 и β-нить 5 вдоль остова. Если выразить это явно, β-нить 2 связана водородной связью с β-нитью 1, которая связана водородной связью с β-нитью 3, которая связана водородной связью с β-нитью 4, которая связана водородной связью с β-нитью 5, другой краевой нитью. В той же системе греческий ключевой мотив, описанный выше, имеет топологию 4123. Вторичную структуру β-слоя можно грубо описать, указав количество нитей, их топологию и то, являются ли их водородные связи параллельными или антипараллельными.
β-слои могут быть открытыми , что означает, что они имеют две краевые нити (как в складке флаводоксина или складке иммуноглобулина ), или они могут быть закрытыми β-бочками (например, бочкой TIM ). β-Бочки часто описываются их шатанием или сдвигом . Некоторые открытые β-слои очень изогнуты и складываются сами на себя (как в домене SH3 ) или образуют подковообразную форму (как в ингибиторе рибонуклеазы ). Открытые β-слои могут собираться лицом к лицу (например, домен β-пропеллера или складка иммуноглобулина ) или край к краю, образуя один большой β-слои.
β-складчатые листовые структуры состоят из удлиненных β-нитевидных полипептидных цепей, в которых нити связаны с соседними цепями водородными связями . Благодаря этой удлиненной конформации остова β-листы устойчивы к растяжению . β-листы в белках могут осуществлять низкочастотное движение, подобное гармошке, как это наблюдается с помощью спектроскопии Рамана [15] и анализируется с помощью квазиконтинуальной модели. [16]

β -спираль образована из повторяющихся структурных единиц, состоящих из двух или трех коротких β-нитей, соединенных короткими петлями. Эти единицы «накладываются» друг на друга в спиральной форме, так что последовательные повторения одной и той же нити образуют водородные связи друг с другом в параллельной ориентации. Для получения дополнительной информации см. статью о β-спирали .
В левозакрученных β-спиралях сами нити довольно прямые и не скрученные; полученные спиральные поверхности почти плоские, образуя правильную треугольную призматическую форму, как показано для архейной карбоангидразы 1QRE справа. Другими примерами являются фермент синтеза липида А LpxA и антифризные белки насекомых с регулярным массивом боковых цепей Thr на одной стороне, которые имитируют структуру льда. [17]

Правосторонние β-спирали, типичным примером которых является фермент пектатлиаза , показанный слева, или белок хвостового шипа фага P22 , имеют менее регулярное поперечное сечение, более длинное и с отступом на одной из сторон; из трех линкерных петель одна последовательно имеет длину всего два остатка, а другие являются вариабельными, часто усложняясь для формирования связывающего или активного центра. [18]
Двусторонняя β-спираль (правосторонняя) обнаружена в некоторых бактериальных металлопротеазах ; ее две петли имеют длину шесть остатков каждая и связывают стабилизирующие ионы кальция для поддержания целостности структуры, используя остов и кислороды боковой цепи Asp мотива последовательности GGXGXD. [19] Эта складка называется β-рулоном в классификации SCOP.
Некоторые белки, которые неупорядочены или спиральны как мономеры, такие как амилоид β (см. амилоидная бляшка ), могут образовывать олигомерные структуры, богатые β-слоями, связанные с патологическими состояниями. Олигомерная форма белка амилоида β считается причиной болезни Альцгеймера . Его структура еще не определена полностью, но последние данные показывают, что она может напоминать необычную двухцепочечную β-спираль. [20]
Боковые цепи аминокислотных остатков, обнаруженные в структуре β-слоя, также могут быть расположены таким образом, что многие из соседних боковых цепей на одной стороне слоя являются гидрофобными, в то время как многие из тех, что соседствуют друг с другом на другой стороне слоя, являются полярными или заряженными (гидрофильными) [21] , что может быть полезно, если слой должен образовывать границу между полярной/водянистой и неполярной/жирной средами.
{{cite book}}: |journal=проигнорировано ( помощь )