В реакциях электрофильного ароматического замещения существующие группы - заместители в ароматическом кольце влияют на общую скорость реакции или оказывают направляющее влияние на позиционный изомер образующихся продуктов .
Электронодонорная группа ( EDG ) или электроновысвобождающая группа ( ERG , Z в структурных формулах) — это атом или функциональная группа , которая отдает часть своей электронной плотности сопряженной π-системе посредством резонанса (мезомерии) или индуктивных эффектов (или индукции) — называемые эффектами +M или +I соответственно, что делает π-систему более нуклеофильной . [1] [2] В результате этих электронных эффектов ароматическое кольцо , к которому присоединена такая группа, с большей вероятностью будет участвовать в реакции электрофильного замещения . Поэтому EDG часто называют активирующими группами , хотя стерические эффекты могут мешать реакции.
Электроноакцепторная группа (EWG) будет оказывать противоположное влияние на нуклеофильность кольца. EWG удаляет электронную плотность из π-системы, делая ее менее реакционноспособной в реакциях этого типа [2] [3] и поэтому называемой дезактивирующими группами .
EDG и EWG также определяют положения (относительно себя) в ароматическом кольце, где наиболее вероятны реакции замещения. Электронодонорные группы обычно являются орто-/пара-директорами электрофильных ароматических замещений , тогда как электроноакцепторные группы (за исключением галогенов ) обычно являются мета-директорами . Селективность, наблюдаемая с помощью EDG и EWG, была впервые описана в 1892 году и известна как правило Крама Брауна – Гибсона. [4]

Группы, отдающие электроны, обычно делятся на три уровня активирующей способности («крайнюю» категорию можно рассматривать как «сильную».) Группы, отдающие электроны, относят к аналогичным группам. Активирующие заместители способствуют электрофильному замещению в орто- и пара -положениях. Слабо дезактивирующие группы направляют электрофилы на атаку молекулы бензола в орто- и пара- положениях, тогда как сильно и умеренно дезактивирующие группы направляют атаку на мета- положение. [5] Это не случай предпочтения мета-позиции, такой как пара- и орто-направленные функциональные группы, а, скорее, невыгодное положение орто- и пара -позиций больше, чем мета -положение.
Активирующие группы в основном являются резонансными донорами (+М). Хотя многие из этих групп являются также индуктивно-акцепторными (–I), что является дезактивирующим эффектом, резонансный (или мезомерный) эффект почти всегда сильнее, за исключением Cl, Br и I.
В целом резонансное влияние элементов третьего периода и далее относительно слабое. Это происходит главным образом из-за относительно плохого перекрытия орбитали 3p-орбитали заместителя (или более высокой) с 2p-орбиталью углерода.
Из-за более сильного резонансного эффекта и индуктивного эффекта, чем у более тяжелых галогенов, фтор является аномальным. Парциальный коэффициент скорости электрофильного ароматического замещения фторбензола часто больше, чем коэффициент в пара -положении, что делает его активирующей группой. [11] И наоборот, он умеренно дезактивирован в орто- и мета- положениях из-за близости этих положений к электроотрицательному фторзаместителю.
Хотя все дезактивирующие группы удаляются индуктивно (–I), большинство из них также удаляются посредством резонанса (–M). Исключение составляют галогеновые заместители: они являются резонансными донорами (+М). За исключением галогенидов, они являются мета- направляющими группами.
Галогениды представляют собой орто- , пара- направляющие группы, но в отличие от большинства орто- , пара -направляющих, галогениды слегка дезактивируют арен. Такое необычное поведение можно объяснить двумя свойствами:
Индуктивные и резонансные свойства конкурируют друг с другом, но при управлении участками реактивности доминирует резонансный эффект. Например, при нитровании фтор сильно направляется в пара- положение, поскольку орто- положение индуктивно деактивируется (86% пара , 13% орто , 0,6% мета ). С другой стороны, йод сравнительно направляется в орто- и пара -позиции (54% пара и 45% орто , 1,3% мета ). [12]
Хотя полную электронную структуру арена можно вычислить только с помощью квантовой механики , о направляющем влиянии различных заместителей часто можно догадаться посредством анализа резонансных диаграмм.

В частности, любые формальные отрицательные или положительные заряды в второстепенных резонансных вкладчиках (соответствующих естественной поляризации, но не обязательно подчиняющихся правилу октетов ) отражают места, имеющие большую или меньшую плотность заряда на молекулярной орбитали для связи, которая с наибольшей вероятностью разорвется . Атом углерода с большим коэффициентом будет атакован преимущественно из-за более выгодного перекрытия орбиталей с электрофилом. [16]
Возмущение сопрягающей электроноакцепторной или электронодонорной группы приводит к тому, что распределение π-электронов на бензольном кольце напоминает ( очень незначительно !) электронодефицитный бензильный катион или электроноизбыточный бензильный анион соответственно. Последние виды допускают поддающиеся квантовому расчету с использованием теории Хюккеля : катион удаляет электронную плотность в орто- и пара -положениях, отдавая предпочтение метаатаке , тогда как анион высвобождает электронную плотность в те же позиции, активируя их для атаки. [17] Это именно тот результат, который можно было бы предсказать, рисуя резонансные структуры.
Например, анилин имеет резонансные структуры с отрицательными зарядами вокруг кольцевой системы:

Атака происходит в орто- и пара -положениях, поскольку (частичные) формальные отрицательные заряды в этих позициях указывают на локальный избыток электронов. С другой стороны, резонансные структуры нитробензола имеют положительные заряды вокруг кольцевой системы:
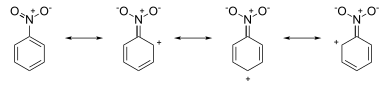
Атака происходит в мета- положении, поскольку (частичные) формальные положительные заряды в орто- и пара -положениях указывают на дефицит электронов в этих позициях.
Другой распространенный аргумент, который делает идентичные предсказания, рассматривает стабилизацию или дестабилизацию заместителями промежуточных продуктов Уиланда в результате электрофильной атаки в орто / пара- или мета -положениях. Затем постулат Хаммонда гласит, что относительные энергии переходного состояния будут отражать различия в энергиях основного состояния промежуточных продуктов Уиланда. [14] [18]
Из-за полного или частичного положительного заряда элемента, непосредственно прикрепленного к кольцу каждой из этих групп, все они обладают электроноакцепторным индуктивным эффектом от умеренного до сильного (известный как эффект -I). Они также демонстрируют эффекты электроноакцепторного резонанса (известные как эффект -M):

Таким образом, эти группы делают ароматическое кольцо очень бедным электронами (δ+) по сравнению с бензолом и, следовательно, сильно дезактивируют кольцо (т.е. реакции протекают гораздо медленнее в кольцах, несущих эти группы, по сравнению с реакциями в бензоле).
Из-за разницы в электроотрицательности между углеродом и кислородом/азотом будет наблюдаться небольшой эффект захвата электронов за счет индуктивного эффекта (известный как эффект –I). Однако другой эффект, называемый резонансом, возвращает электронную плотность кольцу (известный как эффект +M) и доминирует над индуктивным эффектом. Следовательно, в результате они являются EDG и орто / пара -директорами.
Фенол является орто-/пара-директором, но в присутствии основания реакция протекает быстрее. Это связано с более высокой реакционной способностью фенолят-аниона . Отрицательный кислород был «вынужден» придать электронную плотность атомам углерода (поскольку он имеет отрицательный заряд, он оказывает дополнительный эффект +I). Даже в холодном состоянии и с нейтральными (и относительно слабыми) электрофилами реакция все равно протекает быстро.

Алкильные группы являются электронодонорными группами. Углерод в нем гибридизован по sp3 и менее электроотрицательен, чем у тех, которые гибридизованы по sp2 . Они перекрывают связи углерод-водород (или связи углерод-углерод в таких соединениях, как трет -бутилбензол) с p-орбиталью кольца. Следовательно, они более реакционноспособны, чем бензол, и являются орто / пара -директорами.
Индуктивно отрицательно заряженный ион карбоксилата умеренно отталкивает электроны в связи, прикрепляющей его к кольцу. Таким образом, имеет место слабый электронодонорный +I-эффект. Эффект -M практически нулевой, поскольку электроноакцепторная резонансная способность карбонильной группы эффективно устраняется за счет делокализации отрицательного заряда аниона на кислороде. Таким образом, в целом карбоксилатная группа (в отличие от карбоксильной ) оказывает активирующее влияние. [10]

Эти группы обладают сильным электроноакцепторным индуктивным эффектом (-I) либо в силу своего положительного заряда, либо из-за сильной электроотрицательности галогенов. Эффекта резонанса нет, поскольку нет орбиталей или электронных пар, которые могли бы перекрываться с орбиталями кольца. Индуктивный эффект действует аналогично эффекту карбоксилат-аниона, но в противоположном направлении (т.е. он создает небольшие положительные заряды в орто- и пара- положениях, но не в мета- положении, и дестабилизирует промежуточное соединение Уиланда ). Следовательно, эти группы дезактивируют и мета- направляют :

В этих обстоятельствах фтор является чем-то вроде аномалии. Выше она описана как слабая электроноакцепторная группа, но это верно лишь отчасти. Верно, что фтор обладает эффектом -I, который приводит к индуктивному отводу электронов. Однако другой эффект, который играет роль, - это эффект +M, который возвращает электронную плотность обратно в бензольное кольцо (таким образом, оказывая эффект, противоположный эффекту -I, но по другому механизму). Это называется мезомерным эффектом (отсюда +M), и в случае фтора эффект +M примерно компенсирует эффект -I. Эффектом этого для фторбензола в пара- положении является реакционная способность, сравнимая с реакционной способностью бензола (или даже более высокая) . Поскольку индуктивные эффекты сильно зависят от близости, мета- и орто -положения фторбензола значительно менее реакционноспособны, чем бензол. Таким образом, электрофильное ароматическое замещение фторбензола является сильно параселективным .
Этот эффект -I и +M верен для всех галогенидов - каждый из них обладает некоторым электроноакцепторным и отдающим характером. Чтобы понять, почему происходят изменения реактивности, нам необходимо рассмотреть перекрытие орбит , происходящее в каждой из них. Валентные орбитали фтора - это 2p-орбитали, которые одинаковы для углерода - следовательно, они будут очень близки по энергии, и перекрытие орбиталей будет благоприятным. Хлор имеет валентные орбитали 3p, следовательно, энергии орбиталей будут дальше друг от друга, а геометрия будет менее благоприятной, что приведет к меньшему вкладу в стабилизацию карбокатионного промежуточного продукта, следовательно, хлорбензол менее реакционноспособен, чем фторбензол . Однако бромбензол и иодбензол примерно так же или немного более реакционноспособны, чем хлорбензол, поскольку, хотя резонансная отдача еще хуже, индуктивный эффект также ослаблен из-за их меньшей электроотрицательности. Таким образом, общий порядок реакционной способности имеет U-образную форму с минимумом при хлорбензоле/бромбензоле (относительная скорость нитрования по сравнению с бензолом = 1 в скобках): PhF (0,18) > PhCl (0,064) ~ PhBr (0,060) < PhI (0,12). . [12] Однако все галогенбензолы реагируют медленнее, чем сам бензол.
Обратите внимание, что йодбензол все еще менее реакционноспособен, чем фторбензол, поскольку поляризуемость также играет роль. Это также может объяснить, почему фосфор в фосфанах не может отдавать электронную плотность углероду посредством индукции (т.е. эффект +I), хотя он менее электроотрицательен, чем углерод (2,19 против 2,55, см. список электроотрицательности ), и почему иодистоводородная кислота ( pKa = -10) значительно более кислая, чем плавиковая кислота (pKa = 3). (Это в 10–13 раз более кислая, чем плавиковая кислота)
Благодаря неподеленной паре электронов галогенные группы доступны для отдачи электронов. Следовательно, они являются орто / парадиректорами .
Из-за разницы в электроотрицательности углерода и азота нитрозогруппа оказывает относительно сильный -I-эффект, но не такой сильный, как нитрогруппа. (Положительно заряженные атомы азота на катионах алкиламмония и на нитрогруппах оказывают гораздо более сильный -I-эффект)
Нитрозогруппа оказывает как +М, так и -М эффект, но эффект -М более благоприятный.
Азот имеет неподеленную пару электронов. Однако неподеленная пара его мономерной формы неблагоприятна для отдачи в результате резонанса. Для эффекта +M доступна только димерная форма. Однако димерная форма менее стабильна в растворе. Следовательно, нитрозогруппа менее доступна для отдачи электронов.
И наоборот, удаление электронной плотности более выгодно: (см. Рисунок справа).
.jpg/440px-Nitrosobenzene_resonance_(by_pi_bonds).jpg)
В результате нитрозогруппа является дезактиватором. Тем не менее, он может жертвовать электронную плотность бензольному кольцу во время промежуточного соединения Уиланда , что делает его по-прежнему орто- / пара- директором .
У бензола есть 2 орто -положения, 2 мета- положения и 1 пара- положение, когда к нему присоединена группа. Когда группа является орто-/пара- директором, причем орто- и пара -позиции реагируют с одним и тем же коэффициентом частичной скорости, из-за этого статистического эффекта мы ожидаем вдвое больше орто- продукта, чем пара- продукта. Однако коэффициенты частичной скорости в орто- и пара -положениях обычно не равны. Например, в случае фтористого заместителя коэффициент частичной орто- скорости намного меньше, чем пара- , из-за более сильного индуктивного эффекта удаления в орто- положении. Помимо этих эффектов, часто существует также стерический эффект из-за увеличения стерических препятствий в орто- положении, но не в пара- положении, что приводит к увеличению количества пара- продукта.
Эффект проиллюстрирован на примере электрофильных ароматических замещений алкильными заместителями с различной стерической потребностью при электрофильном ароматическом нитровании. [19]
Метильная группа в толуоле небольшая, поэтому основным продуктом является орто- продукт. С другой стороны, т -бутильная группа очень объемна (к одному атому углерода присоединены 3 метильные группы) и будет считать пара- продукт основным. Даже с толуолом продукт не имеет соотношения 2:1, а имеет немного меньшее количество орто- продукта.
Когда в кольце уже присутствуют два заместителя, новое расположение третьего заместителя относительно предсказуемо. Если существующие заместители усиливают или молекула обладает высокой симметрией, не может быть никакой двусмысленности. В противном случае: [20]




{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка ){{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ) CS1 maint: несколько имен: список авторов ( ссылка ){{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )