Температура — физическая величина , количественно выражающая свойство тепла или холода. Температура измеряется термометром . Она отражает среднюю кинетическую энергию колеблющихся и сталкивающихся атомов , составляющих вещество.
Термометры калибруются по различным температурным шкалам , которые исторически опирались на различные опорные точки и термометрические вещества для определения. Наиболее распространенными шкалами являются шкала Цельсия с символом единицы °C (ранее называвшаяся стоградусной ), шкала Фаренгейта (°F) и шкала Кельвина (K), последняя используется преимущественно в научных целях. Кельвин является одной из семи основных единиц в Международной системе единиц (СИ).
Абсолютный ноль , т. е. ноль кельвинов или −273,15 °C, является самой низкой точкой в термодинамической шкале температур . Экспериментально к нему можно приблизиться очень близко, но фактически не достичь, как признано в третьем законе термодинамики . Было бы невозможно извлечь энергию в виде тепла из тела при такой температуре.
Температура важна во всех областях естественных наук , включая физику , химию , науки о Земле , астрономию , медицину , биологию , экологию , материаловедение , металлургию , машиностроение и географию , а также в большинстве аспектов повседневной жизни.
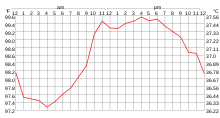
Многие физические процессы связаны с температурой; некоторые из них приведены ниже:
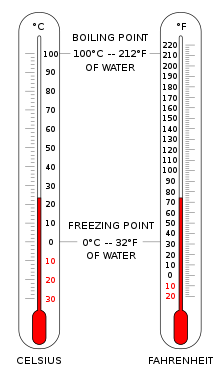
Для определения температурной шкалы необходимы два значения: точка, выбранная за ноль градусов, и величина приращения единицы температуры.
Шкала Цельсия (°C) используется для общих измерений температуры в большинстве стран мира. Это эмпирическая шкала, которая развивалась исторически, что привело к ее нулевой точке0 °C определяется как точка замерзания воды , и100 °C как точка кипения воды, как при атмосферном давлении на уровне моря. Она была названа стоградусной шкалой из-за интервала в 100 градусов. [3] После стандартизации кельвина в Международной системе единиц она впоследствии была переопределена в терминах эквивалентных точек фиксации на шкале Кельвина, так что приращение температуры на один градус Цельсия равно приращению на один кельвин, хотя численно шкалы различаются на точное смещение в 273,15.
Шкала Фаренгейта широко используется в Соединенных Штатах. Вода замерзает при32 °F и кипит при212 °F при атмосферном давлении на уровне моря.
При абсолютном нуле температуры никакая энергия не может быть удалена из материи в виде тепла, факт, выраженный в третьем законе термодинамики . При этой температуре материя не содержит макроскопической тепловой энергии, но все еще имеет квантово-механическую нулевую энергию , как предсказывает принцип неопределенности , хотя это не входит в определение абсолютной температуры. Экспериментально к абсолютному нулю можно приблизиться только очень близко; он никогда не может быть достигнут (самая низкая температура, достигнутая экспериментально, составляет 38 пК). [4] Теоретически, в теле при температуре абсолютного нуля все классическое движение его частиц прекращается, и они находятся в полном покое в этом классическом смысле. Абсолютный ноль, определяемый как0 K , в точности равно−273,15 °С , или−459,67 °F .
Ссылаясь на постоянную Больцмана , распределение Максвелла–Больцмана и статистическое механическое определение энтропии Больцмана , в отличие от определения Гиббса [5] для независимо движущихся микроскопических частиц, без учета межчастичной потенциальной энергии, по международному соглашению шкала температур определяется и называется абсолютной, поскольку она не зависит от характеристик конкретных термометрических веществ и механизмов термометра . Помимо абсолютного нуля, она не имеет эталонной температуры. Она известна как шкала Кельвина , широко используемая в науке и технике. Кельвин (название единицы пишется со строчной буквы «к») является единицей температуры в Международной системе единиц (СИ). Температура тела в состоянии термодинамического равновесия всегда положительна относительно абсолютного нуля.
Помимо международно признанной шкалы Кельвина, существует также термодинамическая температурная шкала , изобретенная лордом Кельвином , также с ее числовым нулем при абсолютном нуле температуры, но напрямую связанная с чисто макроскопическими термодинамическими концепциями, включая макроскопическую энтропию , хотя микроскопически соотносимую со статистическо-механическим определением энтропии Гиббса для канонического ансамбля , которая учитывает межчастичную потенциальную энергию, а также независимое движение частиц, так что она может учитывать измерения температур вблизи абсолютного нуля. [5] Эта шкала имеет опорную температуру в тройной точке воды, численное значение которой определяется измерениями с использованием вышеупомянутой международно признанной шкалы Кельвина.
Многие научные измерения используют температурную шкалу Кельвина (символ единицы: К), названную в честь физика, который впервые ее определил . Это абсолютная шкала. Ее числовая нулевая точка,0 K — это абсолютный ноль температуры. С мая 2019 года кельвин определяется с помощью кинетической теории частиц и статистической механики. В Международной системе единиц (СИ) величина кельвина определяется через постоянную Больцмана , значение которой определяется как фиксированное международным соглашением. [6] [7]
С мая 2019 года величина кельвина определяется по отношению к микроскопическим явлениям, характеризуемым в терминах статистической механики. Ранее, но с 1954 года, Международная система единиц определила шкалу и единицу для кельвина как термодинамической температуры , используя надежно воспроизводимую температуру тройной точки воды в качестве второй точки отсчета, причем первой точкой отсчета является0 К при абсолютном нуле. [ необходима цитата ]
Исторически температура тройной точки воды была определена как ровно 273,16 К. Сегодня это эмпирически измеренная величина. Температура замерзания воды при атмосферном давлении на уровне моря находится очень близко к273,15 К (0 °С ).
Существуют различные виды температурных шкал. Может быть удобно классифицировать их как эмпирически и теоретически обоснованные. Эмпирические температурные шкалы исторически старше, тогда как теоретически обоснованные шкалы возникли в середине девятнадцатого века. [8] [9]
Эмпирически обоснованные температурные шкалы напрямую опираются на измерения простых макроскопических физических свойств материалов. Например, длина столба ртути, заключенного в стеклянной капиллярной трубке, в значительной степени зависит от температуры и является основой очень полезного ртутно-стеклянного термометра. Такие шкалы действительны только в удобных диапазонах температур. Например, выше точки кипения ртути ртутно-стеклянный термометр неприменим. Большинство материалов расширяются с повышением температуры, но некоторые материалы, такие как вода, сжимаются с повышением температуры в некотором определенном диапазоне, и тогда они вряд ли полезны в качестве термометрических материалов. Материал бесполезен в качестве термометра вблизи одной из своих температур фазового перехода, например, своей точки кипения.
Несмотря на эти ограничения, большинство обычно используемых практических термометров являются эмпирически обоснованными. В частности, они использовались для калориметрии , которая внесла большой вклад в открытие термодинамики. Тем не менее, эмпирическая термометрия имеет серьезные недостатки, если рассматривать ее как основу для теоретической физики. Эмпирически обоснованные термометры, помимо своей основы в виде простых прямых измерений обычных физических свойств термометрических материалов, могут быть повторно откалиброваны с использованием теоретических физических рассуждений, и это может расширить диапазон их адекватности.
Теоретически обоснованные температурные шкалы основаны непосредственно на теоретических аргументах, особенно на аргументах кинетической теории и термодинамики. Они более или менее идеально реализуются в практически осуществимых физических устройствах и материалах. Теоретически обоснованные температурные шкалы используются для предоставления калибровочных стандартов для практических эмпирически обоснованных термометров.
В физике общепринятая на международном уровне температурная шкала называется шкалой Кельвина. Она калибруется с помощью общепринятого на международном уровне и предписанного значения постоянной Больцмана, [6] [7] относящейся к движениям микроскопических частиц, таких как атомы, молекулы и электроны, составляющих тело, температура которого должна быть измерена. В отличие от термодинамической температурной шкалы, изобретенной Кельвином, общепринятая в настоящее время температура Кельвина не определяется ни путем сравнения с температурой исходного состояния стандартного тела, ни в терминах макроскопической термодинамики.
Помимо абсолютного нуля температуры, температура Кельвина тела в состоянии внутреннего термодинамического равновесия определяется измерениями соответствующим образом выбранных его физических свойств, таких, которые имеют точно известные теоретические объяснения в терминах постоянной Больцмана . [ требуется ссылка ] Эта константа относится к выбранным видам движения микроскопических частиц в составе тела. В этих видах движения частицы движутся индивидуально, без взаимного взаимодействия. Такие движения обычно прерываются столкновениями между частицами, но для измерения температуры движения выбираются таким образом, чтобы между столкновениями невзаимодействующие сегменты их траекторий были известны как доступные для точного измерения. Для этой цели потенциальная энергия между частицами не учитывается.
В идеальном газе и других теоретически понятых телах температура Кельвина определяется как пропорциональная средней кинетической энергии неинтерактивно движущихся микроскопических частиц, которую можно измерить подходящими методами. Константа пропорциональности является простым кратным постоянной Больцмана. Если молекулы, атомы или электроны [10] [11] испускаются из материала и измеряются их скорости, спектр их скоростей часто почти подчиняется теоретическому закону, называемому распределением Максвелла-Больцмана , что дает хорошо обоснованное измерение температур, для которых этот закон выполняется. [12] Пока еще не было успешных экспериментов такого рода, которые напрямую используют распределение Ферми-Дирака для термометрии, но, возможно, это будет достигнуто в будущем. [13]
Скорость звука в газе может быть теоретически рассчитана из молекулярного характера газа, температуры, давления и постоянной Больцмана. Для газа с известным молекулярным характером и давлением это обеспечивает связь между температурой и постоянной Больцмана. Эти величины могут быть известны или измерены точнее, чем термодинамические переменные, которые определяют состояние образца воды в его тройной точке. Следовательно, принимая значение постоянной Больцмана в качестве первично определенного эталона точно определенного значения, измерение скорости звука может обеспечить более точное измерение температуры газа. [14]
Измерение спектра электромагнитного излучения идеального трехмерного черного тела может обеспечить точное измерение температуры, поскольку частота максимальной спектральной яркости излучения черного тела прямо пропорциональна температуре черного тела; это известно как закон смещения Вина и имеет теоретическое объяснение в законе Планка и законе Бозе-Эйнштейна .
Измерение спектра мощности шума, производимого электрическим резистором, также может обеспечить точное измерение температуры. Резистор имеет два вывода и фактически является одномерным телом. Закон Бозе-Эйнштейна для этого случая указывает, что мощность шума прямо пропорциональна температуре резистора, значению его сопротивления и ширине полосы шума. В заданной полосе частот мощность шума имеет равные вклады от каждой частоты и называется шумом Джонсона . Если значение сопротивления известно, то можно найти температуру. [15] [16]
Исторически, до мая 2019 года, определение шкалы Кельвина было тем, которое придумал Кельвин, основанное на соотношении количеств энергии в процессах в идеальном двигателе Карно, полностью в терминах макроскопической термодинамики. [ требуется ссылка ] Этот двигатель Карно должен был работать между двумя температурами, температурой тела, температура которого должна была измеряться, и эталонной температурой тела при температуре тройной точки воды. Затем эталонная температура, температура тройной точки, была определена как точно273,16 К. С мая 2019 года это значение не зафиксировано по определению, а должно измеряться посредством микроскопических явлений, включающих постоянную Больцмана, как описано выше. Микроскопическое статистическое механическое определение не имеет референтной температуры.
Материалом, на котором может быть основана макроскопически определенная температурная шкала, является идеальный газ . Давление, оказываемое фиксированным объемом и массой идеального газа, прямо пропорционально его температуре. Некоторые природные газы демонстрируют настолько близкие к идеальным свойства в подходящем диапазоне температур, что их можно использовать для термометрии; это было важно во время развития термодинамики и по-прежнему имеет практическое значение сегодня. [17] [18] Однако термометр идеального газа теоретически не идеален для термодинамики. Это связано с тем, что энтропия идеального газа при его абсолютном нуле температуры не является положительной полуопределенной величиной, что ставит газ в нарушение третьего закона термодинамики. В отличие от реальных материалов, идеальный газ не сжижается и не затвердевает, независимо от того, насколько он холоден. Альтернативно думая, закон идеального газа относится к пределу бесконечно высокой температуры и нулевого давления; эти условия гарантируют неинтерактивные движения составляющих его молекул. [19] [20] [21]
Величина кельвина теперь определяется в терминах кинетической теории, выведенной из значения постоянной Больцмана .
Кинетическая теория дает микроскопическое описание температуры для некоторых тел, особенно газов, основанное на том, что макроскопические системы состоят из множества микроскопических частиц, таких как молекулы и ионы различных видов, причем частицы одного вида все одинаковы. Она объясняет макроскопические явления с помощью классической механики микроскопических частиц. Теорема о равнораспределении кинетической теории утверждает, что каждая классическая степень свободы свободно движущейся частицы имеет среднюю кинетическую энергию k B T /2 , где k B обозначает постоянную Больцмана . [ необходима цитата ] Поступательное движение частицы имеет три степени свободы, так что, за исключением очень низких температур, где преобладают квантовые эффекты, средняя поступательная кинетическая энергия свободно движущейся частицы в системе с температурой T будет равна 3 k B T /2 .
Молекулы, такие как кислород (O 2 ), имеют больше степеней свободы , чем отдельные сферические атомы: они совершают вращательные и колебательные движения, а также трансляции. Нагревание приводит к повышению температуры из-за увеличения средней поступательной кинетической энергии молекул. Нагревание также приведет к тому, что посредством равнораспределения увеличится энергия, связанная с колебательными и вращательными модами. Таким образом, двухатомный газ потребует больше энергии для повышения своей температуры на определенную величину, т. е. он будет иметь большую теплоемкость, чем одноатомный газ.
Как отмечено выше, скорость звука в газе можно рассчитать из молекулярного характера газа, температуры, давления и постоянной Больцмана. Принимая значение постоянной Больцмана в качестве первично определенной точки отсчета точно определенного значения, измерение скорости звука может обеспечить более точное измерение температуры газа. [14]
Можно измерить среднюю кинетическую энергию составляющих микроскопических частиц, если им позволить вырваться из основной массы системы через небольшое отверстие в удерживающей стенке. Необходимо измерить спектр скоростей и рассчитать из него среднее значение. Не обязательно, что частицы, которые вырываются и измеряются, имеют такое же распределение скоростей, как и частицы, которые остаются в основной массе системы, но иногда хороший образец возможен.
Температура является одной из основных величин в изучении термодинамики . Раньше величина кельвина определялась в термодинамических терминах, но в настоящее время, как упоминалось выше, она определяется в терминах кинетической теории.
Термодинамическая температура считается абсолютной по двум причинам. Одна из них заключается в том, что ее формальный характер не зависит от свойств конкретных материалов. Другая причина заключается в том, что ее ноль в некотором смысле абсолютен, поскольку он указывает на отсутствие микроскопического классического движения составных частиц материи, так что они имеют предельную удельную теплоемкость, равную нулю, для нулевой температуры, согласно третьему закону термодинамики. Тем не менее, термодинамическая температура на самом деле имеет определенное численное значение, которое было произвольно выбрано традицией и зависит от свойств конкретных материалов; она просто менее произвольна, чем относительные «градусные» шкалы, такие как Цельсия и Фаренгейта . Будучи абсолютной шкалой с одной фиксированной точкой (нулем), для произвольного выбора остается только одна степень свободы, а не две, как в относительных шкалах. Для шкалы Кельвина с мая 2019 года по международной конвенции был сделан выбор в пользу использования знаний о режимах работы различных термометрических приборов, опираясь на микроскопические кинетические теории о молекулярном движении. Числовая шкала устанавливается с помощью общепринятого определения значения постоянной Больцмана , которая связывает макроскопическую температуру со средней микроскопической кинетической энергией частиц, таких как молекулы. Ее численное значение произвольно, и существует альтернативная, менее широко используемая абсолютная температурная шкала, называемая шкалой Ранкина , которая согласована со шкалой Фаренгейта, как Кельвин со шкалой Цельсия.
Термодинамическое определение температуры принадлежит Кельвину. Оно сформулировано в терминах идеализированного устройства, называемого двигателем Карно , которое воображается работающим в фиктивном непрерывном цикле последовательных процессов , которые проходят цикл состояний его рабочего тела. Двигатель принимает количество тепла Q 1 из горячего резервуара и передает меньшее количество отработанного тепла Q 2 < 0 в холодный резервуар. Чистая тепловая энергия, поглощаемая рабочим телом, передается в качестве термодинамической работы в рабочий резервуар и считается выходом двигателя. Цикл воображается протекающим настолько медленно, что в каждой точке цикла рабочее тело находится в состоянии термодинамического равновесия. Таким образом, последовательные процессы цикла воображаются протекающими обратимо без производства энтропии . Тогда количество энтропии, поглощаемое из горячего резервуара при нагревании рабочего тела, равно количеству энтропии, передаваемому в холодный резервуар при охлаждении рабочего тела. Тогда абсолютные или термодинамические температуры T 1 и T 2 резервуаров определяются таким образом, что [22]
Нулевой закон термодинамики позволяет использовать это определение для измерения абсолютной или термодинамической температуры произвольного интересующего тела, заставляя другой резервуар тепла иметь ту же температуру, что и интересующее тело.
Оригинальная работа Кельвина, постулирующая абсолютную температуру, была опубликована в 1848 году. Она была основана на работе Карно, до формулировки первого закона термодинамики. У Карно не было четкого понимания тепла и конкретной концепции энтропии. Он писал о «тепле» и говорил, что вся теплота, которая прошла из горячего резервуара, была передана в холодный резервуар. Кельвин написал в своей статье 1848 года, что его шкала была абсолютной в том смысле, что она была определена «независимо от свойств любого конкретного вида материи». Его окончательная публикация, в которой изложено только что приведенное определение, была напечатана в 1853 году, статья была прочитана в 1851 году. [23] [24] [25] [26]
Ранее числовые данные устанавливались путем создания одного из резервуаров тепла в виде ячейки в тройной точке воды, которая, как было определено, имела абсолютную температуру 273,16 К. [27] В настоящее время численное значение вместо этого получается путем измерения с помощью микроскопического статистического механического международного определения, как указано выше.
В термодинамических терминах температура является интенсивной переменной , поскольку она равна дифференциальному коэффициенту одной экстенсивной переменной по отношению к другой для данного тела. Таким образом, она имеет размерность отношения двух экстенсивных переменных. В термодинамике два тела часто рассматриваются как связанные посредством контакта с общей стенкой, которая имеет некоторые специфические свойства проницаемости. Такая специфическая проницаемость может быть отнесена к специфической интенсивной переменной. Примером является диатермическая стенка, которая проницаема только для тепла; интенсивной переменной для этого случая является температура. Когда два тела были соединены через специфически проницаемую стенку в течение очень длительного времени и установились в постоянном устойчивом состоянии, соответствующие интенсивные переменные равны в двух телах; для диатермической стенки это утверждение иногда называют нулевым законом термодинамики. [28] [29] [30]
В частности, когда тело описывается путем указания его внутренней энергии U , экстенсивной переменной, как функции его энтропии S , также экстенсивной переменной, и других переменных состояния V , N , причем U = U ( S , V , N ), то температура равна частной производной внутренней энергии по энтропии: [29] [30] [31]
Аналогично, когда тело описывается путем указания его энтропии S как функции его внутренней энергии U и других переменных состояния V , N , причем S = S ( U , V , N ) , то обратная величина температуры равна частной производной энтропии по внутренней энергии: [29] [31] [32]
Вышеуказанное определение, уравнение (1) абсолютной температуры, принадлежит Кельвину. Оно относится к системам, закрытым для переноса материи, и имеет особый акцент на непосредственно экспериментальных процедурах. Представление термодинамики Гиббсом начинается на более абстрактном уровне и имеет дело с системами, открытыми для переноса материи; в этом развитии термодинамики уравнения (2) и (3) выше фактически являются альтернативными определениями температуры. [33]
Реальные тела часто не находятся в термодинамическом равновесии и не являются однородными. Для изучения методами классической необратимой термодинамики тело обычно пространственно и временно делится концептуально на «ячейки» небольшого размера. Если в такой «ячейке» с хорошим приближением выполняются классические условия термодинамического равновесия для материи, то она однородна и для нее существует температура. Если это так для каждой «ячейки» тела, то говорят, что локальное термодинамическое равновесие преобладает во всем теле. [34] [35] [36] [37] [38]
Например, имеет смысл сказать об экстенсивной переменной U или об экстенсивной переменной S , что она имеет плотность на единицу объема или количество на единицу массы системы, но не имеет смысла говорить о плотности температуры на единицу объема или количестве температуры на единицу массы системы. С другой стороны, не имеет смысла говорить о внутренней энергии в точке, в то время как при преобладании локального термодинамического равновесия имеет смысл говорить о температуре в точке. Следовательно, температура может меняться от точки к точке в среде, которая не находится в глобальном термодинамическом равновесии, но в которой есть локальное термодинамическое равновесие.
Таким образом, когда в теле преобладает локальное термодинамическое равновесие, температуру можно рассматривать как пространственно изменяющееся локальное свойство этого тела, и это происходит потому, что температура является интенсивной переменной.
Температура является мерой качества состояния материала. [39] Качество может рассматриваться как более абстрактная сущность, чем любая конкретная температурная шкала, которая его измеряет, и некоторые авторы называют его горячностью . [40] [41] [42] Качество горячности относится к состоянию материала только в определенной местности, и в целом, за исключением тел, находящихся в устойчивом состоянии термодинамического равновесия, горячность варьируется от места к месту. Не обязательно, что материал в определенном месте находится в состоянии, которое является устойчивым и почти однородным, чтобы позволить ему иметь четко определенную горячность или температуру. Горячесть может быть представлена абстрактно как одномерное многообразие . Каждая допустимая температурная шкала имеет свою собственную карту один к одному в многообразии горячности. [43] [44]
Когда две системы в тепловом контакте находятся при одной и той же температуре, между ними нет теплопередачи. Когда существует разница температур, тепло самопроизвольно течет от более теплой системы к более холодной, пока они не придут в тепловое равновесие . Такая теплопередача происходит посредством теплопроводности или теплового излучения. [45] [46] [47] [48] [49] [50] [51] [52]
Физики-экспериментаторы, например Галилей и Ньютон , [53] обнаружили, что существует бесконечно много эмпирических температурных шкал . Тем не менее, нулевой закон термодинамики гласит, что все они измеряют одно и то же качество. Это означает, что для тела, находящегося в состоянии внутреннего термодинамического равновесия, каждый правильно откалиброванный термометр, любого типа, измеряющий температуру тела, регистрирует одну и ту же температуру. Для тела, не находящегося в состоянии внутреннего термодинамического равновесия, разные термометры могут регистрировать разные температуры, в зависимости от механизмов работы термометров.
Для экспериментальной физики горячность означает, что при сравнении любых двух данных тел в их соответствующих отдельных термодинамических равновесиях любые два соответствующим образом заданных эмпирических термометра с числовыми показаниями шкалы согласятся относительно того, какое из двух данных тел горячее, или что они имеют одинаковую температуру. [54] Это не требует, чтобы два термометра имели линейную зависимость между своими числовыми показаниями шкалы, но требует, чтобы зависимость между их числовыми показаниями была строго монотонной . [55] [56] Определенное ощущение большей горячности может быть получено, независимо от калориметрии , термодинамики и свойств конкретных материалов, из закона смещения Вина для теплового излучения : температура ванны теплового излучения пропорциональна , посредством универсальной константы, частоте максимума ее частотного спектра ; эта частота всегда положительна, но может иметь значения, стремящиеся к нулю . Тепловое излучение изначально определяется для полости в термодинамическом равновесии . Эти физические факты оправдывают математическое утверждение о том, что горячность существует на упорядоченном одномерном многообразии . Это фундаментальная характеристика температуры и термометров для тел, находящихся в их собственном термодинамическом равновесии. [8] [43] [44] [57] [58]
За исключением системы, претерпевающей фазовый переход первого порядка , такой как таяние льда, когда закрытая система получает тепло, без изменения ее объема и без изменения внешних силовых полей, действующих на нее, ее температура повышается. Для системы, претерпевающей такой фазовый переход так медленно, что отклонением от термодинамического равновесия можно пренебречь, ее температура остается постоянной, поскольку система снабжается скрытой теплотой . Наоборот, потеря тепла из закрытой системы, без фазового перехода, без изменения объема и без изменения внешних силовых полей, действующих на нее, снижает ее температуру. [59]
В то время как для тел в их собственных термодинамических равновесных состояниях понятие температуры требует, чтобы все эмпирические термометры были согласны относительно того, какое из двух тел горячее или что они находятся при одинаковой температуре, это требование не является безопасным для тел, которые находятся в устойчивых состояниях, но не в термодинамическом равновесии. Тогда вполне может быть, что разные эмпирические термометры не согласны относительно того, какое из них горячее, и если это так, то по крайней мере одно из тел не имеет четко определенной абсолютной термодинамической температуры. Тем не менее, любое данное тело и любой подходящий эмпирический термометр все еще могут поддерживать понятия эмпирической, неабсолютной, горячности и температуры для подходящего диапазона процессов. Это вопрос для изучения в неравновесной термодинамике . [ требуется ссылка ]
Когда тело не находится в устойчивом состоянии, то понятие температуры становится еще менее безопасным, чем для тела в устойчивом состоянии, не находящегося в термодинамическом равновесии. Это также является предметом изучения в неравновесной термодинамике .
Для аксиоматической трактовки термодинамического равновесия, начиная с 1930-х годов, стало обычным ссылаться на нулевой закон термодинамики . Обычно излагаемая минималистская версия такого закона постулирует только то, что все тела, которые при термическом соединении будут находиться в тепловом равновесии, должны иметь одинаковую температуру по определению, но сама по себе не устанавливает температуру как величину, выраженную в виде действительного числа на шкале. Более физически информативная версия такого закона рассматривает эмпирическую температуру как график на многообразии горячности. [43] [58] [60] В то время как нулевой закон допускает определения многих различных эмпирических шкал температуры, второй закон термодинамики выбирает определение одной предпочтительной, абсолютной температуры , уникальной с точностью до произвольного масштабного коэффициента, откуда и называется термодинамической температурой . [8] [43] [61] [62] [63] [64] Если внутренняя энергия рассматривается как функция объема и энтропии однородной системы в термодинамическом равновесии, термодинамическая абсолютная температура появляется как частная производная внутренней энергии по энтропии при постоянном объеме. Ее естественное, внутреннее происхождение или нулевая точка - абсолютный ноль , при котором энтропия любой системы минимальна. Хотя это самая низкая абсолютная температура, описываемая моделью, третий закон термодинамики постулирует, что абсолютный ноль не может быть достигнут никакой физической системой.
Когда передача энергии к телу или от него происходит только в виде тепла, состояние тела изменяется. В зависимости от окружающей среды и стенок, отделяющих их от тела, в теле возможны различные изменения. Они включают химические реакции, повышение давления, повышение температуры и фазовый переход. Для каждого вида изменения при определенных условиях теплоемкость представляет собой отношение количества переданного тепла к величине изменения. [65]
Например, если изменение представляет собой увеличение температуры при постоянном объеме, без фазового перехода и химического изменения, то температура тела повышается, а его давление увеличивается. Количество переданного тепла, Δ Q , деленное на наблюдаемое изменение температуры, Δ T , является теплоемкостью тела при постоянном объеме:
Если теплоемкость измеряется для четко определенного количества вещества , то удельная теплоемкость является мерой тепла, необходимого для повышения температуры такой единицы количества на одну единицу температуры. Например, повышение температуры воды на один кельвин (равный одному градусу Цельсия) требует 4186 джоулей на килограмм (Дж/кг).

Измерение температуры с использованием современных научных термометров и температурных шкал восходит как минимум к началу XVIII века, когда Даниэль Габриэль Фаренгейт адаптировал термометр (перейдя на ртутный ) и шкалу, оба разработанные Оле Кристенсеном Рёмером . Шкала Фаренгейта до сих пор используется в Соединенных Штатах для ненаучных целей.
Температура измеряется термометрами , которые могут быть откалиброваны по различным температурным шкалам . В большинстве стран мира (за исключением Белиза , Мьянмы , Либерии и США ) для большинства целей измерения температуры используется шкала Цельсия. Большинство ученых измеряют температуру с помощью шкалы Цельсия, а термодинамическую температуру — с помощью шкалы Кельвина , которая представляет собой смещение шкалы Цельсия таким образом, что ее нулевая точка0 К =−273,15 °C или абсолютный ноль . Многие области техники в США, особенно высокие технологии и федеральные спецификации США (гражданские и военные), также используют шкалы Кельвина и Цельсия. Другие области техники в США также полагаются на шкалу Ренкина (смещенную шкалу Фаренгейта) при работе в дисциплинах, связанных с термодинамикой, таких как горение .
Основной единицей измерения температуры в Международной системе единиц (СИ) является кельвин . Он обозначается символом K.
Для повседневных применений часто бывает удобно использовать шкалу Цельсия, в которой0 °C очень близко соответствует точке замерзания воды и100 °C — это точка кипения на уровне моря. Поскольку жидкие капли обычно существуют в облаках при температурах ниже нуля,0 °C лучше определить как точку плавления льда. В этой шкале разница температур в 1 градус Цельсия соответствует увеличению на 1 кельвин , но шкала смещена на температуру, при которой тает лед (273,15 К ).
По международному соглашению [66] до мая 2019 года шкалы Кельвина и Цельсия определялись двумя точками фиксации: абсолютным нулем и тройной точкой Венского стандарта средней океанической воды , которая представляет собой воду, специально приготовленную с использованием определенной смеси изотопов водорода и кислорода. Абсолютный ноль определялся как точно0 К и−273,15 °C . Это температура, при которой прекращается все классическое поступательное движение частиц, составляющих материю, и они находятся в состоянии полного покоя в классической модели. Однако с точки зрения квантовой механики нулевое движение сохраняется и имеет связанную энергию, энергию нулевой точки . Материя находится в своем основном состоянии , [67] и не содержит тепловой энергии . Температуры273,16 К и0,01 °C были определены как значения тройной точки воды. Это определение служило следующим целям: оно зафиксировало величину кельвина как равную точно 1 части на 273,16 части разницы между абсолютным нулем и тройной точкой воды; оно установило, что один кельвин имеет точно такую же величину, как один градус по шкале Цельсия; и оно установило разницу между нулевыми точками этих шкал как273,15 К (0 К =−273,15 °С и273,16 К =0,01 °C ). С 2019 года действует новое определение, основанное на постоянной Больцмана [68] , но масштабы почти не изменились.
В США наиболее широко используется шкала Фаренгейта. По этой шкале точка замерзания воды соответствует32 °F и точка кипения212 °F . Шкала Ренкина, до сих пор используемая в области химического машиностроения в США, представляет собой абсолютную шкалу, основанную на приращении по Фаренгейту.
Для измерения температуры используются или исторически использовались следующие температурные шкалы:
Область физики плазмы имеет дело с явлениями электромагнитной природы, которые включают очень высокие температуры. Принято выражать температуру как энергию в единицах, связанных с электронвольтом или килоэлектронвольтом ( эВ/ кБ или кэВ/ кБ ). Соответствующая энергия, которая размерно отличается от температуры, затем вычисляется как произведение постоянной Больцмана и температуры, . Тогда 1 эВ / кБ равен 11 605 К. При изучении КХД-материи обычно встречаются температуры порядка нескольких сотен МэВ/ кБ , что эквивалентно примерно10 12 К .
Когда измеряется изменение температуры в области пространства или времени, измерения температуры оказываются непрерывными или дискретными? Существует широко распространенное заблуждение, что такие измерения температуры всегда должны быть непрерывными. [69] Это заблуждение частично берет начало из исторического взгляда, связанного с непрерывностью классических физических величин , который гласит, что физические величины должны принимать каждое промежуточное значение между начальным значением и конечным значением. [69] [70] Однако классическая картина верна только в тех случаях, когда температура измеряется в системе, которая находится в равновесии , то есть температура может не быть непрерывной вне этих условий. [69] Для систем вне равновесия, таких как на границах раздела между материалами (например, на границе раздела металл/неметалл или на границе раздела жидкость-пар), измерения температуры могут показывать резкие разрывы во времени и пространстве. [69] Например, Фанг и Уорд были одними из первых авторов, которые успешно сообщили о разрывах температуры до 7,8 К на поверхности испаряющихся капель воды. [71] Это было сообщено в межмолекулярных масштабах или в масштабе средней длины свободного пробега молекул, которая обычно составляет порядка нескольких микрометров в газах [72] при комнатной температуре. Вообще говоря, скачки температуры считаются нормой, а не исключением в случаях межфазной теплопередачи. [73] Это происходит из-за резкого изменения колебательных или тепловых свойств материалов на таких интерфейсах, что препятствует мгновенной передаче тепла и установлению теплового равновесия (предпосылки для наличия равномерной равновесной температуры на интерфейсе). [74] [75] Кроме того, измерения температуры в макромасштабе (типичный масштаб наблюдения) могут быть слишком грубозернистыми, поскольку они усредняют микроскопическую тепловую информацию, основанную на масштабе объема репрезентативного образца системы управления, и, таким образом, вполне вероятно, что скачки температуры в микромасштабе могут быть упущены из виду в таких средних значениях. [69] Такое усреднение может даже привести к неверным или вводящим в заблуждение результатам во многих случаях измерений температуры, даже в макромасштабах, и поэтому разумно тщательно изучить микрофизическую информацию, прежде чем усреднять или сглаживать любые потенциальные скачки температуры в системе, поскольку такие скачки не всегда можно усреднить или сгладить. [69] [76]Температурные разрывы, являясь не просто аномалиями, на самом деле существенно улучшили наше понимание и предсказательные способности, касающиеся теплопередачи в малых масштабах. [69] [73] [74] [75] [76]
Исторически существует несколько научных подходов к объяснению температуры: классическое термодинамическое описание, основанное на макроскопических эмпирических переменных, которые можно измерить в лаборатории; кинетическая теория газов , которая связывает макроскопическое описание с распределением вероятностей энергии движения частиц газа; и микроскопическое объяснение, основанное на статистической физике и квантовой механике . Кроме того, строгие и чисто математические обработки обеспечили аксиоматический подход к классической термодинамике и температуре. [77] Статистическая физика обеспечивает более глубокое понимание, описывая атомное поведение материи и выводит макроскопические свойства из статистических средних микроскопических состояний, включая как классические, так и квантовые состояния. В фундаментальном физическом описании температура может быть измерена непосредственно в единицах энергии. Однако в практических системах измерения для науки, техники и торговли, таких как современная метрическая система единиц, макроскопическое и микроскопическое описания взаимосвязаны постоянной Больцмана , коэффициентом пропорциональности, который масштабирует температуру до микроскопической средней кинетической энергии.
Микроскопическое описание в статистической механике основано на модели, которая анализирует систему на ее фундаментальные частицы материи или на набор классических или квантово-механических осцилляторов и рассматривает систему как статистический ансамбль микросостояний . Как совокупность классических материальных частиц температура является мерой средней энергии движения, называемой поступательной кинетической энергией , частиц, будь то в твердых телах, жидкостях, газах или плазме. Кинетическая энергия, понятие классической механики , равна половине массы частицы, умноженной на ее квадрат скорости . В этой механической интерпретации теплового движения кинетическая энергия материальных частиц может заключаться в скорости частиц их поступательного или колебательного движения или в инерции их вращательных мод. В одноатомных идеальных газах и, приблизительно, в большинстве газов и в простых металлах температура является мерой средней поступательной кинетической энергии частицы, 3/2 k B T . Она также определяет функцию распределения вероятностей энергии. В конденсированном веществе, и особенно в твердых телах, это чисто механическое описание часто менее полезно, и модель осциллятора обеспечивает лучшее описание для учета квантово-механических явлений. Температура определяет статистическую занятость микросостояний ансамбля. Микроскопическое определение температуры имеет смысл только в термодинамическом пределе , то есть для больших ансамблей состояний или частиц, чтобы выполнить требования статистической модели.
Кинетическая энергия также рассматривается как компонент тепловой энергии . Тепловая энергия может быть разделена на независимые компоненты, приписываемые степеням свободы частиц или модам осцилляторов в термодинамической системе . В общем случае число этих степеней свободы, которые доступны для равнораспределения энергии, зависит от температуры, т. е. энергетической области рассматриваемых взаимодействий. Для твердых тел тепловая энергия связана в первую очередь с колебаниями его атомов или молекул относительно их положения равновесия. В идеальном одноатомном газе кинетическая энергия обнаруживается исключительно в чисто поступательных движениях частиц. В других системах колебательные и вращательные движения также вносят вклад в степени свободы.

Максвелл и Больцман разработали кинетическую теорию , которая дает фундаментальное понимание температуры в газах. [78] Эта теория также объясняет закон идеального газа и наблюдаемую теплоемкость одноатомных (или «благородных» ) газов. [79] [80] [81]
Закон идеального газа основан на наблюдаемых эмпирических соотношениях между давлением ( p ), объемом ( V ) и температурой ( T ) и был признан задолго до разработки кинетической теории газов (см. законы Бойля и Чарльза ). Закон идеального газа гласит: [82]
где n — число молей газа, а R = 8,314 462 618 ... Дж⋅моль −1 ⋅К −1 83] — газовая постоянная .
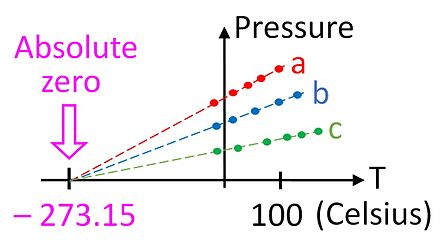
Это соотношение дает нам первый намек на то, что на температурной шкале существует абсолютный ноль , поскольку он имеет место только в том случае, если температура измеряется по абсолютной шкале, например, по шкале Кельвина. Закон идеального газа позволяет измерять температуру по этой абсолютной шкале с помощью газового термометра . Температуру в кельвинах можно определить как давление в паскалях одного моля газа в контейнере объемом один кубический метр, деленное на газовую постоянную.
Хотя это не особенно удобное устройство, газовый термометр обеспечивает существенную теоретическую основу, с помощью которой можно калибровать все термометры. С практической точки зрения, невозможно использовать газовый термометр для измерения абсолютной нулевой температуры, поскольку газы конденсируются в жидкость задолго до того, как температура достигнет нуля. Однако возможно экстраполировать до абсолютного нуля, используя закон идеального газа, как показано на рисунке.
Кинетическая теория предполагает, что давление вызвано силой, связанной с ударами отдельных атомов о стенки, и что вся энергия является поступательной кинетической энергией . Используя сложный аргумент симметрии, [84] Больцман вывел то, что сейчас называется функцией распределения вероятностей Максвелла–Больцмана для скорости частиц в идеальном газе. Из этой функции распределения вероятностей средняя кинетическая энергия (на частицу) одноатомного идеального газа равна [80] [85]
где постоянная Больцмана k B — это постоянная идеального газа, деленная на число Авогадро , и — это среднеквадратичная скорость . [86] Эта прямая пропорциональность между температурой и средней молекулярной кинетической энергией является частным случаем теоремы о равнораспределении и выполняется только в классическом пределе идеального газа . Она не выполняется в точности для большинства веществ.
Когда два в противном случае изолированных тела соединены вместе жестким физическим путем, непроницаемым для материи, происходит спонтанная передача энергии в виде тепла от более горячего к более холодному из них. В конце концов, они достигают состояния взаимного теплового равновесия , в котором передача тепла прекращается, а соответствующие переменные состояния тел устанавливаются, становясь неизменными. [87] [88] [89]
Одно из утверждений нулевого закона термодинамики заключается в том, что если две системы находятся в тепловом равновесии с третьей системой, то они также находятся в тепловом равновесии друг с другом. [90] [91] [92]
Это утверждение помогает определить температуру, но само по себе не завершает определение. Эмпирическая температура — это числовая шкала для горячности термодинамической системы. Такая горячность может быть определена как существующая на одномерном многообразии , простирающемся между горячим и холодным. Иногда утверждается, что нулевой закон включает существование уникального универсального многообразия горячности и числовых шкал на нем, чтобы обеспечить полное определение эмпирической температуры. [60] Чтобы быть пригодным для эмпирической термометрии, материал должен иметь монотонную связь между горячностью и некоторой легко измеряемой переменной состояния, такой как давление или объем, когда все другие соответствующие координаты фиксированы. Исключительно подходящей системой является идеальный газ , который может обеспечить шкалу температур, которая соответствует абсолютной шкале Кельвина. Шкала Кельвина определяется на основе второго закона термодинамики.
В качестве альтернативы рассмотрению или определению нулевого закона термодинамики, исторически сложилось так, что температура определялась в терминах второго закона термодинамики , который имеет дело с энтропией . [ требуется ссылка ] Второй закон гласит, что любой процесс приведет либо к отсутствию изменений, либо к чистому увеличению энтропии Вселенной. Это можно понять с точки зрения вероятности.
Например, в серии подбрасываний монеты идеально упорядоченной системой будет та, в которой либо каждый подбрасывание выпадает орёл, либо каждый подбрасывание выпадает решка. Это означает, что результат всегда на 100% один и тот же. Напротив, возможны многие смешанные ( неупорядоченные ) результаты, и их количество увеличивается с каждым подбрасыванием. В конце концов, комбинации ~50% орлов и ~50% решек становятся доминирующими, и получение результата, значительно отличающегося от 50/50, становится всё более маловероятным. Таким образом, система естественным образом переходит в состояние максимального беспорядка или энтропии.
Поскольку температура управляет передачей тепла между двумя системами, а Вселенная имеет тенденцию к прогрессу в направлении максимума энтропии, ожидается, что существует некоторая связь между температурой и энтропией. Тепловая машина — это устройство для преобразования тепловой энергии в механическую, что приводит к выполнению работы. Анализ тепловой машины Карно дает необходимые связи. Согласно закону сохранения энергии и тому, что энергия является функцией состояния , которая не изменяется в течение полного цикла, работа тепловой машины за полный цикл равна чистому теплу, т. е. сумме тепла, введенного в систему при высокой температуре, q H > 0, и отработанного тепла, отданного при низкой температуре, q C < 0. [93]
Эффективность — это работа, деленная на подводимое тепло:
где w cy — работа, выполненная за цикл. Эффективность зависит только от | q C |/ q H . Поскольку q C и q H соответствуют теплопередаче при температурах T C и T H , соответственно, | q C |/ q H должна быть некоторой функцией этих температур:
Теорема Карно гласит, что все обратимые двигатели, работающие между одними и теми же тепловыми резервуарами, одинаково эффективны. [ требуется ссылка ] Таким образом, тепловой двигатель, работающий между T 1 и T 3, должен иметь такую же эффективность, как и двигатель, состоящий из двух циклов, одного между T 1 и T 2 , а второго между T 2 и T 3 . Это может быть только в том случае, если
что подразумевает
Так как первая функция не зависит от T 2 , эта температура должна сокращаться на правой стороне, то есть f ( T 1 , T 3 ) имеет вид g ( T 1 )/ g ( T 3 ) (т. е. f ( T 1 , T 3 ) = f ( T 1 , T 2 ) f ( T 2 , T 3 ) = g ( T 1 )/ g ( T 2 ) · g ( T 2 )/ g ( T 3 ) = g ( T 1 )/ g ( T 3 )) , где g является функцией одной температуры. Теперь можно выбрать шкалу температур со свойством, что
Подстановка (6) обратно в (4) дает соотношение для эффективности в зависимости от температуры:
Для T C = 0 K эффективность составляет 100%, и эта эффективность становится больше 100% ниже 0 K. Поскольку эффективность больше 100% нарушает первый закон термодинамики, это означает, что 0 K является минимально возможной температурой. Фактически, самая низкая температура, когда-либо полученная в макроскопической системе, была 20 нК, что было достигнуто в 1995 году в NIST. Вычитание правой части (5) из средней части и перестановка дают [22] [93]
где отрицательный знак указывает на тепло, выбрасываемое из системы. Это соотношение предполагает существование функции состояния S , изменение которой характерно исчезает для полного цикла, если оно определяется как
где нижний индекс указывает на обратимый процесс. Эта функция соответствует энтропии системы, которая была описана ранее. Перестановка (8) дает формулу для температуры в терминах фиктивных бесконечно малых квазиобратимых элементов энтропии и тепла:
Для системы постоянного объема, где энтропия S ( E ) является функцией ее энергии E , d E = d q rev и (9) дает
т.е. величина, обратная температуре, представляет собой скорость увеличения энтропии по отношению к энергии при постоянном объеме.
Статистическая механика определяет температуру на основе фундаментальных степеней свободы системы. Уравнение (10) является определяющим соотношением температуры, где энтропия определяется (с точностью до константы) логарифмом числа микросостояний системы в данном макросостоянии (как указано в микроканоническом ансамбле ):
где — постоянная Больцмана, а W — число микросостояний с энергией E системы (вырождение).
Когда две системы с разными температурами находятся в чисто термическом соединении, тепло будет перетекать из системы с более высокой температурой в систему с более низкой температурой; термодинамически это понимается во втором законе термодинамики: Общее изменение энтропии после передачи энергии из системы 1 в систему 2 равно:
и, таким образом, положительно, если
С точки зрения статистической механики, общее число микросостояний в объединенной системе 1 + система 2 равно , логарифм которого (умноженный на постоянную Больцмана) равен сумме их энтропий; таким образом, поток тепла от высокой температуры к низкой, приводящий к увеличению общей энтропии, более вероятен, чем любой другой сценарий (обычно он гораздо более вероятен), поскольку в результирующем макросостоянии больше микросостояний.
Можно расширить определение температуры даже на системы из нескольких частиц, как в квантовой точке . Обобщенная температура получается путем рассмотрения ансамблей времени вместо ансамблей конфигурационного пространства, заданных в статистической механике в случае теплового и корпускулярного обмена между малой системой фермионов ( N даже меньше 10) с системой с одиночным/двойным заселением. Конечный квантовый большой канонический ансамбль , [94] полученный в рамках гипотезы эргодичности и ортодичности, [95] позволяет выразить обобщенную температуру из отношения среднего времени заселения и системы с одиночным/двойным заселением: [96]
где E F — энергия Ферми . Эта обобщенная температура стремится к обычной температуре, когда N стремится к бесконечности.
На эмпирических температурных шкалах, не привязанных к абсолютному нулю, отрицательная температура — это температура на единицу ниже нулевой точки используемой шкалы. Например, температура сублимации сухого льда составляет−78,5 °C, что эквивалентно−109,3 °F . [97] По абсолютной шкале Кельвина эта температура составляет194,6 К. Никакое тело материи не может быть приведено к точно0 К (температура идеально самого холодного тела) любым конечным осуществимым процессом; это следствие третьего закона термодинамики . [98] [99] [100]
Внутренняя кинетическая теория утверждает, что температура тела материи не может принимать отрицательных значений. Однако термодинамическая шкала температур не столь ограничена.
Тело материи иногда можно концептуально определить в терминах микроскопических степеней свободы, а именно спинов частиц, подсистемы с температурой, отличной от температуры всего тела. Когда тело находится в состоянии внутреннего термодинамического равновесия, температуры всего тела и подсистемы должны быть одинаковыми. Две температуры могут различаться, когда посредством работы через внешние силовые поля энергия может передаваться в подсистему и из нее отдельно от остального тела; тогда все тело не находится в своем собственном состоянии внутреннего термодинамического равновесия. Существует верхний предел энергии, которого может достичь такая спиновая подсистема.
Рассматривая подсистему как временно находящуюся в состоянии виртуального термодинамического равновесия, можно получить отрицательную температуру в термодинамической шкале. Термодинамическая температура является обратной производной энтропии подсистемы по ее внутренней энергии. По мере увеличения внутренней энергии подсистемы энтропия увеличивается в некотором диапазоне, но в конечном итоге достигает максимального значения, а затем начинает уменьшаться по мере того, как начинают заполняться состояния с самой высокой энергией. В точке максимальной энтропии температурная функция показывает поведение сингулярности , поскольку наклон энтропии как функции энергии уменьшается до нуля, а затем становится отрицательным. Когда энтропия подсистемы достигает своего максимума, ее термодинамическая температура стремится к положительной бесконечности, переключаясь на отрицательную бесконечность, когда наклон становится отрицательным. Такие отрицательные температуры горячее любой положительной температуры. Со временем, когда подсистема подвергается воздействию остальной части тела, которая имеет положительную температуру, энергия передается в виде тепла от подсистемы с отрицательной температурой к системе с положительной температурой. [101] Температура кинетической теории для таких подсистем не определена.
.jpg/440px-A_Guide_to_Cosmic_Temperatures_(SVS14374_-_Cosmic_Temperatures_Infographic_Final_Full).jpg)
eq.(64).
Следовательно, мы определяем температуру как движущую силу, которая заставляет что-то, называемое теплом, передаваться.
уравнения (39), (40), и (65).