В митохондрии матрица — это пространство внутри внутренней мембраны . Слово «матрица» происходит от того факта, что это пространство вязкое по сравнению с относительно водной цитоплазмой. Митохондриальный матрикс содержит митохондриальную ДНК , рибосомы , растворимые ферменты , небольшие органические молекулы, нуклеотидные кофакторы и неорганические ионы . [1] Ферменты в матриксе облегчают реакции, ответственные за выработку АТФ , такие как цикл лимонной кислоты , окислительное фосфорилирование , окисление пирувата и бета-окисление жирных кислот . [1]
Состав матрицы, основанный на ее структурах и содержании, создает среду, которая позволяет анаболическим и катаболическим путям протекать благоприятно. Цепь переноса электронов и ферменты в матрице играют большую роль в цикле лимонной кислоты и окислительном фосфорилировании . Цикл лимонной кислоты производит NADH и FADH2 посредством окисления, которые будут восстановлены при окислительном фосфорилировании для производства АТФ . [2] [3]
Цитозольное, межмембранное пространство , компартмент имеет более высокое содержание воды:белка, около 3,8 мкл/мг белка по сравнению с тем, что встречается в митохондриальном матриксе, где такие уровни обычно составляют около 0,8 мкл/мг белка. [4] Неизвестно, как митохондрии поддерживают осмотический баланс через внутреннюю митохондриальную мембрану, хотя мембрана содержит аквапорины , которые, как полагают, являются проводниками для регулируемого транспорта воды. Митохондриальный матрикс имеет pH около 7,8, что выше, чем pH межмембранного пространства митохондрий, который составляет около 7,0–7,4. [5] Митохондриальная ДНК была открыта Нэшем и Марджитом в 1963 году. В митохондриальном матриксе присутствует одна-много двухцепочечных, в основном кольцевых ДНК. Митохондриальная ДНК составляет 1% от общей ДНК клетки. Он богат содержанием гуанина и цитозина , и у людей имеет материнское происхождение. Митохондрии млекопитающих имеют 55s рибосомы.
Матрица является хозяином для широкого спектра метаболитов , участвующих в процессах внутри матрицы. Цикл лимонной кислоты включает ацил-КоА , пируват , ацетил-КоА , цитрат , изоцитрат , α-кетоглутарат , сукцинил-КоА , фумарат , сукцинат , L -малат и оксалоацетат . [2] Цикл мочевины использует L -орнитин , карбамоилфосфат и L -цитруллин . [4] Цепь переноса электронов окисляет коферменты НАДН и ФАДН2 . Синтез белка использует митохондриальную ДНК , РНК и тРНК . [5] Регулирование процессов использует ионы ( Ca2 + / K + / Mg + ). [6] Дополнительные метаболиты , присутствующие в матрице, это CO 2 , H 2 O , O 2 , АТФ , АДФ и Pi . [1]
Ферменты из процессов, которые происходят в матрице. Цикл лимонной кислоты облегчается пируватдегидрогеназой , цитратсинтазой , аконитазой , изоцитратдегидрогеназой , α-кетоглутаратдегидрогеназой , сукцинил-КоА-синтетазой , фумараза и малатдегидрогеназой . [2] Цикл мочевины облегчается карбамоилфосфатсинтетазой I и орнитинтранскарбамилазой . [4] β-Окисление использует пируваткарбоксилазу , ацил-КоА-дегидрогеназу и β-кетотиолазу . [1] Производство аминокислот облегчается трансаминазами . [7] Метаболизм аминокислот опосредуется протеазами , такими как пресеквенсная протеаза . [8]
Внутренняя мембрана представляет собой фосфолипидный бислой , содержащий комплексы окислительного фосфорилирования, который содержит цепь переноса электронов , которая находится на кристах внутренней мембраны и состоит из четырех белковых комплексов и АТФ-синтазы . Эти комплексы представляют собой комплекс I (НАДН:кофермент Q оксидоредуктаза), комплекс II (сукцинат:кофермент Q оксидоредуктаза), комплекс III (кофермент Q: цитохром c оксидоредуктаза) и комплекс IV (цитохром c оксидаза). [6]
Цепь переноса электронов отвечает за установление pH и электрохимического градиента , который облегчает выработку АТФ посредством перекачки протонов. Градиент также обеспечивает контроль концентрации ионов, таких как Ca 2+, управляемой потенциалом митохондриальной мембраны. [1] Мембрана позволяет проникать в матрицу только неполярным молекулам, таким как CO 2 и O 2 , и небольшим незаряженным полярным молекулам, таким как H 2 O. Молекулы входят и выходят из митохондриальной матрицы через транспортные белки и ионные переносчики . Затем молекулы могут покидать митохондрии через порин . [9] Эти приписываемые характеристики позволяют контролировать концентрации ионов и метаболитов, необходимые для регуляции, и определяют скорость выработки АТФ. [10] [11]
После гликолиза цикл лимонной кислоты активируется путем образования ацетил-КоА. Окисление пирувата пируватдегидрогеназой в матрице приводит к образованию CO2 , ацетил-КоА и НАДН. Бета-окисление жирных кислот служит альтернативным катаболическим путем, который приводит к образованию ацетил-КоА, НАДН и ФАДН2 . [1] Образование ацетил-КоА начинает цикл лимонной кислоты, в то время как полученные коферменты используются в цепи переноса электронов . [11]
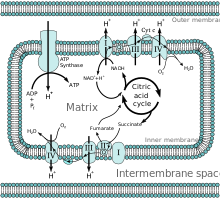
Все ферменты цикла лимонной кислоты находятся в матрице (например, цитратсинтаза , изоцитратдегидрогеназа , α-кетоглутаратдегидрогеназа , фумараза и малатдегидрогеназа ), за исключением сукцинатдегидрогеназы , которая находится на внутренней мембране и является частью белкового комплекса II в цепи переноса электронов . Цикл производит коферменты НАДН и ФАДН 2 посредством окисления углерода в двух циклах. Окисление НАДН и ФАДН 2 производит ГТФ из сукцинил-КоА-синтетазы. [2]
NADH и FADH 2 производятся в матрице или транспортируются через порин и транспортные белки, чтобы подвергнуться окислению посредством окислительного фосфорилирования. [1] NADH и FADH 2 подвергаются окислению в цепи переноса электронов, передавая электроны для регенерации NAD + и FAD . Протоны втягиваются в межмембранное пространство энергией электронов, проходящих через цепь переноса электронов. Четыре электрона в конечном итоге принимаются кислородом в матрице для завершения цепи переноса электронов. Протоны возвращаются в митохондриальную матрицу через белок АТФ-синтазу . Энергия используется для вращения АТФ-синтазы, что облегчает прохождение протона, производя АТФ. Разница pH между матрицей и межмембранным пространством создает электрохимический градиент, с помощью которого АТФ-синтаза может благоприятно пропускать протон в матрицу. [6]
Первые два шага цикла мочевины происходят в митохондриальном матриксе клеток печени и почек. На первом шаге аммиак преобразуется в карбамоилфосфат посредством инвестирования двух молекул АТФ. Этот шаг осуществляется карбамоилфосфатсинтетазой I. Второй шаг, осуществляемый орнитинтранскарбамилазой, преобразует карбамоилфосфат и орнитин в цитруллин . После этих начальных шагов цикл мочевины продолжается во внутреннем мембранном пространстве до тех пор, пока орнитин снова не попадет в матрикс через транспортный канал, чтобы продолжить первый шаг внутри матрикса. [12]
α-кетоглутарат и оксалоацетат могут быть преобразованы в аминокислоты в матрице посредством процесса трансаминирования . Эти реакции облегчаются трансаминазами для получения аспартата и аспарагина из оксалоацетата. Трансаминирование α-кетоглутарата производит глутамат , пролин и аргинин . Эти аминокислоты затем используются либо в матрице, либо транспортируются в цитозоль для производства белков. [7] [13]
Регулирование в матрице в первую очередь контролируется концентрацией ионов, концентрацией метаболитов и энергетическим зарядом. Наличие ионов, таких как Ca2 +, контролирует различные функции цикла лимонной кислоты. в матрице активирует пируватдегидрогеназу , изоцитратдегидрогеназу и α-кетоглутаратдегидрогеназу, что увеличивает скорость реакции в цикле. [14] Концентрация промежуточных продуктов и коферментов в матрице также увеличивает или уменьшает скорость производства АТФ из-за анаплеротических и катаплеротических эффектов. НАДН может действовать как ингибитор α-кетоглутарата , изоцитратдегидрогеназы , цитратсинтазы и пируватдегидрогеназы. Концентрация оксалоацетата, в частности, поддерживается на низком уровне, поэтому любые колебания этой концентрации служат для продвижения цикла лимонной кислоты вперед. [2] Производство АТФ также служит средством регуляции, действуя как ингибитор для изоцитратдегидрогеназы, пируватдегидрогеназы, белковых комплексов цепи переноса электронов и АТФ-синтазы. АДФ действует как активатор . [ 1]
Митохондрии содержат свой собственный набор ДНК, используемый для производства белков, обнаруженных в цепи переноса электронов. Митохондриальная ДНК кодирует только около тринадцати белков, которые используются в обработке митохондриальных транскриптов, рибосомальных белков , рибосомальной РНК , транспортной РНК и белковых субъединиц , обнаруженных в белковых комплексах цепи переноса электронов. [15] [16]