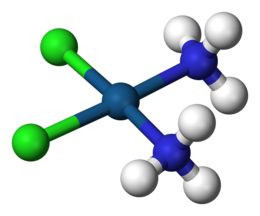
Координационный комплекс — это химическое соединение, состоящее из центрального атома или иона , который обычно является металлическим и называется координационным центром , и окружающего его массива связанных молекул или ионов, которые в свою очередь известны как лиганды или комплексообразователи. [1] [2] [3] Многие металлосодержащие соединения , особенно те, которые включают переходные металлы (элементы, такие как титан , которые относятся к d-блоку периодической таблицы ), являются координационными комплексами. [4]
Координационные комплексы настолько распространены, что их структуры и реакции описываются многими способами, иногда запутанно. Атом внутри лиганда, который связан с центральным атомом или ионом металла, называется атомом-донором . В типичном комплексе ион металла связан с несколькими атомами-донорами, которые могут быть одинаковыми или разными. Полидентатный (множественно связанный) лиганд — это молекула или ион, который связывается с центральным атомом через несколько атомов лиганда; лиганды с 2, 3, 4 или даже 6 связями с центральным атомом являются обычными. Эти комплексы называются хелатными комплексами ; образование таких комплексов называется хелатированием, комплексообразованием и координацией.
Центральный атом или ион вместе со всеми лигандами составляют координационную сферу . [5] [6] Центральные атомы или ион и атомы-доноры составляют первую координационную сферу.
Координация относится к «координационным ковалентным связям» ( диполярным связям ) между лигандами и центральным атомом. Первоначально комплекс подразумевал обратимую ассоциацию молекул , атомов или ионов посредством таких слабых химических связей . Применительно к координационной химии это значение претерпело изменения. Некоторые комплексы металлов образуются практически необратимо, и многие связаны между собой связями, которые являются довольно сильными. [7] [8]
Число атомов-доноров, присоединенных к центральному атому или иону, называется координационным числом . Наиболее распространенные координационные числа — 2, 4 и особенно 6. Гидратированный ион — это один из видов комплексного иона (или просто комплекса), вид, образованный между центральным ионом металла и одним или несколькими окружающими его лигандами, молекулами или ионами, которые содержат по крайней мере одну неподеленную пару электронов.
Если все лиганды монодентатны , то число атомов-доноров равно числу лигандов. Например, ион гексагидрата кобальта(II) или ион гексааквакобальта(II) [Co(H 2 O) 6 ] 2+ представляет собой гидратированный комплексный ион, состоящий из шести молекул воды, присоединенных к иону металла Co. Степень окисления и координационное число отражают число связей, образованных между ионом металла и лигандами в комплексном ионе. Однако координационное число Pt( en )2+
2равно 4 (а не 2), поскольку оно имеет два бидентатных лиганда, которые в общей сложности содержат четыре донорных атома.
Любой атом-донор отдаст пару электронов. Существуют некоторые атомы-доноры или группы, которые могут предложить более одной пары электронов. Такие атомы называются бидентатными (предлагают две пары электронов) или полидентатными (предлагают более двух пар электронов). В некоторых случаях атом или группа предлагает пару электронов двум похожим или разным центральным атомам металла или акцепторам — путем деления электронной пары — в трехцентровую двухэлектронную связь . Их называют мостиковыми лигандами.

Координационные комплексы известны с самого начала современной химии. Ранние известные координационные комплексы включают красители, такие как берлинская лазурь . Их свойства были впервые хорошо изучены в конце 1800-х годов после работы Христиана Вильгельма Бломстранда 1869 года . Бломстранд разработал то, что стало известно как теория комплексных ионных цепей. Рассматривая комплексы аминов металлов, он предположил, что молекулы аммиака компенсируют заряд иона, образуя цепи типа [(NH 3 ) X ] X+ , где X — координационное число иона металла. Он сравнил свои теоретические аммиачные цепи с углеводородами формы (CH 2 ) X . [9]
Следуя этой теории, датский ученый Софус Мадс Йоргенсен внес в нее улучшения. В своей версии теории Йоргенсен утверждал, что при диссоциации молекулы в растворе возможны два результата: ионы будут связываться через аммиачные цепи, описанные Бломстрандом, или ионы будут связываться напрямую с металлом.
Лишь в 1893 году наиболее широко принятая сегодня версия теории была опубликована Альфредом Вернером . Работа Вернера включала два важных изменения в теорию Бломстранда. Первое заключалось в том, что Вернер описал две возможности с точки зрения расположения в координационной сфере. Он утверждал, что если бы ионы образовали цепь, это произошло бы вне координационной сферы, в то время как ионы, которые связывались бы непосредственно с металлом, сделали бы это внутри координационной сферы. [10] Однако в одном из своих самых важных открытий Вернер опроверг большую часть теории цепи. Вернер открыл пространственное расположение лигандов, которые были вовлечены в образование сложного гексакоординированного кобальта. Его теория позволяет понять разницу между координированным лигандом и ионом, уравновешивающим заряд, в соединении, например, хлорид-ионом в хлоридах кобальтаммина, и объяснить многие из ранее необъяснимых изомеров.
В 1911 году Вернер впервые разделил координационный комплекс гексола на оптические изомеры , опровергнув теорию о том, что только соединения углерода могут обладать хиральностью . [11]
Ионы или молекулы, окружающие центральный атом, называются лигандами . Лиганды классифицируются как L или X (или их комбинации), в зависимости от того, сколько электронов они предоставляют для связи между лигандом и центральным атомом. Лиганды L предоставляют два электрона из неподеленной электронной пары , что приводит к образованию координационной ковалентной связи . Лиганды X предоставляют один электрон, а центральный атом предоставляет другой электрон, таким образом образуя обычную ковалентную связь . Говорят, что лиганды координируются с атомом. Для алкенов пи-связи могут координироваться с атомами металлов. Примером является этилен в комплексе [PtCl 3 (C 2 H 4 )] − ( соль Цейзе ).
В координационной химии структура сначала описывается ее координационным числом , числом лигандов, присоединенных к металлу (точнее, числом донорных атомов). Обычно можно посчитать присоединенные лиганды, но иногда даже подсчет может стать неоднозначным. Координационные числа обычно находятся в диапазоне от двух до девяти, но для лантаноидов и актинидов не редкость большое число лигандов. Число связей зависит от размера, заряда и электронной конфигурации иона металла и лигандов. Ионы металлов могут иметь более одного координационного числа.
Обычно химия комплексов переходных металлов определяется взаимодействиями между s- и p- молекулярными орбиталями атомов-доноров в лигандах и d-орбиталями ионов металлов. S-, p- и d-орбитали металла могут вмещать 18 электронов (см. правило 18 электронов ). Максимальное координационное число для определенного металла, таким образом, связано с электронной конфигурацией иона металла (точнее, с числом пустых орбиталей) и с соотношением размеров лигандов и иона металла. Большие металлы и маленькие лиганды приводят к высоким координационным числам, например, [Mo(CN) 8 ] 4− . Малые металлы с большими лигандами приводят к низким координационным числам, например, Pt[P(CMe3 ) ] 2 . Из-за своего большого размера лантаноиды , актиноиды и ранние переходные металлы, как правило, имеют высокие координационные числа.
Большинство структур следуют шаблону точек на сфере (или, как если бы центральный атом находился в середине многогранника , где углы этой формы являются местами расположения лигандов), где перекрытие орбиталей (между лигандом и орбиталями металла) и отталкивание лиганд-лиганд, как правило, приводят к определенным регулярным геометриям. Наиболее наблюдаемые геометрии перечислены ниже, но есть много случаев, которые отклоняются от регулярной геометрии, например, из-за использования лигандов разных типов (что приводит к нерегулярным длинам связей; координационные атомы не следуют шаблону точек на сфере), из-за размера лигандов или из-за электронных эффектов (см., например, искажение Яна-Теллера ):
Идеализированные описания 5-, 7-, 8- и 9-координации часто геометрически неотличимы от альтернативных структур с немного отличающимися углами LML (лиганд-металл-лиганд), например, разница между квадратно-пирамидальной и тригонально-бипирамидальной структурами. [12]
Чтобы различать альтернативные координации для пятикоординированных комплексов, Эддисон и др. изобрели индекс геометрии τ [16]. Этот индекс зависит от углов координационного центра и изменяется от 0 для квадратно-пирамидальной структуры до 1 для тригонально-бипирамидальной структуры, что позволяет классифицировать случаи между ними. Эта система была позже распространена на четырехкоординированные комплексы Хаузером и др. [17] , а также Окуневским и др. [18].
В системах с малым числом d-электронов , из-за особых электронных эффектов, таких как стабилизация Яна-Теллера (второго порядка), [19] определенные геометрии (в которых координационные атомы не следуют схеме «точки на сфере») стабилизируются относительно других возможностей, например, для некоторых соединений тригональная призматическая геометрия стабилизируется относительно октаэдрических структур для шестикоординации.
Расположение лигандов фиксировано для данного комплекса, но в некоторых случаях оно может изменяться в результате реакции, в результате которой образуется другой стабильный изомер .
В координационных комплексах, как и во многих других соединениях, существует множество видов изомерии .
Стереоизомерия происходит с теми же связями в разных ориентациях. Стереоизомерию можно далее классифицировать на: [20]
Цис-транс-изомерия встречается в октаэдрических и квадратных плоских комплексах (но не в тетраэдрических). Когда два лиганда соседствуют, они называются цис- , когда друг напротив друга, транс- . Когда три одинаковых лиганда занимают одну грань октаэдра, изомер называется фациальным, или фас- . В фас -изомере любые два одинаковых лиганда соседствуют или находятся в цис-расположении друг к другу. Если эти три лиганда и ион металла находятся в одной плоскости, изомер называется меридиональным, или мер- . Мер -изомер можно рассматривать как комбинацию транс- и цис -пар , поскольку он содержит как транс-, так и цис-пары идентичных лигандов.
Оптическая изомерия происходит, когда комплекс не накладывается на свое зеркальное изображение. Она так называется, потому что два изомера каждый оптически активны , то есть они вращают плоскость поляризованного света в противоположных направлениях. В первой показанной молекуле символ Λ ( лямбда ) используется в качестве префикса для описания левостороннего пропеллерного закручивания, образованного тремя бидентатными лигандами. Вторая молекула является зеркальным отражением первой, с символом Δ ( дельта ) в качестве префикса для правостороннего пропеллерного закручивания. Третья и четвертая молекулы представляют собой похожую пару изомеров Λ и Δ, в данном случае с двумя бидентатными лигандами и двумя идентичными монодентатными лигандами. [21]
Структурная изомерия происходит, когда связи сами по себе различны. Различают четыре типа структурной изомерии: ионизационная изомерия, сольватная или гидратная изомерия, изомерия связей и координационная изомерия.
Многие свойства комплексов переходных металлов определяются их электронными структурами. Электронная структура может быть описана относительно ионной моделью, которая приписывает формальные заряды металлам и лигандам. Этот подход является сутью теории кристаллического поля (CFT). Теория кристаллического поля, введенная Гансом Бете в 1929 году, дает основанную на квантовой механике попытку понимания комплексов. Но теория кристаллического поля рассматривает все взаимодействия в комплексе как ионные и предполагает, что лиганды могут быть аппроксимированы отрицательными точечными зарядами.
Более сложные модели охватывают ковалентность, и этот подход описывается теорией поля лигандов (LFT) и теорией молекулярных орбиталей (MO). Теория поля лигандов, введенная в 1935 году и построенная на основе теории молекулярных орбиталей, может обрабатывать более широкий диапазон комплексов и может объяснять комплексы, в которых взаимодействия являются ковалентными . Химические приложения теории групп могут помочь в понимании теории поля кристаллов или лигандов, допуская простые решения на основе симметрии для формальных уравнений.
Химики склонны использовать самую простую модель, необходимую для прогнозирования интересующих свойств; по этой причине CFT была фаворитом для обсуждений, когда это было возможно. Теории MO и LF более сложны, но обеспечивают более реалистичную перспективу.
Электронная конфигурация комплексов придает им некоторые важные свойства:

Комплексы переходных металлов часто имеют эффектные цвета, вызванные электронными переходами при поглощении света. По этой причине их часто применяют в качестве пигментов . Большинство переходов, связанных с окрашенными комплексами металлов, являются либо переходами d–d, либо полосами переноса заряда . При переходе ad–d электрон на орбитали ad металла возбуждается фотоном на другую орбиталь d с более высокой энергией, поэтому переходы d–d происходят только для частично заполненных комплексов d-орбиталей (d 1–9 ). Для комплексов с конфигурацией d 0 или d 10 перенос заряда все еще возможен, хотя переходы d–d невозможны. Полоса переноса заряда влечет за собой продвижение электрона с орбитали на основе металла на пустую орбиталь на основе лиганда ( перенос заряда металл-лиганд или MLCT). Обратное также происходит: возбуждение электрона на орбитали на основе лиганда на пустую орбиталь на основе металла ( перенос заряда лиганд-металл или LMCT). Эти явления можно наблюдать с помощью электронной спектроскопии; также известной как UV-Vis . [25] Для простых соединений с высокой симметрией переходы d–d можно определить с помощью диаграмм Танабе–Сугано . Эти определения получают все большую поддержку в вычислительной химии .
Внешне комплексы лантаноидов похожи на комплексы переходных металлов, поскольку некоторые из них окрашены. Однако для обычных ионов Ln 3+ (Ln = лантаноид) все цвета бледные и почти не зависят от природы лиганда. Цвета обусловлены 4f-электронными переходами. Поскольку 4f-орбитали в лантаноидах «похоронены» в ядре ксенона и экранированы от лиганда 5s- и 5p-орбиталями, они, следовательно, не подвержены влиянию лигандов в какой-либо значительной степени, что приводит к гораздо меньшему расщеплению кристаллического поля, чем в переходных металлах. Спектр поглощения иона Ln 3+ приближается к спектру свободного иона, где электронные состояния описываются спин-орбитальной связью . Это контрастирует с переходными металлами, где основное состояние расщеплено кристаллическим полем. Поглощения для Ln 3+ слабы, поскольку электрические дипольные переходы запрещены по четности ( запрещены по Лапорту ), но могут усиливаться из-за эффекта низкосимметричного поля лиганда или смешивания с более высокими электронными состояниями ( например, d-орбиталями). Полосы поглощения ff чрезвычайно резкие, что контрастирует с наблюдаемыми для переходных металлов, которые обычно имеют широкие полосы. [26] [27] Это может привести к крайне необычным эффектам, таким как значительные изменения цвета при различных формах освещения.
Металлические комплексы, имеющие неспаренные электроны, являются парамагнитными . Это может быть связано с нечетным числом электронов в целом или с дестабилизацией электронного спаривания. Таким образом, мономерные виды Ti(III) имеют один «d-электрон» и должны быть (пара)магнитными , независимо от геометрии или природы лигандов. Ti(II) с двумя d-электронами образует некоторые комплексы, имеющие два неспаренных электрона, а другие — ни одного. Этот эффект иллюстрируется соединениями TiX 2 [(CH 3 ) 2 PCH 2 CH 2 P(CH 3 ) 2 ] 2 : когда X = Cl , комплекс является парамагнитным ( высокоспиновая конфигурация), тогда как когда X = CH 3 , он является диамагнитным ( низкоспиновая конфигурация). Лиганды обеспечивают важное средство регулировки свойств основного состояния .
В би- и полиметаллических комплексах, в которых отдельные центры имеют нечетное число электронов или являются высокоспиновыми, ситуация более сложная. Если между двумя (или более) металлическими центрами есть взаимодействие (прямое или через лиганд), электроны могут соединяться ( антиферромагнитная связь , приводящая к диамагнитному соединению), или они могут усиливать друг друга ( ферромагнитная связь ). Когда взаимодействия нет, два (или более) отдельных металлических центра ведут себя так, как будто они находятся в двух отдельных молекулах.
Комплексы демонстрируют различные возможные реактивности: [28]
Если лиганды вокруг металла выбраны тщательно, металл может участвовать в ( стехиометрических или каталитических ) превращениях молекул или использоваться в качестве сенсора.
Металлические комплексы, также известные как координационные соединения, включают практически все металлические соединения. [29] Изучение «координационной химии» — это изучение «неорганической химии» всех щелочных и щелочноземельных металлов , переходных металлов , лантаноидов , актинидов и металлоидов . Таким образом, координационная химия — это химия большинства элементов периодической таблицы. Металлы и ионы металлов существуют, по крайней мере в конденсированных фазах, только окруженные лигандами.
Области координационной химии можно классифицировать в соответствии с природой лигандов в общих чертах:
Минералогия , материаловедение и химия твердого тела — в применении к ионам металлов — являются подмножествами координационной химии в том смысле, что металлы окружены лигандами. Во многих случаях эти лиганды представляют собой оксиды или сульфиды, но металлы тем не менее координируются, и принципы и рекомендации, обсуждаемые ниже, применяются. В гидратах , по крайней мере, некоторые из лигандов представляют собой молекулы воды. Верно, что фокус минералогии, материаловедения и химии твердого тела отличается от обычного фокуса координационной или неорганической химии. Первые в основном занимаются полимерными структурами, свойствами, возникающими в результате коллективного воздействия многих тесно взаимосвязанных металлов. Напротив, координационная химия фокусируется на реакционной способности и свойствах комплексов, содержащих отдельные атомы металлов или небольшие ансамбли атомов металлов.
Основная процедура наименования комплекса следующая:
Примеры:
Координационное число лигандов, присоединенных к более чем одному металлу (мостиковые лиганды), указывается индексом к греческому символу μ, помещаемому перед названием лиганда. Так, димер трихлорида алюминия описывается как Al 2 Cl 4 (μ 2 -Cl) 2 .
Любая анионная группа может быть электронно стабилизирована любым катионом. Анионный комплекс может быть стабилизирован катионом водорода, становясь кислотным комплексом, который может диссоциировать, высвобождая катионный водород. Этот тип комплексного соединения имеет название с добавлением «ic» после центрального металла. Например, H 2 [Pt(CN) 4 ] имеет название тетрацианоплатиновая (II) кислота.
Сродство ионов металлов к лигандам описывается константой устойчивости, также называемой константой образования, и обозначается символом K f . Это константа равновесия для его сборки из составляющего металла и лигандов, и может быть рассчитана соответствующим образом, как в следующем примере для простого случая:
где: x, y и z — стехиометрические коэффициенты каждого вида. M обозначает металл/ион металла, L — основания Льюиса, и, наконец, Z — комплексные ионы. Константы образования сильно различаются. Большие значения указывают на то, что металл имеет высокое сродство к лиганду, при условии, что система находится в равновесии. [31]
Иногда константа устойчивости будет иметь другую форму, известную как константа дестабильности. Эта константа выражается как обратная константе образования и обозначается как K d = 1/K f . [32] Эта константа представляет собой обратную реакцию разложения комплексного иона на его отдельные компоненты металла и лиганда. При сравнении значений K d , чем больше значение, тем более нестабилен комплексный ион.
В результате образования этих комплексных ионов в растворах они также могут играть ключевую роль в растворимости других соединений. Когда образуется комплексный ион, он может изменять концентрации своих компонентов в растворе. Например:
Если бы обе эти реакции происходили в одном реакционном сосуде, растворимость хлорида серебра увеличилась бы за счет присутствия NH 4 OH, поскольку образование комплекса диаммина аргентум(I) потребляет значительную часть свободных ионов серебра из раствора. По принципу Ле Шателье это приводит к смещению равновесия реакции растворения хлорида серебра, в котором в качестве продукта образуется ион серебра, вправо.
Эту новую растворимость можно рассчитать, зная значения K f и K sp для исходных реакций. Растворимость определяется по существу путем объединения двух отдельных равновесий в одну объединенную равновесную реакцию, и эта объединенная реакция определяет новую растворимость. Таким образом, K c , новая константа растворимости, обозначается как:
Поскольку металлы существуют в растворе только в виде координационных комплексов, из этого следует, что этот класс соединений полезен во многих отношениях.
В бионеорганической химии и биоорганометаллической химии координационные комплексы выполняют либо структурные, либо каталитические функции. По оценкам, 30% белков содержат ионы металлов. Примерами являются интенсивно окрашенный витамин B12 , гемовая группа в гемоглобине , цитохромы , хлориновая группа в хлорофилле и карбоксипептидаза , гидролитический фермент, важный для пищеварения. Другим комплексным ионным ферментом является каталаза , которая разлагает отходы клетки — перекись водорода . Синтетические координационные соединения также используются для связывания с белками и особенно нуклеиновыми кислотами (например, противораковый препарат цисплатин ).
Гомогенный катализ является основным применением координационных соединений для производства органических веществ. Процессы включают гидрирование , гидроформилирование , окисление . В одном примере сочетание трихлорида титана и триэтилалюминия приводит к катализаторам Циглера-Натта , используемым для полимеризации этилена и пропилена для получения полимеров, имеющих большое коммерческое значение, таких как волокна, пленки и пластики.
Никель, кобальт и медь могут быть извлечены с помощью гидрометаллургических процессов с участием комплексных ионов. Они извлекаются из руд в виде аммиачных комплексов. Металлы также могут быть разделены с помощью селективного осаждения и растворимости комплексных ионов. Цианид используется в основном для извлечения золота и серебра из руд.
Фталоцианиновые комплексы представляют собой важный класс пигментов.
В свое время координационные соединения использовались для определения наличия металлов в образце. Качественный неорганический анализ в значительной степени был вытеснен инструментальными методами анализа, такими как атомно-абсорбционная спектроскопия (ААС), атомно-эмиссионная спектроскопия с индуктивно связанной плазмой (ИСП-АЭС) и масс-спектрометрия с индуктивно связанной плазмой (ИСП-МС).