Молекулярная биология / m ə ˈ l ɛ k j ʊ l ər / — это раздел биологии , который стремится понять молекулярные основы биологической активности внутри и между клетками , включая биомолекулярный синтез, модификацию, механизмы и взаимодействия. [1] [2] [3]
Молекулярная биология была впервые описана как подход, направленный на изучение основ биологических явлений — раскрытие структур биологических молекул, а также их взаимодействий и того, как эти взаимодействия объясняют наблюдения классической биологии. [4]
Термин «молекулярная биология» впервые был использован в 1945 году физиком Уильямом Эстбери . В 1953 году Фрэнсис Крик , Джеймс Уотсон , Розалинд Франклин и коллеги, работавшие в Отделении Совета медицинских исследований Кавендишской лаборатории , создали модель двойной спирали ДНК . Они предложили структуру ДНК на основе предыдущих исследований, проведенных Франклином и Морисом Уилкинсом . Это привело к открытию материала ДНК у других микроорганизмов, растений и животных. [5]
Область молекулярной биологии включает методы, которые позволяют ученым изучать молекулярные процессы. [6] Эти методы используются для эффективного поиска новых лекарств , диагностики заболеваний и лучшего понимания физиологии клеток. [7] Некоторые клинические исследования и медицинские методы лечения, основанные на молекулярной биологии, подпадают под категорию генной терапии, тогда как использование молекулярной биологии или молекулярно-клеточной биологии в медицине теперь называется молекулярной медициной .


Молекулярная биология находится на стыке биохимии и генетики; По мере того как эти научные дисциплины возникли и развивались в 20 веке, стало ясно, что они обе стремятся определить молекулярные механизмы, лежащие в основе жизненно важных клеточных функций. [8] Достижения молекулярной биологии тесно связаны с разработкой новых технологий и их оптимизацией. [9] Молекулярная биология была объяснена работами многих ученых, и, таким образом, история этой области зависит от понимания этих ученых и их экспериментов. [ нужна цитата ]
Область генетики возникла как попытка понять молекулярные механизмы генетического наследования и структуру гена . Грегор Мендель стал пионером этой работы в 1866 году, когда он впервые написал законы генетического наследования, основанные на его исследованиях скрещивания растений гороха. [10] Одним из таких законов генетического наследования является закон сегрегации , который гласит, что диплоидные особи с двумя аллелями определенного гена передадут одну из этих аллелей своему потомству. [11] Из-за его критической работы изучение генетической наследственности обычно называют менделевской генетикой . [12]
Важнейшей вехой в молекулярной биологии стало открытие структуры ДНК . Эта работа началась в 1869 году Фридрихом Мишером , швейцарским биохимиком, который первым предложил структуру, называемую нуклеином , которая, как мы теперь знаем, представляет собой (дезоксирибонуклеиновую кислоту) или ДНК. [13] Он открыл это уникальное вещество, изучая компоненты гнойных повязок и отмечая уникальные свойства «фосфорсодержащих веществ». [14] Другим заметным автором модели ДНК был Феб Левен , который предложил «полинуклеотидную модель» ДНК в 1919 году в результате своих биохимических экспериментов на дрожжах. [15] В 1950 году Эрвин Чаргафф расширил работу Левена и объяснил несколько важных свойств нуклеиновых кислот: во-первых, последовательность нуклеиновых кислот варьируется у разных видов. [16] Во-вторых, общая концентрация пуринов (аденина и гуанина) всегда равна общей концентрации пиримидинов (цистеина и тимина). [13] Теперь это известно как правило Чаргаффа. В 1953 году Джеймс Уотсон и Фрэнсис Крик опубликовали двойную спиральную структуру ДНК [17] , используя работы по рентгеновской кристаллографии , выполненные Розалиндой Франклин и Морисом Уилкинсом . Уотсон и Крик описали структуру ДНК и высказали предположения о значении этой уникальной структуры для возможных механизмов репликации ДНК. [17] Уотсон и Крик были удостоены Нобелевской премии по физиологии и медицине в 1962 году вместе с Уилкинсом за предложение модели структуры ДНК. [5]
В 1961 году было продемонстрировано, что когда ген кодирует белок , три последовательных основания ДНК гена определяют каждую последующую аминокислоту белка. [18] Таким образом, генетический код представляет собой триплетный код, где каждый триплет (называемый кодоном ) определяет определенную аминокислоту. Кроме того, было показано, что кодоны не перекрываются друг с другом в последовательности ДНК, кодирующей белок, и что каждая последовательность считывается с фиксированной начальной точки. В 1962–1964 годах благодаря использованию условно летальных мутантов бактериального вируса [19] были достигнуты фундаментальные успехи в понимании функций и взаимодействий белков, участвующих в механизмах репликации ДНК , репарации ДНК , рекомбинации ДНК и при сборке молекулярных структур. [20]

В 1928 году Фредерик Гриффит обнаружил свойство вирулентности бактерий пневмококка, которое убивало лабораторных крыс. Согласно распространенному в то время Менделю, передача генов могла происходить только от родительских клеток к дочерним. Гриффит выдвинул другую теорию, заявив, что перенос генов, происходящий у представителей одного поколения, известен как горизонтальный перенос генов (HGT). Это явление теперь называется генетической трансформацией. [ нужна цитата ]
Эксперимент Гриффита касался бактерий Streptococcus pneumoniae , у которых было два разных штамма: один вирулентный и гладкий, а другой авирулентный и шероховатый. Гладкий штамм имел блестящий вид благодаря наличию особого типа полисахарида – капсулы полимера глюкозы и глюкуроновой кислоты. Из-за этого полисахаридного слоя бактерий иммунная система хозяина не может распознать бактерии и убивает хозяина. Другой, авирулентный, шероховатый штамм лишен этой полисахаридной капсулы и имеет тусклый, шероховатый вид. [ нужна цитата ]
Известно, что наличие или отсутствие капсулы у штамма генетически детерминировано. Гладкие и шероховатые деформации встречаются в нескольких различных типах, таких как SI, S-II, S-III и т. д. и RI, R-II, R-III и т. д. соответственно. Все эти подтипы бактерий S и R отличаются друг от друга типом продуцируемого ими антигена. [5]

Подтверждение того, что ДНК является генетическим материалом, вызывающим инфекцию, было получено в эксперименте Херши-Чейза . Для эксперимента они использовали кишечную палочку и бактериофаг. Этот эксперимент также известен как эксперимент с блендером, поскольку кухонный блендер использовался в качестве основного прибора. Альфред Херши и Марта Чейз продемонстрировали, что ДНК, введенная фаговой частицей в бактерию, содержит всю информацию, необходимую для синтеза фаговых частиц-потомков. Они использовали радиоактивность, чтобы пометить белковую оболочку бактериофага радиоактивной серой и ДНК радиоактивным фосфором в двух разных пробирках соответственно. После смешивания бактериофага и E.coli в пробирке начинается инкубационный период, в течение которого фаг трансформирует генетический материал в клетках E.coli . Затем смесь смешивают или взбалтывают, что отделяет фаг от клеток E.coli . Всю смесь центрифугировали, осадок, содержащий клетки E.coli , проверяли, а супернатант отбрасывали. В клетках E.coli был обнаружен радиоактивный фосфор, что указывало на то, что трансформированный материал представлял собой ДНК, а не белковую оболочку.
Трансформированная ДНК прикрепляется к ДНК E.coli , и радиоактивность наблюдается только на ДНК бактериофага. Эта мутировавшая ДНК может быть передана следующему поколению, и появилась теория трансдукции. Трансдукция — это процесс, при котором бактериальная ДНК переносит фрагмент бактериофага и передает его следующему поколению. Это также тип горизонтального переноса генов. [5]
В начале 2020-х годов молекулярная биология вступила в золотой век, определяемый как вертикальным, так и горизонтальным техническим развитием. В вертикальном плане новые технологии позволяют в режиме реального времени отслеживать биологические процессы на атомном уровне. [21] Сегодня молекулярные биологи имеют доступ к все более доступным данным секвенирования на все более глубоких глубинах, что облегчает разработку новых методов генетических манипуляций с новыми немодельными организмами. Аналогичным образом, синтетические молекулярные биологи будут стимулировать промышленное производство малых и макромолекул путем введения экзогенных метаболических путей в различные линии прокариотических и эукариотических клеток. [22]
Горизонтально данные секвенирования становятся все более доступными и используются во многих различных научных областях. Это будет способствовать развитию промышленности в развивающихся странах и увеличит доступность для отдельных исследователей. Аналогичным образом эксперименты по редактированию генов CRISPR-Cas9 теперь могут быть задуманы и реализованы отдельными людьми менее чем за 10 000 долларов США на новых организмах, что будет способствовать развитию промышленных и медицинских приложений. [23]

В следующем списке описывается точка зрения на междисциплинарные отношения между молекулярной биологией и другими смежными областями. [24]
Хотя исследователи практикуют методы, специфичные для молекулярной биологии, обычно они комбинируются с методами генетики и биохимии . Большая часть молекулярной биологии носит количественный характер, и в последнее время значительный объем работы был выполнен с использованием таких методов информатики, как биоинформатика и вычислительная биология . Молекулярная генетика , изучение структуры и функции генов, была одной из наиболее известных областей молекулярной биологии с начала 2000-х годов. Другие разделы биологии получают информацию от молекулярной биологии, либо напрямую изучая взаимодействия молекул сами по себе, например, в клеточной биологии и биологии развития , либо косвенно, когда молекулярные методы используются для вывода об исторических атрибутах популяций или видов , как в области эволюционной биологии , такие как популяционная генетика и филогенетика . В биофизике также существует давняя традиция изучения биомолекул «с нуля», или молекулярно . [27]

Молекулярное клонирование используется для выделения и последующего переноса интересующей последовательности ДНК в плазмидный вектор. [28] Эта технология рекомбинантной ДНК была впервые разработана в 1960-х годах. [29] В этом методе последовательность ДНК , кодирующая интересующий белок, клонируется с использованием полимеразной цепной реакции (ПЦР) и/или ферментов рестрикции в плазмиду ( вектор экспрессии ). Плазмидный вектор обычно имеет как минимум три отличительные особенности: начало репликации, сайт множественного клонирования (MCS) и селективный маркер (обычно устойчивость к антибиотикам ). Кроме того, выше MCS находятся промоторные области и сайт начала транскрипции , которые регулируют экспрессию клонированного гена.
Эту плазмиду можно вставлять как в бактериальные, так и в животные клетки. Введение ДНК в бактериальные клетки может быть осуществлено путем трансформации путем поглощения обнаженной ДНК, конъюгации посредством межклеточного контакта или трансдукции с помощью вирусного вектора. Введение ДНК в эукариотические клетки, например клетки животных, физическими или химическими средствами называется трансфекцией . Доступно несколько различных методов трансфекции, таких как трансфекция фосфатом кальция, электропорация , микроинъекция и трансфекция липосом . Плазмида может быть интегрирована в геном , что приводит к стабильной трансфекции, или может оставаться независимой от генома и временно экспрессироваться, что называется временной трансфекцией. [30] [31]
ДНК, кодирующая интересующий белок, теперь находится внутри клетки, и теперь этот белок можно экспрессировать. Доступны различные системы, такие как индуцируемые промоторы и специфические клеточные сигнальные факторы, которые помогают экспрессировать интересующий белок на высоких уровнях. Затем из бактериальной или эукариотической клетки можно экстрагировать большие количества белка. Белок можно проверить на ферментативную активность в различных ситуациях, белок можно кристаллизовать для изучения его третичной структуры или, в фармацевтической промышленности, можно изучить активность новых лекарств против белка. [32]
Полимеразная цепная реакция (ПЦР) — чрезвычайно универсальный метод копирования ДНК. Короче говоря, ПЦР позволяет копировать или модифицировать определенную последовательность ДНК заранее определенным образом. Реакция чрезвычайно мощная и в идеальных условиях может амплифицировать одну молекулу ДНК до 1,07 миллиарда молекул менее чем за два часа. ПЦР имеет множество применений, включая изучение экспрессии генов, обнаружение патогенных микроорганизмов, обнаружение генетических мутаций и введение мутаций в ДНК. [33] Метод ПЦР можно использовать для введения сайтов рестрикционных ферментов на концы молекул ДНК или для мутации определенных оснований ДНК; последний метод называется сайт-направленным мутагенезом . ПЦР также можно использовать для определения того, обнаружен ли конкретный фрагмент ДНК в библиотеке кДНК . ПЦР имеет множество разновидностей, таких как ПЦР с обратной транскрипцией ( ОТ-ПЦР ) для амплификации РНК и, в последнее время, количественная ПЦР , которая позволяет количественно измерять молекулы ДНК или РНК. [34] [35]
.jpg/440px-Two_percent_Agarose_Gel_in_Borate_Buffer_cast_in_a_Gel_Tray_(Front,_angled).jpg)

Гель-электрофорез — это метод разделения молекул по размеру с использованием агарозного или полиакриламидного геля. [36] Этот метод является одним из основных инструментов молекулярной биологии. Основной принцип заключается в том, что фрагменты ДНК можно разделить, пропуская через гель электрический ток — поскольку основная цепь ДНК содержит отрицательно заряженные фосфатные группы, ДНК будет мигрировать через агарозный гель к положительному концу тока. [36] Белки также можно разделить по размеру с использованием геля SDS-PAGE или по размеру и их электрическому заряду с помощью так называемого 2D-гель-электрофореза . [37]
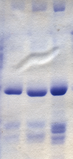
Анализ Брэдфорда — это метод молекулярной биологии, который позволяет быстро и точно определить количество белковых молекул, используя уникальные свойства красителя Coomassie Brilliant Blue G-250. [38] Кумасси синий претерпевает видимый сдвиг цвета от красновато-коричневого до ярко-синего при связывании с белком. [38] В нестабильном катионном состоянии кумасси синий имеет фоновую длину волны 465 нм и излучает красновато-коричневый цвет. [39] Когда кумасси синий связывается с белком в кислом растворе, длина волны фона смещается до 595 нм, и краситель приобретает ярко-синий цвет. [39] Белки, участвовавшие в анализе, связываются с кумасси синим примерно за 2 минуты, а комплекс белок-краситель стабилен в течение примерно часа, хотя рекомендуется измерять поглощение в течение 5–20 минут после начала реакции. [38] Концентрацию белка в анализе Брэдфорда можно затем измерить с помощью спектрофотометра видимого света , и поэтому не требуется обширное оборудование. [39]
Этот метод был разработан в 1975 году Мэрион М. Брэдфорд и позволил значительно быстрее и точнее количественно определить белок по сравнению с предыдущими методами: процедурой Лоури и биуретовым анализом. [38] В отличие от предыдущих методов, анализ Брэдфорда не подвержен помехам со стороны нескольких небелковых молекул, включая этанол, хлорид натрия и хлорид магния. [38] Однако он подвержен влиянию сильных щелочных буферных агентов, таких как додецилсульфат натрия (SDS). [38]
Термины нозерн- , вестерн- и восточный блоттинг произошли от того, что первоначально было шуткой молекулярной биологии, которая разыграла термин Саузерн-блоттинг после метода, описанного Эдвином Саузерн для гибридизации блоттинга ДНК. Патрисия Томас, разработчик РНК-блоттинга, который затем стал известен как нозерн-блоттинг , на самом деле не использовала этот термин. [40]
Саузерн-блоттинг, названный в честь своего изобретателя, биолога Эдвина Саузерна , представляет собой метод исследования наличия определенной последовательности ДНК в образце ДНК. Образцы ДНК до или после расщепления ферментом рестрикции (рестрикционной эндонуклеазой) разделяются с помощью гель-электрофореза, а затем переносятся на мембрану путем блоттинга посредством капиллярного действия . Затем мембрану подвергают воздействию меченого ДНК-зонда, который имеет последовательность оснований, комплементарную последовательности интересующей ДНК. [41] Саузерн-блоттинг реже используется в лабораторных исследованиях из-за способности других методов, таких как ПЦР , обнаруживать определенные последовательности ДНК из образцов ДНК. Однако эти блоты все еще используются для некоторых приложений, таких как измерение количества копий трансгена у трансгенных мышей или при конструировании линий эмбриональных стволовых клеток с нокаутом генов . [27]
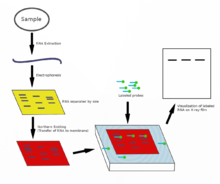
Нозерн-блоттинг используется для изучения присутствия определенных молекул РНК в качестве относительного сравнения между набором различных образцов РНК. По сути, это комбинация денатурирующего гель-электрофореза РНК и блоттинга . В этом процессе РНК разделяется по размеру, а затем переносится на мембрану, которая затем исследуется меченым комплементом интересующей последовательности. Результаты можно визуализировать различными способами в зависимости от используемой метки; однако большинство из них приводит к обнаружению полос, отражающих размеры РНК, обнаруженной в образце. Интенсивность этих полос связана с количеством целевой РНК в анализируемых образцах. Эта процедура обычно используется для изучения того, когда и в каком объеме происходит экспрессия генов, путем измерения количества этой РНК, присутствующей в различных образцах, при условии, что посттранскрипционная регуляция не происходит и что уровни мРНК отражают пропорциональные уровни соответствующего белка, находящегося в организме. произведено. Это один из основных инструментов для определения того, в какое время и при каких условиях определенные гены экспрессируются в живых тканях. [42] [43]
Вестерн-блоттинг — это метод, с помощью которого можно обнаружить определенные белки из смеси белков. [44] Вестерн-блоттинг можно использовать для определения размера выделенных белков, а также для количественной оценки их экспрессии. [45] При вестерн-блоттинге белки сначала разделяются по размеру в тонком геле, зажатом между двумя стеклянными пластинами, с помощью метода, известного как SDS-PAGE . Белки в геле затем переносятся на поливинилиденфторид (ПВДФ), нитроцеллюлозу, нейлон или другую поддерживающую мембрану. Эту мембрану затем можно исследовать растворами антител . Антитела, которые специфически связываются с интересующим белком, затем можно визуализировать с помощью различных методов, включая цветные продукты, хемилюминесценцию или авторадиографию . Часто антитела метят ферментами. Когда хемилюминесцентный субстрат подвергается воздействию фермента, это позволяет его обнаружить. Использование методов вестерн-блоттинга позволяет не только обнаруживать, но и проводить количественный анализ. Методы, аналогичные вестерн-блоттингу, можно использовать для прямого окрашивания специфических белков в живых клетках или срезах тканей . [44] [46]
Техника истерн-блоттинга используется для обнаружения посттрансляционной модификации белков. Белки, нанесенные на мембрану из ПВДФ или нитроцеллюлозы, исследуются на наличие модификаций с использованием определенных субстратов. [47]

Микрочип ДНК представляет собой набор пятен, прикрепленных к твердой основе, такой как предметное стекло микроскопа , где каждое пятно содержит один или несколько фрагментов одноцепочечных олигонуклеотидов ДНК . Массивы позволяют наносить большое количество очень маленьких (диаметром 100 микрометров) пятен на одно предметное стекло. Каждое пятно содержит молекулу фрагмента ДНК, комплементарную одной последовательности ДНК . Вариант этого метода позволяет оценить экспрессию генов организма на определенной стадии развития ( профилирование экспрессии ). В этом методе РНК в ткани выделяется и преобразуется в меченую комплементарную ДНК (кДНК). Затем эта кДНК гибридизуется с фрагментами матрицы, и можно провести визуализацию гибридизации. Поскольку можно создать несколько массивов с одинаковым положением фрагментов, они особенно полезны для сравнения экспрессии генов в двух разных тканях, таких как здоровая и раковая ткань. Кроме того, можно измерить, какие гены экспрессируются и как эта экспрессия меняется со временем или под воздействием других факторов. Существует много разных способов изготовления микрочипов; наиболее распространенными являются кремниевые чипы, предметные стекла с пятнами диаметром около 100 микрометров, индивидуальные матрицы и матрицы с более крупными пятнами на пористых мембранах (макрочипы). В одном массиве может быть от 100 до более 10 000 мест. Массивы также можно создавать с использованием других молекул, помимо ДНК. [48] [49] [50] [51]
Аллель-специфический олигонуклеотид (АСО) — это метод, который позволяет обнаруживать мутации одного основания без необходимости ПЦР или гель-электрофореза. Короткие (20–25 нуклеотидов в длину) меченые зонды подвергаются воздействию нефрагментированной целевой ДНК, гибридизация происходит с высокой специфичностью из-за короткой длины зондов, и даже изменение одного основания будет препятствовать гибридизации. Затем целевую ДНК промывают и удаляют меченые зонды, которые не гибридизовались. Затем целевую ДНК анализируют на наличие зонда с помощью радиоактивности или флуоресценции. В этом эксперименте, как и в большинстве методов молекулярной биологии, необходимо использовать контроль, чтобы обеспечить успешное экспериментирование. [52] [53]
В молекулярной биологии процедуры и технологии постоянно развиваются, а старые технологии отказываются от них. Например, до появления гель-электрофореза ДНК ( агароза или полиакриламид ) размер молекул ДНК обычно определялся по скорости седиментации в градиентах сахарозы - медленный и трудоемкий метод, требующий дорогостоящего оборудования; до градиентов сахарозы использовали вискозиметрию . Помимо исторического интереса, часто стоит знать и о старых технологиях, поскольку иногда бывает полезно решить другую новую проблему, для которой новая техника непригодна. [54]