Нейромедиатор — это сигнальная молекула , секретируемая нейроном для воздействия на другую клетку через синапс . Клетка, получающая сигнал, или клетка-мишень, может быть другим нейроном, но также может быть железистой или мышечной клеткой . [1]
Нейромедиаторы высвобождаются из синаптических везикул в синаптическую щель , где они могут взаимодействовать с рецепторами нейромедиаторов на клетке-мишени. Эффект нейромедиатора на клетку-мишень определяется рецептором, с которым он связывается. Многие нейротрансмиттеры синтезируются из простых и многочисленных предшественников, таких как аминокислоты , которые легко доступны и часто требуют небольшого количества стадий биосинтеза для преобразования.
Нейротрансмиттеры необходимы для функционирования сложных нервных систем. Точное количество уникальных нейротрансмиттеров у человека неизвестно, но идентифицировано более 100. [2] Общие нейротрансмиттеры включают глутамат , ГАМК , ацетилхолин , глицин и норадреналин .
Нейротрансмиттеры обычно синтезируются в нейронах и состоят из молекул-предшественников, которые в изобилии обнаруживаются в клетке, или происходят из них. Классы нейромедиаторов включают аминокислоты , моноамины и пептиды . Моноамины синтезируются путем изменения одной аминокислоты. Например, предшественником серотонина является аминокислота триптофан. Пептидные трансмиттеры, или нейропептиды, представляют собой белковые трансмиттеры, которые часто высвобождаются вместе с другими трансмиттерами, оказывая модулирующее действие. [3] Пуриновые нейротрансмиттеры, такие как АТФ, происходят из нуклеиновых кислот. Другие нейротрансмиттеры состоят из продуктов метаболизма, таких как оксид азота и окись углерода . [ нужна цитата ]

Нейромедиаторы обычно хранятся в синаптических пузырьках , сгруппированных вблизи клеточной мембраны в конце аксона пресинаптического нейрона. Однако некоторые нейротрансмиттеры, такие как метаболические газы окись углерода и оксид азота, синтезируются и высвобождаются сразу после возникновения потенциала действия, даже не откладываясь в везикулах. [4]
Как правило, нейромедиатор высвобождается в пресинаптическом терминале в ответ на электрический сигнал, называемый потенциалом действия, в пресинаптическом нейроне. Однако «базовое» высвобождение низкого уровня происходит и без электрической стимуляции. Нейромедиаторы высвобождаются и диффундируют через синаптическую щель , где они связываются со специфическими рецепторами на мембране постсинаптического нейрона. [5]
После попадания в синаптическую щель нейромедиаторы диффундируют через синапс, где они могут взаимодействовать с рецепторами клетки-мишени. Эффект нейромедиатора зависит от идентичности рецепторов клетки-мишени, присутствующих в синапсе. В зависимости от рецептора связывание нейротрансмиттеров может вызывать возбуждение , торможение или модуляцию постсинаптического нейрона. Смотрите ниже для получения дополнительной информации. [ нужна цитата ]
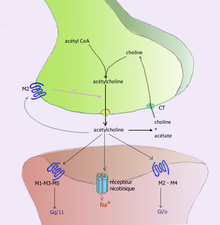
Чтобы избежать постоянной активации рецепторов постсинаптической клетки или клетки-мишени, нейротрансмиттеры должны быть удалены из синаптической щели. [6] Нейромедиаторы удаляются посредством одного из трех механизмов:
Например, ацетилхолин удаляется путем расщепления его ацетильной группы ферментом ацетилхолинэстеразой ; оставшийся холин затем поглощается и перерабатывается пресинаптическим нейроном для синтеза большего количества ацетилхолина . [9] Другие нейромедиаторы способны диффундировать из целевых синаптических соединений и выводятся из организма через почки или разрушаются в печени. Каждый нейромедиатор имеет очень специфические пути деградации в регуляторных точках, на которые может воздействовать регуляторная система организма или лекарства. Кокаин блокирует транспортер дофамина, ответственный за обратный захват дофамина. Без транспортера дофамин гораздо медленнее диффундирует из синаптической щели и продолжает активировать дофаминовые рецепторы на клетке-мишени. [10]
До начала 20-го века ученые предполагали, что большая часть синаптической связи в мозге является электрической. Однако в ходе гистологического исследования Рамона-и-Кахаля был обнаружен разрыв между нейронами размером от 20 до 40 нм, известный сегодня как синаптическая щель . Наличие такого разрыва предполагало связь через химические посланники, пересекающие синаптическую щель, а в 1921 году немецкий фармаколог Отто Леви подтвердил, что нейроны могут общаться, выделяя химические вещества. Благодаря серии экспериментов с блуждающими нервами лягушек Леви смог вручную замедлить частоту сердечных сокращений лягушек, контролируя количество физиологического раствора, окружающего блуждающий нерв. По завершении этого эксперимента Лоуи заявил, что симпатическая регуляция сердечной функции может осуществляться посредством изменения концентрации химических веществ. Кроме того, Отто Леви приписывают открытие ацетилхолина (АХ) – первого известного нейромедиатора. [11]
Для идентификации нейромедиаторов обычно учитывают следующие критерии:
Однако, учитывая достижения фармакологии , генетики и химической нейроанатомии , термин «нейромедиатор» можно применять к химическим веществам, которые:
Анатомическую локализацию нейротрансмиттеров обычно определяют с помощью иммуноцитохимических методов, которые определяют расположение либо самих веществ-медиаторов, либо ферментов, участвующих в их синтезе. Иммуноцитохимические методы также показали, что многие медиаторы, особенно нейропептиды , локализованы совместно, то есть нейрон может высвобождать более одного медиатора из своего синаптического окончания . [13] Для идентификации нейротрансмиттеров во всей центральной нервной системе можно использовать различные методы и эксперименты, такие как окрашивание , стимуляция и сбор . [14]
Нейроны общаются друг с другом через синапсы — специализированные точки контакта, через которые нейротрансмиттеры передают сигналы. Когда потенциал действия достигает пресинаптического терминала , он может вызвать высвобождение нейротрансмиттеров в синаптическую щель. Эти нейротрансмиттеры затем связываются с рецепторами на постсинаптической мембране, влияя на принимающий нейрон либо тормозным , либо возбуждающим образом. Если общие возбуждающие влияния перевешивают тормозящие влияния, принимающий нейрон может генерировать собственный потенциал действия, продолжая передачу информации следующему нейрону в сети. Этот процесс обеспечивает поток информации и формирование сложных нейронных сетей. [15]
Нейромедиатор может оказывать возбуждающее, тормозящее или модулирующее действие на клетку-мишень. Эффект определяется рецепторами, с которыми взаимодействует нейромедиатор на постсинаптической мембране. Нейромедиатор влияет на трансмембранный поток ионов либо увеличивая (возбуждая), либо уменьшая (ингибируя) вероятность того, что клетка, с которой он вступает в контакт, выработает потенциал действия. Синапсы, содержащие рецепторы с возбуждающим эффектом, называются синапсами I типа, а синапсы типа II содержат рецепторы с тормозящим эффектом. [16] Таким образом, несмотря на большое разнообразие синапсов, все они передают сообщения только этих двух типов. Оба типа отличаются внешним видом и преимущественно располагаются на разных участках нейронов, находящихся под его воздействием. [17] Рецепторы с модулирующим эффектом распространены по всем синаптическим мембранам, и связывание нейротрансмиттеров приводит в движение сигнальные каскады, которые помогают клетке регулировать ее функцию. [18] Связывание нейротрансмиттеров с рецепторами с модулирующим эффектом может иметь множество результатов. Например, это может привести к увеличению или уменьшению чувствительности к будущим стимулам за счет привлечения большего или меньшего количества рецепторов к синаптической мембране.
Синапсы типа I (возбуждающие) обычно расположены на стержнях или шипах дендритов, тогда как синапсы типа II (тормозящие) обычно расположены на теле клетки. Кроме того, синапсы I типа имеют круглые синаптические везикулы, тогда как везикулы синапсов II типа уплощены. Материал на пресинаптических и постсинаптических мембранах в синапсе I типа более плотный, чем в синапсе II типа, а синаптическая щель I типа шире. Наконец, активная зона синапса типа I больше, чем активная зона синапса типа II.
Разное расположение синапсов типа I и типа II делит нейрон на две зоны: возбуждающее дендритное дерево и тело тормозной клетки. С точки зрения торможения возбуждение поступает по дендритам и распространяется на аксонный бугорок , вызывая потенциал действия . Если сообщение необходимо остановить, лучше всего остановить его, применив торможение к телу клетки, вблизи аксонного холмика, где возникает потенциал действия. Другой способ концептуализировать возбуждающе-тормозное взаимодействие — представить себе, как возбуждение преодолевает торможение. Если тело клетки обычно находится в заторможенном состоянии, единственный способ создать потенциал действия на аксонном холмике — это уменьшить торможение тела клетки. В этой стратегии «открой ворота» возбуждающее сообщение похоже на скаковую лошадь, готовую бежать по дорожке, но сначала необходимо убрать тормозящие стартовые ворота. [19]
Как объяснялось выше, единственным прямым действием нейромедиатора является активация рецептора. Следовательно, эффекты нейромедиаторной системы зависят от связей нейронов, использующих медиатор, и химических свойств рецепторов.
Существует много разных способов классификации нейротрансмиттеров. Разделения их на аминокислоты , пептиды и моноамины достаточно для некоторых целей классификации. [27]
Основные нейромедиаторы:
Кроме того, обнаружено более 100 нейроактивных пептидов , и регулярно открываются новые. [30] [31] Многие из них выпускаются совместно с низкомолекулярными передатчиками. Тем не менее, в некоторых случаях пептид является основным передатчиком в синапсе. Бета-эндорфин является относительно известным примером пептидного нейротрансмиттера, поскольку он участвует в весьма специфических взаимодействиях с опиоидными рецепторами в центральной нервной системе .
Одиночные ионы (например, синаптически высвобождаемый цинк ) также считаются нейротрансмиттерами [32] , а также некоторые газообразные молекулы, такие как оксид азота (NO), окись углерода (CO) и сероводород (H 2 S). [33] Газы производятся в цитоплазме нейронов и немедленно диффундируют через клеточную мембрану во внеклеточную жидкость и в близлежащие клетки, чтобы стимулировать выработку вторичных мессенджеров. Растворимые газовые нейротрансмиттеры трудно изучать, так как они действуют быстро и сразу же разрушаются, существуя всего несколько секунд.
Наиболее распространенным медиатором является глутамат , который возбуждает более 90% синапсов человеческого мозга. [28] Следующей по распространенности является гамма-аминомасляная кислота, или ГАМК, которая оказывает ингибирующее действие более чем на 90% синапсов, не использующих глутамат. Хотя другие медиаторы используются в меньшем количестве синапсов, они могут быть очень важны функционально: подавляющее большинство психоактивных препаратов оказывают свое действие, изменяя действия некоторых нейромедиаторных систем, часто действующих через трансмиттеры, отличные от глутамата или ГАМК. Наркотики, вызывающие привыкание, такие как кокаин и амфетамины, оказывают свое воздействие в первую очередь на дофаминовую систему. Опиатные препараты, вызывающие привыкание , оказывают свое действие в первую очередь как функциональные аналоги опиоидных пептидов , которые, в свою очередь, регулируют уровень дофамина.
Нейроны, экспрессирующие определенные типы нейротрансмиттеров, иногда образуют отдельные системы, где активация системы влияет на большие объемы мозга, что называется объемной передачей . Основные системы нейромедиаторов включают, среди прочего, систему норадреналина (норадреналина), систему дофамина , систему серотонина и холинергическую систему. Следовые амины оказывают модулирующее действие на нейротрансмиссию в моноаминовых путях (т.е. дофаминовых, норадреналиновых и серотониновых путях) по всему мозгу посредством передачи сигналов через рецепторы, ассоциированные с следовыми аминами 1 . [37] [38] Ниже приводится краткое сравнение этих систем:
Понимание влияния лекарств на нейротрансмиттеры составляет значительную часть исследовательских инициатив в области нейробиологии . Большинство нейробиологов, занимающихся этой областью исследований, считают, что такие усилия могут еще больше продвинуть наше понимание цепей, ответственных за различные неврологические заболевания и расстройства, а также способов эффективного лечения и, возможно, когда-нибудь предотвращения или лечения таких заболеваний. [55] [ нужна медицинская ссылка ]
Наркотики могут влиять на поведение, изменяя активность нейромедиаторов. Например, лекарства могут снизить скорость синтеза нейротрансмиттеров, влияя на синтетический фермент(ы) этого нейромедиатора. Когда синтез нейромедиаторов блокируется, количество нейромедиаторов, доступных для высвобождения, становится существенно меньшим, что приводит к снижению активности нейромедиаторов. Некоторые лекарства блокируют или стимулируют высвобождение определенных нейротрансмиттеров. Альтернативно, лекарства могут предотвратить накопление нейромедиаторов в синаптических везикулах, вызывая утечку мембран синаптических везикул. Препараты, которые препятствуют связыванию нейромедиатора с его рецептором, называются антагонистами рецепторов . Например, препараты, используемые для лечения пациентов с шизофренией, такие как галоперидол, хлорпромазин и клозапин, являются антагонистами рецепторов дофамина в головном мозге. Другие препараты действуют путем связывания с рецептором и имитируют нормальный нейромедиатор. Такие препараты называются агонистами рецепторов . Примером агониста рецепторов является морфин , опиат, который имитирует эффекты эндогенного нейромедиатора β-эндорфина для облегчения боли. Другие препараты препятствуют дезактивации нейромедиатора после его высвобождения, тем самым продлевая действие нейромедиатора. Этого можно достичь путем блокирования обратного захвата или ингибирования деградирующих ферментов. Наконец, лекарства также могут предотвращать возникновение потенциала действия, блокируя активность нейронов в центральной и периферической нервной системе . Такие препараты, как тетродотоксин , которые блокируют нервную активность, обычно смертельны.
Лекарства, нацеленные на нейротрансмиттеры основных систем, влияют на всю систему, что может объяснить сложность действия некоторых лекарств. Кокаин , например, блокирует обратный захват дофамина обратно в пресинаптический нейрон, оставляя молекулы нейромедиатора в синаптической щели на длительный период времени. Поскольку дофамин дольше остается в синапсе, нейромедиатор продолжает связываться с рецепторами постсинаптического нейрона , вызывая приятную эмоциональную реакцию. Физическая зависимость от кокаина может возникнуть в результате длительного воздействия избытка дофамина в синапсах, что приводит к подавлению некоторых постсинаптических рецепторов. После того, как действие препарата проходит, у человека может возникнуть депрессия из-за снижения вероятности связывания нейромедиатора с рецептором. Флуоксетин является селективным ингибитором обратного захвата серотонина (СИОЗС), который блокирует обратный захват серотонина пресинаптической клеткой, что увеличивает количество серотонина, присутствующего в синапсе, и, кроме того, позволяет ему оставаться там дольше, обеспечивая потенциал для эффекта естественного высвободился серотонин. [56] AMPT предотвращает превращение тирозина в L-ДОФА , предшественник дофамина; резерпин предотвращает накопление дофамина в везикулах ; а депренил ингибирует моноаминоксидазу (МАО)-B и, таким образом, повышает уровень дофамина.
Агонист представляет собой химическое вещество, способное связываться с рецептором, таким как рецептор нейромедиатора, и инициировать ту же реакцию, которая обычно возникает при связывании эндогенного вещества. [60] Таким образом, агонист нейромедиатора будет инициировать тот же ответ рецептора, что и передатчик. В нейронах агонист может активировать рецепторы нейромедиаторов прямо или косвенно. Агонисты прямого связывания могут быть дополнительно охарактеризованы как полные агонисты , частичные агонисты и обратные агонисты . [61] [62]
Прямые агонисты действуют аналогично нейротрансмиттеру, связываясь непосредственно с связанными с ним рецепторными участками, которые могут располагаться на пресинаптическом нейроне или постсинаптическом нейроне, или на обоих. [63] Обычно рецепторы нейромедиаторов расположены на постсинаптическом нейроне, тогда как ауторецепторы нейромедиаторов расположены на пресинаптическом нейроне, как в случае моноаминовых нейротрансмиттеров ; [37] в некоторых случаях нейромедиатор использует ретроградную нейротрансмиссию , тип передачи сигналов обратной связи в нейронах, при котором нейромедиатор высвобождается постсинаптически и связывается с рецепторами-мишенями, расположенными на пресинаптическом нейроне. [64] [примечание 1] Никотин , соединение, содержащееся в табаке , является прямым агонистом большинства никотиновых рецепторов ацетилхолина , главным образом расположенных в холинергических нейронах . [59] Опиаты , такие как морфин , героин , гидрокодон , оксикодон , кодеин и метадон , являются агонистами μ-опиоидных рецепторов ; это действие обеспечивает их эйфорические и обезболивающие свойства. [59]
Непрямые агонисты усиливают связывание нейротрансмиттеров с их рецепторами-мишенями, стимулируя высвобождение или предотвращая обратный захват нейротрансмиттеров. [63] Некоторые непрямые агонисты вызывают высвобождение нейромедиаторов и предотвращают обратный захват нейромедиаторов . Амфетамин , например, является непрямым агонистом постсинаптических рецепторов дофамина, норадреналина и серотонина в каждом соответствующем нейроне; [37] [38] он вызывает высвобождение нейромедиаторов в пресинаптический нейрон, а затем и в синаптическую щель, и предотвращает их обратный захват из синаптической щели путем активации TAAR1 , пресинаптического рецептора, связанного с G-белком , и связывания с сайтом на VMAT2 , типа Транспортер моноаминов расположен в синаптических пузырьках внутри моноаминовых нейронов . [37] [38]
Антагонист – это химическое вещество, которое действует внутри организма, снижая физиологическую активность другого химического вещества (например, опиата); особенно тот, который противодействует действию на нервную систему лекарства или вещества, естественным образом присутствующего в организме, путем объединения и блокирования его нервных рецепторов. [65]
Существует два основных типа антагонистов: антагонисты прямого действия и антагонисты непрямого действия:
Препарат-антагонист — это препарат, который прикрепляется (или связывается) к участку, называемому рецептором, без активации этого рецептора для возникновения биологического ответа. Поэтому говорят, что он не обладает внутренней активностью. Антагонист также можно назвать «блокатором» рецептора, поскольку он блокирует действие агониста на этот участок. Таким образом, фармакологические эффекты антагониста приводят к предотвращению связывания и активации соответствующего участка рецептора (например, лекарств, гормонов, нейротрансмиттеров). Антагонисты могут быть «конкурентными» или «необратимыми».
Конкурентный антагонист конкурирует с агонистом за связывание с рецептором. По мере увеличения концентрации антагониста связывание агониста постепенно ингибируется, что приводит к снижению физиологического ответа. Высокая концентрация антагониста может полностью подавить ответ. Однако это ингибирование можно обратить вспять путем увеличения концентрации агониста, поскольку агонист и антагонист конкурируют за связывание с рецептором. Таким образом, конкурентные антагонисты могут быть охарактеризованы как смещающие вправо соотношение «доза-реакция» агониста. В присутствии конкурентного антагониста требуется повышенная концентрация агониста, чтобы вызвать тот же ответ, который наблюдается в отсутствие антагониста.
Необратимый антагонист настолько сильно связывается с рецептором, что делает рецептор недоступным для связывания с агонистом. Необратимые антагонисты могут даже образовывать ковалентные химические связи с рецептором. В любом случае, если концентрация необратимого антагониста достаточно высока, количество несвязанных рецепторов, остающихся для связывания агониста, может быть настолько низким, что даже высокие концентрации агониста не вызывают максимального биологического ответа. [66]
Хотя прием предшественников нейромедиаторов действительно увеличивает синтез нейромедиаторов, данные относительно того, увеличивается ли высвобождение нейромедиаторов и активация постсинаптических рецепторов, неоднозначны. Даже при повышенном высвобождении нейромедиаторов неясно, приведет ли это к долгосрочному увеличению силы сигнала нейромедиаторов, поскольку нервная система может адаптироваться к таким изменениям, как увеличение синтеза нейромедиаторов, и, следовательно, может поддерживать постоянную активность. [70] [ ненадежный медицинский источник? ] Некоторые нейротрансмиттеры могут играть роль в депрессии, и есть некоторые данные, позволяющие предположить, что прием предшественников этих нейротрансмиттеров может быть полезен при лечении легкой и умеренной депрессии. [70] [ ненадежный медицинский источник? ] [71]
L -ДОФА , предшественник дофамина , проникающий через гематоэнцефалический барьер , используется при лечении болезни Паркинсона . Для пациентов с депрессией, у которых наблюдается низкая активность нейромедиатора норадреналина , имеется лишь мало доказательств пользы введения предшественников нейромедиатора. L-фенилаланин и L-тирозин являются предшественниками дофамина , норадреналина и адреналина . Для этих преобразований необходимы витамин B6 , витамин C и S-аденозилметионин . Несколько исследований предполагают потенциальные антидепрессивные эффекты L-фенилаланина и L-тирозина, но в этой области есть много возможностей для дальнейших исследований. [70] [ ненадежный медицинский источник? ]
Установлено, что введение L-триптофана , предшественника серотонина , удваивает выработку серотонина в мозге. Он значительно эффективнее плацебо при лечении легкой и умеренной депрессии. [70] [ ненадежный медицинский источник? ] Для этого преобразования требуется витамин С. [25] 5-гидрокситриптофан (5-HTP), также предшественник серотонина , более эффективен, чем плацебо. [70] [ ненадежный медицинский источник? ]
Заболевания и расстройства могут также влиять на определенные системы нейромедиаторов. Ниже приведены расстройства, связанные с увеличением, уменьшением или дисбалансом определенных нейротрансмиттеров.
Дофамин :
Например, проблемы с выработкой дофамина (в основном в черной субстанции ) могут привести к болезни Паркинсона — расстройству, которое влияет на способность человека двигаться так, как он хочет, что приводит к скованности, тремору или тряске и другим симптомам. Некоторые исследования показывают, что слишком мало или слишком много дофамина или проблемы с использованием дофамина в областях мышления и чувств мозга могут играть роль в таких расстройствах, как шизофрения или синдром дефицита внимания с гиперактивностью (СДВГ). Дофамин также участвует в зависимости и употреблении наркотиков, поскольку большинство рекреационных наркотиков вызывают приток дофамина в мозг (особенно опиоиды и метамфетамины ), что вызывает ощущение удовольствия, поэтому потребители постоянно жаждут наркотиков.
Серотонин :
Аналогичным образом, после того как некоторые исследования показали, что препараты, блокирующие переработку или обратный захват серотонина, помогают некоторым людям с диагнозом депрессия, было высказано предположение, что у людей с депрессией уровень серотонина может быть ниже нормального. Несмотря на широкую популяризацию, эта теория не нашла подтверждения в последующих исследованиях. [72] Поэтому селективные ингибиторы обратного захвата серотонина (СИОЗС) используются для увеличения количества серотонина в синапсах.
Глутамат :
Кроме того, проблемы с выработкой или использованием глутамата предположительно связаны со многими психическими расстройствами, включая аутизм , обсессивно-компульсивное расстройство (ОКР), шизофрению и депрессию . [73] Избыток глютамата связан с неврологическими заболеваниями, такими как болезнь Паркинсона , рассеянный склероз , болезнь Альцгеймера , инсульт и БАС (боковой амиотрофический склероз). [74]

Как правило, не существует научно установленных «норм» для соответствующих уровней или «баланса» различных нейротрансмиттеров. В большинстве случаев практически невозможно даже измерить уровни нейротрансмиттеров в мозге или теле в какие-либо отдельные моменты времени. Нейротрансмиттеры регулируют высвобождение друг друга, и слабый постоянный дисбаланс в этой взаимной регуляции был связан с темпераментом у здоровых людей. [75] [76] [77] [78] [79] Сильный дисбаланс или нарушения нейромедиаторных систем связаны со многими заболеваниями и психическими расстройствами. К ним относятся болезнь Паркинсона, депрессия, бессонница, синдром дефицита внимания и гиперактивности (СДВГ), тревога, потеря памяти, резкие изменения веса и зависимости. Хронический физический или эмоциональный стресс может способствовать изменениям нейромедиаторной системы. Генетика также играет роль в активности нейромедиаторов. Помимо использования в рекреационных целях, лекарства, которые прямо или косвенно взаимодействуют с одним или несколькими передатчиками или его рецепторами, обычно назначаются при психиатрических и психологических проблемах. Примечательно, что лекарства, взаимодействующие с серотонином и норэпинефрином, назначают пациентам с такими проблемами, как депрессия и тревога, хотя представление о том, что существует много убедительных медицинских доказательств в поддержку таких вмешательств, подвергается широкой критике. [80] Исследования показали, что дисбаланс дофамина влияет на рассеянный склероз и другие неврологические расстройства. [81]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )см. страницы 13 и 14 путеводителя.
TAAR1 представляет собой рецептор с высоким сродством к METH/AMPH и DA.
VMAT2 является везикулярным транспортером ЦНС не только для биогенных аминов DA, NE, EPI, 5-HT и HIS, но, вероятно, также для следовых аминов TYR, PEA и тиронамина (THYR) ... [Следовые аминергические ] нейроны в ЦНС млекопитающих можно идентифицировать как нейроны, экспрессирующие VMAT2 для хранения и биосинтетический фермент декарбоксилазу ароматических аминокислот (AADC).
Различные субрегионы ВТА получают глутаматергические входы от префронтальной коры, орексинергические входы от латерального гипоталамуса, холинергические, а также глутаматергические и ГАМКергические входы от латеродорсального тегментального ядра и ядра ножки, норадренергические входы от голубого пятна, серотонинергические входы от ядер шва, и ГАМКергические входы от прилежащего ядра и вентрального паллидума.
Нисходящие волокна NE модулируют афферентные болевые сигналы. ... Голубое пятно (LC), расположенное на дне четвертого желудочка в ростральном мосту, содержит более 50% всех норадренергических нейронов головного мозга; он иннервирует как передний мозг (т. е. обеспечивает практически всю НЭ кору головного мозга), так и области ствола головного мозга и спинного мозга. ... Остальные норадренергические нейроны головного мозга встречаются в рыхлых скоплениях клеток в стволе мозга, включая латеральные покрышки. Эти нейроны проецируются в основном в стволе головного мозга и спинном мозге. НЭ, наряду с 5НТ, АХ, гистамином и орексином, является критическим регулятором цикла сна-бодрствования и уровня возбуждения. ... Запуск LC может также усилить тревогу ... Стимуляция β-адренергических рецепторов в миндалевидном теле приводит к усилению памяти на стимулы, закодированные под сильными негативными эмоциями ... Адреналин возникает лишь в небольшом количестве центральных нейронов, все они расположены в мозговое вещество. Адреналин участвует во висцеральных функциях, таких как контроль дыхания.
Восходящая ретикулярная активирующая система (ARAS) отвечает за устойчивое состояние бодрствования. ... В таламической проекции преобладают холинергические нейроны, происходящие из педункулопонтинного тегментального ядра моста и среднего мозга (ППТ) и латеродорсального тегментального ядра моста и среднего мозга (ЛДТ) [17, 18]. В гипоталамическую проекцию вовлечены норадренергические нейроны голубого пятна (LC) и серотонинергические нейроны дорсального и срединного ядер шва (DR), которые проходят через латеральный гипоталамус и достигают аксонов гистаминергического туберомамиллярного ядра (TMN), образуя вместе Путь, идущий в передний мозг, кору и гиппокамп. Корковое возбуждение также использует преимущества дофаминергических нейронов черной субстанции (SN), вентральной области покрышек (VTA) и периакведуктальной серой зоны (PAG). Меньшее количество холинергических нейронов моста и среднего мозга посылают проекции в передний мозг по вентральному пути, минуя таламус [19, 20].
ARAS представляет собой сложную структуру, состоящую из нескольких различных цепей, включая четыре моноаминергических пути... Путь норадреналина берет свое начало из голубого пятна (LC) и связанных с ним ядер ствола мозга; серотонинергические нейроны также происходят из ядер шва в стволе мозга; дофаминергические нейроны берут начало в вентральной покрышке (ВТА); а гистаминэргический путь начинается от нейронов туберомаммиллярного ядра (ТЯН) заднего гипоталамуса. Как обсуждалось в главе 6, эти нейроны широко разрастаются по всему мозгу из ограниченного набора тел клеток. Норадреналин, серотонин, дофамин и гистамин выполняют сложные модулирующие функции и в целом способствуют бодрствованию. ПТ ствола мозга также является важным компонентом ARAS. Активность PT-холинергических нейронов (клеток быстрого сна) способствует быстрому сну. Во время бодрствования клетки, активные для быстрого сна, ингибируются подмножеством нейронов норадреналина и серотонина ARAS, называемых клетками, выключенными для быстрого сна.
Нейроны SNc плотно иннервируют дорсальное полосатое тело, где они играют решающую роль в обучении и выполнении двигательных программ. Нейроны ВТА иннервируют вентральное полосатое тело (прилежащее ядро), обонятельную луковицу, миндалину, гиппокамп, орбитальную и медиальную префронтальную кору и поясную кору. Нейроны VTA DA играют решающую роль в мотивации, поведении, связанном с вознаграждением, внимании и множественных формах памяти. ... Таким образом, действуя в различных терминальных полях, дофамин придает мотивационную значимость («желание») самому вознаграждению или связанным с ним сигналам (область оболочки прилежащего ядра), обновляет ценность, придаваемую различным целям в свете этого нового опыта (орбитальная префронтальная часть оболочки). кора), помогает консолидировать несколько форм памяти (миндалевидное тело и гиппокамп) и кодирует новые двигательные программы, которые облегчат получение этого вознаграждения в будущем (область ядра прилежащего ядра и дорсальное полосатое тело). ... ДА выполняет несколько действий в префронтальной коре. Он способствует «когнитивному контролю» поведения: выбору и успешному мониторингу поведения для облегчения достижения выбранных целей. Аспекты когнитивного контроля, в которых играет роль DA, включают рабочую память, способность удерживать информацию «в режиме онлайн», чтобы направлять действия, подавление доминирующего поведения, которое конкурирует с целенаправленными действиями, а также контроль внимания и, следовательно, способность преодолевать отвлекающие факторы. ... Таким образом, норадренергические проекции LC взаимодействуют с дофаминергическими проекциями VTA, регулируя когнитивный контроль. ...
Предыдущая работа продемонстрировала, что оптогенетическая стимуляция MSN D1 способствует вознаграждению, тогда как стимуляция MSN D2 вызывает отвращение.
Недавние исследования по внутричерепному самостоятельному введению нейрохимических веществ (лекарств) показали, что крысы учатся самостоятельно вводить различные лекарства в мезолимбические дофаминовые структуры - заднюю вентральную область покрышки, медиальное прилежащее ядро оболочки и медиальный обонятельный бугорок. ... В 1970-х годах было признано, что обонятельный бугорок содержит полосатый компонент, который заполнен ГАМКергическими средними шиповидными нейронами, получающими глутаматергические входы от корковых областей и дофаминергические входы от ВТА и проецирующимися на вентральное паллидум, как и прилежащее ядро.
В головном мозге гистамин синтезируется исключительно нейронами, тела которых находятся в туберомаммиллярном ядре (TMN), расположенном в заднем гипоталамусе. У человека на каждой стороне имеется около 64 000 гистаминергических нейронов. Эти клетки проецируются по всему головному и спинному мозгу. Области, которые получают особенно плотные проекции, включают кору головного мозга, гиппокамп, неостриатум, прилежащее ядро, миндалевидное тело и гипоталамус. ... Хотя наиболее изученной функцией гистаминовой системы головного мозга является регуляция сна и пробуждения, гистамин также участвует в обучении и памяти ... Также оказывается, что гистамин участвует в регуляции питания и энергетического баланса.
Дорсальный шов преимущественно иннервирует кору головного мозга, таламус, области полосатого тела (хвостатое ядро и прилежащее ядро) и дофаминергические ядра среднего мозга (например, черную субстанцию и вентральную область покрышки), в то время как срединный шов иннервирует гиппокамп, перегородка и другие структуры лимбической части переднего мозга. ... очевидно, что 5HT влияет на сон, возбуждение, внимание, обработку сенсорной информации в коре головного мозга, а также на важные аспекты эмоций (вероятно, включая агрессию) и регуляцию настроения. ...Ростральные ядра, включающие линейное ядро, дорсальный шов, медиальный шов и мостовой шов, иннервируют большую часть мозга, включая мозжечок. Каудальные ядра, включающие большой шов, бледный шов и неясный шов, имеют более ограниченные отростки, заканчивающиеся в мозжечке, стволе головного мозга и спинном мозге.
Дорсальный шов является основным местом расположения серотонинергических нейронов головного мозга, которые, как и норадренергические нейроны, повсеместно модулируют функцию мозга, регулируя состояние активации и настроение организма.
Базальные холинергические ядра переднего мозга включают медиальное перегородочное ядро (Ch1), вертикальное ядро диагональной полосы (Ch2), горизонтальное крыло диагональной полосы (Ch3) и базальное ядро Мейнерта (Ch4). Холинергические ядра ствола мозга включают педункулопонтинное ядро (Ch5), латеродорсальное тегментальное ядро (Ch6), медиальную хабенулу (Ch7) и парабигеминальное ядро (Ch8).
{{cite book}}: |journal=игнорируется ( помощь ){{cite book}}: |journal=игнорируется ( помощь )