
История квантовой механики является фундаментальной частью истории современной физики . Главные главы этой истории начинаются с появления квантовых идей для объяснения отдельных явлений — излучения черного тела, фотоэлектрического эффекта, спектров солнечного излучения — эпохи, называемой Старыми или Старыми квантовыми теориями. [1] Основываясь на технологии, разработанной в классической механике , изобретение волновой механики Эрвином Шредингером и расширение многими другими, запускают «современную» эпоху, начинающуюся около 1925 года. Работа Поля Дирака по релятивистской квантовой теории привела его к исследованию квантовых теорий излучения, достигнув кульминации в квантовой электродинамике , первой квантовой теории поля . История квантовой механики продолжается в истории квантовой теории поля . История квантовой химии , теоретической основы химической структуры , реакционной способности и связи , переплетается с событиями, обсуждаемыми в этой статье.
Термин «квантовая механика» был придуман (на немецком языке Quantenmechanik ) группой физиков, включая Макса Борна, Вернера Гейзенберга и Вольфганга Паули , в Гёттингенском университете в начале 1920-х годов и впервые был использован в статье Борна «Zur Quantenmechanik» в 1925 году . [2] [3]
Слово квантовый происходит от латинского слова «сколько» (как и количество ). Что-то, что квантуется , как энергия гармонических осцилляторов Планка, может принимать только определенные значения. Например, в большинстве стран деньги эффективно квантуются, причем квант денег является монетой наименьшего номинала в обращении. Механика — это раздел науки, который занимается воздействием сил на объекты. Таким образом, квантовая механика — это часть механики, которая занимается объектами, для которых квантуются определенные свойства.
Открытия XIX века , как успехи, так и неудачи, подготовили почву для появления квантовой механики.
Начиная с 1670 года и на протяжении более трех десятилетий Исаак Ньютон разрабатывал и отстаивал свою корпускулярную теорию , утверждая, что идеально прямые линии отражения демонстрируют корпускулярную природу света, поскольку в то время ни одна волновая теория не демонстрировала движение по прямым линиям. [1] : 19 Он объяснил преломление, постулируя, что частицы света ускоряются в поперечном направлении при входе в более плотную среду. Примерно в то же время современники Ньютона Роберт Гук и Христиан Гюйгенс , а позднее Огюстен-Жан Френель , математически уточнили волновую точку зрения, показав, что если свет распространяется с разной скоростью в разных средах, преломление можно легко объяснить как зависящее от среды распространение световых волн. Полученный принцип Гюйгенса-Френеля оказался чрезвычайно успешным в воспроизведении поведения света и согласовался с открытием Томасом Юнгом интерференции волн света в его эксперименте с двумя щелями в 1801 году. [4] Волновая точка зрения не сразу вытеснила лучевую и корпускулярную, но начала доминировать в научном мышлении о свете в середине 19-го века, поскольку она могла объяснить явления поляризации, которые не могли объяснить альтернативные теории. [5]
Джеймс Клерк Максвелл обнаружил, что он может применить свои ранее открытые уравнения Максвелла , вместе с небольшой модификацией, для описания самораспространяющихся волн осциллирующих электрических и магнитных полей. Быстро стало очевидно, что видимый свет, ультрафиолетовый свет и инфракрасный свет являются электромагнитными волнами разной частоты. [1] : 272 Эта теория стала критическим ингредиентом в начале квантовой механики.
В начале 19 века химические исследования Джона Дальтона и Амедео Авогадро придали вес атомной теории материи, идее, которую Джеймс Клерк Максвелл , Людвиг Больцман и другие развили, чтобы создать кинетическую теорию газов . Успехи кинетической теории придали еще большее доверие идее о том, что материя состоит из атомов, однако у теории также были недостатки, которые могли быть устранены только с развитием квантовой механики. [6] Существование атомов не было общепринятым среди физиков и химиков; Эрнст Мах , например, был убежденным антиатомистом. [7]

Самые ранние намеки на проблемы в классической механике были высказаны в связи с температурной зависимостью свойств газов. [8] Людвиг Больцман предположил в 1877 году, что уровни энергии физической системы, такой как молекула , могут быть дискретными (а не непрерывными). Обоснование Больцмана наличия дискретных уровней энергии в молекулах, таких как молекулы йода, берет свое начало в его теориях статистической термодинамики и статистической механики и было подкреплено математическими аргументами, как это было и двадцать лет спустя с первой квантовой теорией, выдвинутой Максом Планком.
В последние дни 1800-х годов Дж. Дж. Томсон установил, что электроны несут отрицательный заряд, противоположный, но такой же размер, как у иона водорода, имея массу более чем в тысячу раз меньшую. Было известно, что многие такие электроны связаны с каждым атомом. [1] : 365

На протяжении 1800-х годов многие исследования изучали детали спектра интенсивности в зависимости от частоты для света, излучаемого пламенем, Солнцем или раскаленными объектами. [1] : 367 Формула Ридберга эффективно суммировала темные линии, видимые в спектре, но он не предоставил физической модели для их объяснения. Спектр, излучаемый раскаленными объектами, можно было объяснить на высоких или низких длинах волн, но эти две теории различались.
Квантовая механика развивалась в два отдельных этапа. Первый этап, известный как старая квантовая теория , начался около 1900 года с радикально новыми подходами к объяснению физических явлений, не понятых классической механикой 1800-х годов. [1]

Тепловое излучение — это электромагнитное излучение, испускаемое поверхностью объекта за счет внутренней энергии объекта. Если объект достаточно нагрет, он начинает излучать свет в красном конце видимого спектра , поскольку он становится раскаленным докрасна.
Нагревание его далее приводит к изменению цвета с красного на желтый, белый и синий, поскольку он излучает свет на все более коротких длинах волн (более высоких частотах). Идеальный излучатель также является идеальным поглотителем: когда он холодный, такой объект выглядит идеально черным, потому что он поглощает весь падающий на него свет и не излучает ничего. Следовательно, идеальный тепловой излучатель известен как черное тело , а излучение, которое он испускает, называется излучением черного тела .

К концу 19 века тепловое излучение было довольно хорошо охарактеризовано экспериментально. Было создано несколько формул, которые могли описывать некоторые экспериментальные измерения теплового излучения: то, как длина волны, на которой излучение наиболее сильно, изменяется с температурой, дается законом смещения Вина , общая мощность, излучаемая на единицу площади, дается законом Стефана-Больцмана . Лучшим теоретическим объяснением экспериментальных результатов был закон Рэлея-Джинса, который хорошо согласуется с экспериментальными результатами на больших длинах волн (или, что эквивалентно, на низких частотах), но сильно не согласен на коротких длинах волн (или на высоких частотах). Фактически, на коротких длинах волн классическая физика предсказывала, что энергия будет излучаться горячим телом с бесконечной скоростью. Этот результат, который явно неверен, известен как ультрафиолетовая катастрофа . Однако классическая физика привела к закону Рэлея-Джинса , который, как показано на рисунке, хорошо согласуется с экспериментальными результатами на низких частотах, но сильно не согласен на высоких частотах. Физики искали единую теорию, которая объясняла бы все экспериментальные результаты.
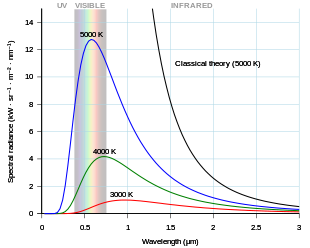
Первая модель, которая смогла объяснить полный спектр теплового излучения, была предложена Максом Планком в 1900 году. [9] Он предложил математическую модель, в которой тепловое излучение находилось в равновесии с набором гармонических осцилляторов . Чтобы воспроизвести экспериментальные результаты, ему пришлось предположить, что каждый осциллятор излучает целое число единиц энергии на своей единственной характерной частоте, а не способен излучать любое произвольное количество энергии. Другими словами, энергия, излучаемая осциллятором, была квантована . Квант энергии для каждого осциллятора, согласно Планку, был пропорционален частоте осциллятора; константа пропорциональности теперь известна как постоянная Планка .
Закон Планка был первой квантовой теорией в физике, и Планк получил Нобелевскую премию в 1918 году «в знак признания заслуг, которые он оказал развитию физики, открыв кванты энергии». [10] В то время, однако, Планк считал, что квантование было чисто эвристической математической конструкцией, а не (как сейчас считается) фундаментальным изменением в нашем понимании мира. [11]

В 1887 году Генрих Герц заметил, что когда свет с достаточной частотой попадает на металлическую поверхность, поверхность испускает катодные лучи . [1] : I:362 Десять лет спустя Дж. Дж. Томсон показал, что многочисленные сообщения о катодных лучах на самом деле были «корпускулами», и их быстро стали называть электронами . В 1902 году Филипп Ленард обнаружил, что максимально возможная энергия выброшенного электрона не связана с его интенсивностью . [12] Это наблюдение противоречит классическому электромагнетизму, который предсказывает, что энергия электрона должна быть пропорциональна интенсивности падающего излучения. [13] : 24

В 1905 году Альберт Эйнштейн предположил, что хотя непрерывные модели света работают исключительно хорошо для усредненных по времени оптических явлений, для мгновенных переходов энергия в свете может происходить из конечного числа квантов энергии. [14] Во вступительном разделе своей квантовой статьи от марта 1905 года «Об эвристической точке зрения относительно излучения и преобразования света» Эйнштейн утверждает:
Согласно рассматриваемому здесь предположению, при распространении светового луча из точки энергия не распределяется непрерывно по все увеличивающимся пространствам, а состоит из конечного числа «квантов энергии», которые локализованы в точках пространства, движутся без деления и могут быть поглощены или сгенерированы только как единое целое.
Это утверждение было названо самым революционным предложением, написанным физиком двадцатого века. [15] Энергия одного кванта света частоты определяется как частота, умноженная на постоянную Планка :
Эйнштейн предположил, что квант света передает всю свою энергию одному электрону, сообщая ему максимум энергии hf . Поэтому только частота света определяет максимальную энергию, которая может быть сообщена электрону; интенсивность фотоэмиссии пропорциональна интенсивности светового луча. [14]
Эйнштейн утверждал, что для удаления электрона из металла требуется определенное количество энергии, называемое работой выхода и обозначаемое φ . [16] Это количество энергии различно для каждого металла. Если энергия квантов света меньше работы выхода, то они не несут достаточной энергии для удаления электрона из металла. Пороговая частота, f 0 , — это частота квантов света, энергия которых равна работе выхода:
Если f больше f 0 , то энергии hf достаточно для удаления электрона. Выброшенный электрон имеет кинетическую энергию E k , которая, самое большее, равна световой энергии за вычетом энергии, необходимой для удаления электрона из металла:
Описание Эйнштейном света как состоящего из квантов энергии расширило понятие Планка о квантованной энергии, которое заключается в том, что один квант заданной частоты, f , выдает инвариантное количество энергии, hf . В природе одиночные кванты встречаются редко. Солнце и источники излучения, доступные в 19 веке, излучают огромное количество энергии каждую секунду. Постоянная Планка , h , настолько мала, что количество энергии в каждом кванте, hf , очень-очень мало. Свет, который мы видим, включает в себя многие триллионы таких квантов.
К началу 20-го века доказательства требовали модели атома с диффузным облаком отрицательно заряженных электронов, окружающих небольшое, плотное, положительно заряженное ядро . Эти свойства предполагали модель, в которой электроны вращаются вокруг ядра, как планеты, вращающиеся вокруг звезды. Классическая модель атома называется планетарной моделью, или иногда моделью Резерфорда — в честь Эрнеста Резерфорда , который предложил ее в 1911 году на основе эксперимента Гейгера-Марсдена с золотой фольгой , который впервые продемонстрировал существование ядра. Однако было также известно, что атом в этой модели будет нестабильным: согласно классической теории, вращающиеся электроны испытывают центростремительное ускорение и, следовательно, должны испускать электромагнитное излучение, потеря энергии также заставляет их двигаться по спирали к ядру, сталкиваясь с ним за доли секунды.
Вторая, связанная с этим загадка — спектр излучения атомов. Когда газ нагревается, он испускает свет только на дискретных частотах. Например, видимый свет, испускаемый водородом, состоит из четырех разных цветов, как показано на рисунке ниже. Интенсивность света на разных частотах также различна. Напротив, белый свет состоит из непрерывного излучения во всем диапазоне видимых частот. К концу девятнадцатого века простое правило, известное как формула Бальмера, показало, как частоты различных линий связаны друг с другом, хотя и без объяснения, почему это так, или без каких-либо предсказаний относительно интенсивностей. Формула также предсказывала некоторые дополнительные спектральные линии в ультрафиолетовом и инфракрасном свете, которые не наблюдались в то время. Эти линии были позже обнаружены экспериментально, что повысило уверенность в значении формулы.
В 1885 году швейцарский математик Иоганн Бальмер открыл, что каждая длина волны λ (лямбда) в видимом спектре водорода связана с некоторым целым числом n уравнением
где B — константа Бальмера, определенная как 364,56 нм.
В 1888 году Иоганнес Ридберг обобщил и значительно увеличил объяснительную полезность формулы Бальмера. Он предсказал, что λ связана с двумя целыми числами n и m согласно тому, что сейчас известно как формула Ридберга : [17]
где R — постоянная Ридберга , равная 0,0110 нм −1 , а n должно быть больше m .
Формула Ридберга учитывает четыре видимые длины волн водорода, устанавливая m = 2 и n = 3, 4, 5, 6. Она также предсказывает дополнительные длины волн в спектре излучения: для m = 1 и для n > 1 спектр излучения должен содержать определенные ультрафиолетовые длины волн, а для m = 3 и n > 3 он должен также содержать определенные инфракрасные длины волн. Экспериментальное наблюдение этих длин волн произошло два десятилетия спустя: в 1908 году Луи Пашен нашел некоторые из предсказанных инфракрасных длин волн, а в 1914 году Теодор Лайман нашел некоторые из предсказанных ультрафиолетовых длин волн. [17]
И формула Бальмера, и формула Ридберга включают целые числа: в современных терминах они подразумевают, что некоторое свойство атома квантуется. Понимание того, что именно это свойство и почему оно квантуется, было важной частью развития квантовой механики, как показано в остальной части этой статьи.
В 1905 году Альберт Эйнштейн использовал кинетическую теорию для объяснения броуновского движения . Французский физик Жан Батист Перрен использовал модель из статьи Эйнштейна для экспериментального определения массы и размеров атомов, тем самым дав прямое эмпирическое подтверждение атомной теории. [ необходима цитата ]

В 1913 году Нильс Бор предложил новую модель атома , которая включала квантованные электронные орбиты: электроны все еще вращаются вокруг ядра, как планеты вращаются вокруг Солнца, но им разрешено находиться только на определенных орбитах, а не на орбитах на произвольном расстоянии. [18] Когда атом испускает (или поглощает) энергию, электрон не движется по непрерывной траектории с одной орбиты вокруг ядра на другую, как можно было бы ожидать в классическом смысле. Вместо этого электрон мгновенно перескакивает с одной орбиты на другую, испуская испускаемый свет в форме фотона. [19] Возможные энергии фотонов, испускаемых каждым элементом, определяются разницей в энергии между орбитами, и поэтому спектр излучения для каждого элемента будет содержать ряд линий. [20]

Начиная всего лишь с одного простого предположения о правиле, которому должны подчиняться орбиты, модель Бора смогла связать наблюдаемые спектральные линии в спектре излучения водорода с ранее известными константами. В модели Бора электрону не разрешалось непрерывно излучать энергию и врезаться в ядро: как только он оказывался на ближайшей разрешенной орбите, он был стабилен навсегда. Модель Бора не объясняла, почему орбиты должны быть квантованы таким образом, и не могла делать точных предсказаний для атомов с более чем одним электроном или объяснять, почему некоторые спектральные линии ярче других.
Некоторые фундаментальные предположения модели Бора вскоре оказались неверными, но ключевой результат, что дискретные линии в спектрах излучения обусловлены некоторым свойством электронов в атомах, которые квантуются, является правильным. То, как на самом деле ведут себя электроны, разительно отличается от атома Бора и от того, что мы видим в мире нашего повседневного опыта; эта современная квантово-механическая модель атома обсуждается ниже.
Бор предположил, что момент импульса L электрона квантуется:
где n — целое число, а h и ħ — постоянная Планка и приведенная постоянная Планка соответственно. Исходя из этого предположения, закон Кулона и уравнения кругового движения показывают, что электрон с n единицами углового момента вращается вокруг протона на расстоянии r, заданном формулой
где k e — постоянная Кулона , m — масса электрона, а e — заряд электрона . Для простоты это записывается как
где a 0 , называемый радиусом Бора , равен 0,0529 нм. Радиус Бора — это радиус наименьшей разрешенной орбиты.
Энергия электрона является суммой его кинетической и потенциальной энергий. Электрон имеет кинетическую энергию в силу своего фактического движения вокруг ядра и потенциальную энергию в силу своего электромагнитного взаимодействия с ядром. В модели Бора эта энергия может быть рассчитана и определяется как
Таким образом, предположение Бора о том, что момент импульса квантуется, означает, что электрон может находиться только на определенных орбитах вокруг ядра и что он может иметь только определенные энергии. Следствием этих ограничений является то, что электрон не врезается в ядро: он не может непрерывно излучать энергию и не может приблизиться к ядру ближе, чем на 0 (радиус Бора).
Электрон теряет энергию, мгновенно перескакивая с исходной орбиты на более низкую орбиту; дополнительная энергия излучается в виде фотона. И наоборот, электрон, поглощающий фотон, приобретает энергию, поэтому он перескакивает на орбиту, которая находится дальше от ядра.
Каждый фотон от светящегося атомарного водорода обусловлен движением электрона с более высокой орбиты с радиусом r n на более низкую орбиту r m . Энергия E γ этого фотона представляет собой разницу энергий E n и E m электрона:
Поскольку уравнение Планка показывает, что энергия фотона связана с его длиной волны соотношением E γ = hc / λ , длины волн света, которые могут быть испущены, определяются выражением
Это уравнение имеет ту же форму, что и формула Ридберга, и предсказывает, что константа R должна быть задана как
Таким образом, модель атома Бора может предсказать спектр излучения водорода в терминах фундаментальных констант. Модель может быть легко модифицирована для учета спектра излучения любой системы, состоящей из ядра и одного электрона (то есть ионов , таких как He + или O 7+ , которые содержат только один электрон), но не может быть распространена на атом с двумя электронами, такой как нейтральный гелий. Однако она не смогла сделать точных предсказаний для многоэлектронных атомов или объяснить, почему некоторые спектральные линии ярче других.
Важный шаг в развитии квантовой теории был сделан на первом Сольвеевском конгрессе 1911 года. Там ведущие физики научного сообщества встретились, чтобы обсудить проблему «Излучение и кванты». К этому времени была опубликована модель атома Эрнеста Резерфорда [21] [22], но большая часть обсуждения, касающегося атомной структуры, вращалась вокруг квантовой модели Артура Хааса 1910 года. Кроме того, на Сольвеевском конгрессе в 1911 году Хендрик Лоренц предложил после доклада Эйнштейна о квантовой структуре, чтобы энергия ротатора была равна nhv. [23] [24] : 244 За этим последовали другие квантовые модели, такие как модель Джона Уильяма Николсона 1912 года, которая была ядерной и дискретизированной по угловому моменту. [25] [26] [27] Николсон ввел спектры в свою атомную модель, используя колебания электронов в ядерном атоме перпендикулярно плоскости орбиты, тем самым поддерживая стабильность. Атомные спектры Николсона идентифицировали много неотнесенных линий в солнечных и туманных спектрах. [25] [28] [29] [24] : 278
В 1913 году Бор объяснил спектральные линии атома водорода , снова используя квантование, в своей статье от июля 1913 года « О строении атомов и молекул» , в которой он обсуждал и цитировал модель Николсона. [30] [31] [27] В модели Бора атом водорода изображается как тяжелое, положительно заряженное ядро, вращающееся вокруг легкого, отрицательно заряженного электрона. Электрон может существовать только на определенных, дискретно разделенных орбитах, обозначенных их угловым моментом , который ограничен целым кратным приведенной постоянной Планка . Ключевой успех модели заключался в объяснении формулы Ридберга для спектральных линий излучения атомарного водорода с использованием переходов электронов между орбитами. [24] : 276 Хотя формула Ридберга была известна экспериментально, она не получила теоретического обоснования, пока не была введена модель Бора. Модель Бора не только объяснила причины структуры формулы Ридберга, но и дала обоснование фундаментальным физическим константам, составляющим эмпирические результаты формулы.
Более того, применение квантовой теории Планка к электрону позволило Штефану Прокопиу в 1911–1913 годах, а затем Нильсу Бору в 1913 году вычислить магнитный момент электрона , который позже был назван « магнетоном »; подобные квантовые вычисления, но с численно совершенно другими значениями, впоследствии стали возможны как для магнитных моментов протона, так и для нейтрона , которые на три порядка меньше, чем у электрона.
Эти теории, хотя и были успешными, были строго феноменологическими : в то время не было строгого обоснования квантования , за исключением, возможно, обсуждения Анри Пуанкаре теории Планка в его статье 1912 года « О теории квантов» . [32] [33] Они известны как старая квантовая теория .
Квантование орбитального углового момента электрона в сочетании с магнитным моментом электрона предполагало, что атомы с магнитным моментом должны демонстрировать квантованное поведение в магнитном поле. В 1922 году Отто Штерн и Вальтер Герлах решили проверить эту теорию. Они нагревали серебро в вакуумной трубке, оснащенной серией узких выровненных щелей, создавая молекулярный пучок атомов серебра. Они пропустили этот пучок через неоднородное магнитное поле . Вместо непрерывного узора атомов серебра они обнаружили два пучка. [34]
Относительно своего северного полюса, направленного вверх, вниз или где-то посередине, в классической механике магнит, брошенный через магнитное поле, может быть отклонен на малое или большое расстояние вверх или вниз. Атомы, которые Штерн и Герлах выстреливали через магнитное поле, действовали аналогично. Однако, в то время как магниты могли отклоняться на переменные расстояния, атомы всегда отклонялись бы на постоянное расстояние либо вверх, либо вниз. Это подразумевало, что свойство атома, которое соответствует ориентации магнита, должно быть квантовано, принимая одно из двух значений (либо вверх, либо вниз), в отличие от свободного выбора под любым углом.
Выбор ориентации магнитного поля, используемого в эксперименте Штерна–Герлаха, произволен. В показанной здесь анимации поле вертикальное, поэтому атомы отклоняются либо вверх, либо вниз. Если магнит повернуть на четверть оборота, атомы отклоняются либо влево, либо вправо. Использование вертикального поля показывает, что спин вдоль вертикальной оси квантуется, а использование горизонтального поля показывает, что спин вдоль горизонтальной оси квантуется.
Результаты эксперимента Штерна-Герлаха стали сенсацией, особенно потому, что ведущие ученые, включая Эйнштейна и Пауля Эренфеста, утверждали, что атомы серебра должны иметь случайную ориентацию в условиях эксперимента: квантование не должно было наблюдаться. [34] Прошло по меньшей мере пять лет, прежде чем эта загадка была разрешена: квантование наблюдалось, но оно не было связано с орбитальным угловым моментом.
В 1925 году Ральф Крониг предположил, что электроны ведут себя так, как будто они вращаются вокруг своей оси или «спинируются». [35] : 56 Спин генерирует крошечный магнитный момент, который разделяет энергетические уровни, ответственные за спектральные линии, в соответствии с существующими измерениями. Два электрона на одной и той же орбитали занимают различные квантовые состояния , если они «вращаются» в противоположных направлениях, тем самым удовлетворяя принципу исключения . К сожалению, теория имела два существенных недостатка: два значения, вычисленные Кронигом, были ошибочны в два раза. Старшие коллеги Кронига отговорили его работу, и она так и не была опубликована.
Десять месяцев спустя голландские физики Джордж Уленбек и Сэмюэл Гоудсмит из Лейденского университета опубликовали свою теорию самовращения электрона. [36] Модель, как и модель Кронига, была по сути классической, но привела к квантовому предсказанию.

В 1924 году Луи де Бройль опубликовал прорывную гипотезу: материя обладает волновыми свойствами. Основываясь на предложении Эйнштейна о том, что фотоэлектрический эффект может быть описан с использованием квантованных переносов энергии, и на отдельном предложении Эйнштейна из специальной теории относительности о том, что масса в состоянии покоя эквивалентна энергии посредством , де Бройль предположил, что движущаяся материя, по-видимому, имеет связанную волну с длиной волны , где — импульс материи от движения. [37] [38] Требуя, чтобы его длина волны охватывала атом, он объяснил квантование орбит Бора. [1] : 217 Одновременно это показало, что волновое поведение света по сути является квантовым эффектом. [1] : 216
Де Бройль расширил модель атома Бора , показав, что электрон на орбите вокруг ядра можно рассматривать как обладающий волнообразными свойствами. В частности, электрон наблюдается только в ситуациях, которые допускают стоячую волну вокруг ядра . Примером стоячей волны является струна скрипки, которая закреплена на обоих концах и может вибрировать. Волны, создаваемые струнным инструментом, по-видимому, колеблются на месте, перемещаясь от гребня к впадине в движении вверх и вниз. Длина волны стоячей волны связана с длиной вибрирующего объекта и граничными условиями. Например, поскольку струна скрипки закреплена на обоих концах, она может нести стоячие волны с длинами волн , где l — длина, а n — положительное целое число. Де Бройль предположил, что разрешенными электронными орбитами являются те, для которых окружность орбиты будет целым числом длин волн. Таким образом, длина волны электрона определяет, что возможны только орбиты Бора определенных расстояний от ядра. В свою очередь, на любом расстоянии от ядра, меньшем определенного значения, было бы невозможно установить орбиту. Минимально возможное расстояние от ядра называется радиусом Бора. [39] Трактовка атома Бора де Бройлем в конечном итоге оказалась неудачной, но его гипотеза послужила отправной точкой для волнового уравнения Шредингера.
Материя, ведущая себя как волна, была впервые экспериментально продемонстрирована для электронов: пучок электронов может демонстрировать дифракцию , как и пучок света или волна на воде. Через три года после того, как де Бройль опубликовал свою гипотезу, две разные группы продемонстрировали дифракцию электронов. В Университете Абердина Джордж Пейджет Томсон и Александр Рид пропускали пучок электронов через тонкую целлулоидную пленку, а затем через металлические пленки и наблюдали предсказанные интерференционные картины. (Александр Рид, аспирант Томсона, провел первые эксперименты, но вскоре погиб в аварии на мотоцикле [40] и редко упоминается.) В Bell Labs Клинтон Джозеф Дэвиссон и Лестер Хэлберт Джермер отражали электронный пучок от образца никеля в своем эксперименте, наблюдая четко определенные пучки, предсказанные волновыми моделями, возвращающиеся из кристалла. [1] : II:218 Де Бройль был удостоен Нобелевской премии по физике в 1929 году за свою гипотезу; В 1937 году Томсон и Дэвиссон разделили Нобелевскую премию по физике за свою экспериментальную работу.
Основываясь на подходе де Бройля, современная квантовая механика родилась в 1925 году, когда немецкие физики Вернер Гейзенберг, Макс Борн и Паскуаль Йордан [41] [42] разработали матричную механику , а австрийский физик Эрвин Шредингер изобрел волновую механику и нерелятивистское уравнение Шредингера как приближение обобщенного случая теории де Бройля. [43] Впоследствии Шредингер показал, что оба подхода эквивалентны. Первыми приложениями квантовой механики к физическим системам были алгебраическое определение спектра водорода Вольфгангом Паули [44] и рассмотрение двухатомных молекул Люси Менсинг . [45]
Конец первой эры квантовой механики был вызван публикацией де Бройлем своей гипотезы о волнах материи , [1] : 268 что привело к открытию Шредингером волновой механики для материи. Точные предсказания спектра поглощения водорода обеспечили широкое признание новой квантовой теории. [1] : 275
В 1925 году Вернер Гейзенберг попытался решить одну из проблем, которую модель Бора оставила без ответа, объяснив интенсивности различных линий в спектре излучения водорода. С помощью ряда математических аналогий он выписал квантово-механический аналог для классического вычисления интенсивностей. [46] Вскоре после этого коллега Гейзенберга Макс Борн понял, что метод Гейзенберга по вычислению вероятностей переходов между различными уровнями энергии лучше всего можно выразить с помощью математической концепции матриц .
Гейзенберг сформулировал раннюю версию принципа неопределенности в 1927 году, проанализировав мысленный эксперимент , в котором пытались одновременно измерить положение и импульс электрона . Однако Гейзенберг не дал точных математических определений того, что означает «неопределенность» в этих измерениях, шаг, который вскоре был сделан Эрлом Гессе Кеннардом , Вольфгангом Паули и Германом Вейлем . [47] [48]
В первой половине 1926 года, основываясь на гипотезе де Бройля, Эрвин Шредингер разработал уравнение, описывающее поведение квантово-механической волны. [49] Математическая модель, названная уравнением Шредингера в честь ее создателя, является центральной в квантовой механике, определяет разрешенные стационарные состояния квантовой системы и описывает, как квантовое состояние физической системы изменяется со временем. [50] Сама волна описывается математической функцией, известной как « волновая функция ». Шредингер сказал, что волновая функция обеспечивает «средства для предсказания вероятности результатов измерений». [51]
Шредингеру удалось рассчитать энергетические уровни водорода, рассматривая электрон атома водорода как классическую волну, движущуюся в яме электрического потенциала, созданного протоном. Этот расчет точно воспроизвел энергетические уровни модели Бора.
В мае 1926 года Шредингер доказал, что матричная механика Гейзенберга и его собственная волновая механика делают одинаковые предсказания о свойствах и поведении электрона; математически эти две теории имели общую базовую форму. Тем не менее, эти двое не согласились с интерпретацией их общей теории. Например, Гейзенберг принял теоретическое предсказание скачков электронов между орбиталями в атоме, [52] но Шредингер надеялся, что теория, основанная на непрерывных волнообразных свойствах, сможет избежать того, что он назвал (перефразируя Вильгельма Вина ) «этой чепухой о квантовых скачках». [53] В конце концов, подход Гейзенберга победил, и квантовые скачки были подтверждены. [54]

Бор, Гейзенберг и другие пытались объяснить, что на самом деле означают эти экспериментальные результаты и математические модели. Термин «копенгагенская интерпретация» был применен к их взглядам в ретроспективе, сглаживая различия между ними. [55] [56] [57] [58] [59] [60] Хотя не существует окончательного утверждения «копенгагенской» интерпретации, следующие идеи широко рассматриваются как ее характерные.
Модель атома Бора была по сути планетарной, с электронами, вращающимися вокруг ядерного «солнца». Однако принцип неопределенности гласит, что электрон не может одновременно иметь точное местоположение и скорость, как это делает планета. Вместо классических орбит, электроны, как говорят, населяют атомные орбитали . Орбиталь — это «облако» возможных местоположений, в которых может быть обнаружен электрон, распределение вероятностей, а не точное местоположение. [62] Каждая орбиталь является трехмерной, а не двумерной орбитой, и часто изображается как трехмерная область, в которой существует 95-процентная вероятность обнаружения электрона. [63]
Шредингеру удалось вычислить энергетические уровни водорода, рассматривая электрон атома водорода как волну, представленную « волновой функцией » Ψ , в потенциальной яме V , созданной протоном. Решения уравнения Шредингера [ необходимо разъяснение ] представляют собой распределения вероятностей для положений и местоположений электронов. Орбитали имеют ряд различных форм в трех измерениях. Энергии различных орбиталей можно вычислить , и они точно соответствуют энергетическим уровням модели Бора.
В картине Шредингера каждый электрон обладает четырьмя свойствами:
Общее название этих свойств — квантовое состояние электрона. Квантовое состояние можно описать, присвоив каждому из этих свойств число; они известны как квантовые числа электрона . Квантовое состояние электрона описывается его волновой функцией. Принцип исключения Паули требует, чтобы никакие два электрона в атоме не могли иметь одинаковые значения всех четырех чисел.

Первое свойство, описывающее орбиталь, — это главное квантовое число n , которое совпадает с таковым в модели Бора. n обозначает уровень энергии каждой орбитали. Возможные значения n — целые числа:
Следующее квантовое число, азимутальное квантовое число , обозначаемое l , описывает форму орбитали. Форма является следствием углового момента орбитали. Угловой момент представляет собой сопротивление вращающегося объекта ускорению или замедлению под воздействием внешней силы. Азимутальное квантовое число представляет собой орбитальный угловой момент электрона вокруг его ядра. Возможные значения для l — целые числа от 0 до n − 1 (где n — главное квантовое число электрона):
Форма каждой орбитали обычно обозначается буквой, а не ее азимутальным квантовым числом. Первая форма ( l =0) обозначается буквой s ( мнемоническое обозначение — « s сфера»). Следующая форма обозначается буквой p и имеет форму гантели. Другие орбитали имеют более сложную форму (см. атомная орбиталь ) и обозначаются буквами d , f , g и т. д.
Третье квантовое число, магнитное квантовое число , описывает магнитный момент электрона и обозначается как m l (или просто m ). Возможные значения для m l — целые числа от − l до l (где l — азимутальное квантовое число электрона):
Магнитное квантовое число измеряет компоненту углового момента в определенном направлении. Выбор направления произволен; условно выбирается направление z.
Четвертое квантовое число, спиновое квантовое число (относящееся к «ориентации» спина электрона), обозначается m s и принимает значения + 1 ⁄ 2 или − 1 ⁄ 2 .
Химик Лайнус Полинг писал в качестве примера:
В случае атома гелия с двумя электронами на орбитали 1 s принцип исключения Паули требует, чтобы два электрона различались по значению одного квантового числа. Их значения n , l и m l одинаковы. Соответственно, они должны различаться по значению m s , которое может иметь значение + 1 ⁄ 2 для одного электрона и − 1 ⁄ 2 для другого." [62]
Именно базовая структура и симметрия атомных орбиталей, а также способ, которым электроны их заполняют, приводят к организации периодической таблицы . То, как атомные орбитали на разных атомах объединяются, образуя молекулярные орбитали, определяет структуру и прочность химических связей между атомами.
Пионерами квантовой химии были физики Вальтер Гайтлер и Фриц Лондон , опубликовавшие в 1927 году исследование ковалентной связи молекулы водорода. Впоследствии квантовая химия была развита большим количеством ученых, включая американского химика-теоретика Лайнуса Полинга из Калифорнийского технологического института и Джона К. Слейтера, в различные теории, такие как теория молекулярных орбиталей или теория валентности.
Начиная примерно с 1927 года, Поль Дирак начал процесс объединения квантовой механики со специальной теорией относительности , предложив уравнение Дирака для электрона. Уравнение Дирака достигает релятивистского описания волновой функции электрона, которое не удалось получить Шредингеру. Оно предсказывает спин электрона и привело Дирака к предсказанию существования позитрона . Он также был пионером в использовании теории операторов, включая влиятельную нотацию скобок , как описано в его знаменитом учебнике 1930 года. В тот же период венгерский эрудит Джон фон Нейман сформулировал строгую математическую основу для квантовой механики как теорию линейных операторов в гильбертовых пространствах, как описано в его не менее знаменитом учебнике 1932 года . Эти, как и многие другие работы периода основания, до сих пор актуальны и широко используются.
Начиная с 1927 года исследователи пытались применить квантовую механику к полям вместо отдельных частиц, что привело к появлению квантовых теорий поля. Ранние исследователи в этой области включают П. А. М. Дирака , В. Паули, В. Вайскопфа и П. Джордана . Эта область исследований достигла кульминации в формулировке квантовой электродинамики Р. П. Фейнманом , Ф. Дайсоном , Дж. Швингером и С. Томонагой в 1940-х годах. Квантовая электродинамика описывает квантовую теорию электронов, позитронов и электромагнитного поля и послужила моделью для последующих квантовых теорий поля . [41] [42] [64]

Теория квантовой хромодинамики была сформулирована в начале 1960-х годов. Теория, какой мы ее знаем сегодня, была сформулирована Политцером , Гроссом и Вильчеком в 1975 году.
Опираясь на новаторские работы Швингера , Хиггса и Голдстоуна , физики Глэшоу , Вайнберг и Салам независимо друг от друга показали, как слабое ядерное взаимодействие и квантовую электродинамику можно объединить в единое электрослабое взаимодействие , за что они получили Нобелевскую премию по физике 1979 года.
Квантовая информатика развивалась в последние десятилетия 20-го века, начиная с таких теоретических результатов, как теорема Холево , концепция обобщенных измерений или POVM , предложение Беннета и Брассара о квантовом распределении ключей и алгоритм Шора .
{{cite book}}: |journal=игнорируется ( помощь ) Альтернативный URLПолучено 29 июля 1925 г.См. статью Вернера Гейзенберга «Квантовая теоретическая переинтерпретация кинематических и механических соотношений», стр. 261–76.
Его великое открытие, волновое уравнение Шредингера, было сделано в конце этой эпохи — в первой половине 1926 г.
[T]Нет смысла искать Копенгагенскую интерпретацию как единую и последовательную логическую структуру. Такие термины, как «Копенгагенская интерпретация» или «Копенгагенская школа», основаны на истории развития квантовой механики; они образуют упрощенный и часто удобный способ ссылки на идеи ряда физиков, сыгравших важную роль в становлении квантовой механики и сотрудничавших с Бором в его Институте или принимавших участие в дискуссиях в решающие годы. При более внимательном рассмотрении довольно легко увидеть, что эти идеи расходятся в деталях и что, в частности, взгляды Бора, духовного лидера школы, образуют отдельную сущность, которую теперь можно понять только путем тщательного изучения как можно большего числа соответствующих публикаций самого Бора.
Кажется, существует по крайней мере столько же различных интерпретаций Копенгагена, сколько людей, использующих этот термин; возможно, их больше.