Сигнальный путь трансформирующего фактора роста бета (TGFβ) участвует во многих клеточных процессах как во взрослом организме, так и в развивающемся эмбрионе, включая рост клеток , дифференцировку клеток , миграцию клеток, апоптоз , клеточный гомеостаз и другие клеточные функции. Сигнальные пути TGFβ консервативны. [1] Несмотря на широкий спектр клеточных процессов, которые регулирует сигнальный путь TGFβ, этот процесс относительно прост. Лиганды суперсемейства TGFβ связываются с рецептором типа II, который привлекает и фосфорилирует рецептор типа I. Затем рецептор типа I фосфорилирует регулируемые рецептором SMAD ( R-SMAD ), которые теперь могут связывать coSMAD SMAD4 . Комплексы R-SMAD/coSMAD накапливаются в ядре, где они действуют как факторы транскрипции и участвуют в регуляции экспрессии целевого гена. [2]
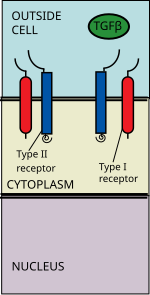
Суперсемейство лигандов TGF beta включает: костные морфогенетические белки (BMP) , факторы роста и дифференцировки (GDF) , антимюллеров гормон (AMH) , активин , нодаль и TGFβs . [3] Сигнализация начинается со связывания лиганда суперсемейства TGF beta с рецептором TGF beta типа II. Рецептор типа II представляет собой сериновую/треониновую рецепторную киназу, которая катализирует фосфорилирование рецептора типа I. Каждый класс лигандов связывается с определенным рецептором типа II. [4] У млекопитающих известно семь рецепторов типа I и пять рецепторов типа II. [5]
Существует три активина: активин A , активин B и активин AB . Активины участвуют в эмбриогенезе и остеогенезе. Они также регулируют многие гормоны, включая гипофизарные , гонадные и гипоталамические гормоны, а также инсулин . Они также являются факторами выживания нервных клеток .
BMP связываются с рецептором костного морфогенетического белка типа 2 (BMPR2). Они участвуют во множестве клеточных функций, включая остеогенез, клеточную дифференцировку , спецификацию передней/задней оси, рост и гомеостаз.
Семейство TGFβ включает: TGFβ1 , TGFβ2 , TGFβ3 . Как и BMP, TGFβ участвуют не только в эмбриогенезе и клеточной дифференцировке, но также в апоптозе и других функциях. Они связываются с рецептором TGF-бета типа 2 (TGFβR2).
Nodal связывается с рецептором активина А, тип IIB ACVR2B . Затем он может либо образовать рецепторный комплекс с рецептором активина А, тип IB ( ACVR1B ), либо с рецептором активина А, тип IC ( ACVR1C ). [5]
Когда связывание рецептора с лигандом происходит посредством локального воздействия, это классифицируется как паракринная сигнализация .

Лиганд TGF бета связывается с димером рецептора типа II, который рекрутирует димер рецептора типа I, образуя гетеротетрамерный комплекс с лигандом. [6] Эти рецепторы являются рецепторами серин/треонин киназы . Они имеют богатый цистеином внеклеточный домен , трансмембранный домен и богатый цитоплазматический серин/треонин домен. Домен GS рецептора типа I состоит из серии примерно из тридцати повторов серина - глицина . [7] Связывание лиганда семейства TGFβ вызывает вращение рецепторов таким образом, что их цитоплазматические домены киназы располагаются в каталитически благоприятной ориентации. Рецептор типа II фосфорилирует остатки серина рецептора типа I, что активирует белок.

Существует пять SMAD, регулируемых рецепторами: SMAD1 , SMAD2 , SMAD3 , SMAD5 и SMAD9 (иногда называемых SMAD8). По сути, существует два внутриклеточных пути, включающих эти R-SMAD . TGFβ, Activins, Nodal и некоторые GDF опосредуются SMAD2 и SMAD3, в то время как BMP, AMH и несколько GDF опосредуются SMAD1 , SMAD5 и SMAD9 . Связывание R-SMAD с рецептором типа I опосредуется белком, содержащим домен FYVE с двойным пальцем цинка . Два таких белка, которые опосредуют путь TGFβ, включают SARA ( якорь SMAD для активации рецептора ) и HGS (субстрат тирозинкиназы, регулируемый фактором роста гепатоцитов).
SARA присутствует в ранней эндосоме , которая посредством эндоцитоза, опосредованного клатрином , интернализует рецепторный комплекс. [8] SARA привлекает R-SMAD . SARA позволяет R-SMAD связываться с областью L45 рецептора типа I. [9] SARA ориентирует R-SMAD таким образом, что остаток серина на его C-конце обращен к каталитической области рецептора типа I. Рецептор типа I фосфорилирует остаток серина R-SMAD. Фосфорилирование вызывает конформационное изменение в домене MH2 R-SMAD и его последующую диссоциацию от рецепторного комплекса и SARA. [10]

Теперь фосфорилированный RSMAD имеет высокое сродство к coSMAD (например, SMAD4 ) и образует комплекс с одним из них. Фосфатная группа не действует как место стыковки для coSMAD, а фосфорилирование открывает аминокислотный участок, позволяющий взаимодействие.

Фосфорилированный комплекс RSMAD/coSMAD проникает в ядро, где связывает промоторы/кофакторы транскрипции и вызывает транскрипцию ДНК.
Костные морфогенетические белки вызывают транскрипцию мРНК, участвующих в остеогенезе , нейрогенезе и спецификации вентральной мезодермы .
TGFβs вызывают транскрипцию мРНК, участвующих в апоптозе , неогенезе внеклеточного матрикса и иммуносупрессии . Они также участвуют в остановке G1 в клеточном цикле .
Активин вызывает транскрипцию мРНК, участвующих в росте гонад , дифференцировке эмбриона и формировании плаценты.
Узел вызывает транскрипцию мРНК, участвующих в спецификации левой и правой оси, индукции мезодермы и энтодермы .
Сигнальный путь TGF бета участвует в широком спектре клеточных процессов и впоследствии очень жестко регулируется. Существует множество механизмов, в которых путь модулируется либо положительно, либо отрицательно, включая агонисты лигандов и R-SMAD, рецепторы-приманки и убиквитинирование R -SMAD и рецепторов.
И хордин, и ноггин являются антагонистами BMP. Они связывают BMP, предотвращая связывание лиганда с рецептором. [11] Было показано, что хордин и ноггин дорсализуют мезодерму . Они оба обнаружены в дорсальной губе Xenopus и преобразуют в противном случае определенную эпидермисом ткань в нервную ткань (см. нейруляция ). Ноггин играет ключевую роль в формировании хряща и кости. У мышей Noggin-/- наблюдается избыток хряща и отсутствует формирование суставов. [11]
Члены семейства белков DAN также антагонизируют членов семейства TGF бета. К ним относятся Cerberus , DAN и Gremlin . Эти белки содержат девять консервативных цистеинов , которые могут образовывать дисульфидные мостики. Считается, что DAN антагонизирует GDF5 , GDF6 и GDF7 .
Фоллистатин ингибирует активин, который он связывает. Он напрямую влияет на секрецию фолликулостимулирующего гормона (ФСГ). Фоллистатин также участвует в раке простаты, где мутации в его гене могут помешать ему воздействовать на активин, который имеет антипролиферативные свойства. [11]
Lefty является регулятором TGFβ и участвует в формировании осевого паттерна во время эмбриогенеза. Он также является членом суперсемейства белков TGF. Он асимметрично экспрессируется в левой стороне мышиных эмбрионов и впоследствии играет роль в лево-правой спецификации. Lefty действует, предотвращая фосфорилирование R-SMAD. Он делает это через конститутивно активный рецептор TGFβ типа I и через процесс ниже по течению от его активации. [12]
Также были идентифицированы лекарственные антагонисты, такие как SB431542 [13], который селективно ингибирует ALK4, ALK5 и ALK7.
Рецептор трансформирующего фактора роста 3 (TGFβR3) является наиболее распространенным из рецепторов TGF-β на данный момент, [14] он не имеет известного сигнального домена. [15] Однако он может служить для усиления связывания лигандов TGFβ с рецепторами TGFβ типа II путем связывания TGFβ и представления его TGFβR2. Одна из нижестоящих целей сигнализации TGF β, GIPC , связывается с его доменом PDZ, что предотвращает его протеосомную деградацию, что впоследствии увеличивает активность TGFβ. Он также может служить в качестве корецептора ингибина для ActivinRII . [11]
BMP и ингибитор мембранного связывания активина (BAMBI) имеет аналогичный внеклеточный домен, как и рецепторы типа I. Он не имеет внутриклеточного домена серин/треонин протеинкиназы и, следовательно, является псевдорецептором. Он связывается с рецептором типа I, предотвращая его активацию. Он служит отрицательным регулятором сигнализации TGFβ и может ограничивать экспрессию TGFβ во время эмбриогенеза. Для его экспрессии требуется сигнализация BMP
FKBP12 связывает GS-регион рецептора типа I, предотвращая фосфорилирование рецептора рецепторами типа II. Считается, что FKBP12 и его гомологи помогают предотвратить активацию рецептора типа I в отсутствие лиганда, поскольку связывание лиганда вызывает его диссоциацию.
Есть еще два SMAD, которые завершают семейство SMAD, ингибиторные SMAD (I-SMADS), SMAD6 и SMAD7 . Они играют ключевую роль в регуляции сигнализации TGF бета и участвуют в отрицательной обратной связи. Как и другие SMAD, они имеют домены MH1 и MH2. SMAD7 конкурирует с другими R-SMAD с рецептором типа I и предотвращает их фосфорилирование. [11] [16] Он находится в ядре и при активации рецептора TGFβ перемещается в цитоплазму, где связывается с рецептором типа I. SMAD6 связывает SMAD4, предотвращая связывание других R-SMAD с coSMAD. Уровни I-SMAD увеличиваются с сигнализацией TGFβ, что позволяет предположить, что они являются нисходящими целями сигнализации TGFβ.
Убиквитин-протеинлигазы E3 SMURF1 и SMURF2 регулируют уровни SMAD. Они принимают убиквитин от конъюгирующего фермента E2, где они переносят убиквитин в RSMAD, что вызывает их убиквитинирование и последующую протеосомную деградацию. SMURF1 связывается с SMAD1 и SMAD5 , в то время как SMURF2 связывается с SMAD1 , SMAD2 , SMAD3 , SMAD6 и SMAD7 . Он [ требуется разъяснение ] усиливает ингибирующее действие SMAD7, одновременно снижая транскрипционную активность SMAD2.
Лиганды TGF-β H.sapiens выделены серым цветом, лиганды D.melanogaster — розовым, C.elegans — желтым.