Искусственный кардиостимулятор , обычно называемый просто кардиостимулятором , представляет собой имплантируемое медицинское устройство , которое генерирует электрические импульсы , подаваемые электродами в одну или несколько камер сердца . Каждый импульс заставляет целевую камеру(ы) сокращаться и перекачивать кровь, [3] тем самым регулируя функцию электропроводящей системы сердца .
Основная цель кардиостимулятора — поддерживать равномерный сердечный ритм , либо потому, что естественный кардиостимулятор сердца обеспечивает неадекватное или нерегулярное сердцебиение, либо потому, что в системе электропроводимости сердца есть блок . Современные кардиостимуляторы программируются извне и позволяют кардиологу выбирать оптимальные режимы стимуляции для отдельных пациентов. Большинство кардиостимуляторов работают по требованию, в которых стимуляция сердца основана на динамическом спросе кровеносной системы . Другие посылают фиксированную частоту импульсов. [4]
Определенный тип кардиостимулятора, называемый имплантируемым кардиовертером-дефибриллятором , объединяет функции кардиостимулятора и дефибриллятора в одном имплантируемом устройстве . [5] Другие, называемые бивентрикулярными кардиостимуляторами , имеют несколько электродов, стимулирующих различные позиции внутри желудочков (нижних камер сердца) для улучшения их синхронизации. [6]


Перкуссионная стимуляция, также известная как трансторакальная механическая стимуляция, представляет собой использование сжатого кулака, обычно на левом нижнем крае грудины над правым желудочком в полой вене , ударяя с расстояния 20–30 см, чтобы вызвать желудочковый ритм ( Британский журнал анестезиологии предполагает, что это должно быть сделано, чтобы поднять желудочковое давление до 10–15 мм рт. ст. для того, чтобы вызвать электрическую активность). Это старая процедура, используемая только как средство спасения жизни, пока пациенту не поднесут электрический кардиостимулятор. [7]
Транскутанная стимуляция (TCP), также называемая внешней стимуляцией, рекомендуется для начальной стабилизации гемодинамически значимых брадикардий всех типов. Процедура выполняется путем размещения двух электродов стимуляции на груди пациента, либо в передне-боковом положении, либо в передне-заднем положении. Спасатель выбирает частоту стимуляции и постепенно увеличивает ток стимуляции (измеряется в мА) до тех пор, пока не будет достигнут электрический захват (характеризующийся широким комплексом QRS с высоким, широким зубцом T на ЭКГ ) с соответствующим импульсом. Артефакт стимуляции на ЭКГ и сильное подергивание мышц могут затруднить это определение. На внешнюю стимуляцию не следует полагаться в течение длительного периода времени. Это экстренная процедура, которая действует как мост до тех пор, пока не будет применена трансвенозная стимуляция или другие методы лечения. [8]

Временная эпикардиальная стимуляция используется во время операции на открытом сердце, если хирургическая процедура создает атриовентрикулярную блокаду. Электроды размещаются в контакте с внешней стенкой желудочка (эпикардом) для поддержания удовлетворительного сердечного выброса до тех пор, пока не будет вставлен временный трансвенозный электрод. [9]
Трансвенозная стимуляция, используемая для временной стимуляции, является альтернативой транскутанной стимуляции. Провод кардиостимулятора помещается в вену в стерильных условиях, а затем проводится либо в правое предсердие, либо в правый желудочек. Затем провод кардиостимулятора подключается к внешнему кардиостимулятору вне тела. Трансвенозная стимуляция часто используется в качестве моста к постоянному размещению кардиостимулятора. Его можно оставить на месте до тех пор, пока не будет имплантирован постоянный кардиостимулятор или пока не отпадет необходимость в кардиостимуляторе, а затем его удаляют.

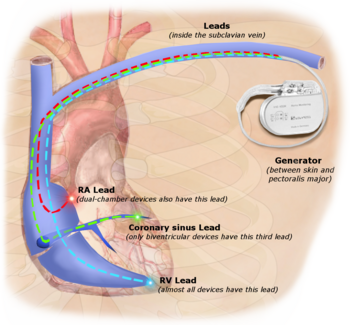
Постоянная стимуляция с помощью имплантируемого кардиостимулятора подразумевает трансвенозное размещение одного или нескольких электродов кардиостимулятора в камере или камерах сердца, в то время как кардиостимулятор имплантируется под кожу ниже ключицы. Процедура выполняется путем надреза подходящей вены, в которую вставляется электродный вывод и проводится по вене через клапан сердца до тех пор, пока он не будет расположен в камере. Процедура облегчается флюороскопией , которая позволяет врачу видеть прохождение электродного вывода. После подтверждения удовлетворительного размещения электрода противоположный конец электродного вывода подключается к генератору кардиостимулятора.
Существует три основных типа постоянных кардиостимуляторов, классифицируемых в зависимости от количества задействованных камер и их основного механизма работы: [10]
Генератор кардиостимулятора представляет собой герметичное устройство, содержащее источник питания, обычно литиевую батарею , чувствительный усилитель, который обрабатывает электрические проявления естественных сердечных сокращений, воспринимаемые сердечными электродами, компьютерную логику для кардиостимулятора и выходную схему, которая подает импульс стимуляции на электроды.
Чаще всего генератор размещается под подкожным жиром грудной стенки, над мышцами и костями грудной клетки. Однако размещение может варьироваться в зависимости от конкретного случая.
Внешний корпус кардиостимуляторов разработан таким образом, что он редко будет отторгаться иммунной системой организма . Обычно он изготавливается из титана , который инертен в организме.
Беспроводные кардиостимуляторы — это устройства размером с капсулу, которые достаточно малы, чтобы генератор можно было поместить в сердце, избегая, таким образом, необходимости в электродах для стимуляции. [11] Поскольку электроды кардиостимулятора могут со временем выйти из строя, система стимуляции, которая избегает этих компонентов, предлагает теоретические преимущества. Беспроводные кардиостимуляторы можно имплантировать в сердце с помощью управляемого катетера, который вводится в бедренную вену через разрез в паху. [11]

.jpg/440px-Boston_Scientific_Altrua_50_Dual-chamber_cardiac_pacemaker_29.01.21_JM_(2).jpg)
Современные кардиостимуляторы обычно имеют несколько функций. Самая простая форма контролирует собственный электрический ритм сердца. Когда провод или «провод» кардиостимулятора не обнаруживает электрическую активность сердца в камере — предсердии или желудочке — в течение нормального периода времени от удара к удару — чаще всего одной секунды — он будет стимулировать либо предсердие, либо желудочек коротким импульсом низкого напряжения. Если он обнаруживает электрическую активность, он откладывает стимуляцию. Эта сенсорная и стимулирующая активность продолжается от удара к удару и называется «стимуляцией по требованию». В случае двухкамерного устройства, когда верхние камеры имеют спонтанную или стимулированную активацию, устройство начинает обратный отсчет, чтобы гарантировать, что в приемлемом — и программируемом — интервале произойдет активация желудочка, в противном случае снова будет подан импульс.
Более сложные формы включают способность ощущать и/или стимулировать как предсердные, так и желудочковые камеры.
Из этого следует, что основным режимом желудочковой стимуляции «по требованию» является VVI или с автоматической регулировкой частоты для нагрузки VVIR — этот режим подходит, когда не требуется синхронизация с предсердным ритмом, как при фибрилляции предсердий. Эквивалентным режимом предсердной стимуляции является AAI или AAIR, который является режимом выбора, когда атриовентрикулярное проведение не повреждено, но синоатриальный узел естественного водителя ритма ненадежен — заболевание синусового узла (SND) или синдром слабости синусового узла . Если проблема заключается в атриовентрикулярной блокаде (AVB), кардиостимулятор должен обнаружить (ощутить) предсердный ритм и после нормальной задержки (0,1–0,2 секунды) вызвать желудочковый ритм, если он еще не произошел — это режим VDD, и его можно достичь с помощью одного стимулирующего электрода с электродами в правом предсердии (для восприятия) и желудочке (для восприятия и стимуляции). Эти режимы AAIR и VDD необычны в США, но широко используются в Латинской Америке и Европе. [13] [14] Режим DDDR используется чаще всего, поскольку он охватывает все варианты, хотя для кардиостимуляторов требуются отдельные предсердные и желудочковые электроды, и они более сложны, требуя тщательного программирования их функций для достижения оптимальных результатов.
Автоматические кардиостимуляторы разработаны таким образом, чтобы их можно было перекрыть естественным ритмом сердца в любой момент, когда оно возвращается к нормальному непатологическому синусовому ритму , и они могут возобновить свое действие, влияя на электрическую активность сердца, когда патологическое событие происходит снова. [15] « Желудочковый кардиостимулятор» производит узкий вертикальный пик на ЭКГ , непосредственно перед широким QRS . Пик « предсердного кардиостимулятора» появляется непосредственно перед зубцом P. [16]
Для сравнения, активируемый кардиостимулятор активируется сразу после того, как электрическая активность начинается в сердечной ткани сама по себе. «Желудочковый кардиостимулятор» производит импульс сразу после того, как импульс создается в желудочковой ткани, и он выглядит как одновременный спайк с QRS. «Предсердный кардиостимулятор» — это режим, в котором импульс производится сразу после электрического события в предсердии. Он выглядит как разряд, следующий за p-волной, но до QRS, который обычно расширен. [17]

Сердечная ресинхронизирующая терапия (CRT) используется для людей с сердечной недостаточностью , у которых левый и правый желудочки не сокращаются одновременно ( желудочковая диссинхрония ), что встречается примерно у 25–50% пациентов с сердечной недостаточностью. Для достижения CRT используется бивентрикулярный кардиостимулятор (BVP), который может стимулировать как перегородчатую , так и боковую стенки левого желудочка . Стимулируя обе стороны левого желудочка, кардиостимулятор может ресинхронизировать сокращения желудочков.
Устройства CRT имеют по крайней мере два провода, один из которых проходит через полую вену и правое предсердие в правый желудочек для стимуляции перегородки , а другой проходит через полую вену и правое предсердие и вставляется через коронарный синус для стимуляции эпикардиальной стенки левого желудочка. Часто у пациентов с нормальным синусовым ритмом также имеется провод в правом предсердии для облегчения синхронизации с сокращением предсердий. Таким образом, синхронизация между сокращениями предсердий и желудочков, а также между перегородкой и боковыми стенками левого желудочка может быть скорректирована для достижения оптимальной сердечной функции.
Было показано, что устройства СРТ снижают смертность и улучшают качество жизни у пациентов с симптомами сердечной недостаточности; фракцией выброса ЛЖ менее или равной 35% и длительностью QRS на ЭКГ 120 мс или более. [18] [19]
Бивентрикулярная стимуляция сама по себе называется CRT-P (для стимуляции). Для отдельных пациентов с риском аритмии CRT может сочетаться с имплантируемым кардиовертером-дефибриллятором (ICD): такие устройства, известные как CRT-D (для дефибрилляции), также обеспечивают эффективную защиту от опасных для жизни аритмий. [20]
Традиционное размещение желудочковых электродов в кончике или верхушке правого желудочка или вокруг них, или апикальная стимуляция ПЖ, может иметь отрицательные последствия для функции сердца. Это связано с повышенным риском мерцательной аритмии , сердечной недостаточности , ослабления сердечной мышцы и потенциально более короткой продолжительностью жизни. Стимуляция пучка Гиса (HBP) приводит к более естественной или совершенно естественной активации желудочков и вызвала большой исследовательский и клинический интерес. Стимулируя сеть волокон Гиса–Пуркинье напрямую с помощью специального электрода и техники размещения, HBP вызывает синхронизированную и, следовательно, более эффективную активацию желудочков и позволяет избежать долгосрочного заболевания сердечной мышцы. В некоторых случаях HBP также может исправить паттерны блокады ножек пучка Гиса . [21] [22]

Важным шагом вперед в функции кардиостимулятора стала попытка имитировать природу, используя различные входы для создания кардиостимулятора, реагирующего на частоту, с использованием таких параметров, как интервал QT , pO2 – pCO2 ( уровни растворенного кислорода или углекислого газа ) в артериовенозной системе, физическая активность, определяемая акселерометром , температура тела , уровни АТФ , адреналин и т. д. Вместо создания статической, заранее определенной частоты сердечных сокращений или прерывистого контроля, такой кардиостимулятор, «динамический кардиостимулятор», мог компенсировать как фактическую респираторную нагрузку, так и потенциально ожидаемую респираторную нагрузку. Первый динамический кардиостимулятор был изобретен Энтони Рикардсом из Национальной кардиологической больницы в Лондоне, Великобритания, в 1982 году. [23]
Технология динамической кардиостимуляции может также применяться в будущих искусственных сердцах . Достижения в области сварки переходных тканей поддержат эти и другие попытки замены искусственных органов/суставов/тканей. Стволовые клетки могут представлять интерес для сварки переходных тканей. [ необходима цитата ]
Было сделано много усовершенствований для улучшения контроля кардиостимулятора после имплантации. Многие из них стали возможны благодаря переходу на микропроцессорные кардиостимуляторы. Кардиостимуляторы, которые контролируют не только желудочки, но и предсердия, стали обычным явлением. Кардиостимуляторы, которые контролируют как предсердия, так и желудочки, называются двухкамерными кардиостимуляторами. Хотя эти двухкамерные модели обычно более дороги, синхронизация сокращений предсердий с сокращениями желудочков повышает насосную эффективность сердца и может быть полезна при застойной сердечной недостаточности.
Частотно-адаптивная стимуляция позволяет устройству определять физическую активность пациента и соответствующим образом реагировать, увеличивая или уменьшая базовую частоту стимуляции с помощью алгоритмов частотной адаптации.
Испытания DAVID [24] показали, что ненужная стимуляция правого желудочка может усугубить сердечную недостаточность и увеличить частоту возникновения мерцательной аритмии. Новые двухкамерные устройства могут свести к минимуму объем стимуляции правого желудочка и, таким образом, предотвратить ухудшение заболевания сердца.
Кардиостимулятор может быть имплантирован, когда человек бодрствует, с использованием местной анестезии , чтобы обезболить кожу с седацией или без нее , или спящему, с использованием общей анестезии . [25] Обычно назначают антибиотик, чтобы снизить риск инфекции. [25] Кардиостимуляторы обычно имплантируются в переднюю часть груди в области левого или правого плеча. Кожа подготавливается путем стрижки или бритья любых волос над местом имплантации перед очисткой кожи дезинфицирующим средством, таким как хлоргексидин . Делается разрез ниже ключицы, и под кожей создается пространство или карман для размещения генератора кардиостимулятора. Этот карман обычно создается чуть выше большой грудной мышцы (препекторальный), но в некоторых случаях устройство может быть вставлено под мышцу (субмускулярный). [26] Провод или провода вводятся в сердце через большую вену под контролем рентгеновского изображения ( флюороскопии ). Кончики электродов могут быть расположены в правом желудочке , правом предсердии или коронарном синусе, в зависимости от типа требуемого кардиостимулятора. [25] Операция обычно завершается в течение 30–90 минут. После имплантации хирургическая рана должна оставаться чистой и сухой до тех пор, пока она не заживет. Некоторые движения плеча в течение нескольких недель после установки несут риск смещения электродов кардиостимулятора. [25]
Батареи в генераторе кардиостимулятора обычно служат от 5 до 10 лет. Когда срок службы батарей подходит к концу, генератор заменяют с помощью процедуры, которая обычно проще, чем новый имплант. Замена включает в себя надрез для удаления существующего устройства, отсоединение проводов от старого устройства и повторное подключение их к новому генератору, повторную установку нового устройства и зашивание кожи. [25]

После имплантации кардиостимулятора его периодически проверяют, чтобы убедиться, что устройство работает и работает надлежащим образом; устройство можно проверять так часто, как это необходимо. Плановые проверки кардиостимулятора обычно проводятся в офисе каждые шесть месяцев, хотя могут варьироваться в зависимости от состояния пациента/устройства и доступности удаленного мониторинга. Более новые модели кардиостимуляторов также можно опрашивать удаленно, при этом пациент передает данные своего кардиостимулятора с помощью передатчика дома, подключенного к сотовой телефонной сети.
Во время последующего наблюдения в клинике диагностические тесты могут включать:
Образ жизни пациента обычно не претерпевает существенных изменений после установки кардиостимулятора. Есть несколько видов деятельности, которые неразумны, например, контактные виды спорта и воздействие на кардиостимулятор интенсивных магнитных полей.
Пациент с кардиостимулятором может обнаружить, что некоторые виды повседневных действий необходимо изменить. Например, плечевой ремень безопасности автомобиля может быть неудобен, если он попадает на место установки кардиостимулятора. Женщины не смогут носить бюстгальтеры в течение некоторого времени после операции, а позже, возможно, будут вынуждены носить бюстгальтеры с широкими лямками.
При некоторых видах спорта и физических нагрузках можно использовать специальную защиту для кардиостимулятора, чтобы предотвратить возможные травмы или повреждение электродов кардиостимулятора.
Кардиостимуляторы могут быть подвержены влиянию магнитных или электромагнитных полей , а также ионизирующего и акустического излучения . Однако исследование 2013 года показало, что «общий риск клинически значимых неблагоприятных событий, связанных с ЭМП (электромагнитными помехами) у реципиентов CIED (сердечно-сосудистых имплантируемых электронных устройств), очень низок. Поэтому не требуется никаких специальных мер предосторожности при использовании бытовых приборов. Экологические и промышленные источники ЭМП относительно безопасны, когда время воздействия ограничено, а расстояние от CIED максимально. Риск событий, вызванных ЭМП, наиболее высок в больничной среде». [27] В исследовании перечислены и сведены в таблицы многие источники помех и множество различных потенциальных эффектов: повреждение схем, асинхронная стимуляция и т. д. Некоторые источники опасности в старых устройствах были устранены в новых.
Следует избегать действий, связанных с сильными магнитными полями . Это включает в себя такие действия, как дуговая сварка с определенными типами оборудования, [28] и обслуживание тяжелого оборудования, которое может генерировать сильные магнитные поля. Некоторые медицинские процедуры, в частности магнитно-резонансная томография (МРТ), связаны с очень сильными магнитными полями или другими условиями, которые могут повредить кардиостимуляторы.
Однако многие современные кардиостимуляторы определены как МР-условно совместимые или МРТ-условно совместимые , безопасные для использования во время МРТ при соблюдении определенных условий. [29] Первым, кто был так указан, был Medtronic Revo MRI SureScan, одобренный FDA США в феврале 2011 года, [30] который был первым, кто был указан как МР-условно совместимый. [31] [32] Существует несколько условий для использования МР-условно совместимых кардиостимуляторов, включая квалификацию определенных пациентов и настройки сканирования. Устройство, условно пригодное для МРТ, должно иметь настройки МРТ, включенные перед сканированием и отключенные после него. [33]
По состоянию на 2014 год [обновлять]пять наиболее часто используемых производителей кардиостимуляторов (покрывающих более 99% рынка США) выпускали одобренные FDA кардиостимуляторы, совместимые с МРТ. [34] Использование МРТ может быть исключено, если у пациента установлен старый кардиостимулятор, несовместимый с МРТ, или если внутри сердца находятся старые провода для кардиостимулятора, которые больше не подключены к кардиостимулятору.
Исследование, проведенное в США в 2008 году, показало [35] , что магнитное поле, создаваемое некоторыми наушниками, используемыми с портативными музыкальными плеерами или мобильными телефонами, может вызывать помехи, если их разместить очень близко к некоторым кардиостимуляторам.
Кроме того, по данным Американской кардиологической ассоциации , некоторые домашние устройства могут иногда тормозить одиночный удар. Мобильные телефоны, по-видимому, не повреждают генераторы импульсов или не влияют на работу кардиостимулятора. [36] Рекомендуется, чтобы предметы, содержащие магниты или создающие значительное магнитное поле, не находились в непосредственной близости от кардиостимулятора. Индукционные варочные панели, в частности, могут представлять опасность. [37]
Перед медицинскими процедурами пациент должен сообщить всему медицинскому персоналу, что у него есть кардиостимулятор. Наличие кардиостимулятора не означает, что пациенту необходимо принимать антибиотики перед такими процедурами, как стоматологические. [38]
Группа Heart Rhythm Society , специализированной организации США, базирующейся в Вашингтоне, округ Колумбия, посчитала законным и этичным удовлетворять просьбы пациентов или лиц, имеющих законные полномочия принимать решения за пациентов, о деактивации имплантированных сердечных устройств. Юристы говорят, что правовая ситуация похожа на удаление зонда для кормления, хотя по состоянию на 2010 год [обновлять]в Соединенных Штатах не было ни одного юридического прецедента, связанного с кардиостимуляторами. Пациент во многих юрисдикциях (включая США) считается имеющим право отказаться или прекратить лечение, включая кардиостимулятор, который поддерживает его жизнь. Врачи имеют право отказаться от его отключения, но группа HRS рекомендует им направить пациента к врачу, который это сделает. [39] [40] Некоторые пациенты считают, что безнадежные, изнурительные состояния, такие как тяжелые инсульты или деменция на поздней стадии, могут причинить столько страданий, что они предпочли бы не продлевать свою жизнь поддерживающими мерами. [41]
Проблемы безопасности и конфиденциальности были подняты в связи с кардиостимуляторами, которые допускают беспроводную связь. Неавторизованные третьи лица могут читать записи пациентов, содержащиеся в кардиостимуляторе, или перепрограммировать устройства, как было продемонстрировано группой исследователей. [42] Демонстрация работала на близком расстоянии; они не пытались разработать антенну дальнего действия. Эксплойт доказательства концепции помогает продемонстрировать необходимость улучшения мер безопасности и оповещения пациентов в удаленно доступных медицинских имплантатах. [42] В ответ на эту угрозу исследователи Университета Пердью и Принстонского университета разработали прототип устройства брандмауэра под названием MedMon, которое предназначено для защиты беспроводных медицинских устройств, таких как кардиостимуляторы и инсулиновые помпы, от злоумышленников. [43]
Осложнения после операции по имплантации кардиостимулятора встречаются редко (приблизительно 1–3%), но могут включать: инфекцию в месте имплантации кардиостимулятора или в кровотоке; аллергическую реакцию на краситель или анестезию, используемые во время процедуры; отек, синяки или кровотечение в месте установки генератора или вокруг сердца, особенно если пациент принимает препараты для разжижения крови , пожилой, худой или иным образом хронически употребляет стероиды . [45]
Возможным осложнением двухкамерных искусственных водителей ритма является «тахикардия, опосредованная водителем ритма» (ПМТ), форма реципрокной тахикардии. При ПМТ искусственный водитель ритма формирует антероградную (от предсердия к желудочку) ветвь контура, а атриовентрикулярный (АВ) узел формирует ретроградную ветвь (от желудочка к предсердию) контура. [46] Лечение ПМТ обычно включает перепрограммирование водителя ритма. [46]
Другим возможным осложнением является «тахикардия, отслеживаемая кардиостимулятором», когда наджелудочковая тахикардия, такая как мерцательная аритмия или трепетание предсердий, отслеживается кардиостимулятором и производит удары от желудочкового электрода. [47] Это становится чрезвычайно редким явлением, поскольку новые устройства часто программируются на распознавание наджелудочковых тахикардий и переключение в режимы без отслеживания. [48]
Важно рассматривать электроды как потенциальный очаг тромбоэмболических событий. Электроды представляют собой провода небольшого диаметра от кардиостимулятора к месту имплантации в сердечной мышце и обычно вводятся внутривенно через подключичную вену для доступа к правому предсердию. Размещение инородного предмета в венозной системе таким образом может нарушить кровоток и привести к образованию тромба. Поэтому пациентам с кардиостимуляторами может потребоваться антикоагуляционная терапия, чтобы избежать потенциально опасного для жизни тромбоза или эмболии. [49] [50]
Эти электроды также могут повредить створки трехстворчатого клапана , либо во время размещения, либо из-за износа с течением времени. Это может привести к регургитации трехстворчатого клапана и правосторонней сердечной недостаточности , что может потребовать замены трехстворчатого клапана . [51]
Иногда электроды необходимо удалить. Наиболее распространенной причиной удаления электродов является инфекция; однако со временем электроды могут деградировать из-за ряда причин, таких как изгиб электрода. [52] Изменения в программировании кардиостимулятора могут в некоторой степени преодолеть деградацию электродов. Однако пациенту, у которого было несколько замен кардиостимулятора в течение десятилетия или двух, в течение которых электроды использовались повторно, может потребоваться операция по замене электродов.
Замена электродов может быть выполнена одним из двух способов. Вставьте новый набор электродов, не удаляя текущие электроды (не рекомендуется, так как это создает дополнительные препятствия для кровотока и функции сердечного клапана) или удалите текущие электроды, а затем вставьте новые. Техника удаления электродов будет зависеть от оценки хирургом вероятности того, что простого вытягивания будет достаточно для более сложных процедур. Электроды обычно можно легко отсоединить от кардиостимулятора, поэтому замена устройства обычно подразумевает простую операцию для доступа к устройству и его замены путем простого отсоединения электродов от устройства для замены и присоединения электродов к новому устройству. Возможные осложнения, такие как перфорация стенки сердца, возникают при удалении электрода(ов) из тела пациента.
Свободный конец электрода кардиостимулятора фактически имплантируется в сердечную мышцу с помощью миниатюрного винта или закрепляется небольшими пластиковыми крючками, называемыми зубцами. Чем дольше имплантируются электроды (начиная с года или двух), тем больше вероятность того, что они будут иметь дополнительные прикрепления к телу пациента в различных местах на пути от устройства к сердечной мышце, поскольку организм имеет тенденцию включать инородные устройства в ткани. В некоторых случаях для электрода, который был вставлен на короткое время, удаление может включать простое вытягивание, чтобы вытянуть электрод из тела. Удаление в других случаях обычно выполняется с помощью лазера или режущего устройства, которое надевается как канюля с режущей кромкой на электрод и перемещается вниз по электроду, чтобы удалить любые органические прикрепления с помощью крошечных режущих лазеров или аналогичного устройства. [53] [54]
В литературе описаны случаи неправильного расположения электрода кардиостимулятора в различных местах. Лечение варьируется в зависимости от расположения электрода кардиостимулятора и симптомов. [55]
Другое возможное осложнение, называемое синдромом Вертлюга, возникает, когда пациент манипулирует кардиостимулятором, в результате чего электроды смещаются с предполагаемого места и возникает возможная стимуляция других нервов.
Общая продолжительность жизни с кардиостимуляторами отличная и в основном зависит от сопутствующих заболеваний, наличия мерцательной аритмии, возраста и пола на момент первой имплантации. [56]
Иногда имплантируются устройства, напоминающие кардиостимуляторы, называемые имплантируемыми кардиовертерами-дефибрилляторами (ИКД). Эти устройства часто используются при лечении пациентов с риском внезапной сердечной смерти. ИКД способен лечить многие типы нарушений сердечного ритма с помощью кардиостимуляции, кардиоверсии или дефибрилляции . Некоторые устройства ИКД могут различать фибрилляцию желудочков и желудочковую тахикардию (ЖТ) и могут пытаться стимулировать сердце быстрее его собственной частоты в случае ЖТ, чтобы попытаться прервать тахикардию до того, как она перейдет в фибрилляцию желудочков. Это известно как быстрая стимуляция , ускоренная стимуляция или антитахикардическая стимуляция (АТП). АТП эффективна только в том случае, если основным ритмом является желудочковая тахикардия, и никогда не эффективна, если ритмом является желудочковая фибрилляция.

В 1889 году Джон Александр Мак-Вильям сообщил в British Medical Journal (BMJ) о своих экспериментах, в которых приложение электрического импульса к сердцу человека в асистолии вызывало сокращение желудочков , и что сердечный ритм в 60–70 ударов в минуту можно было вызвать импульсами, приложенными с интервалом, равным 60–70/минуту. [58]
В 1926 году Марк С. Лидвилл из Королевской больницы принца Альфреда в Сиднее, при поддержке физика Эдгара Х. Бута из Сиднейского университета , разработал портативный аппарат, который «подключался к точке освещения» и в котором «один полюс был приложен к кожной прокладке, пропитанной крепким солевым раствором», в то время как другой полюс «состоял из иглы, изолированной за исключением ее кончика, и был погружен в соответствующую сердечную камеру». «Частота кардиостимулятора варьировалась от примерно 80 до 120 импульсов в минуту, а напряжение также варьировалось от 1,5 до 120 вольт». [59] В 1928 году аппарат использовался для оживления мертворожденного младенца в Женской больнице Краун-стрит в Сиднее, чье сердце продолжало «биться само по себе» «после 10 минут» стимуляции. [60] [61]
В 1932 году американский физиолог Альберт Хайман с помощью своего брата описал электромеханический инструмент собственного изобретения, работающий от ручного двигателя с пружинным заводом. Сам Хайман называл свое изобретение «искусственным водителем ритма», этот термин используется и по сей день. [62] [63]
Очевидный перерыв в публикации исследований, проведенных между началом 1930-х годов и Второй мировой войной, может быть связан с общественным восприятием вмешательства в природу путем «оживления мертвых». [64] Например, «Хайман не опубликовал данные об использовании своего кардиостимулятора на людях из-за негативной рекламы, как среди его коллег-врачей, так и из-за газетных сообщений того времени. Лидвелл, возможно, знал об этом и не продолжил свои эксперименты на людях». [61]
В 1950 году канадский инженер-электрик Джон Хоппс спроектировал и построил первый внешний кардиостимулятор, основываясь на наблюдениях кардиоторакальных хирургов Уилфреда Гордона Бигелоу и Джона Каллагана в Торонтской больнице общего профиля . [65] Устройство было впервые испытано на собаке в Институте Бантинга при Университете Торонто . [66] Это существенное внешнее устройство, использующее технологию вакуумных трубок для обеспечения чрескожной стимуляции , было несколько грубым и болезненным для пациента в использовании и, будучи запитанным от розетки переменного тока, несло потенциальную опасность поражения пациента электрическим током и вызывая фибрилляцию желудочков . [67]
Ряд новаторов, включая Пола Цолла , с 1952 года создали меньшие, но все еще громоздкие устройства для транскутанной кардиостимуляции, используя большую перезаряжаемую батарею в качестве источника питания. [68]
В 1957 году Уильям Л. Вайрих опубликовал результаты исследований, проведенных в Университете Миннесоты . Эти исследования продемонстрировали восстановление частоты сердечных сокращений, сердечного выброса и среднего аортального давления у животных с полной блокадой сердца с помощью миокардиального электрода. [69]
В 1958 году колумбийский врач Альберто Вехарано Лаверде и колумбийский инженер-электрик Хорхе Рейнольдс Помбо сконструировали внешний кардиостимулятор, похожий на те, что были у Хоппса и Цолла, весом 45 кг и работающий от 12-вольтовой свинцово-кислотной автомобильной батареи , но подключенный к электродам, прикрепленным к сердцу. Этот аппарат успешно использовался для поддержания жизни 70-летнего священника Херардо Флореса. [70]
Разработка кремниевого транзистора и его первая коммерческая доступность в 1956 году стали ключевым событием, которое привело к быстрому развитию практической кардиостимуляции. [71]
В 1958 году инженер Эрл Баккен из Миннеаполиса, штат Миннесота, создал первый носимый внешний кардиостимулятор для пациента C. Walton Lillehei . Этот транзисторный кардиостимулятор, размещенный в небольшой пластиковой коробке, имел элементы управления, позволяющие регулировать частоту сердечных сокращений и выходное напряжение, и был подключен к электродным выводам , которые проходили через кожу пациента и заканчивались электродами, прикрепленными к поверхности миокарда сердца .
В Великобритании в 1960-х годах Lucas Engineering в Бирмингеме получил от г-на Абрамса из больницы королевы Елизаветы запрос на создание прототипа транзисторной замены электромеханического продукта. Команду возглавлял Роджер Нолан, инженер из исследовательского центра Lucas Group. Нолан спроектировал и создал первый блокирующий генератор и транзисторный кардиостимулятор. Этот кардиостимулятор носился на поясе и питался от герметичной перезаряжаемой батареи, что позволяло пользователям жить более нормальной жизнью.
Одним из первых пациентов, получивших этот кардиостимулятор Lucas, была женщина в возрасте около 30 лет. Операция была проведена в 1964 году южноафриканским кардиохирургом Альфом Ганнингом, [72] [73] учеником Кристиана Барнарда . Эта новаторская операция проводилась под руководством кардиолога Питера Слейта в больнице Рэдклиффа в Оксфорде и его исследовательской группы в больнице Святого Георгия в Лондоне. [74] [75]
Первая клиническая имплантация человеку полностью имплантируемого кардиостимулятора состоялась 8 октября 1958 года [76] в Каролинском институте в Сольне, Швеция , с использованием кардиостимулятора, разработанного изобретателем Руне Элмквистом и хирургом Оке Сеннингом (в сотрудничестве с Elema-Schönander AB, позже Siemens-Elema AB), подключенного к электродам, прикрепленным к миокарду сердца путем торакотомии . Устройство вышло из строя через три часа. Затем было имплантировано второе устройство, которое прослужило два дня. Первый в мире пациент с имплантируемым кардиостимулятором, Арне Ларссон , получил 26 различных кардиостимуляторов в течение своей жизни. Он умер в 2001 году в возрасте 86 лет, пережив изобретателя и хирурга. [77]
В 1959 году Сеймур Фурман и Джон Шведель впервые продемонстрировали временную трансвенозную стимуляцию , при которой катетерный электрод вводился через базилярную вену пациента . [78]
В феврале 1960 года улучшенная версия шведской конструкции Элмквиста была имплантирована докторами Орестесом Фиандрой и Роберто Рубио в больнице Casmu 1 в Монтевидео , Уругвай. Этот кардиостимулятор, первый имплантированный в Америке, прослужил до тех пор, пока пациент не умер от других заболеваний девять месяцев спустя. Ранние шведские устройства использовали батареи, заряжаемые индукционной катушкой извне.
Имплантируемые кардиостимуляторы, созданные инженером Уилсоном Грейтбатчем, начали использоваться у людей с апреля 1960 года после обширных испытаний на животных . Инновация Грейтбатча отличалась от более ранних шведских устройств тем, что в качестве источника энергии использовались первичные элементы ( ртутная батарея ). Первый пациент прожил еще 18 месяцев.
Первое использование трансвенозной стимуляции в сочетании с имплантированным кардиостимулятором было осуществлено Парсоннетом в Соединенных Штатах [79] [80] [81] Лагергреном в Швеции [82] [83] и Жан-Жаком Вельти во Франции [84] в 1962–63 годах. Трансвенозная, или первенозная, процедура включала разрез вены, в которую вводился электрод катетера под флюороскопическим контролем, пока он не застрял в трабекулах правого желудочка. Это стало методом выбора к середине 1960-х годов.
Кардиоторакальный хирург Леон Абрамс и медицинский инженер Рэй Лайтвуд разработали и имплантировали первый пациенту контролируемый кардиостимулятор с переменной частотой в 1960 году в Университете Бирмингема . Первая имплантация состоялась в марте 1960 года, а еще две имплантации в следующем месяце. Эти три пациента хорошо выздоровели и вернулись к высокому качеству жизни. К 1966 году имплантацию перенесли 56 пациентов, один из которых прожил более 5 лет .+1 ⁄ 2 года. [85] [86]

Все предшествующие имплантируемые устройства страдали от ненадежности и короткого срока службы доступной технологии первичных элементов, в основном ртутных батарей . В конце 1960-х годов несколько компаний, включая ARCO в США, разработали кардиостимуляторы на изотопном питании , но эта разработка была опередлена разработкой в 1971 году элемента на основе литий-йодида Уилсоном Грейтбатчем . [88] Литий-йодидные или литиевые анодные элементы стали стандартом для конструкций кардиостимуляторов.
Еще одним препятствием для надежности ранних устройств была диффузия водяного пара из жидкостей организма через эпоксидную смолу, что влияло на электронные схемы. Это явление было преодолено путем заключения генератора кардиостимулятора в герметичный металлический корпус, первоначально Telectronics из Австралии в 1969 году, а затем Cardiac Pacemakers, Inc. из Сент-Пола, Миннесота, в 1972 году. Эта технология, использующая титан в качестве металла корпуса, стала стандартом к середине 1970-х годов.
9 июля 1974 года Мануэль А. Вильяфанья и Энтони Аддуччи , основатели Cardiac Pacemakers, Inc. ( Guidant ), изготовили первый в мире кардиостимулятор с литиевым анодом и твердотельной батареей с литий-йодистым электролитом. Литий-йодистые или литиевые анодные элементы увеличили срок службы кардиостимуляторов с одного года до одиннадцати лет и стали стандартом для конструкций кардиостимуляторов. Они начали проектировать и тестировать свой имплантируемый кардиостимулятор, работающий от новой литиевой батареи с более длительным сроком службы, в 1971 году. Первый пациент, которому был установлен кардиостимулятор CPI, вышел из операции в июне 1973 года. [87] [89]
Лизе Мортон имплантировали кардиостимулятор в возрасте 11 дней в 1978 году в больнице Йоркхилл в Глазго, Шотландия. Она была самым младшим ребенком в то время [90] [91]
В 2013 году несколько фирм объявили об устройствах, которые можно было бы вводить через катетер в ногу, а не инвазивной хирургией. Устройства примерно такого же размера и формы, как таблетка, намного меньше, чем размер традиционного кардиостимулятора. После имплантации зубцы устройства контактируют с мышцей и стабилизируют сердцебиение. Разработка этого типа устройств продолжалась. [92] В ноябре 2014 года Билл Пайк из Фэрбанкса, Аляска , получил кардиостимулятор Medtronic Micra в больнице Providence St Vincent в Портленде, штат Орегон . Д. Рэндольф Джонс был врачом EP. Также в 2014 году St. Jude Medical Inc. объявила о первых зачислениях в наблюдательное исследование компании Leadless Pacemaker Observational Study, оценивающее технологию безвыводной стимуляции Nanostim. Кардиостимулятор Nanostim получил европейскую маркировку CE в 2013 году. Испытания имплантатов после одобрения проводились в Европе. [93] Европейское исследование было остановлено после сообщений о шести перфорациях, которые привели к двум смертям пациентов. После расследования St Jude Medical возобновила исследование. [94] В Соединенных Штатах эта терапия не была одобрена FDA по состоянию на 2014 год [обновлять]. [95] Хотя St Jude Nanostim и Medtronic Micra являются однокамерными кардиостимуляторами, предполагалось, что безэлектродная двухкамерная стимуляция для пациентов с атриовентрикулярной блокадой станет возможной при дальнейшем развитии. [96]
Ежегодно во всем мире тысячи кардиостимуляторов извлекаются из тел для кремации с помощью простой процедуры, позволяющей избежать взрывов. Кардиостимуляторы со значительным оставшимся сроком службы батареи являются потенциально спасающими жизни устройствами для людей в странах с низким и средним уровнем дохода (СНСД). [97] Институт медицины , неправительственная организация США , сообщил, что недостаточный доступ к передовым сердечно-сосудистым технологиям является основным фактором заболеваемости и смертности от сердечно-сосудистых заболеваний в СНСД. Начиная с 1970-х годов многочисленные исследования по всему миру сообщали о безопасности и эффективности повторного использования кардиостимуляторов. По состоянию на 2016 год [обновлять]общепринятые стандарты безопасного повторного использования кардиостимуляторов и ИКД не были разработаны, и по-прежнему существуют правовые и нормативные барьеры для широкого внедрения повторного использования медицинских устройств. [98]
Текущие и предыдущие производители имплантируемых кардиостимуляторов
{{cite web}}: CS1 maint: неподходящий URL ( ссылка )