
Фагоциты — это клетки , которые защищают организм, поглощая вредные инородные частицы, бактерии , а также мертвые или умирающие клетки. Их название происходит от греческого phagein , «есть» или «пожирать», и «-cyte», суффикса в биологии, обозначающего «клетку», от греческого kutos , «полый сосуд». [1] Они необходимы для борьбы с инфекциями и последующего иммунитета . [2] Фагоциты играют важную роль во всем животном мире [3] и высоко развиты у позвоночных. [4] В одном литре человеческой крови содержится около шести миллиардов фагоцитов. [5] Они были открыты в 1882 году Ильей Ильичем Мечниковым во время изучения личинок морских звезд . [6] За свое открытие Мечников был удостоен Нобелевской премии по физиологии и медицине 1908 года . [7] Фагоциты встречаются у многих видов; некоторые амебы ведут себя как фагоциты-макрофаги, что позволяет предположить, что фагоциты появились на ранних стадиях эволюции жизни. [8]
Фагоциты человека и других животных называются «профессиональными» или «непрофессиональными» в зависимости от того, насколько они эффективны при фагоцитозе . [9] К профессиональным фагоцитам относятся многие типы лейкоцитов (такие как нейтрофилы , моноциты , макрофаги , тучные клетки и дендритные клетки ). [10] Основное различие между профессиональными и непрофессиональными фагоцитами заключается в том, что профессиональные фагоциты имеют на своей поверхности молекулы, называемые рецепторами , которые могут обнаруживать вредные объекты, такие как бактерии, которые обычно не встречаются в организме. Непрофессиональные фагоциты не имеют эффективных фагоцитарных рецепторов, например, для опсонинов . [11] Фагоциты играют решающую роль в борьбе с инфекциями, а также в поддержании здоровья тканей путем удаления мертвых и умирающих клеток, срок службы которых истек. [12]
Во время инфекции химические сигналы привлекают фагоциты к местам проникновения возбудителя в организм. Эти химические вещества могут поступать из бактерий или других уже присутствующих фагоцитов. Фагоциты перемещаются методом, называемым хемотаксисом . Когда фагоциты вступают в контакт с бактериями, рецепторы на поверхности фагоцита связываются с ними. Это связывание приведет к поглощению бактерий фагоцитом. [13] Некоторые фагоциты убивают проглоченный патоген с помощью окислителей и оксида азота . [14] После фагоцитоза макрофаги и дендритные клетки также могут участвовать в презентации антигена — процессе, при котором фагоцит перемещает части проглоченного материала обратно на свою поверхность. Этот материал затем отображается другим клеткам иммунной системы. Некоторые фагоциты затем попадают в лимфатические узлы организма и отображают материал лейкоцитам, называемым лимфоцитами . Этот процесс важен для формирования иммунитета [15] , и многие патогены разработали методы уклонения от атак фагоцитов. [2]

Русский зоолог Илья Ильич Мечников (1845–1916) впервые признал, что специализированные клетки участвуют в защите от микробных инфекций. [16] В 1882 году он изучал подвижные (свободно движущиеся) клетки личинок морских звезд , полагая, что они важны для иммунной защиты животных. Чтобы проверить свою идею, он вставил в личинки небольшие шипы мандаринового дерева. Через несколько часов он заметил, что шипы окружили подвижные клетки. [16] Мечников отправился в Вену и поделился своими идеями с Карлом Фридрихом Клаусом , который предложил название «фагоцит» (от греческих слов phagein , что означает «есть или пожирать», и kutos , что означает «полый сосуд» [1] ) для клетки, которые наблюдал Мечников. [17]
Год спустя Мечников изучал пресноводного ракообразного под названием дафния , крошечное прозрачное животное, которое можно рассматривать прямо под микроскопом. Он обнаружил, что споры грибков, атаковавшие животное, уничтожались фагоцитами. Он распространил свои наблюдения на лейкоциты млекопитающих и обнаружил, что бактерия Bacillus anthracis может быть поглощена и уничтожена фагоцитами - процесс, который он назвал фагоцитозом . [18] Мечников предположил, что фагоциты являются основной защитой от вторгающихся организмов. [16]
В 1903 году Альмрот Райт обнаружил, что фагоцитоз усиливается специфическими антителами , которые он назвал опсонинами , от греческого opson — «приправа или приправа». [19] Мечников был удостоен (совместно с Паулем Эрлихом ) Нобелевской премии по физиологии и медицине 1908 года за работы по фагоцитам и фагоцитозу. [7]
Хотя важность этих открытий постепенно получила признание в начале двадцатого века, сложные взаимоотношения между фагоцитами и всеми другими компонентами иммунной системы не были известны до 1980-х годов. [20]
![Мультфильм: 1. Частица изображена овалом, а поверхность фагоцита - прямой линией. Различные более мелкие фигуры находятся на линии и овале. 2. Меньшие частицы на каждой поверхности соединяются. 3. Линия теперь вогнутая и частично охватывает овал.[21]](http://upload.wikimedia.org/wikipedia/commons/thumb/b/ba/Phagocytosis_in_three_steps.png/220px-Phagocytosis_in_three_steps.png)
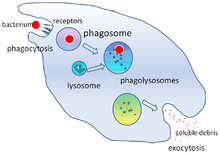
Фагоцитоз — это процесс поглощения клеткой таких частиц, как бактерии, инвазивные грибы , паразиты, мертвые клетки-хозяева , а также клеточный и инородный мусор. [22] Это включает в себя цепочку молекулярных процессов. [23] [24] Фагоцитоз происходит после того, как инородное тело, например, бактериальная клетка, связалось с молекулами, называемыми «рецепторами», которые находятся на поверхности фагоцита. Затем фагоцит растягивается вокруг бактерии и поглощает ее. Фагоцитоз бактерий нейтрофилами человека занимает в среднем девять минут. [25] Попав внутрь этого фагоцита, бактерия попадает в отсек, называемый фагосомой . В течение одной минуты фагосома сливается либо с лизосомой , либо с гранулой , образуя фаголизосому . Затем бактерия подвергается множеству механизмов уничтожения [26] и через несколько минут погибает. [25] Дендритные клетки и макрофаги не такие быстрые, и фагоцитоз в этих клетках может занять много часов. Макрофаги едят медленно и неопрятно; они поглощают огромное количество материала и часто выделяют непереваренную часть обратно в ткани. Этот мусор служит сигналом для привлечения большего количества фагоцитов из крови. [27] Фагоциты обладают ненасытным аппетитом; ученые даже кормили макрофаги железными опилками , а затем использовали небольшой магнит, чтобы отделить их от других клеток. [28]

Фагоцит имеет на своей поверхности множество типов рецепторов, которые используются для связывания материала. [2] К ним относятся опсониновые рецепторы, рецепторы-мусорщики и Toll-подобные рецепторы . Рецепторы опсонина усиливают фагоцитоз бактерий, покрытых антителами к иммуноглобулину G (IgG) или комплементом . «Комплемент» — это название сложной серии белковых молекул, обнаруженных в крови, которые разрушают клетки или помечают их для разрушения. [29] Рецепторы-мусорщики связываются с большим количеством молекул на поверхности бактериальных клеток, а Toll-подобные рецепторы, названные так из-за их сходства с хорошо изученными рецепторами плодовых мух, которые кодируются геном Toll, связываются с большим количеством молекул. специфические молекулы, включая чужеродную ДНК и РНК. [30] Связывание с Toll-подобными рецепторами увеличивает фагоцитоз и заставляет фагоцит высвобождать группу гормонов, вызывающих воспаление . [2]
Уничтожение микробов является важнейшей функцией фагоцитов, которая осуществляется либо внутри фагоцита ( внутриклеточное уничтожение), либо вне фагоцита ( внеклеточное уничтожение). [31]
Когда фагоцит поглощает бактерии (или любой материал), его потребление кислорода увеличивается. Увеличение потребления кислорода, называемое респираторным взрывом , приводит к образованию реактивных кислородсодержащих молекул, обладающих противомикробным действием. [32] Соединения кислорода токсичны как для захватчика, так и для самой клетки, поэтому они хранятся в отсеках внутри клетки. Этот метод уничтожения вторгшихся микробов с использованием активных кислородсодержащих молекул называется кислородзависимым внутриклеточным уничтожением, которое существует двух типов. [14]
Первый тип — это кислородзависимое производство супероксида [ 2] , который является богатым кислородом веществом, убивающим бактерии. [33] Супероксид преобразуется в перекись водорода и синглетный кислород с помощью фермента, называемого супероксиддисмутазой . Супероксиды также реагируют с перекисью водорода с образованием гидроксильных радикалов , которые помогают убить вторгшийся микроб. [2]
Второй тип предполагает использование фермента миелопероксидазы из гранул нейтрофилов. [34] Когда гранулы сливаются с фагосомой, миелопероксидаза высвобождается в фаголизосому, и этот фермент использует перекись водорода и хлор для создания гипохлорита , вещества, используемого в домашнем отбеливателе . Гипохлорит чрезвычайно токсичен для бактерий. [2] Миелопероксидаза содержит гемовый пигмент, который отвечает за зеленый цвет секретов, богатых нейтрофилами, таких как гной и инфицированная мокрота . [35]

Фагоциты также могут убивать микробы кислороднезависимыми методами, но они не так эффективны, как кислородзависимые. Существует четыре основных типа. Первый использует электрически заряженные белки, которые повреждают мембрану бактерии . Второй тип использует лизоцимы; эти ферменты разрушают клеточную стенку бактерий . Третий тип использует лактоферрины , которые присутствуют в гранулах нейтрофилов и удаляют необходимое железо из бактерий. [36] Четвертый тип использует протеазы и гидролитические ферменты ; эти ферменты используются для переваривания белков уничтоженных бактерий. [37]
Интерферон-гамма , который когда-то назывался фактором активации макрофагов, стимулирует макрофаги вырабатывать оксид азота . Источником гамма-интерферона могут быть CD4 + Т-клетки , CD8 + Т-клетки , естественные клетки-киллеры , В-клетки , естественные Т-киллеры Т-клетки , моноциты, другие макрофаги или дендритные клетки. [38] Оксид азота затем высвобождается из макрофага и из-за своей токсичности убивает микробы вблизи макрофага. [2] Активированные макрофаги продуцируют и секретируют фактор некроза опухоли . Этот цитокин — класс сигнальных молекул [39] — убивает раковые клетки и клетки, инфицированные вирусами, и помогает активировать другие клетки иммунной системы. [40]
При некоторых заболеваниях, например, редкой хронической гранулематозной болезни , эффективность фагоцитов снижается, и проблемой являются рецидивирующие бактериальные инфекции. [41] При этом заболевании наблюдается аномалия, затрагивающая различные элементы кислородзависимого уничтожения. Другие редкие врожденные аномалии, такие как синдром Чедиака-Хигаси , также связаны с дефектным уничтожением проглоченных микробов. [42]
Вирусы могут размножаться только внутри клеток и проникать в них, используя многие рецепторы, участвующие в иммунитете. Попав внутрь клетки, вирусы используют ее биологические механизмы в своих целях, заставляя клетку создавать сотни идентичных копий самих себя. Хотя фагоциты и другие компоненты врожденной иммунной системы могут в ограниченной степени контролировать вирусы, когда вирус оказывается внутри клетки, адаптивные иммунные реакции, особенно лимфоциты, становятся более важными для защиты. [43] В местах вирусных инфекций лимфоциты часто значительно превосходят по численности все остальные клетки иммунной системы; это часто встречается при вирусном менингите . [44] Зараженные вирусом клетки, убитые лимфоцитами, выводятся из организма фагоцитами. [45]
У животного клетки постоянно умирают. Баланс между делением клеток и их гибелью сохраняет количество клеток относительно постоянным у взрослых. [12] Клетка может погибнуть двумя способами: в результате некроза или апоптоза. В отличие от некроза, который часто возникает в результате заболевания или травмы, апоптоз — или запрограммированная гибель клеток — является нормальной здоровой функцией клеток. Организму ежедневно приходится избавляться от миллионов мертвых или умирающих клеток, и фагоциты играют в этом процессе решающую роль. [46]
Умирающие клетки, которые проходят заключительные стадии апоптоза [47], отображают на своей поверхности молекулы, такие как фосфатидилсерин , для привлечения фагоцитов. [48] Фосфатидилсерин обычно обнаруживается на цитозольной поверхности плазматической мембраны, но во время апоптоза перераспределяется на внеклеточную поверхность белком, известным как скрамблаза . [49] [50] Эти молекулы маркируют клетку для фагоцитоза клетками, которые обладают соответствующими рецепторами, такими как макрофаги. [51] Удаление умирающих клеток фагоцитами происходит упорядоченно, не вызывая воспалительной реакции , и является важной функцией фагоцитов. [52]
Фагоциты обычно не связаны с каким-либо конкретным органом , а перемещаются по организму, взаимодействуя с другими фагоцитирующими и нефагоцитарными клетками иммунной системы. Они могут взаимодействовать с другими клетками, производя химические вещества, называемые цитокинами , которые привлекают другие фагоциты к месту инфекции или стимулируют спящие лимфоциты . [53] Фагоциты являются частью врожденной иммунной системы , с которой рождаются животные, включая человека. Врожденный иммунитет очень эффективен, но неспецифичен, поскольку не делает различий между различными типами захватчиков. С другой стороны, адаптивная иммунная система челюстных позвоночных — основа приобретенного иммунитета — высокоспециализирована и может защитить практически от любого типа захватчика. [54] Адаптивная иммунная система зависит не от фагоцитов, а от лимфоцитов, которые производят защитные белки, называемые антителами , которые метят захватчиков для уничтожения и предотвращают заражение клеток вирусами. [55] Фагоциты, в частности дендритные клетки и макрофаги, стимулируют лимфоциты вырабатывать антитела посредством важного процесса, называемого презентацией антигена . [56]

Презентация антигена — это процесс, при котором некоторые фагоциты перемещают части поглощенных материалов обратно на поверхность своих клеток и «презентуют» их другим клеткам иммунной системы. [57] Существует две «профессиональные» антигенпрезентирующие клетки: макрофаги и дендритные клетки. [58] После поглощения чужеродные белки ( антигены ) расщепляются на пептиды внутри дендритных клеток и макрофагов. Эти пептиды затем связываются с гликопротеинами главного комплекса гистосовместимости клетки (MHC), которые переносят пептиды обратно на поверхность фагоцита, где они могут быть «презентированы» лимфоцитам. [15] Зрелые макрофаги не уходят далеко от места заражения, но дендритные клетки могут достигать лимфатических узлов организма , где находятся миллионы лимфоцитов. [59] Это повышает иммунитет, поскольку лимфоциты реагируют на антигены, представленные дендритными клетками, так же, как и в месте первоначальной инфекции. [60] Но дендритные клетки также могут разрушать или успокаивать лимфоциты, если они распознают компоненты тела хозяина; это необходимо для предотвращения аутоиммунных реакций. Этот процесс называется толерантностью. [61]
Дендритные клетки также способствуют иммунологической толерантности, [62] которая не позволяет организму атаковать сам себя. Первый тип толерантности — центральная толерантность , возникающая в тимусе. Т-клетки , которые слишком сильно связываются (через свои Т-клеточные рецепторы) с аутоантигеном (представленным дендритными клетками на молекулах MHC), погибают. Второй тип иммунологической толерантности — периферическая толерантность . Некоторые аутореактивные Т-клетки покидают тимус по ряду причин, в основном из-за отсутствия экспрессии некоторых аутоантигенов в тимусе. Другой тип Т-клеток; Т-регуляторные клетки могут подавлять аутореактивные Т-клетки на периферии. [63] Когда иммунологическая толерантность снижается, могут возникнуть аутоиммунные заболевания . [64]

Фагоциты человека и других челюстных позвоночных делятся на «профессиональные» и «непрофессиональные» группы в зависимости от эффективности их участия в фагоцитозе. [9] Профессиональные фагоциты — это миелоидные клетки , в состав которых входят моноциты , макрофаги , нейтрофилы , тканевые дендритные клетки и тучные клетки . [10] В одном литре человеческой крови содержится около шести миллиардов фагоцитов. [5]
Все фагоциты, и особенно макрофаги, существуют в степени готовности. Макрофаги обычно относительно дремлют в тканях и медленно размножаются. В этом полупокоящемся состоянии они удаляют мертвые клетки-хозяева и другой неинфекционный мусор и редко принимают участие в презентации антигена. Но во время инфекции они получают химические сигналы — обычно гамма-интерферон — которые увеличивают выработку ими молекул MHC II и подготавливают их к представлению антигенов. В этом состоянии макрофаги являются хорошими антигенпрезентаторами и киллерами. Если они получают сигнал непосредственно от захватчика, они становятся «гиперактивными», перестают размножаться и концентрируются на убийстве. Их размер и скорость фагоцитоза увеличиваются — некоторые становятся достаточно большими, чтобы поглотить вторгшихся простейших . [65]
В крови нейтрофилы неактивны, но движутся с высокой скоростью. Когда они получают сигналы от макрофагов в местах воспаления, они замедляются и покидают кровь. В тканях они активируются цитокинами и прибывают на место боя готовые убивать. [66]

При возникновении инфекции подается химический сигнал «SOS», привлекающий к месту заражения фагоциты. [67] Эти химические сигналы могут включать белки вторгшихся бактерий, пептиды системы свертывания крови , продукты комплемента и цитокины, выделяемые макрофагами, расположенными в ткани вблизи места инфекции. [2] Другая группа химических аттрактантов — это цитокины , которые привлекают нейтрофилы и моноциты из крови. [13]
Чтобы добраться до места заражения, фагоциты покидают кровоток и попадают в пораженные ткани. Сигналы инфекции заставляют эндотелиальные клетки, выстилающие кровеносные сосуды, вырабатывать белок под названием селектин , к которому нейтрофилы прилипают, проходя мимо. Другие сигналы, называемые вазодилататорами , ослабляют соединения, соединяющие эндотелиальные клетки, позволяя фагоцитам проходить через стенку. Хемотаксис — это процесс, при котором фагоциты следуют по «запаху» цитокинов к инфицированному участку. [2] Нейтрофилы перемещаются через органы, выстланные эпителиальными клетками, к местам инфекции, и хотя это важный компонент борьбы с инфекцией, сама миграция может привести к симптомам, похожим на болезнь. [68] Во время инфекции миллионы нейтрофилов рекрутируются из крови, но они погибают через несколько дней. [69]
.jpg/440px-Monocytes,_a_type_of_white_blood_cell_(Giemsa_stained).jpg)
Моноциты развиваются в костном мозге и достигают зрелости в крови. Зрелые моноциты имеют крупные гладкие дольчатые ядра и обильную цитоплазму , содержащую гранулы. Моноциты поглощают чужеродные или опасные вещества и представляют антигены другим клеткам иммунной системы. Моноциты образуют две группы: циркулирующую и маргинальную группу, которые остаются в других тканях (около 70% находятся в маргинальной группе). Большинство моноцитов покидают кровоток через 20–40 часов и попадают в ткани и органы, превращаясь при этом в макрофаги [70] или дендритные клетки в зависимости от получаемых ими сигналов. [71] В одном литре человеческой крови содержится около 500 миллионов моноцитов. [5]
Зрелые макрофаги не путешествуют далеко, а стоят на страже тех участков тела, которые подвергаются воздействию внешнего мира. Там они действуют как сборщики мусора, антигенпредставляющие клетки или свирепые убийцы, в зависимости от получаемых сигналов. [72] Они происходят из моноцитов, гранулоцитарных стволовых клеток или клеточного деления ранее существовавших макрофагов. [73] Макрофаги человека имеют диаметр около 21 микрометра . [74]

Этот тип фагоцитов не имеет гранул, но содержит множество лизосом . Макрофаги обнаруживаются по всему телу почти во всех тканях и органах (например, микроглиальные клетки в мозге и альвеолярные макрофаги в легких ), где они молча подстерегают. Местоположение макрофага может определять его размер и внешний вид. Макрофаги вызывают воспаление посредством производства интерлейкина-1 , интерлейкина-6 и TNF-альфа . [75] Макрофаги обычно обнаруживаются только в тканях и редко встречаются в кровообращении. По оценкам, продолжительность жизни тканевых макрофагов составляет от четырех до пятнадцати дней. [76]
Макрофаги могут быть активированы для выполнения функций, которые покоящийся моноцит не может выполнять. [75] Т-хелперные клетки (также известные как эффекторные Т-клетки или Т - клетки), подгруппа лимфоцитов, ответственны за активацию макрофагов. Клетки Th 1 активируют макрофаги путем передачи сигнала IFN-гамма и демонстрации белка- лиганда CD40 . [77] Другие сигналы включают TNF-альфа и липополисахариды бактерий. [75] Клетки Th 1 могут рекрутировать другие фагоциты в место инфекции несколькими способами. Они секретируют цитокины, которые действуют на костный мозг , стимулируя выработку моноцитов и нейтрофилов, а также секретируют некоторые цитокины , которые отвечают за миграцию моноцитов и нейтрофилов из кровотока. [78] Клетки Th 1 возникают в результате дифференцировки CD4 + Т-клеток, как только они ответили на антиген во вторичных лимфоидных тканях . [75] Активированные макрофаги играют важную роль в разрушении опухоли , производя TNF-альфа, IFN-гамма, оксид азота, активные соединения кислорода, катионные белки и гидролитические ферменты. [75]

Нейтрофилы обычно обнаруживаются в кровотоке и являются наиболее распространенным типом фагоцитов, составляя от 50% до 60% от общего количества циркулирующих лейкоцитов. [79] Один литр человеческой крови содержит около пяти миллиардов нейтрофилов, [5] диаметром около 10 микрометров [80] и живущих всего около пяти дней. [40] После получения соответствующих сигналов им требуется около тридцати минут, чтобы выйти из крови и добраться до места заражения. [81] Они свирепые пожиратели и быстро поглощают захватчиков, покрытых антителами и комплементом , а также поврежденные клетки или клеточный мусор. Нейтрофилы не возвращаются в кровь; они превращаются в гнойные клетки и умирают. [81] Зрелые нейтрофилы меньше моноцитов и имеют сегментированное ядро с несколькими участками; каждый участок соединен нитями хроматина — нейтрофилы могут иметь 2–5 сегментов. Нейтрофилы обычно не покидают костный мозг до зрелости, но во время инфекции высвобождаются предшественники нейтрофилов, называемые метамиелоцитами , миелоцитами и промиелоцитами . [82]
Внутриклеточные гранулы нейтрофилов человека давно известны своими белковоразрушающими и бактерицидными свойствами. [83] Нейтрофилы могут секретировать продукты, которые стимулируют моноциты и макрофаги. Секреция нейтрофилов усиливает фагоцитоз и образование активных соединений кислорода, участвующих во внутриклеточном уничтожении. [84] Секреции первичных гранул нейтрофилов стимулируют фагоцитоз бактерий, покрытых IgG -антителами. [85] При встрече с бактериями, грибами или активированными тромбоцитами они образуют паутинные структуры хроматина, известные как внеклеточные ловушки нейтрофилов (NET). Состоящие в основном из ДНК, NETs вызывают смерть в результате процесса, называемого нетозом: после того, как патогены попадают в ловушку NETs, они погибают за счет окислительных и неокислительных механизмов. [86]

Дендритные клетки — это специализированные антигенпрезентирующие клетки, имеющие длинные отростки, называемые дендритами, [87] которые помогают поглощать микробы и других захватчиков. [88] [89] Дендритные клетки присутствуют в тканях, которые контактируют с внешней средой, главным образом в коже, внутренней оболочке носа, легких, желудке и кишечнике. [90] После активации они созревают и мигрируют в лимфоидные ткани, где взаимодействуют с Т- и В-клетками , инициируя и организуя адаптивный иммунный ответ. [91] Зрелые дендритные клетки активируют Т-хелперные клетки и цитотоксические Т-клетки . [92] Активированные Т-хелперы взаимодействуют с макрофагами и В-клетками, активируя их по очереди. Кроме того, дендритные клетки могут влиять на тип вырабатываемого иммунного ответа; когда они попадают в лимфоидные области, где содержатся Т-клетки, они могут активировать Т-клетки, которые затем дифференцируются в цитотоксические Т-клетки или Т-хелперы. [88]
Тучные клетки имеют Toll-подобные рецепторы и взаимодействуют с дендритными клетками, В-клетками и Т-клетками, помогая опосредовать адаптивные иммунные функции. [93] Тучные клетки экспрессируют молекулы MHC класса II и могут участвовать в презентации антигена; однако роль тучных клеток в презентации антигена не очень хорошо изучена. [94] Тучные клетки могут потреблять и убивать грамотрицательные бактерии (например, сальмонеллу ), а также перерабатывать их антигены. [95] Они специализируются на переработке фимбриальных белков на поверхности бактерий, которые участвуют в адгезии к тканям. [96] [97] В дополнение к этим функциям тучные клетки вырабатывают цитокины, которые вызывают воспалительную реакцию. [98] Это жизненно важная часть уничтожения микробов, поскольку цитокины привлекают больше фагоцитов к месту инфекции. [95] [99]
Умирающие клетки и чужеродные организмы потребляются клетками, отличными от «профессиональных» фагоцитов. [101] Эти клетки включают эпителиальные клетки , эндотелиальные клетки , фибробласты и мезенхимальные клетки. Их называют непрофессиональными фагоцитами, чтобы подчеркнуть, что, в отличие от профессиональных фагоцитов, фагоцитоз не является их основной функцией. [102] Например, фибробласты, которые могут фагоцитировать коллаген в процессе реконструкции рубцов, также будут предпринимать попытки поглотить инородные частицы. [103]
Непрофессиональные фагоциты более ограничены, чем профессиональные фагоциты, в типе частиц, которые они могут поглощать. Это связано с отсутствием у них эффективных фагоцитарных рецепторов, в частности опсонинов , которые представляют собой антитела и комплемент, присоединяемые к захватчикам иммунной системой. [11] Кроме того, большинство непрофессиональных фагоцитов не производят активные кислородсодержащие молекулы в ответ на фагоцитоз. [104]

Патогену удается заразить организм только в том случае, если он может преодолеть его защиту. Патогенные бактерии и простейшие разработали множество методов сопротивления атакам фагоцитов, и многие из них действительно выживают и размножаются внутри фагоцитирующих клеток. [107] [108]
Существует несколько способов, которыми бактерии избегают контакта с фагоцитами. Во-первых, они могут расти в местах, куда фагоциты не способны добраться (например, на поверхности неповрежденной кожи). Во-вторых, бактерии могут подавлять воспалительную реакцию ; без этого ответа на инфекцию фагоциты не могут реагировать адекватно. В-третьих, некоторые виды бактерий могут подавлять способность фагоцитов перемещаться к месту инфекции, нарушая хемотаксис. [107] В-четвертых, некоторые бактерии могут избегать контакта с фагоцитами, обманывая иммунную систему, заставляя ее «думать», что бактерии — это «собственные». Treponema pallidum — бактерия, вызывающая сифилис, — прячется от фагоцитов, покрывая свою поверхность фибронектином , [109] который естественным образом вырабатывается организмом и играет решающую роль в заживлении ран . [110]
Бактерии часто производят капсулы из белков или сахаров, которые покрывают их клетки и препятствуют фагоцитозу. [107] Некоторыми примерами являются капсула K5 и антиген O75 O, обнаруженные на поверхности Escherichia coli , [111] и экзополисахаридные капсулы Staphylococcus epidermidis . [112] Streptococcus pneumoniae производит несколько типов капсул, которые обеспечивают разные уровни защиты, [113] и стрептококки группы А производят белки, такие как белок М и фимбриальные белки , чтобы блокировать поглощение. Некоторые белки препятствуют приему пищи, связанному с опсонином; Золотистый стафилококк вырабатывает белок А, блокирующий рецепторы антител, что снижает эффективность опсонинов. [114] Энтеропатогенные виды рода Yersinia связываются с помощью фактора вирулентности YopH с рецепторами фагоцитов, откуда влияют на способность клеток осуществлять фагоцитоз. [115]

Бактерии разработали способы выживания внутри фагоцитов, где они продолжают уклоняться от иммунной системы. [116] Чтобы безопасно проникнуть внутрь фагоцита, они экспрессируют белки, называемые инвазинами . Находясь внутри клетки, они остаются в цитоплазме и избегают токсичных химических веществ, содержащихся в фаголизосомах. [117] Некоторые бактерии предотвращают слияние фагосомы и лизосомы с образованием фаголизосомы. [107] Другие патогены, такие как Leishmania , создают сильно модифицированную вакуоль внутри фагоцита, которая помогает им персистировать и размножаться. [118] Некоторые бактерии способны жить внутри фаголизосомы. Например, золотистый стафилококк вырабатывает ферменты каталазу и супероксиддисмутазу , которые расщепляют химические вещества, такие как перекись водорода, вырабатываемые фагоцитами для уничтожения бактерий. [119] Бактерии могут покинуть фагосому до образования фаголизосомы: Listeria monocytogenes может проделать отверстие в стенке фагосомы с помощью ферментов, называемых листериолизин О и фосфолипаза С. [120] M.tuberculosis инфицирует нейтрофилы , которые, в свою очередь, поглощаются макрофагами и тем самым заражают и последние. [121] M. leprae инфицирует макрофаги , шванновские клетки и нейтрофилы . [121]
Бактерии разработали несколько способов уничтожения фагоцитов. [114] К ним относятся цитолизины , которые образуют поры в клеточных мембранах фагоцитов, стрептолизины и лейкоцидины , которые вызывают разрыв гранул нейтрофилов и выделение токсичных веществ, [122] [123] и экзотоксины , которые уменьшают поступление АТФ в фагоцит , необходимого для фагоцитоза. После проглатывания бактерия может убить фагоцит, высвобождая токсины, которые проходят через мембрану фагосомы или фаголизосомы и поражают другие части клетки. [107]
Некоторые стратегии выживания часто включают в себя разрушение цитокинов и других методов передачи сигналов клетками , чтобы предотвратить реакцию фагоцита на инвазию. [124] Простейшие паразиты Toxoplasma gondii , Trypanosoma cruzi и Leishmania заражают макрофаги, и каждый из них имеет уникальный способ их приручения. [124] Некоторые виды Leishmania изменяют передачу сигналов инфицированных макрофагов, подавляют выработку цитокинов и микробицидных молекул — оксида азота и активных форм кислорода — и нарушают презентацию антигена. [125]
Макрофаги и нейтрофилы, в частности, играют центральную роль в воспалительном процессе, высвобождая белки и низкомолекулярные медиаторы воспаления, которые контролируют инфекцию, но могут повредить ткани хозяина. В общем, фагоциты стремятся уничтожить патогены, поглощая их и подвергая воздействию ряда токсичных химикатов внутри фаголизосомы . Если фагоциту не удается поглотить свою цель, эти токсичные агенты могут быть выброшены в окружающую среду (действие, называемое «разочарованным фагоцитозом»). Поскольку эти агенты также токсичны для клеток-хозяев, они могут нанести серьезный ущерб здоровым клеткам и тканям. [126]
Когда нейтрофилы высвобождают содержимое своих гранул в почках , содержимое гранул (активные кислородные соединения и протеазы) разрушает внеклеточный матрикс клеток-хозяев и может вызвать повреждение клубочковых клеток, влияя на их способность фильтровать кровь и вызывая изменения формы. Кроме того, продукты фосфолипазы (например, лейкотриены ) усиливают повреждение. Это высвобождение веществ способствует хемотаксису большего количества нейтрофилов к месту инфекции, и клетки клубочков могут быть дополнительно повреждены молекулами адгезии во время миграции нейтрофилов. Повреждение клубочковых клеток может привести к почечной недостаточности . [127]
Нейтрофилы также играют ключевую роль в развитии большинства форм острого повреждения легких . [128] Здесь активированные нейтрофилы выделяют содержимое своих токсичных гранул в легочную среду. [129] Эксперименты показали, что снижение количества нейтрофилов уменьшает последствия острого повреждения легких, [130] но лечение путем ингибирования нейтрофилов клинически нереалистично, поскольку оно сделало бы хозяина уязвимым для инфекции. [129] В печени повреждение нейтрофилов может способствовать дисфункции и повреждению в ответ на выброс эндотоксинов , вырабатываемых бактериями, сепсис , травму, алкогольный гепатит , ишемию и гиповолемический шок в результате острого кровоизлияния . [131]
Химические вещества, выделяемые макрофагами, также могут повредить ткани хозяина. TNF-α — это важное химическое вещество, которое выделяется макрофагами и вызывает свертывание крови в мелких сосудах, предотвращая распространение инфекции. [132] Если бактериальная инфекция распространяется в кровь, TNF-α высвобождается в жизненно важные органы, что может вызвать расширение сосудов и уменьшение объема плазмы ; за этим, в свою очередь, может последовать септический шок . Во время септического шока выброс TNF-α вызывает закупорку мелких сосудов, снабжающих кровью жизненно важные органы, и органы могут выйти из строя. Септический шок может привести к смерти. [13]
_(52606801786).jpg/440px-Streptococcus_Pyogenes_(Group_A_Strep)_(52606801786).jpg)
Фагоцитоз является обычным явлением и, вероятно, появился на ранних стадиях эволюции , [133] сначала развиваясь у одноклеточных эукариот. [134] Амебы — это одноклеточные протисты , которые отделились от дерева и превратились в многоклеточных животных вскоре после дивергенции растений, и они разделяют многие специфические функции с фагоцитирующими клетками млекопитающих. [134] Dictyostelium discoideum , например, представляет собой амебу, которая живет в почве и питается бактериями. Подобно фагоцитам животных, он поглощает бактерии путем фагоцитоза преимущественно через Toll-подобные рецепторы и имеет другие биологические функции, общие с макрофагами. [135] Dictyostelium discoideum социален; при голодании он агрегирует, образуя мигрирующий псевдоплазмодий или слизняк . Этот многоклеточный организм в конечном итоге образует плодовое тело со спорами , устойчивыми к опасностям окружающей среды. До образования плодовых тел клетки в течение нескольких дней мигрируют как слизнеобразный организм. В течение этого времени воздействие токсинов или бактериальных патогенов может поставить под угрозу выживание вида из-за ограничения производства спор. Некоторые из амеб поглощают бактерии и токсины, циркулируя внутри слизняка, и в конечном итоге эти амебы умирают. Они генетически идентичны другим амебам слизняка; их самопожертвование для защиты других амеб от бактерий похоже на самопожертвование фагоцитов, наблюдаемое в иммунной системе высших позвоночных. Эта древняя иммунная функция социальных амеб предполагает эволюционно консервативный клеточный механизм поиска пищи, который мог быть адаптирован к защитным функциям задолго до диверсификации амеб в более высокие формы. [136] Фагоциты встречаются во всем животном мире, [3] от морских губок до насекомых, а также низших и высших позвоночных. [137] [138] Способность амеб различать свое и чужое является ключевой и лежит в основе иммунной системы многих видов амеб. [8]