Neisseria gonorrhoeae , также известная как гонококк (единственное число) или гонококки (множественное число), является видом грамотрицательных диплококковых бактерий, впервые выделенных Альбертом Нейссером в 1879 году. [3] Как облигатный патоген человека, она в первую очередь колонизирует слизистую оболочку урогенитального тракта; однако она также способна прикрепляться к слизистой оболочке носа, глотки, прямой кишки и конъюнктивы . [4] Она вызывает передающуюся половым путем урогенитальную инфекцию гонорею [5], а также другие формы гонококковых заболеваний, включая диссеминированную гонококкемию, септический артрит и гонококковую офтальмию новорожденных.
N. gonorrhoeae является оксидазоположительным и микроаэрофилом , способным выживать при фагоцитозе и расти внутри нейтрофилов . [5] Для его культивирования требуется добавление углекислого газа и обогащенный агар ( шоколадный агар ) с различными антибиотиками ( Тейер-Мартин ). Он проявляет антигенную изменчивость посредством генетической рекомбинации своих пилей и поверхностных белков, которые взаимодействуют с иммунной системой . [3]
Половой путь передачи — вагинальный, анальный или оральный секс. [6] Половой путь передачи можно предотвратить с помощью барьерной защиты. [7] Перинатальная передача может произойти во время родов, хотя ее можно предотвратить с помощью лечения матери антибиотиками до рождения и нанесения антибактериального глазного геля на глаза новорожденного. [7] Гонококковые инфекции не вызывают защитного иммунитета; поэтому люди могут быть инфицированы многократно. Повторное заражение возможно из-за способности N. gonorrhoeae уклоняться от иммунной системы, изменяя свои поверхностные белки. [8]
Бессимптомная инфекция распространена как среди мужчин, так и среди женщин. [7] [9] Нелеченая инфекция может распространиться на остальные части тела (диссеминированная гонорея), особенно на суставы (септический артрит). Нелеченая инфекция у женщин может вызвать воспалительные заболевания органов малого таза и возможное бесплодие из-за образующихся рубцов. [10] Гонорея диагностируется с помощью посевов , окрашивания по Граму или тестов на нуклеиновые кислоты (например, полимеразной цепной реакции ) образцов мочи, мазков из уретры или мазков из шейки матки. [11] [12] Рекомендуется совместное тестирование на хламидиоз и тестирование на другие ИППП из-за высоких показателей коинфекции. [13]
Устойчивость к антибиотикам у N. gonorrhoeae становится все более серьезной проблемой общественного здравоохранения, особенно учитывая его склонность к легкому развитию устойчивости. [14] Эта способность N. gonorrhoeae быстро адаптироваться к новым методам лечения антимикробными препаратами наблюдалась несколько раз с 1930-х годов, что сделало многочисленные планы лечения устаревшими. Некоторые штаммы продемонстрировали устойчивость к текущему лечению цефтриаксоном. [15]

Виды Neisseria — это прихотливые грамотрицательные кокки (хотя некоторые виды имеют палочковидную форму и встречаются парами или короткими цепочками), которым для роста в лабораторных культурах требуются питательные добавки. [17] Они являются факультативными внутриклеточными патогенами, то есть они способны сохраняться и колонизировать клетки хозяина, но также могут размножаться вне клеточной среды хозяина. [18] [19] [20] Обычно они появляются парами (диплококки), напоминая по форме кофейные зерна. [20] Представители этого рода не образуют эндоспор и считаются неподвижными, за исключением патогенных видов, которые способны двигаться с помощью подергивающейся моторики ; большинство из них также являются облигатными аэробами , за исключением патогенных видов. [21] [22] Из 17 видов, которые могут быть выделены от людей, только два являются патогенными: N. gonorrhoeae, вызывающий гонорею, и N. meningitidis , основная причина бактериального менингита . [23] [24]
В отличие от других видов Neisseria , которые также могут метаболизировать мальтозу, N. gonorrhoeae способен использовать только глюкозу, пируват и лактат в качестве основных источников углерода, при этом глюкоза катаболизируется как по пути Энтнера-Дудорова (ED), так и по пути пентозофосфата (PP), причем путь ED является основным окислительным методом. [18] [25] Использование этих путей необходимо, поскольку N. gonorrhoeae не способен катаболизировать глюкозу по пути Эмбдена-Мейерхофа-Парнаса (EMP) из-за отсутствия у него гена фосфофруктокиназы (PFK); однако фермент фруктозо-1,6-бисфосфатаза присутствует, что позволяет происходить глюконеогенезу . [18]
Глюкоза сначала метаболизируется через путь ED с образованием пирувата и глицеральдегид-3-фосфата, последний из которых затем может далее метаболизироваться ферментами пути EMP с образованием другой молекулы пирувата. [26] Полученные молекулы пирувата затем преобразуются в ацетил-КоА , который затем может быть включен в качестве субстрата для цикла лимонной кислоты (CAC) для получения высокоэнергетических переносчиков электронов, которые будут использоваться цепью переноса электронов (ETC) для производства АТФ; однако исследования отметили, что CAC в основном используется для генерации биосинтетических предшественников, а не для катаболических целей. [18] [27] Это частично связано с ингибированной экспрессией нескольких ферментов CAC в присутствии глюкозы, пируата или лактата. Эти ферменты, а именно цитратсинтаза , аконитаза и изоцитратдегидрогеназа , необходимы для включения ацетата. Вместо этого наблюдался частичный CAC, где α-кетоглутарат образуется глутаматдегидрогеназой или трансаминированием оксалоацетата и глутамата аспартатаминотрансферазой (давая аспартат и α-кетоглутарат). [25] [27] Затем CAC продолжает оттуда, чтобы произвести оксалоацетат, который является важной молекулой-предшественником для ряда биосинтетических путей. [27] Другим отличительным аспектом гонококкового CAC является отсутствие малатдегидрогеназы, которая вместо этого заменяется мембранно-связанной малат:хинон-оксидоредуктазой, которая действует независимо от НАД + , напрямую перенося электроны на убихинон. [18]
Наоборот, ацетил-КоА, который не попадает в CAC, попадает в путь фосфотрансацетилаза - ацетаткиназа (PTA-AckA), где он может быть преобразован в ацетат путем фосфорилирования (для образования ацетилфосфата и высвобождения кофермента А) и дефосфорилирования с образованием АТФ. [28] Хотя этот ацетат может поступать в CAC для дальнейшего окисления, исследования показали, что этого не происходит, пока присутствуют другие источники углерода, такие как глюкоза или лактат, в этом случае он выводится из клетки или включается в синтез липидов. [26] [29] Кроме того, у N. gonorrhoeae отсутствует глиоксилатный шунт , что не позволяет им использовать ацетат для образования промежуточных продуктов CAC для пополнения цикла. [26] [25]
Кроме того, исследования также показали, что значительная часть глицеральдегид-3-фосфата, образующегося в гонококках, перерабатывается через глюконеогенный путь для реформирования глюкозо-6-фосфата, а также промежуточного фруктозо-6-фосфата. Оба они затем могут быть использованы для синтеза пентозы в пути PP через окислительный и неокислительный пути, соответственно, для последующего образования нуклеотидов, а также для производства энергии. [25]
N. gonorrhoeae , как и другие патогенные представители рода Neisseria , считаются капнофилами , то есть им требуются более высокие, чем обычно, концентрации углекислого газа (CO 2 ) для эффективного роста, либо в форме CO 2 , либо бикарбоната (HCO 3 - ) в зависимости от штамма бактерий. Это требование должно быть выполнено экзогенно во время фаз задержки и стационарного роста, хотя, по-видимому, оно выполняется за счет высокого метаболического производства CO 2 в экспоненциальной фазе. Усвоение этого CO 2 у видов Neisseria осуществляется ферментами карбоангидразы и фосфоенолпирувата в периплазматическом пространстве и цитоплазме соответственно. [25]
Катаболизм лактата также имеет особое значение для гонококков, как для патогенности, так и для роста. [18] Внешний лактат транспортируется в клетку через лактатпермеазу (LctP). [18] Геном N. gonorrhoeae кодирует три фермента лактатдегидрогеназы (ЛДГ), которые обеспечивают метаболизм как L -лактата, так и D -лактата: цитоплазматическую НАД + -зависимую D -лактатдегидрогеназу (LdhA), которая отвечает за два связанных с мембраной ЛДГ, один из которых специфичен для L -лактата (LldD), а другой - для D -лактата (LdhD). [18] [30] Было установлено, что связанные с мембраной ЛДГ представляют собой флавопротеинсодержащие дыхательные ферменты, которые напрямую окисляют лактат для восстановления убихинона . Хотя эти ферменты не перекачивают протоны (ионы H + ) напрямую в периплазматическое пространство, предполагается, что восстановление убихинона этими ферментами способно поступать в более крупную цепь электронов. [30]
Как облигатный патоген человека и факультативный анаэробный капнофил, Neisseria gonorrhoeae обычно колонизирует слизистые поверхности в микроаэробных средах, таких как мочеполовой тракт. [18] Рост в областях, где концентрация кислорода ограничена, требует терминальной оксидазы с высоким сродством к кислороду; у гонококков восстановление кислорода осуществляется цитохромоксидазой типа ccb 3. В дополнение к аэробному дыханию гонококки также способны осуществлять анаэробное дыхание посредством восстановления нитрита (NO 2 ) до оксида азота (NO), а также восстановления NO до оксида азота (N 2 O). [18] [31]
Исследования выявили ряд ферментов, способных вносить электроны в интрамембранный пул убихинона, первый шаг в ETC. К ним относятся связанные с мембраной LDH (LldD и LdhD), NADH:убихинон оксидоредуктаза (она же NADH дегидрогеназа; комплекс Nuo I), Na + -транслоцирующая NADH дегидрогеназа (Nqr), сукцинатдегидрогеназа (SDH) и связанная с мембраной NAD + -независимая малат:хинон-оксидоредуктаза (MqR). [18]
После первоначального переноса электронов на убихинон, предлагаемые схемы организации гонококковой цепи переноса электронов предполагают, что электроны могут далее передаваться по цепи путем восстановления комплекса цитохрома bc 1 или могут быть напрямую переданы NO как конечному акцептору электронов NO-редуктазой (NorB). [18] [32] В первом случае электроны затем могут передаваться из комплекса bc 1 по двум альтернативным путям через восстановление либо цитохрома c 4 , либо c 5 . Оба этих цитохрома способны переносить электроны на конечную оксидазу цитохрома ccb 3 для восстановления O 2 с образованием H 2 O в аэробных условиях. [18] [31]
Гонококки также способны восстанавливать NO 2 с помощью индуцируемой наружной мембранной медьсодержащей нитритредуктазы (AniA, член семейства белков NirK) в анаэробных условиях, хотя этот процесс также был отмечен в микроаэробных условиях как средство дополнительного роста. [32] Это приводит к образованию NO, который впоследствии восстанавливается до N 2 O в частичном пути денитрификации. [18] [ 31] [32] Оксидаза ccb 3 N. gonorrhoeae , в отличие от других членов рода Neisseria , является трехгемовым белком, который, как было показано , способен переносить электроны не только на O 2 (сохраняется среди видов Neisseria ), но и на AniA для восстановления NO 2. Эта способность является дополнением к типичному процессу получения электронов, переданных от цитохрома c 5 . [32] [33]
Общей целью ETC является формирование электрохимического градиента ионов водорода (H + или протонов), возникающих в результате разницы концентраций на плазматической мембране, необходимого для обеспечения производства АТФ в процессе, известном как окислительное фосфорилирование . [34] У гонококков перемещение протонов в периплазматическое пространство осуществляется комплексом Nuo I, комплексом цитохрома bc 1 и цитохромом ccb 3. [18] [ 32] [35] Впоследствии синтез АТФ осуществляется F 1 F 0 АТФ-синтазой , двухкомпонентным белковым комплексом, присутствующим у гонококков, а также у многочисленных других видов в филогенетических доменах. [36] Этот комплекс связывает транслокацию протонов обратно в цитоплазму вдоль своего градиента с механическим вращением для генерации АТФ. [37]
Как один из ключевых компонентов многих биологических ферментов и металлопротеинов , железо является одним из самых необходимых переходных металлов как для жизни человека, так и для бактериальных патогенов. [38] Во время инфекции гонококки должны получать свое железо от хозяина; однако у человеческих хозяев есть несколько механизмов для предотвращения этого получения. Одним из основных механизмов этого является секвестрация в железосвязывающих металлопротеинах. Это происходит внутриклеточно, через ферритин и гем , а также внеклеточно, через трансферрин , лактоферрин и гемоглобин . [38] [39]
Чтобы получить необходимое железо, гонококки производят TonB-зависимые транспортеры (TDTs) на поверхности своей внешней мембраны, которые способны напрямую извлекать железо вместе с другими металлами из соответствующих им белков-носителей. Некоторые из них включают трансферрин-связывающие белки A (TbpA) и B (TbpB), лактоферрин-связывающие белки A (LbpA) и B (LbpB), а также гемоглобин/гемоглобин-гаптоглобин-связывающие белки HpuB и HpuA. [18] [38] В дополнение к этим белкам гонококки также способны использовать сидерофоры , или соединения, способные хелатировать железо в окружающей среде, которые производятся другими бактериями; однако гонококковые клетки не способны синтезировать сидерофоры сами. Эти ксеносидерофоры поглощаются TDT FetA через внешнюю мембрану, а затем переносятся в клетку транспортной системой fetBCDEF . [18] [38]
Наряду с защитой от секвестрации, которая может быть дополнительно усилена воспалением хозяина, люди также вырабатывают сидерокалины , которые способны хелатировать сидерофоры в качестве дополнительного метода ингибирования роста патогенных бактерий. Эти методы иногда неэффективны против N. gonorrhoeae , которая способна колонизировать внутриклеточно, особенно в фагоцитарных клетках, таких как макрофаги и нейтрофилы. Увеличение внутриклеточного железа хозяина также подавляет некоторые внутриклеточные механизмы уничтожения патогенов; по совпадению, патогенные Neisseria способны изменять несколько механизмов клетки хозяина, что в конечном итоге позволяет патогену забирать большую часть доступного железа из иммунной клетки хозяина. [38]
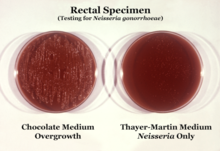
N. gonorrhoeae обычно изолируют на агаре Тайера-Мартина (или VPN) в атмосфере, обогащенной 3-7% углекислого газа. [11] Агар Тайера-Мартина представляет собой шоколадную агаровую пластину (нагретый кровяной агар), содержащую питательные вещества и противомикробные препараты ( ванкомицин , колистин , нистатин и триметоприм ). Этот препарат агара способствует росту видов Neisseria , одновременно подавляя рост загрязняющих бактерий и грибков. Агар Мартина-Льюиса и Нью-Йорк-Сити — другие типы селективного шоколадного агара, обычно используемые для роста Neisseria . [11] N. gonorrhoeae является оксидазоположительным (обладает цитохром с оксидазой) и каталазоположительным (способен преобразовывать перекись водорода в кислород). [11] При инкубации с углеводами лактозой, мальтозой , сахарозой и глюкозой N. gonorrhoeae окисляет только глюкозу. [11]
На своей поверхности N. gonorrhoeae несет волосовидные пили , поверхностные белки с различными функциями и сахара, называемые липоолигосахаридами . Пили опосредуют адгезию, движение и обмен ДНК. Белки, ассоциированные с непрозрачностью (Opa), взаимодействуют с иммунной системой, как и порины . Липоолигосахарид — это эндотоксин , который вызывает иммунный ответ. Все они являются антигенными и демонстрируют антигенную изменчивость . Пили, белки Opa, порины и даже липоолигосахарид обладают механизмами ингибирования иммунного ответа, что делает возможным бессимптомное инфицирование. [40]
Белки адгезина, ассоциированные с фазово-переменной непрозрачностью (Opa), используются N. gonorrhoeae как часть уклонения от иммунного ответа в клетке-хозяине. Известно не менее 12 белков Opa, а многочисленные вариации поверхностных белков затрудняют распознавание N. gonorrhoeae и создание защиты иммунными клетками. [41] Белки Opa расположены во внешней мембране и способствуют ответу, когда бактерии взаимодействуют с различными клетками-хозяевами. Эти белки связываются с различными эпителиальными клетками и позволяют N. gonorrhoeae увеличивать продолжительность инфекции, а также увеличивать объем вторжения в другие клетки-хозяева. [42]

Динамические полимерные белковые нити, называемые пилями типа IV, позволяют N. gonorrhoeae выполнять множество бактериальных процессов, включая адгезию к поверхностям, способность к трансформации, подергивание подвижности и уклонение от иммунного ответа. [18] Чтобы проникнуть в хозяина, бактерия использует пили для прикрепления к слизистым поверхностям и проникновения в них. Пили являются ключевым фактором вирулентности для N. gonorrhoeae ; без них бактерия не способна вызвать инфекцию. Для подвижности отдельные бактерии используют свои пили таким образом, который напоминает крюк для захвата: сначала они вытягиваются с поверхности клетки и прикрепляются к субстрату . Последующее втягивание пилей тянет клетку вперед. Результирующее движение называется подергиванием подвижности. N. gonorrhoeae способна тянуть в 100 000 раз больше собственного веса, и пили, используемые для этого, являются одними из самых мощных биологических двигателей, известных на сегодняшний день, прилагая один наноньютон . Белки АТФазы PilF и PilT отвечают за обеспечение расширения и ретракции пилей типа IV соответственно. Адгезивные функции гонококковых пилей играют роль в агрегации микроколоний и образовании биопленки . Эти пили также используются для избежания иммунных реакций со стороны клетки, в которую они вторгаются, за счет антигенной вариации их пилей типа IV. Основная нить пилей очень часто заменяется вариабельными последовательностями ДНК. [18] Быстро выполняя этот процесс, они способны создавать на своей поверхности разнообразные пили и уклоняться от иммунного ответа клетки-хозяина.
Липоолигосахарид — это низкомолекулярная версия липополисахарида, присутствующая на поверхности большинства других грамотрицательных бактерий. Это боковая цепь сахара (сахарида), прикрепленная к липиду А (следовательно, «липо-») во внешней мембране, покрывающей клеточную стенку бактерий. Корень «олиго» относится к тому факту, что он на несколько сахаров короче типичного липополисахарида. [5] Как эндотоксин, он провоцирует воспаление. Выделение липоолигосахарида бактериями иногда является причиной проблем, связанных с воспалительными заболеваниями органов малого таза. [5] Хотя он функционирует в первую очередь как эндотоксин, липоолигосахарид может маскироваться под сиаловую кислоту хозяина и блокировать инициацию каскада комплемента . [5]
N. gonorrhoeae ускользает от иммунной системы с помощью процесса, называемого антигенной изменчивостью . [43] Этот процесс позволяет N. gonorrhoeae рекомбинировать свои гены и изменять антигенные детерминанты , которые украшают его поверхность, [5], такие как пили типа IV. [44] Проще говоря, химический состав молекул изменяется из-за изменений на генетическом уровне. [8] N. gonorrhoeae способен изменять состав своих пилей и липоолигосахаридов. Из них пили демонстрируют наибольшую антигенную изменчивость из-за хромосомной перестройки. [10] [5] Ген pilS является примером этой способности к перестройке, поскольку его сочетание с геном pilE, как оценивается, производит более 100 вариантов белка PilE. [8] Эти изменения позволяют приспосабливаться к локальным различиям окружающей среды в месте заражения, уклоняться от распознавания целевыми антителами и подавлять формирование эффективной вакцины. [8]
В дополнение к перестройке генов, он также обладает естественной компетентностью , то есть может приобретать внеклеточную ДНК из окружающей среды через свои пили типа IV, в частности белки PilQ и PilT. [45] Эти процессы позволяют N. gonorrhoeae приобретать и распространять новые гены, маскироваться с помощью различных поверхностных белков и предотвращать развитие иммунологической памяти — способности, которая способствовала устойчивости к антибиотикам и препятствовала разработке вакцин. [46]
Фазовая вариация похожа на антигенную вариацию, но вместо изменений на генетическом уровне, изменяющих состав молекул, эти генетические изменения приводят к активации или деактивации гена. [8] Фазовая вариация чаще всего возникает из-за сдвига рамки считывания в экспрессируемом гене. [8] Белки Opa N. gonorrhoeae строго зависят от фазовой вариации. [8] Каждый раз, когда бактерии реплицируются, они могут включать или выключать несколько белков Opa посредством неправильного спаривания со смещенной цепью . То есть, бактерии вносят мутации сдвига рамки считывания, которые вводят гены в рамку или выводят их из нее. В результате каждый раз транслируются разные гены Opa. [5] Пили различаются антигенной вариацией, но также и фазовой вариацией. [8] Сдвиги рамки происходят как в генах pilE , так и в генах pilC , эффективно отключая экспрессию пилей в ситуациях, когда они не нужны, например, во время внутриклеточной колонизации в отличие от адгезии к поверхности внеклеточных слизистых клеток. [8]
После того, как гонококки проникают в эпителиальные клетки хозяина и трансцитируют их, они попадают в подслизистую оболочку, где нейтрофилы быстро их поглощают. [5] Пили и белки Opa на поверхности могут мешать фагоцитозу, [10] но большинство гонококков оказываются в нейтрофилах. Экссудаты инфицированных людей содержат много нейтрофилов с проглоченными гонококками. Нейтрофилы выделяют окислительный выброс активных форм кислорода в своих фагосомах, чтобы убить гонококки. [47] Однако значительная часть гонококков может противостоять убийству благодаря действию своей каталазы [5], которая расщепляет активные формы кислорода и способна размножаться внутри нейтрофильных фагосом. [48]
Stohl и Seifert показали, что бактериальный белок RecA, который опосредует восстановление повреждений ДНК, играет важную роль в выживании гонококков. [49] Michod et al. предположили, что N. gonorrhoeae может заменять ДНК, поврежденную в нейтрофильных фагосомах, ДНК соседних гонококков. [50] Процесс, в котором реципиентные гонококки интегрируют ДНК соседних гонококков в свой геном, называется трансформацией. [51]
Геномы нескольких штаммов N. gonorrhoeae были секвенированы. Большинство из них имеют размер около 2,1 Мб и кодируют от 2100 до 2600 белков (хотя большинство, по-видимому, находятся в нижнем диапазоне). [ 52] Например, штамм NCCP11945 состоит из одной кольцевой хромосомы (2 232 025 п.н.), кодирующей 2 662 предсказанных открытых рамок считывания (ORF), и одной плазмиды (4 153 п.н.), кодирующей 12 предсказанных ORF. Расчетная плотность кодирования по всему геному составляет 87%, а среднее содержание G+C составляет 52,4%, значения, которые аналогичны значениям штамма FA1090. Геном NCCP11945 кодирует 54 тРНК и четыре копии оперонов 16S-23S-5S рРНК. [53]
Горизонтальный перенос генов , также называемый латеральным переносом генов, представляет собой обмен генетической информацией между живыми организмами. [54] Эта передача информации является движущей силой устойчивости к антибиотикам у N. gonorrhoeae . [55] [56] Исследования показали, что N. gonorrhoeae приобрела методы устойчивости к противомикробным препаратам посредством горизонтального переноса генов от других видов Neisseria, включая N. lactamica , N. macacae и N. mucosa. [57]
N. gonorrhoeae является естественно компетентным, что означает, что он имеет возможность приобретать ДНК из окружающей среды посредством трансформации и включать последовательности в свой собственный геном. [56] Трансформация у N. gonorrhoeae осуществляется пилями типа IV, где ДНК связывается и переносится в клетку, после чего следует процессинг и гомологичная рекомбинация. [58]
Найденный в некоторых геномах Neisseria gonorrhoeae , гонококковый генетический остров (GGI), геномный остров (GI), специфичный для гонококков, был идентифицирован как мобильный генетический элемент, который приобретается горизонтально. [59] [60] GGI участвует в устойчивости к противомикробным препаратам, передаче генетической информации и приобретении железа. [59] Гены в гонококковом генетическом острове кодируют печально известную систему секреции типа IV (T4SS), которая отвечает за секрецию ДНК и необходима для образования биопленки. [59] [61]
В 2011 году исследователи из Северо-Западного университета обнаружили доказательства наличия фрагмента человеческой ДНК в геноме N. gonorrhoeae , что стало первым примером горизонтального переноса генов от человека к бактериальному патогену. [62] [63]
Симптомы заражения N. gonorrhoeae различаются в зависимости от места заражения, и многие инфекции протекают бессимптомно независимо от пола. [64] [40] [6] В зависимости от пути передачи N. gonorrhoeae может вызывать инфекцию горла ( фарингит ) или инфекцию заднего прохода/прямой кишки ( проктит ). [65] [10]
Диссеминированные гонококковые инфекции могут возникнуть, когда N. gonorrhoeae попадает в кровоток, часто распространяясь на суставы и вызывая сыпь (синдром дерматита-артрита). [65] Синдром дерматита-артрита приводит к болям в суставах ( артрит ), воспалению сухожилий ( теносиновит ) и безболезненному незудящему (не зудящему) дерматиту . [10] Диссеминированная инфекция и воспалительные заболевания органов малого таза у женщин, как правило, начинаются после менструации из-за рефлюкса во время менструации, что облегчает распространение. [65] В редких случаях диссеминированная инфекция может вызвать инфекцию оболочек головного и спинного мозга ( менингит ) или инфекцию клапанов сердца ( эндокардит ). [65] [66]
У мужчин с симптомами основным симптомом инфекции мочеполовой системы является уретрит — жжение при мочеиспускании ( дизурия ), учащенные позывы к мочеиспусканию и гнойные выделения из полового члена. Выделения могут иметь неприятный запах. [65] При отсутствии лечения рубцевание уретры может привести к затруднению мочеиспускания. Инфекция может распространиться из уретры в половой член на близлежащие структуры, включая яички ( эпидидимит / орхит ) или на простату ( простатит ). [65] [10] [67] У мужчин, перенесших гонорею , значительно повышен риск развития рака простаты. [68]
.jpg/440px-Neisseria_gonorrhoeae_and_pus_cells_in_a_vaginal_swab_(Gram_stain).jpg)
У женщин с симптомами основными симптомами инфекции мочеполовой системы являются повышенные выделения из влагалища, жжение при мочеиспускании ( дизурия ), повышенные позывы к мочеиспусканию, боль при половом акте или нарушения менструального цикла. Воспалительное заболевание органов малого таза возникает, если N. gonorrhoeae поднимается в тазовую брюшину (через шейку матки , эндометрий и маточные трубы ). Возникающее в результате воспаление и рубцевание маточных труб может привести к бесплодию и повышенному риску внематочной беременности. [65] Воспалительное заболевание органов малого таза развивается у 10–20 % женщин, инфицированных N. gonorrhoeae . [65]
При перинатальной инфекции первичным проявлением является инфекция глаза (неонатальный конъюнктивит или ophthalmia neonatorum ), когда новорожденный подвергается воздействию N. gonorrhoeae в родовых путях. Инфекция глаза может привести к рубцеванию или перфорации роговицы, что в конечном итоге приводит к слепоте. Если новорожденный подвергается воздействию во время родов, конъюнктивит возникает в течение 2–5 дней после рождения и является тяжелым. [65] [66] Гонококковая ophthalmia neonatorum, когда-то распространенная у новорожденных, предотвращается нанесением эритромицинового (антибиотического) геля на глаза младенцев при рождении в качестве меры общественного здравоохранения. Нитрат серебра больше не используется в Соединенных Штатах. [66] [65]
N. gonorrhoeae чаще всего передается через вагинальный, оральный или анальный секс; неполовая передача маловероятна при инфицировании взрослых. [6] Он также может передаваться новорожденному во время прохождения через родовые пути, если у матери есть нелеченная инфекция мочеполовой системы. Учитывая высокий уровень бессимптомной инфекции, рекомендуется, чтобы беременные женщины проходили тестирование на гонококковую инфекцию до рождения. [6] Общие ванны, общие полотенца или ткани, ректальные термометры и ненадлежащая гигиена рук лицами, осуществляющими уход, были определены как потенциальные средства передачи в педиатрических условиях. [69] Недавно было установлено, что поцелуи являются способом передачи гонореи через ротоглотку, особенно среди гомосексуальной мужской популяции. [70] [71]
Традиционно считалось, что бактерия перемещается, прикрепляясь к сперматозоидам, но эта гипотеза не объясняла передачу заболевания от женщины к мужчине. Недавнее исследование предполагает, что вместо того, чтобы «плыть» по шевелящейся сперме , бактерии N. gonorrhoeae используют пили для закрепления на белках в сперме и перемещения через коитальную жидкость. [72]
Успешная передача сопровождается прилипанием к эпителиальным клеткам , обнаруженным на инфицированном участке слизистой оболочки, пилями типа IV бактерии . Способность пилей прикрепляться и впоследствии втягиваться тянет N. gonorrhoeae к эпителиальной мембране на поверхности клетки слизистой оболочки. [14] После прикрепления N. gonorrhoeae реплицирует свой геном и делится, образуя микроколонии . [14] Гонококковой инфекции иногда способствует мембранный кофакторный белок CD46, поскольку он, как известно, действует как рецептор для гонококковых пилей. [40] Кроме того, было показано, что взаимодействие с пилями вызывает перестройку цитоскелета клетки-хозяина, что дополнительно демонстрирует, что вовлечение гонококковых пилей нарушает реакцию клетки-хозяина и увеличивает вероятность успешного инфицирования. [40] Во время роста и колонизации N. gonorrhoeae стимулирует высвобождение провоспалительных цитокинов и хемокинов из иммунных клеток хозяина, что приводит к привлечению нейтрофилов в эту область. [8] Эти фагоцитарные клетки обычно поглощают чужеродные патогены и уничтожают их, однако способность N. gonorrhoeae манипулировать реакцией клеток хозяина позволяет патогену выживать внутри этих иммунных клеток и избегать элиминации. [8]
Основными методами обнаружения Neisseria gonorrhoeae являются тесты амплификации нуклеиновых кислот , которые являются наиболее чувствительными из имеющихся методов. [73] [74] Другие методы обнаружения включают микроскопию и культивирование. [73]
Передача снижается при использовании латексных барьеров (например, презервативов или зубных прокладок ) во время секса и при ограничении числа сексуальных партнеров. [7] Презервативы и зубные прокладки следует использовать также во время орального и анального секса. Спермициды, вагинальные пены и спринцевания не являются эффективными методами профилактики передачи. [5]
Вакцина против N. gonorrhoeae необходима из-за растущей заболеваемости, повышения устойчивости к противомикробным препаратам и ее влияния на репродуктивное здоровье. [ требуется ссылка ] Существуют проблемы, которые препятствуют разработке вакцины, в том числе: отсутствие иммунитета после заражения, исключительно человеческие хозяева, а также антигенная и фазовая изменчивость потенциальных мишеней вакцины. [75] В настоящее время разрабатывается несколько вакцин против N. gonorrhoeae , включая вакцину на основе везикул внешней мембраны. [75] К ним относятся вакцины-кандидаты NGoXIM, нативная OMV и Bexsero/4CMenB, которые все находятся на поздних клинических стадиях разработки. [76] Создание вакцины против N. gonorrhoeae имеет несколько потенциальных последствий для общественного здравоохранения. По одной из оценок, вакцина для гетеросексуального населения, вводимая до начала половой жизни, показала, что распространенность N. gonorrhoeae может быть снижена на 90% через 20 лет. [75]
Текущее лечение, рекомендованное CDC, представляет собой однократную инъекцию цефтриаксона ( цефалоспорин третьего поколения ). [77] Половые партнеры (определяемые CDC как половой контакт в течение последних 60 дней) [12] также должны быть уведомлены, проверены и пролечены. [7] [77] Если симптомы сохраняются после лечения инфекции N. gonorrhoeae , следует провести повторную оценку. [77]
Устойчивость к антибиотикам при гонорее была впервые выявлена в 1940-х годах. Гонорею лечили пенициллином, но дозы приходилось постепенно увеличивать, чтобы они оставались эффективными. К 1970-м годам гонорея, устойчивая к пенициллину и тетрациклину, появилась в Тихоокеанском бассейне. Затем эти устойчивые штаммы распространились на Гавайи, в Калифорнию, остальную часть Соединенных Штатов, Австралию и Европу. Фторхинолоны были следующей линией обороны, но вскоре появилась и устойчивость к этому антибиотику. С 2007 года стандартным лечением стали цефалоспорины третьего поколения, такие как цефтриаксон, которые считаются нашей «последней линией обороны». [78] [79] Недавно в Японии был обнаружен штамм гонореи с высокой устойчивостью к цефтриаксону под названием H041. Лабораторные тесты показали, что он устойчив к высоким концентрациям цефтриаксона, а также к большинству других протестированных антибиотиков. В N. gonorrhoeae существуют гены, которые обеспечивают устойчивость к каждому антибиотику, используемому для лечения гонореи, но до сих пор они не сосуществуют в пределах одного гонококка. Однако из-за высокой способности N. gonorrhoeae к горизонтальному переносу генов, гонорея, устойчивая к антибиотикам, рассматривается как новая угроза общественному здравоохранению. [79]
До 2007 года фторхинолоны были распространенной рекомендацией по лечению гонореи. CDC прекратили предлагать эти системные бактериальные агенты, как только в Соединенных Штатах появился резистентный штамм N. gonorrhoeae . Удаление фторхинолонов как потенциального лечения оставило цефалоспорины как единственный жизнеспособный антимикробный вариант лечения гонореи. Опасаясь дальнейшей гонококковой резистентности, рекомендации CDC в 2010 году изменились на стратегию двойной терапии — цефалоспорин с азитромицином или доксициклином . Несмотря на эти усилия, к 2011 году резистентные N. gonorrhoeae были зарегистрированы на пяти континентах, что еще больше ограничило варианты лечения и рекомендации. Устойчивость к противомикробным препаратам не является универсальной, и штаммы N. gonorrhoeae в Соединенных Штатах продолжают реагировать на комбинированный режим цефтриаксона и азитромицина. [80]
Как грамотрицательная бактерия, N. gonorrhoeae требует защитных механизмов для защиты себя от системы комплемента (или каскада комплемента), компоненты которой обнаружены в сыворотке человека . [40] Существует три различных пути, которые активируют эту систему, однако все они приводят к активации белка комплемента 3 (C3). [81] Расщепленная часть этого белка, C3b , откладывается на патогенных поверхностях и приводит к опсонизации , а также к последующей активации комплекса мембранной атаки . [81] N. gonorrhoeae имеет несколько механизмов, чтобы избежать этого действия. [14] В целом эти механизмы называются сывороточной резистентностью. [14]
Neisseria gonorrhoeae названа в честь Альберта Нейссера, который выделил ее как возбудителя гонореи в 1878 году. [14] [3] Гален (130 г. н. э.) ввел термин «гонорея» от греческого gonos , что означает «семя» и rhoe , что означает «поток». [82] [8] Таким образом, гонорея означает «поток семени», описание, относящееся к белым выделениям из полового члена, предположительно, семенной жидкости, наблюдаемым при мужском заражении. [14]
В 1878 году Альберт Нейссер выделил и визуализировал диплококки N. gonorrhoeae в образцах гноя от 35 мужчин и женщин с классическими симптомами мочеполовой инфекции гонореей — двое из которых также имели инфекции глаз. [8] В 1882 году Лейстиков и Леффлер смогли вырастить организм в культуре. [14] Затем в 1883 году Макс Бокхарт окончательно доказал, что бактерия, выделенная Альбертом Нейссером, была возбудителем заболевания, известного как гонорея, путем инокуляции полового члена здорового мужчины бактериями. [8] У мужчины развились классические симптомы гонореи через несколько дней, что удовлетворило последний из постулатов Коха . До этого момента исследователи спорили, являются ли сифилис и гонорея проявлениями одного и того же заболевания или двумя разными сущностями. [83] [8] Один из таких исследователей 18-го века, Джон Хантер, попытался урегулировать спор в 1767 году [8] , привив мужчине гной, взятый у пациента с гонореей. Он ошибочно заключил, что сифилис и гонорея действительно были одним и тем же заболеванием, когда у мужчины появилась сыпь медного цвета, которая является классической для сифилиса. [81] [83] Хотя многие источники повторяют, что Хантер привил себя сам, [81] [14] другие утверждали, что на самом деле это был другой мужчина. [84] После эксперимента Хантера другие ученые пытались опровергнуть его выводы, прививая других мужчин-врачей, студентов-медиков [14] и заключенных мужчин гонорейным гноем, у всех из которых развилось жжение и выделение гонореи. Один исследователь, Рикорд, взял на себя инициативу провести 667 прививок гонорейного гноя пациентам психиатрической больницы, при этом не было ни одного случая сифилиса. [8] [14] Примечательно, что появление пенициллина в 1940-х годах сделало доступным эффективное лечение гонореи. [ необходима цитата ]
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на ноябрь 2024 г. ( ссылка )