

Фаза G 2 , фаза Gap 2 или фаза Growth 2 — это третья подфаза интерфазы в клеточном цикле, непосредственно предшествующая митозу . Она следует за успешным завершением фазы S , во время которой реплицируется ДНК клетки . Фаза G 2 заканчивается наступлением профазы — первой фазы митоза, в которой хроматин клетки конденсируется в хромосомы .
Фаза G 2 — это период быстрого роста клеток и синтеза белка , во время которого клетка готовится к митозу. Любопытно, что фаза G 2 не является необходимой частью клеточного цикла, так как некоторые типы клеток (особенно молодые эмбрионы Xenopus [1] и некоторые виды рака [2] ) переходят непосредственно от репликации ДНК к митозу. Хотя многое известно о генетической сети , которая регулирует фазу G2 и последующий вход в митоз, еще многое предстоит узнать относительно ее значения и регуляции, особенно в отношении рака. Одна из гипотез заключается в том, что рост в фазе G 2 регулируется как метод контроля размера клетки. Ранее было показано, что делящиеся дрожжи ( Schizosaccharomyces pombe ) используют такой механизм посредством опосредованной Cdr2 пространственной регуляции активности Wee1 . [3] Хотя Wee1 является довольно консервативным отрицательным регулятором входа в митоз, общий механизм контроля размера клетки в G2 пока не выяснен.
Биохимически конец фазы G 2 происходит, когда достигается пороговый уровень активного комплекса циклин B1 / CDK1 , также известного как фактор, способствующий созреванию (MPF). [4] Активность этого комплекса строго регулируется во время G 2 . В частности, контрольная точка G 2 останавливает клетки в G 2 в ответ на повреждение ДНК посредством ингибирующей регуляции CDK1.
Во время митотической фазы S репликация ДНК производит две почти идентичные сестринские хроматиды . Двунитевые разрывы ДНК, возникающие после того, как репликация прогрессировала или во время фазы G2, могут быть восстановлены до того, как произойдет деление клетки (М-фаза клеточного цикла ). Таким образом, во время фазы G2 двунитевые разрывы в одной сестринской хроматиде могут быть восстановлены путем гомологичной рекомбинационной репарации с использованием другой неповрежденной сестринской хроматиды в качестве матрицы. [5]
Вход в митотический процесс определяется пороговым уровнем активного комплекса циклин-B1/CDK1, также известного как циклин-B1/Cdc2 или фактор, способствующий созреванию (MPF). Активный циклин-B1/CDK1 запускает необратимые действия в раннем митозе, включая разделение центросом , разрушение ядерной оболочки и сборку веретена . У позвоночных существует пять изоформ циклина B ( B1 , B2 , B3, B4 и B5), но конкретная роль каждой из этих изоформ в регуляции входа в митотический процесс до сих пор неясна. Известно, что циклин B1 может компенсировать потерю обоих циклинов B2 (и наоборот у Drosophila ). [6] Saccharomyces cerevisiae содержит шесть циклинов B-типа (Clb1-6), причем Clb2 является наиболее важным для функционирования. Предполагается, что как у позвоночных, так и у S. cerevisiae наличие нескольких циклинов B-типа позволяет разным циклинам регулировать разные части перехода G2/M, а также делает переход устойчивым к возмущениям. [7]
Последующие обсуждения будут сосредоточены на пространственной и временной активации циклина B1/CDK в клетках млекопитающих, но схожие пути применимы как у других метазоа, так и у S. cerevisiae.
Уровни циклина B1 подавляются в течение фаз G1 и S комплексом, стимулирующим анафазу (APC), E3 убиквитинлигазой, которая нацеливает циклин B1 на протеолиз. Транскрипция начинается в конце фазы S после репликации ДНК в ответ на фосфорилирование факторов транскрипции, таких как NF-Y , FoxM1 и B-Myb, комплексами циклина-CDK вышестоящих G1 и G1/S. [8]
Повышенные уровни циклина B1 вызывают повышение уровней комплексов циклин B1-CDK1 на протяжении G2, но комплекс остается неактивным до перехода G2/M из-за ингибирующего фосфорилирования киназами Wee1 и Myt1. Wee1 локализуется в основном в ядре и действует на сайте Tyr15, тогда как Myt1 локализуется на внешней поверхности ЭР и действует преимущественно на сайте Thr14.
Эффекты Wee1 и Myt1 нейтрализуются фосфатазами семейства cdc25, которые удаляют ингибирующие фосфаты с CDK1 и таким образом преобразуют комплекс циклин B1-CDK1 в его полностью активированную форму, MPF.

Активный циклинB1-CDK1 фосфорилирует и модулирует активность Wee1 и изоформ Cdc25 A и C. В частности, фосфорилирование CDK1 ингибирует активность киназы Wee1, активирует активность фосфатазы Cdc25C посредством активации промежуточной киназы PLK1 и стабилизирует Cdc25A. Таким образом, CDK1 образует положительную обратную связь с Cdc25 и двойную отрицательную обратную связь с Wee1 (по сути, чистую положительную обратную связь).
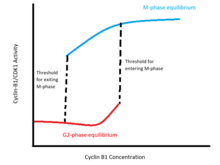
Эти положительные обратные связи кодируют гистерезисное бистабильное переключение активности CDK1 относительно уровней циклина B1 (см. рисунок). Это переключение характеризуется двумя различными стабильными равновесиями в бистабильной области концентраций циклина B1. Одно равновесие соответствует интерфазе и характеризуется неактивностью циклина-B1/CDK1 и Cdc25, а также высоким уровнем активности Wee1 и Myt1. Другое равновесие соответствует М-фазе и характеризуется высокой активностью циклина-B1/CDK1 и Cdc25, а также низкой активностью Wee1 и Myt1. В пределах диапазона бистабильности состояние клетки зависит от того, находилась ли она ранее в интерфазе или М-фазе: пороговая концентрация для входа в М-фазу выше минимальной концентрации, которая будет поддерживать активность М-фазы после того, как клетка уже вышла из интерфазы.
Ученые теоретически и эмпирически подтвердили бистабильную природу перехода G2/M. Модель Новака-Тайсона показывает, что дифференциальные уравнения, моделирующие петлю обратной связи циклин-B/CDK1-cdc25-Wee1-Myt1, допускают два стабильных равновесия в диапазоне концентраций циклина-B. [9] Экспериментально бистабильность была подтверждена путем блокирования синтеза эндогенного циклина B1 и титрования интерфазных и М-фазных клеток с различными концентрациями неразлагаемого циклина B1. Эти эксперименты показывают, что пороговая концентрация для входа в М-фазу выше, чем порог для выхода из М-фазы: разрушение ядерной оболочки происходит между 32-40 нм циклина-B1 для клеток, выходящих из интерфазы, в то время как ядро остается дезинтегрированным при концентрациях выше 16-24 нм в клетках, уже находящихся в М-фазе. [10]
Этот бистабильный, гистерезисный переключатель физиологически необходим по крайней мере по трем причинам. [11] Во-первых, переход G2/M сигнализирует об инициации нескольких событий, таких как конденсация хромосом и разрушение ядерной оболочки, которые заметно изменяют морфологию клетки и жизнеспособны только в делящихся клетках. Поэтому важно, чтобы активация циклина-B1/CDK1 происходила подобно переключателю; то есть клетки должны быстро переходить в дискретное состояние M-фазы после перехода и не должны сохраняться в континууме промежуточных состояний (например, с частично разложившейся ядерной оболочкой). Это требование выполняется за счет резкого разрыва, разделяющего уровни интерфазного и M-фазного равновесия активности CDK1; по мере того, как концентрация циклина-B превышает порог активации, клетка быстро переключается в равновесие M-фазы.
Во-вторых, также важно, чтобы переход G2/M происходил однонаправленно или только один раз за клеточный цикл. Биологические системы по своей природе шумные , и небольшие колебания концентраций циклина B1 вблизи порога перехода G2/M не должны вызывать переключение клетки туда и обратно между состояниями интерфазы и M-фазы. Это обеспечивается бистабильной природой переключения: после перехода клетки в состояние M-фазы небольшие снижения концентрации циклина B не заставляют клетку переключаться обратно в интерфазу.
Наконец, продолжение клеточного цикла требует сохраняющихся колебаний активности циклина-B/CDK1, когда клетка и ее потомки переходят в М-фазу и из нее. Отрицательная обратная связь обеспечивает один существенный элемент этого долгосрочного колебания: циклин-B/CDK активирует APC/C, что вызывает деградацию циклина-B, начиная с метафазы, восстанавливая CDK1 до его неактивного состояния. Однако простые петли отрицательной обратной связи приводят к затухающим колебаниям , которые в конечном итоге устанавливаются в устойчивом состоянии. Кинетические модели показывают, что петли отрицательной обратной связи в сочетании с бистабильными мотивами положительной обратной связи могут приводить к постоянным, незатухающим колебаниям (см. релаксационный осциллятор ) того типа, который требуется для долгосрочного клеточного цикла.
Положительная обратная связь, упомянутая выше, в которой циклин-B1/CDK1 способствует своей собственной активации путем ингибирования Wee1 и Myst1 и активации cdc25, по своей сути не включает в себя «триггерный» механизм для инициирования обратной связи. Недавно появились доказательства, предполагающие более важную роль комплексов циклин A2 /CDK в регуляции инициирования этого переключения. Активность циклин A2/ CDK2 начинается в ранней фазе S и увеличивается во время G 2 . Было показано, что Cdc25B дефосфорилирует Tyr15 на CDK2 в начале-середине G 2 способом, аналогичным вышеупомянутому механизму CDK1. Понижение регуляции циклина A2 в клетках U2OS задерживает активацию циклина-B1/CDK1 путем увеличения активности Wee1 и снижения активности Plk1 и Cdc25C. Однако комплексы циклин A2/CDK не функционируют строго как активаторы циклин B1/CDK1 в G 2 , поскольку было показано, что CDK2 требуется для активации p53-независимой активности контрольной точки G 2 , возможно, через стабилизирующее фосфорилирование на Cdc6 . Клетки CDK2-/- также имеют аномально высокие уровни Cdc25A. Было также показано, что циклин A2/CDK1 опосредует протеасомное разрушение Cdc25B. Эти пути часто дерегулированы при раке. [7]
В дополнение к бистабильным и гистерезисным аспектам активации циклина B1-CDK1, регуляция субклеточной локализации белка также вносит вклад в переход G2/M. Неактивный циклин B1-CDK1 накапливается в цитоплазме, начинает активироваться цитоплазматическим cdc25, а затем быстро секвестрируется в ядро во время профазы (по мере дальнейшей активации). У млекопитающих транслокация циклина B1/CDK1 в ядро активируется фосфорилированием пяти сериновых участков на цитоплазматическом участке удержания (CRS) циклина B1: S116, S26, S128, S133 и S147. У Xenopus laevis циклин B1 содержит четыре аналогичных участка фосфорилирования серина CRS (S94, S96, S101 и S113), что указывает на высокую консервативность этого механизма. Ядерный экспорт также инактивируется фосфорилированием ядерного экспортного сигнала циклина B1 (NES). Регуляторы этих участков фосфорилирования до сих пор в значительной степени неизвестны, но было идентифицировано несколько факторов, включая внеклеточные сигнально-регулируемые киназы (ERK), PLK1 и сам CDK1. При достижении некоторого порогового уровня фосфорилирования транслокация циклина B1/CDK1 в ядро происходит чрезвычайно быстро. Попав в ядро, циклин B1/CDK1 фосфорилирует многие мишени в рамках подготовки к митозу, включая гистон H1 , ядерные ламины , центросомальные белки и белки, ассоциированные с микротрубочками (MAP) .
Субклеточная локализация cdc25 также смещается из цитозоля в ядро во время профазы. Это достигается путем удаления фосфатов, скрывающих последовательность ядерной локализации (NLS), и фосфорилирования сигнала ядерного экспорта. Считается, что одновременный транспорт cdc25 и циклина-B1/CDK1 в ядро усиливает переключающую природу перехода за счет увеличения эффективных концентраций белков. [7]
Клетки реагируют на повреждение ДНК или неполностью реплицированные хромосомы в фазе G2, задерживая переход G2/M, чтобы предотвратить попытки разделения поврежденных хромосом. Повреждение ДНК обнаруживается киназами ATM и ATR , которые активируют Chk1 , ингибиторную киназу Cdc25. Chk1 ингибирует активность Cdc25 как напрямую, так и способствуя его исключению из ядра. [7] Чистый эффект заключается в повышении порога циклина B1, необходимого для инициирования гистерезисного перехода в M-фазу, эффективно останавливая клетку в G2 до тех пор, пока повреждение не будет устранено такими механизмами, как гомологически-направленная репарация (см. выше). [4]
Долгосрочное поддержание ареста G2 также опосредовано p53 , который стабилизируется в ответ на повреждение ДНК. CDK1 напрямую ингибируется тремя транскрипционными мишенями p53: p21 , Gadd45 и 14-3-3σ . Неактивный циклин B1/CDK1 секвестрируется в ядре p21, [12] в то время как активные комплексы циклин B1/CDK1 секвестрируются в цитоплазме 14-3-3σ. [13] Gadd45 нарушает связывание циклина B1 и CDK1 посредством прямого взаимодействия с CDK1. P53 также напрямую транскрипционно репрессирует CDK1. [13] [14]
Мутации в нескольких генах, вовлеченных в переход G2/M, вовлечены во многие виды рака. Повышенная экспрессия как циклина B, так и CDK1, часто ниже потери супрессоров опухолей, таких как p53, может вызвать увеличение пролиферации клеток. [7] Экспериментальные подходы к смягчению этих изменений включают как фармакологическое ингибирование CDK1, так и подавление экспрессии циклина B1 (например, через siRNA ). [15] [16]
Другие попытки модулировать переход G2/M для химиотерапевтических приложений были сосредоточены на контрольной точке повреждения ДНК. Фармакологический обход контрольной точки G2/M посредством ингибирования Chk1, как было показано, усиливает цитотоксичность других химиотерапевтических препаратов. Обход контрольной точки приводит к быстрому накоплению вредных мутаций, что, как считается, приводит раковые клетки к апоптозу . Наоборот, попытки продлить остановку G2/M также, как было показано, усиливают цитотоксичность таких препаратов, как доксорубицин . Эти подходы остаются на клинических и доклинических этапах исследований. [17]
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ) CS1 maint: числовые имена: список авторов ( ссылка )12345678910