Химия хлорорганических соединений занимается свойствами хлорорганических соединений , или хлорорганических соединений , органических соединений, содержащих по крайней мере один ковалентно связанный атом хлора . Класс хлоралканов ( алканы с одним или несколькими атомами водорода, замещенными хлором) включает общие примеры. Широкое структурное разнообразие и расходящиеся химические свойства хлорорганических соединений приводят к широкому диапазону названий, применений и свойств. Хлорорганические соединения широко используются во многих областях, хотя некоторые из них представляют серьезную экологическую проблему, причем ТХДД является одним из самых известных. [1]
Хлорорганические соединения, такие как трихлорэтилен , тетрахлорэтилен , дихлорметан и хлороформ, обычно используются в качестве растворителей и называются «хлорированными растворителями».
Хлорирование изменяет физические свойства углеводородов несколькими способами. Эти соединения обычно плотнее воды из-за более высокого атомного веса хлора по сравнению с водородом. Они имеют более высокие температуры кипения и плавления по сравнению с родственными углеводородами. Воспламеняемость снижается с увеличением замещения хлора в углеводородах.
Алифатические органохлориды часто являются алкилирующими агентами , поскольку хлор может действовать как уходящая группа , что может привести к повреждению клеток.
Многие хлорорганические соединения были выделены из природных источников, начиная от бактерий и заканчивая людьми. [2] [3] Хлорированные органические соединения встречаются почти в каждом классе биомолекул и природных продуктов, включая алкалоиды , терпены , аминокислоты , флавоноиды , стероиды и жирные кислоты . [2] [4] Диоксины , которые представляют особую опасность для здоровья человека и окружающей среды, производятся в условиях высоких температур лесных пожаров и были обнаружены в сохранившемся пепле пожаров, вызванных молнией, которые предшествовали синтетическим диоксинам. [5] Кроме того, из морских водорослей были выделены различные простые хлорированные углеводороды, включая дихлорметан , хлороформ и четыреххлористый углерод . [6] Большая часть хлорметана в окружающей среде производится естественным образом в результате биологического разложения, лесных пожаров и вулканов. [7]
Природный органохлорид эпибатидин , алкалоид, выделенный из древесных лягушек, обладает мощным анальгетическим действием и стимулировал исследования в области новых обезболивающих средств. Однако из-за неприемлемого терапевтического индекса он больше не является предметом исследований для потенциального терапевтического использования. [8] Лягушки получают эпибатидин через свой рацион, который затем изолируется в их коже. Вероятными источниками питания являются жуки, муравьи, клещи и мухи. [9]
Алканы и арильные алканы могут быть хлорированы в условиях свободных радикалов, с УФ-излучением. Однако степень хлорирования трудно контролировать. Арильные хлориды могут быть получены галогенированием Фриделя-Крафтса , используя хлор и кислотный катализатор Льюиса . [1]
Реакция галоформа , использующая хлор и гидроксид натрия , также способна генерировать алкилгалогениды из метилкетонов и родственных соединений. Раньше таким образом получали хлороформ.
Хлор также присоединяется к кратным связям алкенов и алкинов, образуя ди- или тетрахлорсоединения.
Алкены реагируют с хлористым водородом (HCl) с образованием алкилхлоридов. Например, промышленное производство хлорэтана осуществляется путем реакции этилена с HCl:
При оксихлорировании вместо более дорогого хлора для той же цели используют хлористый водород:
Вторичные и третичные спирты реагируют с хлористым водородом, давая соответствующие хлориды. В лаборатории родственная реакция с участием хлорида цинка в концентрированной соляной кислоте :
Эта смесь, называемая реагентом Лукаса , когда-то использовалась в качественном органическом анализе для классификации спиртов.
Алкилхлориды проще всего получить обработкой спиртов тионилхлоридом (SOCl2 ) или пентахлоридом фосфора (PCl5 ) , но также обычно с сульфурилхлоридом (SO2Cl2 ) и трихлоридом фосфора ( PCl3 ) :
В лабораторных условиях особенно удобен тионилхлорид, поскольку побочные продукты газообразны. В качестве альтернативы можно использовать реакцию Аппеля :
Алкилхлориды являются универсальными строительными блоками в органической химии. В то время как алкилбромиды и иодиды более реакционноспособны, алкилхлориды, как правило, менее дороги и более доступны. Алкилхлориды легко подвергаются атаке нуклеофилов.
Нагревание алкилгалогенидов с гидроксидом натрия или водой дает спирты. Реакция с алкоксидами или арилоксидами дает эфиры в синтезе эфиров Уильямсона ; реакция с тиолами дает тиоэфиры . Алкилхлориды легко реагируют с аминами, давая замещенные амины . Алкилхлориды замещаются более мягкими галогенидами, такими как иодид, в реакции Финкельштейна . Также возможны реакции с другими псевдогалогенидами, такими как азид , цианид и тиоцианат . В присутствии сильного основания алкилхлориды подвергаются дегидрогалогенированию, давая алкены или алкины .
Алкилхлориды реагируют с магнием, давая реактивы Гриньяра , преобразуя электрофильное соединение в нуклеофильное соединение. Реакция Вюрца восстановительно связывает два алкилгалогенида, чтобы соединиться с натрием .
Некоторые органохлориды (например, этилхлорид ) могут использоваться в качестве алкилирующих агентов . Тетраэтилсвинец был получен из этилхлорида и сплава натрия и свинца : [10] [11]
Восстановительное дехлорирование редко бывает полезным в химическом синтезе, но является ключевым этапом в биодеградации нескольких стойких хлорорганических загрязняющих веществ. [ необходима ссылка ]
Наибольшее применение хлорорганической химии — производство винилхлорида . Годовое производство в 1985 году составило около 13 миллионов тонн, почти весь из которых был преобразован в поливинилхлорид (ПВХ).
Большинство низкомолекулярных хлорированных углеводородов, таких как дихлорметан , хлороформ , дихлорэтилен , трихлорэтилен и тетрахлорэтилен, являются полезными растворителями. Эти растворители, как правило, относительно неполярны ; поэтому они не смешиваются с водой и эффективны в чистящих приложениях, таких как обезжиривание и химическая чистка . Они в основном не воспламеняемы или имеют очень низкую воспламеняемость.
Ежегодно производится несколько миллиардов килограммов хлорированного метана, в основном путем хлорирования метана:
Наиболее важным является дихлорметан, который в основном используется в качестве растворителя. Хлорметан является предшественником хлорсиланов и силиконов . Исторически значимым, но менее масштабным является хлороформ, в основном предшественник хлордифторметана (CHClF 2 ) и тетрафторэтена , который используется в производстве тефлона. [1]
Две основные группы хлорорганических инсектицидов — это соединения типа ДДТ и хлорированные алициклические соединения . Механизм их действия несколько отличается.
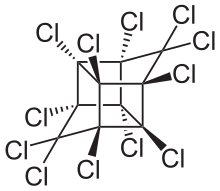
Полихлорированные бифенилы (ПХБ) когда-то были широко используемыми электроизоляторами и теплоносителями. Их использование, как правило, было прекращено из-за проблем со здоровьем. ПХБ были заменены полибромированными дифениловыми эфирами (ПБДЭ), которые вызывают схожие проблемы токсичности и биоаккумуляции . [ необходима цитата ]
Некоторые типы органохлоридов обладают значительной токсичностью для растений или животных, включая людей. Диоксины, образующиеся при сжигании органических веществ в присутствии хлора, являются стойкими органическими загрязнителями , которые представляют опасность при попадании в окружающую среду, как и некоторые инсектициды (такие как ДДТ ). Например, ДДТ, который широко использовался для борьбы с насекомыми в середине 20-го века, также накапливается в пищевых цепях, как и его метаболиты ДДЕ и ДДД , и вызывает репродуктивные проблемы (например, истончение яичной скорлупы) у некоторых видов птиц. [14] ДДТ также создал дополнительные проблемы для окружающей среды, поскольку он чрезвычайно подвижен, его следы были обнаружены даже в Антарктиде, несмотря на то, что это химическое вещество никогда там не использовалось. Некоторые хлорорганические соединения, такие как сернистый иприт , азотистый иприт и люизит , даже используются в качестве химического оружия из-за их токсичности.
Однако присутствие хлора в органическом соединении не гарантирует токсичность. Некоторые органохлориды считаются достаточно безопасными для потребления в пищевых продуктах и лекарствах. Например, горох и бобы содержат природный хлорированный растительный гормон 4-хлориндол-3-уксусную кислоту (4-Cl-IAA); [15] [16] а подсластитель сукралоза (Splenda) широко используется в диетических продуктах. По состоянию на 2004 год [обновлять]по меньшей мере 165 органохлоридов были одобрены во всем мире для использования в качестве фармацевтических препаратов, включая природный антибиотик ванкомицин , антигистаминный препарат лоратадин (Кларитин), антидепрессант сертралин (Золофт), противоэпилептический препарат ламотриджин (Ламиктал) и ингаляционный анестетик изофлуран . [17]
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка )