
Экспрессия гена — это процесс, посредством которого информация гена используется в синтезе функционального генного продукта , который позволяет ему производить конечные продукты, белки или некодирующую РНК , и в конечном итоге влиять на фенотип . Этими продуктами часто являются белки , но в генах, не кодирующих белок, таких как транспортная РНК (тРНК) и малая ядерная РНК (мяРНК) , продуктом является функциональная некодирующая РНК . Экспрессия генов обобщена в центральной догме молекулярной биологии, впервые сформулированной Фрэнсисом Криком в 1958 году, [1] получившей дальнейшее развитие в его статье 1970 года, [2] и расширенной последующими открытиями обратной транскрипции [3] [4] [5] и репликация РНК . [6]
Процесс экспрессии генов используется всеми известными формами жизни — эукариотами (включая многоклеточные организмы ), прокариотами ( бактериями и архей ), а также вирусами — для создания макромолекулярного механизма жизни.
В генетике экспрессия генов является наиболее фундаментальным уровнем, на котором генотип порождает фенотип , то есть наблюдаемый признак. Генетическая информация, хранящаяся в ДНК, представляет собой генотип, тогда как фенотип является результатом «интерпретации» этой информации. Такие фенотипы часто проявляются в синтезе белков, которые контролируют структуру и развитие организма или действуют как ферменты , катализирующие определенные метаболические пути.
Все этапы процесса экспрессии генов можно модулировать (регулировать), включая транскрипцию , сплайсинг РНК , трансляцию и посттрансляционную модификацию белка. Регуляция экспрессии генов обеспечивает контроль над временем, местоположением и количеством данного генного продукта (белка или нкРНК), присутствующего в клетке, и может оказывать глубокое влияние на клеточную структуру и функцию. Регуляция экспрессии генов является основой клеточной дифференциации , развития , морфогенеза , а также универсальности и адаптивности любого организма . Таким образом, регуляция генов может служить субстратом для эволюционных изменений.

Производство копии РНК из цепи ДНК называется транскрипцией и осуществляется РНК-полимеразами , которые добавляют по одному рибонуклеотиду за раз к растущей цепи РНК в соответствии с законом комплементарности нуклеотидных оснований. Эта РНК комплементарна матричной 3' → 5'-цепи ДНК [7] , за исключением того, что тимины (Т) заменены урацилами (U) в РНК и возможны ошибки.
У бактерий транскрипция осуществляется одним типом РНК-полимеразы, которой необходимо связать последовательность ДНК, называемую коробкой Прибнова , с помощью белка сигма-фактора (σ-фактора), чтобы начать транскрипцию. У эукариот транскрипция осуществляется в ядре тремя типами РНК-полимераз, каждому из которых для инициации процесса необходима особая последовательность ДНК, называемая промотором, и набор ДНК-связывающих белков — факторов транскрипции (см. регуляцию транскрипции ниже). . РНК-полимераза I отвечает за транскрипцию генов рибосомальной РНК (рРНК). РНК-полимераза II (Pol II) транскрибирует все гены, кодирующие белки, а также некоторые некодирующие РНК ( например , мяРНК, мяРНК или длинные некодирующие РНК ). РНК-полимераза III транскрибирует 5S рРНК , гены транспортной РНК (тРНК) и некоторые небольшие некодирующие РНК ( например , 7SK ). Транскрипция заканчивается, когда полимераза встречает последовательность, называемую терминатором .
В то время как транскрипция генов, кодирующих прокариотические белки, создает информационную РНК (мРНК), готовую к трансляции в белок, транскрипция эукариотических генов оставляет первичный транскрипт РНК (пре-РНК), который сначала должен претерпеть ряд модификаций, чтобы стать зрелая РНК. Типы и этапы процессов созревания различаются между кодирующими и некодирующими преРНК; т.е. даже несмотря на то, что молекулы преРНК как для мРНК, так и для тРНК подвергаются сплайсингу, этапы и задействованные механизмы различны. [8] Процессинг некодирующей РНК описан ниже (созревание некодирующей РНК).
Процессинг пре-мРНК включает 5'- кэпирование , которое представляет собой набор ферментативных реакций, которые добавляют 7-метилгуанозин (m 7 G) к 5'-концу пре-мРНК и, таким образом, защищают РНК от деградации экзонуклеазами . Затем кэп m 7 G связывается гетеродимером комплекса кэп-связывания (CBC20/CBC80), который способствует экспорту мРНК в цитоплазму, а также защищает РНК от декэпирования .
Другой модификацией является 3'- расщепление и полиаденилирование . Они возникают, если сигнальная последовательность полиаденилирования (5'-AAUAAA-3') присутствует в пре-мРНК, которая обычно находится между последовательностью, кодирующей белок, и терминатором. Пре-мРНК сначала расщепляется, а затем добавляется серия из ~200 аденинов (А) с образованием поли(А)-хвоста, который защищает РНК от деградации. Поли(А)-хвост связан с множеством поли(А)-связывающих белков (PABP), необходимых для экспорта мРНК и повторной инициации трансляции. В обратном процессе деаденилирования хвосты поли(А) укорачиваются под действием 3'-5' экзонуклеазы CCR4-Not , что часто приводит к полному распаду транскрипта.
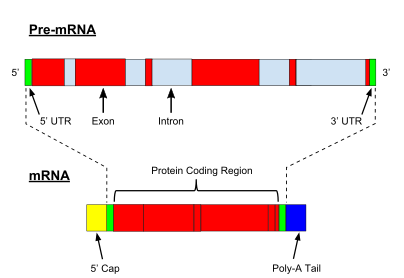
Очень важной модификацией пре-мРНК эукариот является сплайсинг РНК . Большинство эукариотических пре-мРНК состоят из чередующихся сегментов, называемых экзонами и интронами . В процессе сплайсинга каталитический комплекс РНК-белок, известный как сплайсосома , катализирует две реакции переэтерификации , которые удаляют интрон и высвобождают его в форме лариатной структуры, а затем соединяют соседние экзоны вместе. В определенных случаях некоторые интроны или экзоны могут быть удалены или сохранены в зрелой мРНК. Этот так называемый альтернативный сплайсинг создает серию различных транскриптов, происходящих от одного гена. Поскольку эти транскрипты потенциально могут транслироваться в различные белки, сплайсинг увеличивает сложность экспрессии эукариотических генов и размер видового протеома .
Обширный процессинг РНК может быть эволюционным преимуществом , которое стало возможным благодаря ядру эукариот. У прокариот транскрипция и трансляция происходят одновременно, тогда как у эукариот ядерная мембрана разделяет эти два процесса, давая время для процессинга РНК.
В большинстве организмов некодирующие гены (нкРНК) транскрибируются как предшественники, которые подвергаются дальнейшему процессингу. В случае рибосомальных РНК (рРНК) они часто транскрибируются как пре-рРНК, которая содержит одну или несколько рРНК. Пре-рРНК расщепляется и модифицируется ( 2'- О -метилирование и образование псевдоуридина ) в определенных сайтах примерно 150 различными небольшими видами РНК, ограниченными ядрышком, называемыми мякРНК. SnoRNAs связываются с белками, образуя snoRNP. В то время как часть мякРНК спаривается с РНК-мишенью и, таким образом, позиционирует модификацию в точном месте, белковая часть выполняет каталитическую реакцию. У эукариотов, в частности, мяРНП, называемая РНКазой, MRP расщепляет 45S пре-рРНК на 28S , 5,8S и 18S рРНК . Факторы процессинга рРНК и РНК образуют большие агрегаты, называемые ядрышками . [9]
Например, в случае транспортной РНК (тРНК) 5'-последовательность удаляется РНКазой P [10] , тогда как 3'-конец удаляется ферментом тРНКазы Z [11] и нематрицированный 3'-конец CCA добавляется нуклеотидилтрансферазой . [12] В случае микроРНК (миРНК) , микроРНК сначала транскрибируются как первичные транскрипты или при-миРНК с кэпом и поли-А-хвостом и процессируются в короткие 70-нуклеотидные структуры «стебель-петля», известные как пре-миРНК в ядро клетки ферментами Дроша и Паша . После экспорта он затем обрабатывается для созревания микроРНК в цитоплазме путем взаимодействия с эндонуклеазой Dicer , которая также инициирует образование РНК -индуцированного комплекса молчания (RISC) , состоящего из белка Argonaute .
Даже мяРНК и сами мяРНК претерпевают ряд модификаций, прежде чем они станут частью функционального комплекса РНП. Это делается либо в нуклеоплазме, либо в специализированных отсеках, называемых тельцами Кахаля . Их основания метилированы или псевдоуридинилированы группой малых РНК, специфичных для тела Кахаля (scaRNA) , которые структурно сходны с мякРНК.
У эукариот наиболее зрелая РНК должна экспортироваться в цитоплазму из ядра . Хотя некоторые РНК функционируют в ядре, многие РНК транспортируются через ядерные поры в цитозоль . [13] Экспорт РНК требует ассоциации со специфическими белками, известными как экспортины. За экспорт определенного типа РНК отвечают специфические молекулы экспортина. Транспорт мРНК также требует правильной ассоциации с комплексом экзонов (EJC), который гарантирует, что перед экспортом будет завершена правильная обработка мРНК. В некоторых случаях РНК дополнительно транспортируются в определенную часть цитоплазмы, например в синапс ; затем их буксируют моторные белки , которые связываются через линкерные белки со специфическими последовательностями (называемыми «зипкодами») на РНК. [14]
Для некоторых некодирующих РНК зрелая РНК является конечным продуктом гена. [15] В случае информационной РНК (мРНК) РНК является носителем информации, кодирующим синтез одного или нескольких белков. мРНК, несущая одну белковую последовательность (часто встречающаяся у эукариот), является моноцистронной, тогда как мРНК, несущая несколько белковых последовательностей (распространенная у прокариот), известна как полицистронная .
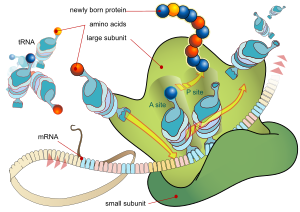
Каждая мРНК состоит из трех частей: 5'-нетранслируемой области (5'-UTR), белково-кодирующей области или открытой рамки считывания (ORF) и 3'-нетранслируемой области (3'-UTR). Кодирующая область несет информацию для синтеза белка, закодированную генетическим кодом, с образованием триплетов. Каждый триплет нуклеотидов кодирующей области называется кодоном и соответствует участку связывания, комплементарному триплету антикодона в транспортной РНК. Транспортные РНК с одинаковой последовательностью антикодонов всегда несут аминокислоты одинакового типа . Затем аминокислоты соединяются рибосомой в соответствии с порядком триплетов в кодирующей области. Рибосома помогает транспортной РНК связываться с информационной РНК, забирает аминокислоту из каждой транспортной РНК и создает из нее бесструктурный белок. [16] [17] Каждая молекула мРНК транслируется во множество белковых молекул, в среднем около 2800 у млекопитающих. [18] [19]
У прокариот трансляция обычно происходит в точке транскрипции (котранскрипционно), часто с использованием информационной РНК, которая все еще находится в процессе создания. У эукариот трансляция может происходить в различных областях клетки в зависимости от того, где должен находиться записываемый белок. Основными местами локализации являются цитоплазма растворимых цитоплазматических белков и мембрана эндоплазматического ретикулума для белков, которые предназначены для экспорта из клетки или для встраивания в клеточную мембрану . Белки, которые, как предполагается, производятся в эндоплазматическом ретикулуме, распознаются на полпути процесса трансляции. Этим управляет частица распознавания сигнала — белок, который связывается с рибосомой и направляет ее в эндоплазматический ретикулум, когда обнаруживает сигнальный пептид на растущей (зарождающейся) аминокислотной цепи. [20]
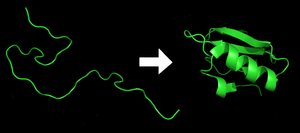
Каждый белок существует как развернутый полипептид или случайный клубок при трансляции из последовательности мРНК в линейную цепь аминокислот . У этого полипептида отсутствует развитая трехмерная структура (левая часть соседнего рисунка). Затем полипептид сворачивается в свою характерную и функциональную трехмерную структуру из случайного спираля . [21] Аминокислоты взаимодействуют друг с другом, образуя четко определенную трехмерную структуру — свернутый белок (правая часть рисунка), известный как нативное состояние . Получающаяся трехмерная структура определяется аминокислотной последовательностью ( догма Анфинсена ). [22]
Правильная трехмерная структура необходима для функционирования, хотя некоторые части функциональных белков могут оставаться развернутыми . [23] Неспособность свернуться в нужную форму обычно приводит к образованию неактивных белков с различными свойствами, включая токсичные прионы . Считается, что некоторые нейродегенеративные и другие заболевания возникают в результате накопления неправильно свернутых белков. [24] Многие аллергии вызваны сворачиванием белков, поскольку иммунная система не вырабатывает антитела к определенным белковым структурам. [25]
Ферменты, называемые шаперонами, помогают вновь образовавшемуся белку достичь ( свернуться ) трехмерной структуры, необходимой для его функционирования. [26] Точно так же РНК-шапероны помогают РНК обрести свою функциональную форму. [27] Помощь в сворачивании белков является одной из основных функций эндоплазматической сети у эукариот.
Секреторные белки эукариот или прокариот должны быть транслоцированы, чтобы войти в секреторный путь. Вновь синтезированные белки направляются в эукариотический канал транслокации Sec61 или прокариотический SecYEG с помощью сигнальных пептидов . Эффективность секреции белка у эукариот во многом зависит от использованного сигнального пептида . [28]
Многие белки предназначены для других частей клетки, помимо цитозоля, и широкий спектр сигнальных последовательностей или (сигнальных пептидов) используется для направления белков туда, где они должны быть. У прокариот это обычно простой процесс из-за ограниченной компартментализации клетки. Однако у эукариот существует множество различных процессов нацеливания, обеспечивающих попадание белка в нужную органеллу.
Не все белки остаются внутри клетки, а многие экспортируются, например, пищеварительные ферменты , гормоны и белки внеклеточного матрикса . У эукариот путь экспорта хорошо развит, и основным механизмом экспорта этих белков является транслокация в эндоплазматический ретикулум с последующим транспортом через аппарат Гольджи . [29] [30]

Регуляция экспрессии генов — это контроль количества и сроков появления функционального продукта гена. Контроль экспрессии жизненно важен для того, чтобы позволить клетке производить необходимые ей генные продукты тогда, когда они ей нужны; в свою очередь, это дает клеткам возможность адаптироваться к изменяющейся среде, внешним сигналам, повреждениям клетки и другим раздражителям. В более общем смысле, регуляция генов дает клетке контроль над всей структурой и функциями и является основой клеточной дифференциации , морфогенеза , а также универсальности и адаптивности любого организма.
Для описания типов генов используются многочисленные термины в зависимости от того, как они регулируются; к ним относятся:
Любой этап экспрессии гена можно модулировать, от этапа транскрипции ДНК-РНК до посттрансляционной модификации белка. Стабильность конечного продукта гена, будь то РНК или белок, также способствует уровню экспрессии гена: нестабильный продукт приводит к низкому уровню экспрессии. В целом экспрессия генов регулируется посредством изменения [31] числа и типа взаимодействий между молекулами [32] , которые коллективно влияют на транскрипцию ДНК [33] и трансляцию РНК. [34]
Вот несколько простых примеров того, где важна экспрессия генов:

Регуляцию транскрипции можно разделить на три основных пути влияния; генетический (прямое взаимодействие фактора контроля с геном), модуляционное взаимодействие фактора контроля с аппаратом транскрипции и эпигенетический (непоследовательные изменения в структуре ДНК, влияющие на транскрипцию).

Прямое взаимодействие с ДНК — самый простой и прямой метод изменения уровня транскрипции белка. Гены часто имеют несколько сайтов связывания белков вокруг кодирующей области со специфической функцией регулирования транскрипции. Существует много классов регуляторных сайтов связывания ДНК, известных как энхансеры , инсуляторы и сайленсеры . Механизмы регуляции транскрипции разнообразны: от блокирования ключевых сайтов связывания РНК-полимеразы на ДНК до действия в качестве активатора и стимулирования транскрипции, помогая связыванию РНК-полимеразы.
Активность факторов транскрипции дополнительно модулируется внутриклеточными сигналами, вызывающими посттрансляционную модификацию белка, включая фосфорилирование , ацетилирование или гликозилирование . Эти изменения влияют на способность транскрипционного фактора прямо или косвенно связываться с промотором ДНК, рекрутировать РНК-полимеразу или способствовать удлинению вновь синтезированной молекулы РНК.
Ядерная мембрана у эукариот позволяет осуществлять дальнейшую регуляцию факторов транскрипции за счет продолжительности их присутствия в ядре, что регулируется обратимыми изменениями их структуры и связыванием других белков. [35] Стимулы окружающей среды или эндокринные сигналы [36] могут вызывать модификацию регуляторных белков [37] , вызывая каскады внутриклеточных сигналов [38] , которые приводят к регуляции экспрессии генов.
Стало очевидным, что существует значительное влияние специфичных эффектов, не связанных с последовательностями ДНК, на транскрипцию. Эти эффекты называются эпигенетическими и включают структуру ДНК более высокого порядка, ДНК-связывающие белки, не специфичные для последовательности, и химическую модификацию ДНК. В целом эпигенетические эффекты изменяют доступность ДНК для белков и тем самым модулируют транскрипцию.

У эукариот структура хроматина , контролируемая кодом гистонов , регулирует доступ к ДНК, оказывая значительное влияние на экспрессию генов в областях эухроматина и гетерохроматина .

Экспрессия генов у млекопитающих регулируется многими цис-регуляторными элементами , включая коровые промоторы и проксимальные промоторные элементы , которые расположены рядом с сайтами начала транскрипции генов, выше по ДНК (по направлению к 5'-области смысловой цепи ). Другие важные цис-регуляторные модули локализованы в участках ДНК, удаленных от сайтов начала транскрипции. К ним относятся усилители , глушители , изоляторы и привязывающие элементы. [39] Энхансеры и связанные с ними факторы транскрипции играют ведущую роль в регуляции экспрессии генов. [40]
Энхансеры — это области генома, которые регулируют гены. Энхансеры контролируют программы экспрессии генов, специфичные для конкретного типа клеток, чаще всего преодолевая большие расстояния, чтобы оказаться в физической близости с промоторами своих генов-мишеней. [41] Множественные энхансеры, каждый из которых часто находится на расстоянии десятков или сотен тысяч нуклеотидов от генов-мишеней, соединяются с промоторами гена-мишени и координируются друг с другом, чтобы контролировать экспрессию генов. [41]
На иллюстрации показан энхансер, вращающийся вокруг, чтобы приблизиться к промотору целевого гена. Петля стабилизируется димером соединительного белка (например, димером CTCF или YY1 ). Один член димера прикреплен к своему мотиву связывания на энхансере, а другой член прикреплен к своему мотиву связывания на промоторе (представлен красным зигзагами на иллюстрации). [42] Несколько факторов транскрипции, специфичных для клеточной функции (среди примерно 1600 факторов транскрипции в клетке человека) [43] обычно связываются со специфическими мотивами на энхансере. [44] Небольшая комбинация этих связанных с энхансером факторов транскрипции, когда они приближаются к промотору с помощью петли ДНК, регулирует уровень транскрипции целевого гена. Медиатор (комплекс, обычно состоящий примерно из 26 белков во взаимодействующей структуре) передает регуляторные сигналы от энхансерных ДНК-связанных факторов транскрипции непосредственно ферменту РНК-полимеразы II (pol II), связанному с промотором. [45]
Энхансеры, когда они активны, обычно транскрибируются с обеих цепей ДНК с помощью РНК-полимераз, действующих в двух разных направлениях, образуя две эРНК, как показано на рисунке. [46] Неактивный энхансер может быть связан с неактивным фактором транскрипции. Фосфорилирование фактора транскрипции может активировать его, и этот активированный фактор транскрипции может затем активировать энхансер, с которым он связан (см. маленькую красную звездочку, обозначающую фосфорилирование фактора транскрипции, связанного с энхансером, на иллюстрации). [47] Активированный энхансер начинает транскрипцию своей РНК до активации транскрипции информационной РНК из своего гена-мишени. [48]

Метилирование ДНК является широко распространенным механизмом эпигенетического влияния на экспрессию генов, наблюдается у бактерий и эукариот и играет роль в наследственном подавлении транскрипции и регуляции транскрипции. Метилирование чаще всего происходит на цитозине (см. рисунок). Метилирование цитозина в основном происходит в динуклеотидных последовательностях, где за цитозином следует гуанин, сайт CpG . Число CpG-сайтов в геноме человека составляет около 28 миллионов. [49] В зависимости от типа клетки около 70% сайтов CpG содержат метилированный цитозин. [50]
Метилирование цитозина в ДНК играет важную роль в регуляции экспрессии генов. Метилирование CpG в промоторной области гена обычно подавляет транскрипцию гена [51] , тогда как метилирование CpG в теле гена увеличивает его экспрессию. [52] Ферменты ТЕТ играют центральную роль в деметилировании метилированных цитозинов. Деметилирование CpG в промоторе гена под действием фермента TET увеличивает транскрипцию гена. [53]

Для крыс контекстуальное обусловливание страха (CFC) представляет собой болезненный опыт обучения. Всего лишь один эпизод ХФУ может привести к появлению страшных воспоминаний на всю жизнь. [54] После эпизода CFC метилирование цитозина изменяется в промоторных областях примерно 9,17% всех генов в ДНК нейронов гиппокампа крысы. [55] Гиппокамп — это место , где первоначально хранятся новые воспоминания. После CFC около 500 генов имеют повышенную транскрипцию (часто из-за деметилирования сайтов CpG в промоторной области) и около 1000 генов имеют пониженную транскрипцию (часто из-за новообразованного 5-метилцитозина в сайтах CpG в промоторной области). Паттерн индуцированных и репрессированных генов в нейронах, по-видимому, обеспечивает молекулярную основу для формирования первых временных воспоминаний об этом тренировочном событии в гиппокампе мозга крысы. [55]
Были установлены некоторые специфические механизмы, управляющие новым метилированием ДНК и новым деметилированием ДНК в гиппокампе во время установления памяти (резюме см. [56] ). Один из механизмов включает в себя направление короткой изоформы фермента деметилирования ДНК TET1 , TET1, примерно в 600 мест генома. Управление осуществляется путем ассоциации TET1 с белком EGR1 , фактором транскрипции, важным для формирования памяти. Прибытие TET1 в эти места инициирует деметилирование ДНК в этих местах, активируя связанные гены. Второй механизм включает DNMT3A2, сплайс-изоформу ДНК-метилтрансферазы DNMT3A, которая добавляет метильные группы к цитозинам в ДНК. Эта изоформа индуцируется синаптической активностью, и место ее действия, по-видимому, определяется посттрансляционными модификациями гистонов ( гистоновый код ). Полученные новые матричные РНК затем транспортируются информационными частицами РНП (нейрональными гранулами) к синапсам нейронов, где они могут транслироваться в белки, влияющие на активность синапсов. [56]
В частности, ген нейротрофического фактора головного мозга ( BDNF ) известен как «ген обучения». [57] После CFC наблюдалась активация экспрессии гена BDNF , связанная со снижением метилирования CpG некоторых внутренних промоторов гена, и это коррелировало с обучением. [57]
Большинство промоторов генов содержат островок CpG с многочисленными сайтами CpG . [58] Когда многие сайты CpG промотора гена метилированы, ген замолкает. [59] Колоректальный рак обычно имеет от 3 до 6 мутаций водителя и от 33 до 66 мутаций автостопщика или пассажира. [60] Однако подавление транскрипции может иметь большее значение, чем мутация, в возникновении прогрессирования рака. Например, при колоректальном раке около 600–800 генов транскрипционно подавляются в результате метилирования CpG-островков (см. Регуляция транскрипции при раке ). Репрессия транскрипции при раке может также происходить за счет других эпигенетических механизмов, таких как изменение экспрессии микроРНК . [61] При раке молочной железы репрессия транскрипции BRCA1 может происходить чаще из-за чрезмерной транскрипции микроРНК-182, чем из-за гиперметилирования промотора BRCA1 (см. Низкая экспрессия BRCA1 при раке молочной железы и яичников ).
Считается, что у эукариот, где экспорт РНК необходим до того, как станет возможной трансляция, ядерный экспорт обеспечивает дополнительный контроль над экспрессией генов. Весь транспорт в ядро и из ядра осуществляется через ядерную пору , и транспорт контролируется широким спектром белков импортина и экспортина .
Экспрессия гена, кодирующего белок, возможна только в том случае, если информационная РНК, несущая код, выживает достаточно долго для трансляции. В типичной клетке молекула РНК стабильна только в том случае, если она специально защищена от деградации. Деградация РНК имеет особое значение для регуляции экспрессии в эукариотических клетках, где мРНК должна преодолевать значительные расстояния, прежде чем транслироваться. У эукариот РНК стабилизируется за счет определенных посттранскрипционных модификаций, в частности 5'-кэпа и полиаденилированного хвоста .
Намеренная деградация мРНК используется не только как механизм защиты от чужеродной РНК (обычно от вирусов), но и как путь дестабилизации мРНК . Если молекула мРНК имеет последовательность, комплементарную небольшой интерферирующей РНК , то она подвергается разрушению посредством пути РНК-интерференции.
Три основных нетранслируемых участка (3'UTR) информационных РНК (мРНК) часто содержат регуляторные последовательности, которые посттранскрипционно влияют на экспрессию генов. Такие 3'-UTR часто содержат как сайты связывания микроРНК (миРНК), так и регуляторные белки. Связываясь со специфическими сайтами внутри 3'-UTR, микроРНК могут снижать экспрессию генов различных мРНК, либо ингибируя трансляцию, либо непосредственно вызывая деградацию транскрипта. 3'-UTR также может иметь участки сайленсера, которые связывают белки-репрессоры, ингибирующие экспрессию мРНК.
3'-UTR часто содержит элементы ответа микроРНК (MRE) . MRE — это последовательности, с которыми связываются микроРНК. Это преобладающие мотивы в 3'-UTR. Среди всех регуляторных мотивов внутри 3'-UTR (например, включая сайленсеры), MRE составляют около половины мотивов.
По состоянию на 2014 год на веб-сайте miRBase [62] , архиве последовательностей и аннотаций микроРНК , было перечислено 28 645 записей о 233 биологических видах. Из них 1881 микроРНК находились в аннотированных локусах микроРНК человека. Было предсказано, что микроРНК содержат в среднем около четырехсот целевых мРНК (влияющих на экспрессию нескольких сотен генов). [63] Фридман и др. [63] подсчитали, что >45 000 целевых сайтов микроРНК в 3'UTR мРНК человека консервативны выше фоновых уровней, и >60% генов, кодирующих белки человека, находились под селективным давлением, требующим поддержания спаривания с микроРНК.
Прямые эксперименты показывают, что одна микроРНК может снизить стабильность сотен уникальных мРНК. [64] Другие эксперименты показывают, что одна микроРНК может подавлять продукцию сотен белков, но эта репрессия часто бывает относительно легкой (менее чем в 2 раза). [65] [66]
Эффекты нарушения регуляции экспрессии генов микроРНК, по-видимому, важны при раке. [67] Например, при раке желудочно-кишечного тракта девять микроРНК были идентифицированы как эпигенетически измененные и эффективные в подавлении ферментов репарации ДНК. [68]
Эффекты нарушения регуляции экспрессии генов микроРНК также кажутся важными при нервно-психических расстройствах, таких как шизофрения, биполярное расстройство, большая депрессия, болезнь Паркинсона, болезнь Альцгеймера и расстройства аутистического спектра. [69] [70]
Прямая регуляция трансляции менее распространена, чем контроль транскрипции или стабильности мРНК, но иногда используется. Ингибирование трансляции белка является основной мишенью для токсинов и антибиотиков , поэтому они могут убить клетку, игнорируя ее нормальный контроль экспрессии генов. Ингибиторы синтеза белка включают антибиотик неомицин и токсин рицин .
Посттрансляционные модификации (ПТМ) представляют собой ковалентные модификации белков. Подобно сплайсингу РНК, они помогают значительно разнообразить протеом. Эти модификации обычно катализируются ферментами. Кроме того, такие процессы, как ковалентное присоединение к остаткам боковой цепи аминокислот, часто могут быть обращены вспять другими ферментами. Однако некоторые из них, например протеолитическое расщепление белкового остова, необратимы. [71]
ПТМ играют много важных ролей в клетке. [72] Например, фосфорилирование в первую очередь участвует в активации и деактивации белков, а также в сигнальных путях. [73] PTMs участвуют в регуляции транскрипции: важной функцией ацетилирования и метилирования является модификация хвоста гистонов, которая изменяет доступность ДНК для транскрипции. [71] Их также можно увидеть в иммунной системе, где гликозилирование играет ключевую роль. [74] Один тип PTM может инициировать другой тип PTM, как можно видеть на примере того, как убиквитинирование помечает белки для деградации посредством протеолиза. [71] Протеолиз, помимо участия в расщеплении белков, также важен для их активации и деактивации, а также для регулирования биологических процессов, таких как транскрипция ДНК и гибель клеток. [75]

Измерение экспрессии генов является важной частью многих наук о жизни , поскольку возможность количественного определения уровня экспрессии определенного гена в клетке, ткани или организме может предоставить много ценной информации. Например, измерение экспрессии генов может:
Точно так же анализ места экспрессии белка является мощным инструментом, и его можно проводить в организменном или клеточном масштабе. Исследование локализации особенно важно для изучения развития многоклеточных организмов и как индикатор функции белка в одиночных клетках. В идеале измерение экспрессии осуществляется путем обнаружения конечного продукта гена (для многих генов это белок); однако зачастую легче обнаружить один из предшественников, обычно мРНК , и сделать вывод об уровнях экспрессии генов на основе этих измерений.
Уровни мРНК можно количественно измерить с помощью нозерн-блоттинга , который предоставляет информацию о размере и последовательности молекул мРНК. Образец РНК отделяют на агарозном геле и гибридизуют с радиоактивно меченным зондом РНК, который комплементарен целевой последовательности. Радиомеченую РНК затем обнаруживают с помощью авторадиографа . Поскольку использование радиоактивных реагентов делает процедуру трудоемкой и потенциально опасной, были разработаны альтернативные методы маркировки и обнаружения, такие как химический анализ дигоксигенина и биотина. Предполагаемые недостатки нозерн-блоттинга заключаются в том, что требуются большие количества РНК и что количественный анализ может быть не совсем точным, поскольку он включает измерение силы полосы на изображении геля. С другой стороны, дополнительная информация о размере мРНК, полученная при нозерн-блоттинге, позволяет распознавать поочередно сплайсированные транскрипты.
Другим подходом к измерению содержания мРНК является RT-qPCR. В этом методе за обратной транскрипцией следует количественная ПЦР . Обратная транскрипция сначала генерирует матрицу ДНК из мРНК; эта одноцепочечная матрица называется кДНК . Затем матрица кДНК амплифицируется на количественном этапе, во время которого флуоресценция , излучаемая мечеными зондами гибридизации или интеркалирующими красителями, меняется по мере продвижения процесса амплификации ДНК . С помощью тщательно построенной стандартной кривой кПЦР может дать абсолютное измерение количества копий исходной мРНК, обычно в единицах копий на нанолитр гомогенизированной ткани или копий на клетку. qPCR очень чувствителен (обнаружение одной молекулы мРНК теоретически возможно), но может быть дорогостоящим в зависимости от типа используемого репортера; флуоресцентно меченные олигонуклеотидные зонды стоят дороже, чем неспецифические интеркалирующие флуоресцентные красители.
Для профилирования экспрессии или высокопроизводительного анализа многих генов в образце количественная ПЦР может выполняться для сотен генов одновременно в случае массивов с низкой плотностью. Второй подход — гибридизация микрочипов . Один массив или «чип» может содержать зонды для определения уровней транскриптов для каждого известного гена в геноме одного или нескольких организмов. В качестве альтернативы можно использовать технологии «на основе меток», такие как серийный анализ экспрессии генов (SAGE) и RNA-Seq , которые могут обеспечить относительную оценку клеточной концентрации различных мРНК. Преимуществом методов на основе тегов является «открытая архитектура», позволяющая точно измерить любой транскрипт с известной или неизвестной последовательностью. Секвенирование следующего поколения (NGS), такое как RNA-Seq , является еще одним подходом, позволяющим получить огромные объемы данных о последовательностях, которые можно сопоставить с эталонным геномом. Хотя NGS сравнительно трудоемкий, дорогой и ресурсоемкий процесс, он может идентифицировать однонуклеотидные полиморфизмы , варианты сплайсинга и новые гены, а также может использоваться для профилирования экспрессии в организмах, для которых мало или вообще нет информации о последовательностях. .
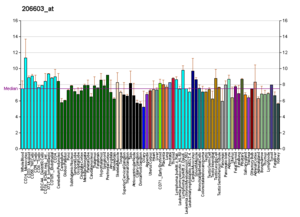
Подобные профили встречаются почти для всех белков, перечисленных в Википедии. Их генерируют такие организации, как Институт геномики исследовательского фонда Novartis и Европейский институт биоинформатики . Дополнительную информацию можно найти, выполнив поиск по их базам данных (пример транспортера GLUT4, изображенного здесь, см. В цитате). [76] Эти профили указывают уровень экспрессии ДНК (и, следовательно, продуцируемой РНК) определенного белка в определенной ткани и имеют соответствующую цветовую кодировку на изображениях, расположенных в блоке белков в правой части каждой страницы Википедии.
Уровень экспрессии генов, кодирующих белки, можно напрямую оценить с помощью ряда методов, имеющих некоторые явные аналогии с методами количественного определения мРНК.
Одним из наиболее часто используемых методов является проведение вестерн-блоттинга интересующего белка. [77] Это дает информацию о размере белка в дополнение к его идентичности. Образец (часто клеточный лизат ) отделяют на полиакриламидном геле , переносят на мембрану и затем исследуют антителом к интересующему белку. Антитело можно конъюгировать либо с флуорофором , либо с пероксидазой хрена для визуализации и/или количественного определения. Гелевая природа этого анализа делает количественную оценку менее точной, но он имеет то преимущество, что позволяет идентифицировать более поздние модификации белка, например протеолиз или убиквитинирование, по изменениям размера.
Хотя транскрипция напрямую отражает экспрессию генов, количество копий молекул мРНК не коррелирует напрямую с количеством белковых молекул, транслируемых с мРНК. Количественное определение белка и мРНК позволяет коррелировать эти два уровня. Регулирование каждого этапа экспрессии генов может влиять на корреляцию, как показано в случае регуляции трансляции [19] или стабильности белка. [78] Посттрансляционные факторы, такие как транспорт белка в высокополярных клетках, [79] также могут влиять на измеренную корреляцию мРНК-белок.

Анализ экспрессии не ограничивается количественной оценкой; локализацию также можно определить. мРНК можно обнаружить с помощью соответственно меченной комплементарной цепи мРНК, а белок можно обнаружить с помощью меченых антител. Затем зондированный образец исследуют под микроскопом, чтобы определить, где находится мРНК или белок.
Заменив ген новой версией, слитой с маркером зеленого флуоресцентного белка (или аналогичного), экспрессию можно напрямую определить количественно в живых клетках. Это делается путем визуализации с помощью флуоресцентного микроскопа . Очень сложно клонировать белок, слитый с GFP, в его нативное место в геноме, не влияя при этом на уровни экспрессии, поэтому этот метод часто нельзя использовать для измерения экспрессии эндогенных генов. Однако его широко используют для измерения экспрессии гена, искусственно введенного в клетку, например, с помощью вектора экспрессии . Важно отметить, что путем слияния целевого белка с флуоресцентным репортером поведение белка, включая его клеточную локализацию и уровень экспрессии, может быть существенно изменено.
Иммуноферментный анализ основан на использовании антител, иммобилизованных на титрационном микропланшете , для захвата интересующих белков из образцов, добавленных в лунку. Используя детектирующее антитело, конъюгированное с ферментом или флуорофором, количество связанного белка можно точно измерить с помощью флуорометрического или колориметрического обнаружения. Процесс обнаружения очень похож на процесс вестерн-блоттинга, но, избегая этапов геля, можно добиться более точного количественного определения.
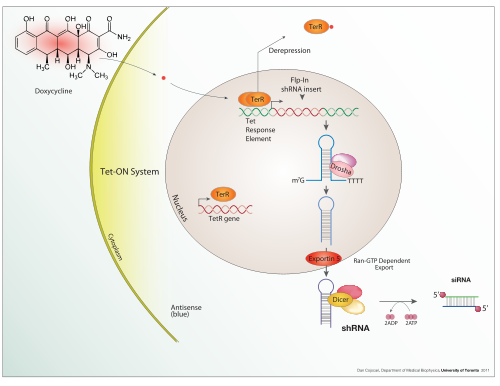
Система экспрессии представляет собой систему, специально разработанную для производства выбранного генного продукта. Обычно это белок, хотя также может быть РНК, например тРНК или рибозим . Система экспрессии состоит из гена, обычно кодируемого ДНК , и молекулярного механизма, необходимого для транскрипции ДНК в мРНК и трансляции мРНК в белок с использованием предоставленных реагентов. В самом широком смысле это включает в себя каждую живую клетку, но этот термин чаще используется для обозначения экспрессии как лабораторного инструмента. Поэтому система экспрессии часто бывает в некотором роде искусственной. Однако системы экспрессии представляют собой фундаментально естественный процесс. Вирусы являются прекрасным примером того, как они реплицируются, используя клетку-хозяина в качестве системы экспрессии вирусных белков и генома.
Доксициклин также используется в контролируемой тетрациклином активации транскрипции «Tet-on» и «Tet-off» для регуляции экспрессии трансгена в организмах и клеточных культурах .
В дополнение к этим биологическим инструментам, некоторые естественно наблюдаемые конфигурации ДНК (гены, промоторы, энхансеры, репрессоры) и связанные с ними механизмы сами по себе называются системой экспрессии. Этот термин обычно используется в случае, когда ген или набор генов включаются при четко определенных условиях, например, простая система экспрессии переключения репрессора в фаге лямбда и система lac-операторов у бактерий. Некоторые естественные системы экспрессии непосредственно используются или модифицируются и используются для искусственных систем экспрессии, таких как системы экспрессии Tet-on и Tet-off .
Гены иногда рассматривают как узлы в сети, где входными данными являются белки, такие как факторы транскрипции , а выходными — уровень экспрессии генов. Сам узел выполняет функцию, и работа этих функций интерпретируется как своего рода обработка информации внутри клеток и определяет клеточное поведение.
Генные сети также могут быть построены без формулирования явной причинно-следственной модели. Это часто происходит при сборке сетей из больших наборов данных выражений. [80] Ковариация и корреляция экспрессии рассчитываются на основе большой выборки случаев и измерений (часто данных транскриптома или протеома ). Источник изменчивости может быть как экспериментальным, так и естественным (наблюдательным). Существует несколько способов построения сетей экспрессии генов, но один из распространенных подходов заключается в вычислении матрицы всех парных корреляций экспрессии между условиями, моментами времени или отдельными людьми и преобразованием этой матрицы (после порогового значения при некотором пороговом значении) в графическое представление, в котором узлы представляют гены, транскрипты или белки, а ребра, соединяющие эти узлы, представляют силу ассоциации (см. GeneNetwork GeneNetwork 2). [81]
Следующие экспериментальные методы используются для измерения экспрессии генов и перечислены примерно в хронологическом порядке, начиная со старых и более устоявшихся технологий. Они разделены на две группы в зависимости от степени мультиплексности .
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )