
Эндоплазматическая сеть ( ЭР ) является частью транспортной системы эукариотической клетки и выполняет множество других важных функций, таких как сворачивание белков . Это тип органеллы , состоящий из двух субъединиц — шероховатой эндоплазматической сети ( RER ) и гладкой эндоплазматической сети ( SER ). Эндоплазматическая сеть обнаружена в большинстве эукариотических клеток и образует взаимосвязанную сеть уплощенных, закрытых мембраной мешочков, известных как цистерны (в RER), и трубчатых структур в SER. Мембраны ЭР являются продолжением наружной ядерной мембраны . Эндоплазматический ретикулум не обнаруживается в эритроцитах или сперматозоидах .
Два типа ЭР имеют много одних и тех же белков и участвуют в некоторых общих видах деятельности, таких как синтез определенных липидов и холестерина . Различные типы клеток содержат разные соотношения двух типов ЭР в зависимости от активности клетки. RER обнаруживается в основном по направлению к ядру клетки, а SER - по направлению к клеточной мембране или плазматической мембране клетки.
Внешняя ( цитозольная ) поверхность RER усеяна рибосомами , которые являются местами синтеза белка . RER особенно заметен в таких клетках, как гепатоциты . В SER отсутствуют рибосомы, и он участвует в синтезе липидов , но не в метаболизме , выработке стероидных гормонов и детоксикации . [1] SER особенно распространен в клетках печени и гонад млекопитающих .
ЭР наблюдал с помощью световой микроскопии Гарнье в 1897 году, который ввел термин эргастоплазма . [2] [3] Кружевные мембраны эндоплазматической сети были впервые обнаружены с помощью электронной микроскопии в 1945 году Китом Р. Портером , Альбертом Клодом и Эрнестом Ф. Фулламом. [4] Позже слово reticulum , что означает «сеть», было применено Портером в 1953 году для описания этой мембранной ткани. [5]
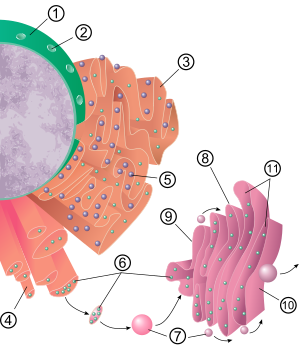

Общая структура эндоплазматической сети представляет собой сеть мембран, называемых цистернами . Эти мешкообразные структуры удерживаются вместе цитоскелетом . Фосфолипидная мембрана окружает цистернальное пространство (или просвет), которое является продолжением перинуклеарного пространства , но отделено от цитозоля . Функции эндоплазматического ретикулума можно резюмировать как синтез и экспорт белков и мембранных липидов, но они варьируются в зависимости от ЭР, типа клеток и функции клеток. Количество как шероховатой, так и гладкой эндоплазматической сети в клетке может медленно меняться от одного типа к другому в зависимости от меняющейся метаболической активности клетки. Трансформация может включать встраивание новых белков в мембрану, а также структурные изменения. Изменения содержания белка могут происходить без заметных структурных изменений. [6] [7]
Поверхность шероховатой эндоплазматической сети (часто сокращенно RER или шероховатой ER ; также называемая гранулярной эндоплазматической сетью ) усеяна рибосомами, производящими белок, что придает ей «шероховатый» вид (отсюда и название). [8] Местом связывания рибосомы на шероховатой эндоплазматической сети является транслокон . [9] Однако рибосомы не являются стабильной частью структуры этой органеллы, поскольку они постоянно связываются и высвобождаются из мембраны. Рибосома связывается с RER только после того, как в цитозоле образуется специфический комплекс белок-нуклеиновая кислота. Этот специальный комплекс образуется, когда свободная рибосома начинает транслировать мРНК белка , предназначенного для секреторного пути . [10] Первые 5–30 полимеризованных аминокислот кодируют сигнальный пептид , молекулярное послание, которое распознается и связывается частицей распознавания сигнала (SRP). Трансляция приостанавливается, и рибосомный комплекс связывается с транслоконом RER , где трансляция продолжается с образованием зарождающегося (нового) белка в просвете и/или мембране RER. Белок обрабатывается в просвете ЭР ферментом (сигнальной пептидазой ), который удаляет сигнальный пептид. Рибосомы в этот момент могут высвободиться обратно в цитозоль; однако известно, что нетранслирующие рибосомы остаются связанными с транслоконами. [11]
Мембрана шероховатой эндоплазматической сети представляет собой большие двухмембранные листы, расположенные вблизи наружного слоя ядерной оболочки и продолжающие его . [12] Листы двойной мембраны укладываются и соединяются через несколько правосторонних или левых спиральных пандусов, «пандусов Терасаки», в результате чего образуется конструкция, напоминающая гараж . [13] [14] Хотя между эндоплазматической сетью и аппаратом Гольджи нет непрерывной мембраны , мембраносвязанные транспортные везикулы переносят белки между этими двумя отсеками. [15] Везикулы окружены покрывающими белками, называемыми COPI и COPII. COPII нацеливает пузырьки на аппарат Гольджи, а COPI маркирует их возвращение в шероховатый эндоплазматический ретикулум. Шероховатая эндоплазматическая сеть работает совместно с комплексом Гольджи , направляя новые белки по назначению. Второй метод транспорта из эндоплазматической сети включает в себя области, называемые сайтами контакта с мембраной , где мембраны эндоплазматической сети и других органелл удерживаются близко друг к другу, что позволяет переносить липиды и другие небольшие молекулы. [16] [17]
Шероховатая эндоплазматическая сеть играет ключевую роль во многих функциях :

В большинстве клеток гладкая эндоплазматическая сеть (сокращенно SER ) отсутствует. Вместо этого есть области, где ЭР частично гладкий, а частично шероховатый, эта область называется переходным ЭР. Переходный ЭР получил свое название потому, что содержит места выхода ЭР. Это области, где транспортные везикулы, содержащие липиды и белки, образующиеся в ЭР, отделяются от ЭР и начинают двигаться к аппарату Гольджи . Специализированные клетки могут иметь много гладкой эндоплазматической сети, и в этих клетках гладкая ЭР выполняет множество функций. [6] Он синтезирует липиды , фосфолипиды , [18] [19] [20] и стероиды . Клетки, секретирующие эти продукты, например клетки семенников , яичников и сальных желез, имеют обилие гладкой эндоплазматической сети. [21] Он также осуществляет метаболизм углеводов, детоксикацию продуктов естественного метаболизма, а также алкоголя и наркотиков, прикрепление рецепторов к белкам клеточной мембраны и метаболизм стероидов . [22] В мышечных клетках он регулирует концентрацию ионов кальция . Гладкая эндоплазматическая сеть встречается во многих типах клеток (как животных, так и растений) и в каждом из них выполняет разные функции. Гладкая эндоплазматическая сеть также содержит фермент глюкозо-6-фосфатазу , которая превращает глюкозо-6-фосфат в глюкозу, что является этапом глюконеогенеза . Он связан с ядерной оболочкой и состоит из канальцев, расположенных вблизи периферии клетки. Эти трубочки иногда разветвляются, образуя сеть сетчатого вида. [12] В некоторых клетках имеются расширенные участки, подобные мешочкам грубой эндоплазматической сети. Сеть гладкой эндоплазматической сети позволяет увеличить площадь поверхности, отведенную для действия или хранения ключевых ферментов и продуктов этих ферментов. [ нужна цитата ]

Саркоплазматический ретикулум (СР), от греческого σάρξ sarx («плоть»), представляет собой гладкий ЭР, обнаруженный в мышечных клетках . Единственное структурное различие между этой органеллой и гладкой эндоплазматической сетью — это состав белков, которые они имеют, как связанных с их мембранами, так и дрейфующих в пределах их просветов. Это фундаментальное различие указывает на их функции: эндоплазматический ретикулум синтезирует молекулы, а саркоплазматический ретикулум хранит ионы кальция и выкачивает их в саркоплазму при стимуляции мышечного волокна. [23] [24] После выхода из саркоплазматического ретикулума ионы кальция взаимодействуют с сократительными белками, которые используют АТФ для укорачивания мышечного волокна. Саркоплазматический ретикулум играет важную роль в соединении возбуждения и сокращения . [25]
Эндоплазматическая сеть выполняет множество общих функций, включая сворачивание белковых молекул в мешочки, называемые цистернами , и транспорт синтезированных белков в везикулах к аппарату Гольджи . Шероховатая эндоплазматическая сеть также участвует в синтезе белка. Правильная укладка вновь созданных белков становится возможной благодаря нескольким белкам -шаперонам эндоплазматического ретикулума , включая протеиндисульфидизомеразу (PDI), ERp29, члена семейства Hsp70 BiP/Grp78 , кальнексина , кальретикулина и семейства пептидилпролилизомераз. Только правильно свернутые белки транспортируются из шероховатого ЭР в аппарат Гольджи — развернутые белки вызывают реакцию развернутого белка как реакцию на стресс в ЭР. Нарушения окислительно-восстановительной регуляции, регуляции кальция, депривация глюкозы и вирусная инфекция [26] или сверхэкспрессия белков [27] могут привести к реакции на стресс эндоплазматического ретикулума (стресс ER), состоянию, при котором сворачивание белков замедляется, что приводит к к увеличению развернутых белков . Этот стресс становится потенциальной причиной повреждений при гипоксии/ишемии, резистентности к инсулину и других расстройствах. [28]
Секреторные белки, в основном гликопротеины , перемещаются через мембрану эндоплазматического ретикулума. Белки, которые транспортируются эндоплазматической сетью по клетке, помечены адресной меткой, называемой сигнальной последовательностью . N-конец (один конец) полипептидной цепи (т.е. белка) содержит несколько аминокислот , которые действуют как адресная метка и удаляются, когда полипептид достигает места назначения. Возникающие пептиды достигают ЭР через транслокон , встроенный в мембрану мультипротеиновый комплекс. Белки, предназначенные для мест за пределами эндоплазматической сети, упаковываются в транспортные пузырьки и перемещаются по цитоскелету к месту назначения. В фибробластах человека ЭР всегда сораспределен с микротрубочками, и деполимеризация последних вызывает его коагрегацию с митохондриями, которые также связаны с ЭР. [29]
Эндоплазматическая сеть также является частью пути сортировки белков. По сути, это транспортная система эукариотической клетки. Большинство его резидентных белков удерживаются внутри него посредством мотива удержания . Этот мотив состоит из четырех аминокислот в конце белковой последовательности. Наиболее распространенными удерживающими последовательностями являются KDEL для белков, расположенных в просвете, и KKXX для трансмембранных белков. [30] Однако вариации KDEL и KKXX действительно встречаются, и другие последовательности также могут вызывать задержку эндоплазматического ретикулума. Неизвестно, могут ли такие изменения привести к локализации суб-ER. В клетках млекопитающих имеется три рецептора KDEL ( 1 , 2 и 3 ), и они имеют очень высокую степень идентичности последовательностей. Функциональные различия между этими рецепторами еще предстоит установить. [31]

Эндоплазматический ретикулум не содержит механизма регенерации АТФ и, следовательно, требует импорта АТФ из митохондрий. Импортированный АТФ жизненно важен для выполнения ЭР своих домашних клеточных функций, таких как сворачивание и транспортировка белков. [32]
Транспортер АТФ в ЭР, SLC35B1/AXER, был недавно клонирован и охарактеризован [33] , а митохондрии доставляют АТФ в ЭР посредством Ca 2+ -антагонизированного транспорта в ЭР ( CaATiER ). [34] Механизм CaATiER демонстрирует чувствительность к цитозольному Ca 2+ в диапазоне от высоких нМ до низких мкМ, при этом Ca 2+ -чувствительный элемент еще не идентифицирован и не подтвержден. [ нужна цитата ]
Повышенный и супрафизиологический стресс ЭР в β-клетках поджелудочной железы нарушает нормальную секрецию инсулина, что приводит к гиперинсулинемии [35] и, следовательно, к периферической резистентности к инсулину, связанной с ожирением у людей. [36] Клинические испытания на людях также показали причинную связь между увеличением секреции инсулина, вызванным ожирением, и периферической резистентностью к инсулину. [37]
Нарушения XBP1 приводят к усилению стрессовой реакции эндоплазматического ретикулума и впоследствии вызывают более высокую восприимчивость к воспалительным процессам, которые могут даже способствовать развитию болезни Альцгеймера . [38] В толстой кишке аномалии XBP1 связаны с воспалительными заболеваниями кишечника, включая болезнь Крона . [39]
Ответ развернутого белка (UPR) представляет собой клеточную реакцию на стресс , связанную с эндоплазматической сетью. [40] UPR активируется в ответ на накопление развернутых или неправильно свернутых белков в просвете эндоплазматической сети. Функция UPR восстанавливает нормальную функцию клетки, останавливая трансляцию белков , разрушая неправильно свернутые белки и активируя сигнальные пути, которые приводят к увеличению выработки молекулярных шаперонов , участвующих в сворачивании белков . Устойчивая сверхактивация UPR связана с прионовыми заболеваниями, а также с некоторыми другими нейродегенеративными заболеваниями , и ингибирование UPR может стать методом лечения этих заболеваний. [41]