
Наследственный раковый синдром ( семейный/семейный раковый синдром , наследственный раковый синдром , синдром предрасположенности к раку , раковый синдром и т. д.) — это генетическое заболевание , при котором наследственные генетические мутации в одном или нескольких генах предрасполагают пораженных лиц к развитию рака и могут также вызывать раннее начало этих видов рака. Наследственные раковые синдромы часто показывают не только высокий пожизненный риск развития рака, но и развитие множественных независимых первичных опухолей . [1]
Многие из этих синдромов вызваны мутациями в генах-супрессорах опухолей , генах, которые участвуют в защите клетки от превращения в раковую. Другие гены, которые могут быть затронуты, это гены репарации ДНК , онкогены и гены, участвующие в производстве кровеносных сосудов ( ангиогенез ). [2] Распространенными примерами наследственных раковых синдромов являются наследственный синдром рака груди и яичников и наследственный неполипозный рак толстой кишки (синдром Линча). [3] [4]
Наследственные раковые синдромы лежат в основе от 5 до 10% всех видов рака, и существует более 50 идентифицируемых наследственных форм рака. [5] Научное понимание синдромов восприимчивости к раку активно расширяется: обнаруживаются дополнительные синдромы, [6] лежащая в их основе биология становится яснее, а генетическое тестирование улучшает обнаружение, лечение и профилактику раковых синдромов. [7] Учитывая распространенность рака молочной железы и толстой кишки, наиболее широко признанными синдромами являются наследственный синдром рака молочной железы и яичников и наследственный неполипозный рак толстой кишки (синдром Линча). [6]
Некоторые редкие виды рака тесно связаны с наследственными синдромами предрасположенности к раку. Генетическое тестирование следует проводить при адренокортикальной карциноме ; карциноидных опухолях ; диффузном раке желудка ; раке фаллопиевой трубы/первичном брюшинном раке ; лейомиосаркоме ; медуллярном раке щитовидной железы ; параганглиоме /феохромоцитоме; почечноклеточной карциноме хромофобной, гибридной онкоцитарной или онкоцитомной гистологии; карциноме сальных желез ; и опухолях полового тяжа с кольцевыми канальцами. [6] Врачи первичной медико-санитарной помощи могут определить людей, которые подвержены риску наследственного синдрома рака. [8]
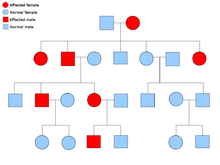
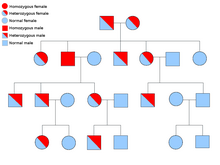
Две копии каждого гена присутствуют во всех клетках организма, и каждая из них называется аллелем . Большинство раковых синдромов передаются менделевским аутосомно -доминантным способом. В этих случаях для того, чтобы у человека была предрасположенность к раку, достаточно присутствия только одного дефектного аллеля. Индивидуумы с одним нормальным аллелем и одним дефектным аллелем известны как гетерозиготные . Гетерозиготный индивидуум и человек с двумя нормальными аллелями ( гомозиготный ) будут иметь 50% шанс родить больного ребенка. [9] Мутация в унаследованном гене известна как мутация зародышевой линии , а дальнейшая мутация в нормальном аллеле приводит к развитию рака. Это известно как гипотеза двух ударов Кнудсона , где первый удар гена является унаследованной мутацией, а второй удар происходит позже в жизни. [2] Поскольку мутация требуется только для одного аллеля (по сравнению с мутацией обоих при так называемых «спорадических видах рака»), у человека вероятность развития рака выше, чем у населения в целом. [10]
Реже синдромы могут передаваться как аутосомно-рецессивный признак. Оба аллеля гена должны быть мутированы при аутосомно-рецессивных расстройствах, чтобы у человека была предрасположенность к раку. Человек с двумя рецессивными аллелями известен как гомозиготный рецессивный . У обоих родителей должен быть по крайней мере один дефектный аллель, чтобы ребенок был гомозиготным рецессивным. Если у обоих родителей есть один мутантный аллель и один нормальный аллель ( гетерозиготный ), то у них есть 25% шанс произвести гомозиготного рецессивного ребенка (имеет предрасположенность), 50% шанс произвести гетерозиготного ребенка (носитель дефектного гена) и 25% шанс произвести ребенка с двумя нормальными аллелями. [9]
Примерами аутосомно-доминантных раковых синдромов являются аутоиммунный лимфопролиферативный синдром (синдром Канале-Смита), синдром Беквита-Видеманна (хотя 85% случаев являются спорадическими), [ требуется ссылка ] синдром Бирта-Хогга-Дюбе , синдром Карни , семейная хордома , синдром Коудена , синдром диспластического невуса с семейной меланомой , семейный аденоматозный полипоз , синдром наследственного рака молочной железы и яичников , наследственный диффузный рак желудка (HDGC), наследственный неполипозный колоректальный рак (синдром Линча), синдром Хауэла-Эванса рака пищевода с каллозом , синдром ювенильного полипоза , синдром Ли-Фраумени , множественная эндокринная неоплазия типа 1/2, множественный остеохондроматоз , нейрофиброматоз типа 1/2, синдром невоидной базальноклеточной карциномы (синдром Горлина), синдром Пейтца-Егерса , семейный рак предстательной железы , наследственный лейомиоматозный почечноклеточный рак (LRCC), наследственный папиллярный почечноклеточный рак , наследственный синдром параганглиомы -феохромоцитомы, ретинобластома , туберозный склероз , болезнь фон Гиппеля-Линдау и опухоль Вильмса . [11]
Примерами аутосомно-рецессивных раковых синдромов являются атаксия-телеангиэктазия , синдром Блума , анемия Фанкони , полипоз, связанный с MUTYH, синдром Ротмунда-Томсона , синдром Вернера и пигментная ксеродерма . [11]
Хотя раковые синдромы демонстрируют повышенный риск рака, риск варьируется. Для некоторых из этих заболеваний рак не является их основным признаком. [ необходима цитата ]
Анемия Фанкони — это заболевание с широким клиническим спектром, включающим: раннее начало и повышенный риск развития рака; недостаточность костного мозга ; и врожденные аномалии . Наиболее выраженные проявления этого заболевания связаны с кроветворением (выработкой крови костным мозгом ); к ним относятся апластическая анемия , миелодиспластический синдром и острый миелоидный лейкоз . Опухоли печени и плоскоклеточный рак пищевода , ротоглотки и язычка — это солидные опухоли, обычно связанные с ФА. Врожденные аномалии включают: аномалии скелета (особенно те, которые поражают руки), пятна цвета кофе с молоком и гипопигментацию . На сегодняшний день известны следующие гены, вызывающие FA: FANCA , FANCB , FANCC , FANCD2 , FANCE , FANCF , FANCG , FANCI , FANCJ , FANCL , FANCM , FANCN , FANCO , FANCP и BRCA2 (ранее известный как FANCD1). Наследование этого синдрома в основном аутосомно-рецессивное , но FANCB может быть унаследован от материнской или отцовской X-хромосомы ( рецессивное наследование, сцепленное с X-хромосомой ). Путь FA участвует в репарации ДНК, когда две нити ДНК неправильно соединены ( межцепочечные сшивки ). Многие пути координируются путем FA для этого, включая репарацию нуклеотидов , синтез транслезиона и гомологичную рекомбинацию . [12] [13] [14] [15] [16]
Семейный аденоматозный полипоз (FAP) — это аутосомно-доминантный синдром, который значительно увеличивает риск колоректального рака . Примерно у 1 из 8000 человек будет это заболевание, и оно имеет приблизительно 100% пенетрантность . У человека с этим заболеванием будут сотни или тысячи доброкачественных аденом по всей толстой кишке , которые в большинстве случаев прогрессируют в рак. Другие опухоли, частота которых увеличилась, включают: остеомы , аденомы и карциномы надпочечников , опухоли щитовидной железы и десмоидные опухоли . Причиной этого расстройства является мутировавший ген APC , который участвует в регуляции β-катенина . Неисправный APC заставляет β-катенин накапливаться в клетках и активировать факторы транскрипции, участвующие в пролиферации клеток , миграции , дифференцировке и апоптозе (запрограммированная гибель клеток). [17] [18] [19]
Синдром наследственного рака груди и яичников является аутосомно-доминантным генетическим заболеванием , вызванным генетическими мутациями генов BRCA1 и BRCA2 . У женщин это заболевание в первую очередь увеличивает риск рака груди и яичников , но также увеличивает риск карциномы фаллопиевой трубы и папиллярной серозной карциномы брюшины. У мужчин увеличивается риск рака предстательной железы . Другие виды рака, которые непоследовательно связаны с этим синдромом, — это рак поджелудочной железы , рак мужской груди , колоректальный рак и рак матки и шейки матки . Генетические мутации составляют приблизительно 7% и 14% случаев рака груди и яичников соответственно, а BRCA1 и BRCA2 составляют 80% этих случаев. BRCA1 и BRCA2 являются генами-супрессорами опухолей, участвующими в поддержании и восстановлении ДНК, что, в свою очередь, приводит к нестабильности генома. Мутации в этих генах допускают дальнейшее повреждение ДНК, что может привести к раку. [20] [21]
Наследственный неполипозный рак толстой кишки , также известный как синдром Линча, является аутосомно-доминантным раковым синдромом, который увеличивает риск развития колоректального рака. Он вызван генетическими мутациями в генах репарации несоответствий ДНК (MMR), в частности MLH1 , MSH2 , MSH6 и PMS2 . Помимо колоректального рака, частота многих других видов рака увеличивается. К ним относятся: рак эндометрия , рак желудка , рак яичников , рак тонкой кишки и рак поджелудочной железы . Наследственный неполипозный рак толстой кишки также связан с ранним началом колоректального рака. Гены MMR участвуют в восстановлении ДНК, когда основания на каждой нити ДНК не совпадают. Дефектные гены MMR допускают непрерывные мутации вставки и делеции в областях ДНК, известных как микросателлиты . Эти короткие повторяющиеся последовательности ДНК становятся нестабильными, что приводит к состоянию нестабильности микросателлитов (MSI). Мутировавшие микросателлиты часто обнаруживаются в генах, участвующих в возникновении и развитии опухолей, а MSI может повышать выживаемость клеток, что приводит к раку. [4] [22] [23] [24]
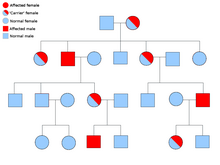
Большинство случаев семейной параганглиомы вызваны мутациями в генах субъединицы сукцинатдегидрогеназы (сукцинат:убихиноноксидоредуктазы) ( SDHD , SDHAF2 , SDHC , SDHB ).
PGL-1 связан с мутацией SDHD, и большинство людей с параганглиомой PGL-1 имеют пораженных отцов, а не пораженных матерей. PGL1 и PGL2 являются аутосомно-доминантными с импринтингом . PGL-4 связан с мутацией SDHB и связан с более высоким риском феохромоцитомы, а также рака почечных клеток и немедуллярного рака щитовидной железы. [25]
Синдром Ли-Фраумени — это аутосомно-доминантный синдром, в первую очередь вызванный мутациями в гене TP53 , что значительно увеличивает риск многих видов рака, а также тесно связано с ранним началом этих видов рака. Рак, связанный с этим расстройством, включает: саркомы мягких тканей (часто обнаруживаемые в детстве), остеосаркому , рак молочной железы , рак мозга , лейкемию и адренокортикальную карциному . У людей с синдромом Ли-Фраумени часто бывает несколько независимых первичных видов рака. Причина большого клинического спектра этого расстройства может быть связана с другими мутациями генов, которые изменяют течение заболевания. Белок, вырабатываемый геном TP53 , p53, участвует в остановке клеточного цикла , восстановлении ДНК и апоптозе . Дефектный p53 может быть не в состоянии должным образом выполнять эти процессы, что может быть причиной образования опухолей. Поскольку только у 60–80 % людей с этим расстройством обнаруживаются мутации в гене TP53 , другие мутации в пути p53 могут быть связаны с синдромом Ли-Фраумени. [26] [27] [28] [29] Людям с синдромом Ли-Фраумени необходимо пожизненное интенсивное обследование для раннего выявления рака. [30] Более подробную информацию см . в разделе Синдром Ли-Фраумени .
MUTYH-ассоциированный полипоз разделяет большинство своих клинических признаков с FAP; разница в том, что это аутосомно-рецессивное заболевание, вызванное мутациями в гене репарации ДНК MUTYH . Опухоли с повышенным риском при этом заболевании - колоректальный рак, аденомы желудка и аденомы двенадцатиперстной кишки. [17] [31]

Синдром невоидной базальноклеточной карциномы , также известный как синдром Горлина, является аутосомно-доминантным раковым синдромом, при котором риск базальноклеточной карциномы очень высок. Заболевание характеризуется базальноклеточными невусами , кератокистами челюсти и скелетными аномалиями. Оценки распространенности синдрома невоидной базальноклеточной карциномы варьируются, но составляют примерно 1 на 60000. Наличие базальноклеточной карциномы намного выше у белых, чем у черных людей; 80% и 38% соответственно. Одонтогенные кератокисты обнаруживаются примерно у 75% людей с этим заболеванием и часто возникают в раннем возрасте. Наиболее распространенные скелетные аномалии возникают на голове и лице, но часто поражаются и другие области, такие как грудная клетка . Причинная генетическая мутация этого заболевания происходит в гене PTCH , а продукт PTCH является супрессором опухоли, участвующим в клеточной сигнализации . Хотя точная роль этого белка в синдроме невоидной базальноклеточной карциномы неизвестна, он участвует в сигнальном пути hedgehog , который, как известно, контролирует рост и развитие клеток . [32] [33]
Болезнь фон Гиппеля–Линдау — редкое аутосомно-доминантное генетическое заболевание, которое предрасполагает людей к доброкачественным и злокачественным опухолям. Наиболее распространенными опухолями при болезни фон Гиппеля–Линдау являются гемангиобластомы центральной нервной системы и сетчатки, светлоклеточные почечные карциномы, феохромоцитомы, нейроэндокринные опухоли поджелудочной железы, кисты поджелудочной железы, опухоли эндолимфатического мешка и папиллярные цистаденомы придатка яичка. [34] [35] Болезнь фон Гиппеля–Линдау возникает в результате мутации в гене-супрессоре опухолей фон Гиппеля–Линдау на хромосоме 3p25.3. [36]
Пигментная ксеродерма — это аутосомно-рецессивное заболевание, характеризующееся чувствительностью к ультрафиолетовому (УФ) свету , значительно повышенным риском солнечных ожогов и повышенным риском рака кожи . Риск рака кожи более чем в 10000 раз выше, чем у обычных людей, и включает в себя многие типы рака кожи, включая меланому и немеланомный рак кожи. Кроме того, подверженные воздействию солнца участки языка, губ и глаз имеют повышенный риск стать раковыми. Пигментная ксеродерма может быть связана с другими внутренними раковыми заболеваниями и доброкачественными опухолями. [ необходима цитата ] Помимо рака, некоторые генетические мутации , вызывающие пигментную ксеродерму, связаны с нейродегенерацией . Пигментная ксеродерма может быть вызвана генетическими мутациями в 8 генах, которые производят следующие ферменты : XPA , XPB , XPC , XPD , XPE , XPF , XPG и Pol η . XPA-XPF — это ферменты эксцизионной репарации нуклеотидов , которые восстанавливают поврежденную УФ-светом ДНК, а дефектные белки позволяют накапливаться мутациям, вызванным УФ-светом. Pol η — это полимераза , которая является ферментом, участвующим в репликации ДНК. Существует много полимераз, но pol η — это фермент, который реплицирует поврежденную УФ-светом ДНК. Мутации в этом гене приведут к образованию дефектного фермента pol η, который не может реплицировать ДНК с повреждением УФ-светом. У людей с мутациями этого гена есть подмножество XP; заболевание XP-варианта. [37] [38]
Многие раковые синдромы обусловлены наследственным нарушением способности к восстановлению ДНК . [ необходима цитата ] Когда наследственная мутация присутствует в гене репарации ДНК, ген репарации либо не будет экспрессироваться, либо будет экспрессироваться в измененной форме. Тогда функция восстановления, вероятно, будет неполноценной, и, как следствие, повреждения ДНК будут иметь тенденцию к накоплению. Такие повреждения ДНК могут вызывать ошибки во время синтеза ДНК, приводящие к мутациям, некоторые из которых могут привести к раку. Мутации репарации ДНК зародышевой линии, которые увеличивают риск рака, перечислены в таблице.
Генетическое тестирование может использоваться для выявления мутировавших генов или хромосом , которые передаются из поколения в поколение. Люди, у которых положительный результат теста на наличие генетической мутации, не обязательно обречены на развитие рака, связанного с мутацией, однако они имеют повышенный риск развития рака по сравнению с общей популяцией. Людям рекомендуется пройти генетический тест, если в их семейной истории болезни есть: несколько членов семьи с раком, кто-то в их семье заболел раком в особенно молодом возрасте или являясь частью определенной этнической группы . [7]

Процесс генетического скрининга — простая, неинвазивная процедура. Однако перед тем, как гены будут проверены на мутации, пациент обычно должен обратиться к врачу и пройти индивидуальную консультацию , где они обсуждают как личную, так и семейную историю рака. Затем медицинский работник может оценить вероятность наличия у пациента мутации и провести его через процесс, который является генетическим скринингом. [66] Важно, чтобы эта консультация состоялась, поскольку она гарантирует, что человек дает осознанное согласие на участие в генетическом тестировании, знает и понимает этапы, преимущества и ограничения процедуры и лучше осведомлен о последствиях результатов теста на слух. [67] Тест может быть проведен с использованием биологических жидкостей или клеток пациента, включая: кровь (что является наиболее распространенным), слюну, амниотическую жидкость и даже клетки из внутренней части рта, полученные из буккального мазка . Затем этот материал отправляется в специализированную генетическую лабораторию, где его изучат специалисты, результаты теста отправляются обратно врачу, который запросил анализ, и результаты обсуждаются с пациентом. [7]
Тестирование напрямую у потребителя можно получить без медицинского специалиста, но это не рекомендуется, поскольку потребитель теряет возможность обсудить свое решение с образованным специалистом. [68] По данным Национальной медицинской библиотеки США, генетическое тестирование в Америке стоит от 100 до 2000 долларов в зависимости от типа и сложности теста. [69]
Генетическое тестирование важно, поскольку, если результат теста положительный, люди становятся более осведомленными о своем собственном здоровье и здоровье своих ближайших родственников. [70] С помощью и советом медицинского специалиста они могут предпринять шаги для снижения повышенного риска развития рака с помощью:
Существуют и другие формы профилактических действий, примером для наследственного рака груди и яичников может быть хирургическое вмешательство: гистерэктомия — это удаление всей или части матки , тогда как мастэктомия — это удаление груди ( двойная мастэктомия означает, что удаляются обе груди), это часто может добавить годы к ожидаемой продолжительности жизни . [72] Еще одной профилактической мерой является регулярный скрининг рака и осмотры. Если у человека синдром Линча , то ему следует регулярно проходить колоноскопию, чтобы проверить, есть ли какие-либо изменения в клетках, выстилающих стенку кишечника, регулярные осмотры связаны с дополнительными 7 годами к ожидаемой продолжительности жизни в среднем для человека с синдромом Линча. Это связано с тем, что раннее обнаружение означает правильные профилактические действия и возможность проведения операции быстрее. [73] Регулярный скрининг груди также рекомендуется женщинам, у которых диагностированы мутации BRCA , а также недавние исследования показывают, что мужчины с повышенным риском развития рака простаты из-за мутаций BRCA могут снизить свой риск, принимая аспирин . [74] Аспирин чрезвычайно полезен для снижения заболеваемости раком; однако, чтобы получить какой-либо эффект, его необходимо принимать регулярно в течение как минимум пяти лет. [75]
Часто генетические мутации более распространены в определенных этнических группах, это связано с тем, что раса может отследить своих предков до одного географического местоположения, мутировавшие гены затем передаются от предков через поколения, поэтому некоторые этнические группы более восприимчивы к мутациям, тем самым увеличивая их шансы заболеть раком [61]. Как упоминалось выше, это может быть полезно, поскольку может помочь медицинским работникам оценить риск наличия мутации у пациента до того, как он пройдет тестирование. [66] Синдром Вернера имеет распространенность 1 на 200 000 живорождений в США, но он поражает людей в Японии в 1 из 20 000-40 000 случаев. [76] У 1 из 40 евреев-ашкенази есть мутация BRCA, это огромный контраст по сравнению с общей популяцией в Соединенных Штатах, где поражен 1 из 400 человек. Евреи-ашкенази подвержены высокому риску развития наследственного рака груди и яичников, поэтому им рекомендуется проходить как генетическое тестирование, чтобы определить, есть ли у них мутация, так и регулярный скрининг на рак. [77]