В химии константа диссоциации кислоты (также известная как константа кислотности или константа кислотной ионизации ; обозначается ) является количественной мерой силы кислоты в растворе . Это константа равновесия для химической реакции
известная как диссоциация в контексте кислотно-основных реакций . Химический вид HA представляет собой кислоту , которая диссоциирует на A − , называемую сопряженным основанием кислоты, и ион водорода , H + . [a] Система считается находящейся в равновесии , когда концентрации ее компонентов не изменяются со временем, поскольку как прямая, так и обратная реакции происходят с одинаковой скоростью. [1]
Константа диссоциации определяется как [b]
где величины в квадратных скобках представляют молярные концентрации видов в равновесии. [c] [2] Например, гипотетическая слабая кислота, имеющая K a = 10 −5 , значение log K a является показателем (−5), что дает p K a = 5. Для уксусной кислоты K a = 1,8 x 10 −5 , поэтому p K a составляет около 5. Более высокое значение K a соответствует более сильной кислоте (кислоте, которая более диссоциирована в равновесии). Форма p K a часто используется, поскольку она обеспечивает удобную логарифмическую шкалу , где более низкое значение p K a соответствует более сильной кислоте.
Константа диссоциации кислоты является прямым следствием лежащей в основе термодинамики реакции диссоциации; значение p K a прямо пропорционально стандартному изменению свободной энергии Гиббса для реакции. Значение p K a изменяется с температурой и может быть качественно понято на основе принципа Ле Шателье : когда реакция эндотермическая , K a увеличивается, а p K a уменьшается с ростом температуры; для экзотермических реакций справедливо обратное .
Значение p K a также во многом зависит от молекулярной структуры кислоты. Например, Полинг предложил два правила: одно для последовательных p K a полипротонных кислот (см. Полипротонные кислоты ниже), и одно для оценки p K a оксикислот на основе числа групп =O и −OH (см. Факторы, влияющие на значения pKa ниже). Другие структурные факторы, влияющие на величину константы диссоциации кислоты, включают индуктивные эффекты , мезомерные эффекты и водородные связи . Уравнения типа Гаммета часто применялись для оценки p K a . [3] [4]
Количественное поведение кислот и оснований в растворе можно понять, только если известны их значения p K a . В частности, pH раствора можно предсказать, если известны аналитическая концентрация и значения p K a всех кислот и оснований; и наоборот, можно рассчитать равновесную концентрацию кислот и оснований в растворе, если известен pH. Эти расчеты находят применение во многих различных областях химии, биологии, медицины и геологии. Например, многие соединения, используемые в медицине, являются слабыми кислотами или основаниями, и знание значений p K a вместе с коэффициентом распределения октанол-вода может быть использовано для оценки степени, в которой соединение попадает в кровоток. Константы диссоциации кислот также важны в водной химии и химической океанографии , где кислотность воды играет фундаментальную роль. В живых организмах кислотно-щелочной гомеостаз и кинетика ферментов зависят от значений p K a многих кислот и оснований, присутствующих в клетке и в организме. В химии знание значений p K a необходимо для приготовления буферных растворов , а также является предпосылкой для количественного понимания взаимодействия кислот или оснований с ионами металлов с образованием комплексов . Экспериментально значения p K a можно определить с помощью потенциометрического (pH) титрования , но для значений p K a менее 2 или более 11 могут потребоваться спектрофотометрические или ЯМР- измерения из-за практических трудностей с измерениями pH.
Согласно первоначальному молекулярному определению Аррениуса , кислота — это вещество, которое диссоциирует в водном растворе, выделяя ион водорода H + (протон): [5]
Константа равновесия для этой реакции диссоциации известна как константа диссоциации . Освобожденный протон соединяется с молекулой воды, образуя ион гидроксония (или оксония) H 3 O + (голые протоны не существуют в растворе), и поэтому Аррениус позже предложил записать диссоциацию как кислотно-основную реакцию :
Бренстед и Лоури обобщили это далее до реакции обмена протонами: [6] [7] [8]
Кислота теряет протон, оставляя сопряженное основание; протон переносится к основанию, создавая сопряженную кислоту. Для водных растворов кислоты HA основанием является вода; сопряженное основание — A − , а сопряженная кислота — ион гидроксония. Определение Бренстеда–Лоури применимо и к другим растворителям, таким как диметилсульфоксид : растворитель S действует как основание, принимая протон и образуя сопряженную кислоту SH + .
В химии растворов принято использовать H + как аббревиатуру для сольватированного иона водорода, независимо от растворителя. В водном растворе H + обозначает сольватированный ион гидроксония, а не протон. [9] [10]
Обозначение кислоты или основания как «конъюгата» зависит от контекста. Сопряженная кислота BH + основания B диссоциирует согласно
что является обратным равновесию
Гидроксидный ион OH − , хорошо известное основание, здесь действует как сопряженное основание кислой воды. Кислоты и основания, таким образом, рассматриваются просто как доноры и акцепторы протонов соответственно.
Более широкое определение кислотной диссоциации включает гидролиз , при котором протоны производятся путем расщепления молекул воды. Например, борная кислота ( B(OH) 3 ) производит H3O +, как если бы она была донором протонов, [11] но было подтверждено Рамановской спектроскопией , что это происходит из-за равновесия гидролиза: [12]
Аналогично гидролиз ионов металлов приводит к тому, что ионы, такие как [Al(H 2 O) 6 ] 3+, ведут себя как слабые кислоты: [13]
Согласно первоначальному определению Льюиса , кислота — это вещество, которое принимает электронную пару для образования координационной ковалентной связи . [14]
Константа диссоциации кислоты является частным примером константы равновесия . Диссоциация монопротонной кислоты , HA, в разбавленном растворе может быть записана как
Термодинамическая константа равновесия может быть определена как [15]
где представляет собой активность , в равновесии, химического вида X. является безразмерной , поскольку активность безразмерна. Активности продуктов диссоциации помещены в числитель, активности реагентов помещены в знаменатель. См. коэффициент активности для вывода этого выражения.

Поскольку активность является произведением концентрации и коэффициента активности ( γ ), определение можно также записать как
где представляет собой концентрацию ГК, а — частное коэффициентов активности.
Чтобы избежать осложнений, связанных с использованием активностей, константы диссоциации определяются , где это возможно, в среде с высокой ионной силой , то есть в условиях, в которых можно считать всегда постоянным. [15] Например, среда может представлять собой раствор 0,1 молярного (М) нитрата натрия или 3 М перхлората калия . При таком предположении
получено. Обратите внимание, однако, что все опубликованные значения константы диссоциации относятся к конкретной ионной среде, используемой при их определении, и что разные значения получаются при разных условиях, как показано для уксусной кислоты на иллюстрации выше. Когда опубликованные константы относятся к ионной силе, отличной от той, которая требуется для конкретного применения, их можно скорректировать с помощью теории конкретных ионов (SIT) и других теорий. [16]
Константа кумулятивного равновесия, обозначаемая , связана с произведением ступенчатых констант, обозначаемых Для двухосновной кислоты соотношение между ступенчатыми и общими константами выглядит следующим образом:
Обратите внимание, что в контексте образования комплексов металл-лиганд константы равновесия для образования комплексов металлов обычно определяются как константы ассоциации . В этом случае константы равновесия для протонирования лиганда также определяются как константы ассоциации. Нумерация констант ассоциации обратна нумерации констант диссоциации; в этом примере
При обсуждении свойств кислот константы равновесия обычно указываются как константы диссоциации кислот, обозначаемые K a , а числовые значения обозначаются символом p K a .
С другой стороны, для баз используются константы ассоциации.
Однако универсальные компьютерные программы , которые используются для получения значений констант равновесия из экспериментальных данных, используют константы ассоциации как для кислот, так и для оснований. Поскольку константы устойчивости для комплекса металл-лиганд всегда указываются как константы ассоциации, протонирование лиганда также должно быть указано как реакция ассоциации. [17] Определения показывают, что значение константы диссоциации кислоты является обратной величиной значения соответствующей константы ассоциации:
Примечания
Все константы равновесия изменяются с температурой согласно уравнению Вант-Гоффа [18]
— газовая постоянная , а — абсолютная температура . Таким образом, для экзотермических реакций стандартное изменение энтальпии , , отрицательно, а K уменьшается с температурой. Для эндотермических реакций, положительно, а K увеличивается с температурой.
Стандартное изменение энтальпии для реакции само по себе является функцией температуры, согласно закону термохимии Кирхгофа :
где — изменение теплоёмкости при постоянном давлении. На практике можно считать постоянным в небольшом диапазоне температур.
В уравнении
K a , по-видимому, имеет размерность концентрации. Однако, поскольку , константа равновесия, , не может иметь физическую размерность. Этот кажущийся парадокс можно разрешить различными способами.
Процедуры (1) и (2) дают идентичные числовые значения для константы равновесия. Более того, поскольку концентрация просто пропорциональна мольной доле и плотности :
и поскольку молярная масса является постоянной величиной в разбавленных растворах, значение константы равновесия, определенное с использованием (3), будет просто пропорционально значениям, полученным с использованием (1) и (2).
В биохимии принято указывать величину с размерностью, например, « K a = 30 мМ», чтобы указать масштаб, миллимолярный (мМ) или микромолярный (мкМ) значений концентрации , используемых для ее расчета.
Кислота классифицируется как «сильная», когда концентрация ее недиссоциированных видов слишком мала для измерения. [6] Любая водная кислота со значением ap K a менее 0 почти полностью депротонирована и считается сильной кислотой . [20] Все такие кислоты переносят свои протоны в воду и образуют катионные виды растворителя (H 3 O + в водном растворе), так что все они имеют по существу одинаковую кислотность, явление, известное как выравнивание растворителя . [21] [22] Говорят, что они полностью диссоциированы в водном растворе, потому что количество недиссоциированной кислоты, находящейся в равновесии с продуктами диссоциации, находится ниже предела обнаружения . Аналогично, любое водное основание с константой ассоциации p K b менее примерно 0, что соответствует p K a более примерно 14, выравнивается до OH − и считается сильным основанием . [22]
Азотная кислота со значением ap K около −1,7 ведет себя как сильная кислота в водных растворах с pH больше 1. [23] При более низких значениях pH она ведет себя как слабая кислота.
Значения p K a для сильных кислот были оценены теоретическими методами. [24] Например, значение p K a водного раствора HCl было оценено как −9,3.
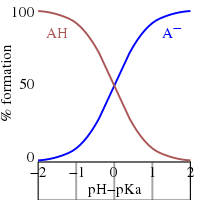
После перестановки выражения, определяющего K a , и подстановки pH = −log 10 [H + ] , получаем [25]
Это уравнение Хендерсона–Хассельбаха , из которого можно сделать следующие выводы.
В воде измеримые значения p K a варьируются от примерно -2 для сильной кислоты до примерно 12 для очень слабой кислоты (или сильного основания).
Буферный раствор с желаемым pH можно приготовить как смесь слабой кислоты и сопряженного с ней основания. На практике смесь можно создать, растворив кислоту в воде и добавив необходимое количество сильной кислоты или основания. Когда известны p K a и аналитическая концентрация кислоты, степень диссоциации и pH раствора одноосновной кислоты можно легко рассчитать с помощью таблицы ICE .

Полипротонная кислота — это соединение, которое может терять более 1 протона. Константы ступенчатой диссоциации определяются для потери одного протона. Константа диссоциации первого протона может быть обозначена как K a1 , а константы диссоциации последующих протонов — как K a2 и т. д. Фосфорная кислота , H 3 PO 4 , является примером полипротонной кислоты, поскольку она может терять три протона.
Когда разница между последовательными значениями p K составляет около четырех или более, как в этом примере, каждый вид может рассматриваться как кислота сама по себе; [27] Фактически соли H
2ПО−
4может быть кристаллизован из раствора путем регулирования pH примерно до 5,5 и солей HPO2−4может быть кристаллизован из раствора путем регулирования pH примерно до 10. Диаграмма распределения видов показывает, что концентрации двух ионов максимальны при pH 5,5 и 10.
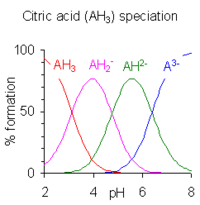
Когда разница между последовательными значениями p K меньше примерно четырех, происходит перекрытие диапазонов pH существования видов в равновесии. Чем меньше разница, тем больше перекрытие. Случай лимонной кислоты показан справа; растворы лимонной кислоты буферны во всем диапазоне pH от 2,5 до 7,5.
Согласно первому правилу Полинга, последовательные значения p K данной кислоты увеличиваются (p K a2 > p K a1 ) . [28] Для оксикислот с более чем одним ионизированным водородом на одном атоме значения p K a часто увеличиваются примерно на 5 единиц для каждого удаленного протона, [29] [30] как в примере с фосфорной кислотой выше.
Из таблицы выше видно, что второй протон удаляется из отрицательно заряженного вида. Поскольку протон несет положительный заряд, для его удаления требуется дополнительная работа, поэтому p K a2 больше, чем p K a1 . p K a3 больше, чем p K a2 , поскольку происходит дальнейшее разделение зарядов. Когда обнаруживается исключение из правила Полинга, это указывает на то, что также происходит существенное изменение структуры. В случае VO+2(aq), ванадий октаэдрический , 6-координированный, тогда как ванадиевая кислота тетраэдрическая , 4-координированная. Это означает, что при первой диссоциации высвобождаются четыре «частицы», но при других диссоциациях высвобождаются только две «частицы», что приводит к гораздо большему вкладу энтропии в стандартное изменение свободной энергии Гиббса для первой реакции, чем для других.
Для веществ в растворе изоэлектрическая точка (p I ) определяется как pH, при котором сумма, взвешенная по значению заряда, концентраций положительно заряженных видов равна взвешенной сумме концентраций отрицательно заряженных видов. В случае, если имеется один вид каждого типа, изоэлектрическую точку можно получить непосредственно из значений p K. Возьмем, к примеру, глицин , определяемый как AH. Необходимо рассмотреть два равновесия диссоциации.
Подставим выражение для [AH] из второго уравнения в первое уравнение
В изоэлектрической точке концентрация положительно заряженных частиц AH+2, равна концентрации отрицательно заряженных частиц, A − , поэтому
Таким образом, принимая кологарифмы , pH определяется по формуле
Значения p I для аминокислот указаны в протеиногенной аминокислоте . Когда более двух заряженных видов находятся в равновесии друг с другом, может потребоваться полный расчет видообразования.
Константа равновесия Kb для основания обычно определяется как константа ассоциации для протонирования основания B с образованием сопряженной кислоты HB + .
Используя рассуждения, аналогичные тем, что использовались ранее
K b связан с K a для сопряженной кислоты. В воде концентрация гидроксид - иона [OH − ] связана с концентрацией иона водорода соотношением K w = [H + ][OH − ] , поэтому
Подстановка выражения для [OH − ] в выражение для K b дает
Когда K a , K b и K w определяются при тех же условиях температуры и ионной силы, то, взяв кологарифмы , следует, что p K b = p K w − p K a . В водных растворах при 25 °C p K w равен 13,9965, [31] поэтому
с достаточной точностью для большинства практических целей. Фактически нет необходимости определять p K b отдельно от p K a , [32] но это сделано здесь, поскольку часто в старой литературе можно найти только значения p K b .
Для гидролизованного иона металла K b также можно определить как константу ступенчатой диссоциации
Это величина, обратная константе ассоциации для образования комплекса.
Поскольку соотношение p K b = p K w − p K a справедливо только для водных растворов (хотя аналогичные соотношения применимы и к другим амфотерным растворителям), такие разделы химии, как органическая химия , которые обычно имеют дело с неводными растворами, обычно не используют p K b в качестве меры основности. Вместо этого p K a сопряженной кислоты, обозначаемой как p K aH , указывается, когда необходимо количественно определить основность. Для основания B и его сопряженной кислоты BH + в равновесии это определяется как
Более высокое значение p K aH соответствует более сильному основанию. Например, значения p K aH (C 5 H 5 N) = 5,25 и p K aH ((CH 3 CH 2 ) 3 N) = 10,75 указывают на то, что (CH 3 CH 2 ) 3 N (триэтиламин) является более сильным основанием, чем C 5 H 5 N (пиридин).
Амфотерное вещество — это вещество, которое может действовать как кислота или как основание в зависимости от pH. Вода (ниже) амфотерна. Другим примером амфотерной молекулы является ион бикарбоната HCO−3что является сопряженным основанием молекулы угольной кислоты H2CO3 в равновесии
но также и сопряженная кислота карбонат- иона CO2−3в (обратном) равновесии
Равновесие углекислоты важно для кислотно-щелочного гомеостаза в организме человека.
Аминокислота также является амфотерной , но с тем дополнительным осложнением, что нейтральная молекула подвержена внутреннему кислотно-щелочному равновесию, в котором основная аминогруппа притягивает и связывает протон из кислотной карбоксильной группы, образуя цвиттер-ион .
При pH менее 5 протонируются как карбоксилатная группа, так и аминогруппа. По мере увеличения pH кислота диссоциирует в соответствии с
При высоком pH может иметь место вторичная диссоциация.
Таким образом, молекула аминокислоты является амфотерной, поскольку она может быть либо протонирована, либо депротонирована.
Молекула воды может либо получить, либо потерять протон. Она называется амфипротной . Равновесие ионизации можно записать
где в водном растворе H + обозначает сольватированный протон. Часто это записывается как ион гидроксония H 3 O + , но эта формула не точна, поскольку на самом деле сольватация происходит более чем одной молекулой воды и такими видами, как H 5 O+2, Н7О+3, и Н 9 О+4также присутствуют. [33]
Константа равновесия определяется выражением
В растворах, в которых концентрации растворенных веществ не очень высоки, концентрацию [H 2 O] можно считать постоянной, независимо от растворенного вещества(в); это выражение можно заменить на
Константа самоионизации воды, K w , таким образом, является лишь частным случаем константы диссоциации кислоты. Логарифмическая форма, аналогичная p K a , также может быть определена
Эти данные можно смоделировать с помощью параболы
Из этого уравнения p K w = 14 при 24,87 ° C. При этой температуре ионы водорода, и гидроксид-ионы имеют концентрацию 10 −7 M.
Растворитель с большей вероятностью будет способствовать ионизации растворенной кислотной молекулы в следующих обстоятельствах: [35]
Значения p K a органических соединений часто получают с использованием апротонных растворителей диметилсульфоксида (ДМСО) [35] и ацетонитрила (ACN). [36]
ДМСО широко используется в качестве альтернативы воде, поскольку он имеет более низкую диэлектрическую проницаемость, чем вода, и менее полярен, поэтому легче растворяет неполярные гидрофобные вещества. Он имеет измеримый диапазон p K a примерно от 1 до 30. Ацетонитрил менее щелочной, чем ДМСО, и, поэтому, в общем, кислоты слабее, а основания сильнее в этом растворителе. Некоторые значения p K a при 25 °C для ацетонитрила (ACN) [37] [38] [39] и диметилсульфоксида (ДМСО). [40] показаны в следующих таблицах. Значения для воды включены для сравнения.
Ионизация кислот меньше в кислотном растворителе, чем в воде. Например, хлористый водород является слабой кислотой при растворении в уксусной кислоте . Это происходит потому, что уксусная кислота является гораздо более слабым основанием, чем вода.
Сравните эту реакцию с тем, что происходит при растворении уксусной кислоты в более кислом растворителе – чистой серной кислоте: [41]

Маловероятный геминальный диол CH 3 C (OH)+2стабилен в этих средах. Для водных растворов шкала pH является наиболее удобной функцией кислотности . [42] Были предложены и другие функции кислотности для неводных сред, наиболее примечательной из которых является функция кислотности Гаммета , H 0 , для сверхкислотных сред и ее модифицированная версия H − для сверхосновных сред. [43]
В апротонных растворителях олигомеры , такие как хорошо известный димер уксусной кислоты , могут быть образованы путем водородной связи. Кислота также может образовывать водородные связи со своим сопряженным основанием. Этот процесс, известный как гомоконъюгация , имеет эффект повышения кислотности кислот, снижения их эффективных значений p K a , путем стабилизации сопряженного основания. Гомоконъюгация увеличивает протонодонорную способность толуолсульфоновой кислоты в растворе ацетонитрила почти в 800 раз. [44]
В водных растворах гомоконъюгация не происходит, поскольку вода образует с сопряженным основанием более прочные водородные связи, чем кислота.
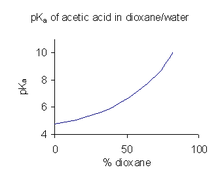
Когда соединение имеет ограниченную растворимость в воде, обычной практикой (например, в фармацевтической промышленности) является определение значений pKa в смеси растворителей, такой как вода/ диоксан или вода/ метанол , в которой соединение более растворимо. [46] В примере, показанном справа, значение pKa резко возрастает с увеличением процентного содержания диоксана, поскольку диэлектрическая проницаемость смеси уменьшается.
Значение p K a , полученное в смешанном растворителе, не может быть использовано непосредственно для водных растворов. Причина этого в том, что когда растворитель находится в своем стандартном состоянии, его активность определяется как единица. Например, стандартное состояние смеси вода:диоксан с соотношением смешивания 9:1 — это именно эта смесь растворителей без добавления растворенных веществ. Чтобы получить значение p K a для использования с водными растворами, его необходимо экстраполировать до нулевой концентрации сорастворителя из значений, полученных из различных смесей сорастворителей.
Эти факты затемняются из-за исключения растворителя из выражения, которое обычно используется для определения p K a , но значения p K a , полученные в данном смешанном растворителе, можно сравнивать друг с другом, давая относительную кислотность. То же самое относится и к значениям p K a , полученным в определенном неводном растворителе, таком как ДМСО.
Универсальная, независимая от растворителя шкала констант диссоциации кислот не разработана, поскольку не существует известного способа сравнения стандартных состояний двух различных растворителей.
Второе правило Полинга заключается в том, что значение первого p K a для кислот формулы XO m (OH) n зависит в первую очередь от числа оксогрупп m и приблизительно не зависит от числа гидроксигрупп n , а также от центрального атома X. Приблизительные значения p K a составляют 8 для m = 0, 2 для m = 1, −3 для m = 2 и < −10 для m = 3. [28] В качестве альтернативы были предложены различные числовые формулы, включая p K a = 8 − 5 m (известное как правило Белла ), [29] [47] p K a = 7 − 5 m , [30] [48] или p K a = 9 − 7 m . [29] Зависимость от m коррелирует со степенью окисления центрального атома X: чем выше степень окисления, тем сильнее оксикислота.
Например, p K a для HClO равен 7,2, для HClO 2 равен 2,0, для HClO 3 равен −1, а HClO 4 является сильной кислотой ( p K a ≪ 0 ). [7] Повышение кислотности при добавлении оксогруппы обусловлено стабилизацией сопряженного основания путем делокализации его отрицательного заряда по дополнительному атому кислорода. [47] Это правило может помочь определить молекулярную структуру: например, фосфористая кислота , имеющая молекулярную формулу H 3 PO 3 , имеет ap K a около 2, что предполагает, что структура представляет собой HPO(OH) 2 , как позже подтвердила спектроскопия ЯМР , а не P(OH) 3 , которая, как ожидалось, имела бы ap K a около 8. [48]

Индуктивные эффекты и мезомерные эффекты влияют на значения p K a . Простой пример — эффект замены атомов водорода в уксусной кислоте более электроотрицательным атомом хлора. Электроноакцепторный эффект заместителя облегчает ионизацию, поэтому последовательные значения p K a уменьшаются в ряду 4,7, 2,8, 1,4 и 0,7, когда присутствует 0, 1, 2 или 3 атома хлора. [49] Уравнение Гаммета дает общее выражение для эффекта заместителей. [50]
K a — константа диссоциации замещенного соединения, K0
аконстанта диссоциации, когда заместитель — водород, ρ — свойство незамещенного соединения, а σ имеет определенное значение для каждого заместителя. График зависимости log( K a ) от σ — это прямая линия с отсекаемым осью log( K0
а) и наклон ρ. Это пример линейной зависимости свободной энергии , поскольку log( K a ) пропорционален стандартному изменению свободной энергии. Первоначально Хамметт [51] сформулировал зависимость с данными по бензойной кислоте с различными заместителями в орто- и пара - положениях: некоторые числовые значения находятся в уравнении Хамметта . Это и другие исследования позволили упорядочить заместители в соответствии с их способностью оттягивать или отдавать электроны , а также различать индуктивные и мезомерные эффекты. [52] [53]
Спирты обычно не ведут себя как кислоты в воде, но наличие двойной связи рядом с группой ОН может существенно снизить p K a по механизму кето-енольной таутомерии . Аскорбиновая кислота является примером этого эффекта. Дикетон 2,4-пентандион ( ацетилацетон ) также является слабой кислотой из-за кето-енольного равновесия. В ароматических соединениях, таких как фенол , которые имеют заместитель ОН, сопряжение с ароматическим кольцом в целом значительно увеличивает стабильность депротонированной формы.
Структурные эффекты также могут быть важны. Классический пример — разница между фумаровой и малеиновой кислотами . Фумаровая кислота — это (E)-1,4-бут-2-ендиовая кислота, транс -изомер , тогда как малеиновая кислота — это соответствующий цис -изомер, т. е. (Z)-1,4-бут-2-ендиовая кислота (см. цис-транс-изомерия ). Фумаровая кислота имеет значения p K a приблизительно 3,0 и 4,5. Напротив, малеиновая кислота имеет значения p K a приблизительно 1,5 и 6,5. Причина такой большой разницы в том, что при удалении одного протона из цис- изомера (малеиновой кислоты) образуется сильная внутримолекулярная водородная связь с близлежащей оставшейся карбоксильной группой. Это способствует образованию малеата H + и препятствует удалению второго протона из этого вида. В транс- изомере две карбоксильные группы всегда находятся далеко друг от друга, поэтому водородная связь не наблюдается. [54]
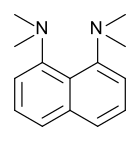
Протонная губка , 1,8-бис(диметиламино)нафталин, имеет значение ap K = 12,1. Это одно из самых сильных известных аминных оснований. Высокая основность объясняется снятием напряжения при протонировании и прочными внутренними водородными связями. [55] [56]
Влияние растворителя и сольватации также следует упомянуть в этом разделе. Оказывается, эти влияния более тонкие, чем влияние диэлектрической среды, упомянутой выше. Например, ожидаемый (по электронным эффектам метильных заместителей) и наблюдаемый в газовой фазе порядок основности метиламинов, Me 3 N > Me 2 NH > MeNH 2 > NH 3 , изменяется водой на Me 2 NH > MeNH 2 > Me 3 N > NH 3 . Нейтральные молекулы метиламина связаны водородными связями с молекулами воды в основном через одно акцепторное взаимодействие N–HOH и лишь изредка еще через одну донорную связь NH–OH 2 . Следовательно, метиламины стабилизируются примерно в одинаковой степени гидратацией, независимо от количества метильных групп. В резком контрасте соответствующие катионы метиламмония всегда используют все доступные протоны для донорной связи NH–OH 2 . Относительная стабилизация ионов метиламмония, таким образом, уменьшается с числом метильных групп, что объясняет порядок основности воды метиламинов. [4]
Константа равновесия связана со стандартным изменением энергии Гиббса для реакции, поэтому для константы диссоциации кислоты
R — газовая постоянная , а T — абсолютная температура . Обратите внимание, что p K a = −log( K a ) и 2,303 ≈ ln (10) . При 25 °C Δ G ⊖ в кДж·моль −1 ≈ 5,708 p K a (1 кДж·моль −1 = 1000 джоулей на моль ). Свободная энергия состоит из энтальпийного и энтропийного члена. [11]
Стандартное изменение энтальпии можно определить калориметрией или с помощью уравнения Ван 'т Гоффа , хотя калориметрический метод предпочтительнее. Когда и стандартное изменение энтальпии, и константа диссоциации кислоты определены, стандартное изменение энтропии легко вычисляется из уравнения выше. В следующей таблице энтропийные члены вычисляются из экспериментальных значений p K a и Δ H ⊖ . Данные были критически выбраны и относятся к 25 °C и нулевой ионной силе в воде. [11]
Первое, что следует отметить, это то, что когда p K a положительно, стандартное изменение свободной энергии для реакции диссоциации также положительно. Во-вторых, некоторые реакции являются экзотермическими , а некоторые - эндотермическими , но, когда Δ H ⊖ отрицательно, T ΔS ⊖ является доминирующим фактором, который определяет, что Δ G ⊖ положительно. Наконец, вклад энтропии всегда неблагоприятен ( Δ S ⊖ < 0 ) в этих реакциях. Ионы в водном растворе имеют тенденцию ориентировать окружающие молекулы воды, что упорядочивает раствор и уменьшает энтропию. Вклад иона в энтропию - это парциальная молярная энтропия, которая часто отрицательна, особенно для малых или сильно заряженных ионов. [57] Ионизация нейтральной кислоты включает образование двух ионов, так что энтропия уменьшается ( Δ S ⊖ < 0 ). При второй ионизации той же кислоты теперь имеется три иона, а анион имеет заряд, поэтому энтропия снова уменьшается.
Обратите внимание, что стандартное изменение свободной энергии для реакции — это изменение от реагентов в их стандартных состояниях к продуктам в их стандартных состояниях. Изменение свободной энергии в равновесии равно нулю, поскольку химические потенциалы реагентов и продуктов равны в равновесии.

Экспериментальное определение значений p K a обычно выполняется с помощью титрования в среде с высокой ионной силой и при постоянной температуре. [58] Типичная процедура выглядит следующим образом. Раствор соединения в среде подкисляется сильной кислотой до точки, в которой соединение полностью протонируется. Затем раствор титруется сильным основанием до тех пор, пока все протоны не будут удалены. В каждой точке титрования измеряется pH с помощью стеклянного электрода и pH-метра . Константы равновесия находятся путем подгонки рассчитанных значений pH к наблюдаемым значениям с использованием метода наименьших квадратов . [59]
Общий объем добавленного сильного основания должен быть небольшим по сравнению с начальным объемом раствора титранда, чтобы поддерживать ионную силу практически постоянной. Это обеспечит неизменность p K a во время титрования.
Рассчитанная кривая титрования щавелевой кислоты показана справа. Щавелевая кислота имеет значения p K a 1,27 и 4,27. Следовательно, буферные области будут центрированы примерно при pH 1,3 и pH 4,3. Буферные области несут информацию, необходимую для получения значений p K a по мере изменения концентраций кислоты и сопряженного основания вдоль буферной области.
Между двумя буферными областями находится конечная точка, или точка эквивалентности , примерно при pH 3. Эта конечная точка не является резкой и типична для дипротонной кислоты, буферные области которой перекрываются на небольшую величину: p K a2 − p K a1 составляет около трех в этом примере. (Если бы разница в значениях p K была около двух или меньше, конечная точка не была бы заметна.) Вторая конечная точка начинается примерно при pH 6,3 и является резкой. Это указывает на то, что все протоны были удалены. Когда это так, раствор не буферизирован, и pH резко повышается при добавлении небольшого количества сильного основания. Однако pH не продолжает расти бесконечно. Новая буферная область начинается примерно при pH 11 (p K w − 3), где самоионизация воды становится важной.
Очень трудно измерить значения pH менее двух в водном растворе с помощью стеклянного электрода , поскольку уравнение Нернста нарушается при таких низких значениях pH. Для определения значений p K менее примерно 2 или более примерно 11 вместо измерений pH или в сочетании с ними можно использовать спектрофотометрические [60] [61] или ЯМР [62] [63] измерения.
Когда стеклянный электрод использовать невозможно, как в случае с неводными растворами, часто применяются спектрофотометрические методы. [38] Они могут включать измерения поглощения или флуоресценции . В обоих случаях предполагается, что измеряемая величина пропорциональна сумме вкладов от каждого фотоактивного вида; при измерениях поглощения предполагается, что применяется закон Бера-Ламберта .
Изотермическая титрационная калориметрия (ИТК) может использоваться для определения как значения ap K , так и соответствующей стандартной энтальпии для диссоциации кислоты. [64] Программное обеспечение для выполнения расчетов предоставляется производителями приборов для простых систем.
Водные растворы с обычной водой не могут использоваться для измерений 1 H ЯМР, вместо этого следует использовать тяжелую воду , D 2 O. Однако данные 13 C ЯМР можно использовать с обычной водой, а спектры 1 H ЯМР можно использовать с неводными средами. Величины, измеренные с помощью ЯМР, представляют собой усредненные по времени химические сдвиги , поскольку обмен протонами происходит быстро по шкале времени ЯМР. Могут быть измерены и другие химические сдвиги, например, сдвиги 31 P.

Для некоторых полипротонных кислот диссоциация (или ассоциация) происходит в более чем одном неэквивалентном месте, [4] и наблюдаемая макроскопическая константа равновесия, или макроконстанта, представляет собой комбинацию микроконстант, включающих различные виды. Когда один реагент образует два продукта параллельно, макроконстанта представляет собой сумму двух микроконстант, Это справедливо, например, для депротонирования аминокислоты цистеина , которая существует в растворе в виде нейтрального цвиттер-иона HS−CH 2 −CH(NH +3)−COO − . Две микроконстанты представляют депротонирование либо по сере, либо по азоту, а сумма макроконстант здесь представляет собой константу диссоциации кислоты [65]

Аналогично, основание, такое как спермин, имеет более одного сайта, где может происходить протонирование. Например, монопротонирование может происходить на терминальной группе −NH 2 или на внутренних группах −NH− . Значения K b для диссоциации спермина, протонированного на одном или другом сайте, являются примерами микроконстант . Их нельзя определить напрямую с помощью измерений pH, поглощения, флуоресценции или ЯМР; измеренное значение K b представляет собой сумму значений K для микрореакций.
Тем не менее, место протонирования очень важно для биологической функции, поэтому были разработаны математические методы для определения микроконстант. [66]
Когда два реагента образуют один продукт параллельно, макроконстанта [65] Например, вышеупомянутое равновесие для спермина можно рассматривать в терминах значений K a двух таутомерных сопряженных кислот, с макроконстантой В этом случае Это эквивалентно предыдущему выражению, поскольку пропорционально
Когда реагент подвергается двум реакциям последовательно, макроконстанта для объединенной реакции является произведением микроконстанты для двух стадий. Например, вышеупомянутый цвиттер-ион цистеина может потерять два протона, один из серы и один из азота, и общая макроконстанта для потери двух протонов является произведением двух констант диссоциации [65] Это также можно записать в терминах логарифмических констант как
Знание значений p K a важно для количественной обработки систем, включающих кислотно-щелочное равновесие в растворе. Существует множество приложений в биохимии ; например, значения p K a белков и боковых цепей аминокислот имеют большое значение для активности ферментов и стабильности белков. [67] Значения p K a белков не всегда можно измерить напрямую, но их можно рассчитать с помощью теоретических методов. Буферные растворы широко используются для получения растворов при физиологическом pH или около него для изучения биохимических реакций; [68] разработка этих растворов зависит от знания значений p K a их компонентов. Важные буферные растворы включают MOPS , который обеспечивает раствор с pH 7,2, и трицин , который используется в гель-электрофорезе . [69] [70] Буферизация является неотъемлемой частью кислотно-щелочной физиологии , включая кислотно-щелочной гомеостаз , [71] и является ключом к пониманию таких расстройств, как кислотно-щелочное расстройство . [72] [73] [74] Изоэлектрическая точка данной молекулы является функцией ее значений p K , поэтому разные молекулы имеют разные изоэлектрические точки. Это позволяет использовать технику, называемую изоэлектрической фокусировкой , [75] которая используется для разделения белков с помощью электрофореза в полиакриламидном геле 2-D .
Буферные растворы также играют ключевую роль в аналитической химии . Они используются всякий раз, когда необходимо зафиксировать pH раствора на определенном значении. По сравнению с водным раствором, pH буферного раствора относительно нечувствителен к добавлению небольшого количества сильной кислоты или сильного основания. Буферная емкость [76] простого буферного раствора является наибольшей, когда pH = p K a . При кислотно-щелочной экстракции эффективность экстракции соединения в органическую фазу, такую как эфир , может быть оптимизирована путем регулирования pH водной фазы с помощью соответствующего буфера. При оптимальном pH концентрация электронейтральных видов максимальна; такие виды более растворимы в органических растворителях с низкой диэлектрической проницаемостью , чем в воде. Этот метод используется для очистки слабых кислот и оснований. [77]
Индикатор pH — это слабая кислота или слабое основание, которые меняют цвет в диапазоне переходного pH, который приблизительно равен pKa ± 1. Для создания универсального индикатора требуется смесь индикаторов, соседние значения pKa которых различаются примерно на два, так что их диапазоны переходного pH просто перекрываются.
В фармакологии ионизация соединения изменяет его физическое поведение и макросвойства, такие как растворимость и липофильность , log p ). Например, ионизация любого соединения увеличит растворимость в воде, но уменьшит липофильность. Это используется при разработке лекарств для увеличения концентрации соединения в крови путем регулирования p K a ионизируемой группы. [78]
Знание значений p K a важно для понимания координационных комплексов , которые образуются при взаимодействии иона металла M m+ , действующего как кислота Льюиса , с лигандом L, действующим как основание Льюиса . Однако лиганд также может подвергаться реакциям протонирования, поэтому образование комплекса в водном растворе можно символически представить реакцией
Чтобы определить константу равновесия для этой реакции, в которой лиганд теряет протон, необходимо знать p K a протонированного лиганда. На практике лиганд может быть полипротонным; например, EDTA 4− может принимать четыре протона; в этом случае все значения p K a должны быть известны. Кроме того, ион металла подвержен гидролизу , то есть ведет себя как слабая кислота, поэтому значения p K для реакций гидролиза также должны быть известны. [79]
Оценка опасности, связанной с кислотой или основанием, может потребовать знания значений p K a . [80] Например, цианистый водород является очень токсичным газом, поскольку ион цианида ингибирует железосодержащий фермент цитохром c оксидазу . Цианистый водород является слабой кислотой в водном растворе с ap K a около 9. В сильнощелочных растворах, скажем, выше pH 11, следует, что цианистый натрий «полностью диссоциирован», поэтому опасность, вызванная газом цианистого водорода, значительно снижается. Кислотный раствор, с другой стороны, очень опасен, поскольку весь цианид находится в кислотной форме. Проглатывание цианида через рот потенциально смертельно, независимо от pH, из-за реакции с цитохром c оксидазой.
В науке об окружающей среде кислотно-щелочное равновесие важно для озер [81] и рек; [82] [83] например, гуминовые кислоты являются важными компонентами природных вод. Другой пример встречается в химической океанографии : [84] для количественной оценки растворимости железа(III) в морской воде при различной солености , значения p K a для образования продуктов гидролиза железа(III) Fe(OH) 2+ , Fe(OH)+2и Fe(OH) 3 были определены вместе с произведением растворимости гидроксида железа . [85]
Существует несколько методов определения p K a химического вещества, что приводит к некоторым расхождениям между разными источниками. Хорошо измеренные значения обычно находятся в пределах 0,1 единицы друг от друга. Представленные здесь данные были получены при 25 °C в воде. [7] [86] Дополнительные значения можно найти в разделе Термодинамика выше. Таблицу p K a карбоновых кислот, измеренных в ДМСО, можно найти на странице о карбанионах .
Вам интересно... Как использование видов деятельности делает константу равновесия безразмерной?