В органической химии алкенолы ( сокращенно « енолы» ) — это тип реакционноспособной структуры или промежуточного соединения в органической химии , который представлен в виде алкена ( олефина ) с гидроксильной группой , присоединенной к одному концу двойной связи алкена ( C=C-OH ). . Термины енол и алкенол представляют собой производные от «-ен»/«алкен» и суффикса «-ол», обозначающего гидроксильную группу спиртов , без концевого «-е» первого термина. Образование енолов часто включает депротонирование в α- положении карбонильной группы , т. е. удаление там атома водорода в виде протона Н + . Если этот протон не возвращается в конце поэтапного процесса, в результате образуется анион, называемый енолятом ( см. изображения справа). Показанные енолятные структуры схематичны; более современное представление рассматривает молекулярные орбитали , которые образуются и заняты электронами в еноляте. Подобным образом, образование енола часто сопровождается «захватом» или маскировкой гидроксильной группы в виде простого эфира, такого как эфир силиленола . [1]
Кето-енольная таутомерия относится к химическому равновесию между «кето»-формой ( карбонилом , названным в честь обычного кетона ) и енолом. Взаимное превращение двух форм включает перенос альфа-атома водорода и реорганизацию связывающих электронов . Кето- и енольная формы являются таутомерами друг друга. [2]
Органические сложные эфиры , кетоны и альдегиды с α-водородом ( связь CH-H, примыкающая к карбонильной группе ) часто образуют енолы. Реакция включает миграцию протона ( H ) от углерода к кислороду: [1]
В случае кетонов превращение называется кето-енольной таутомерией, хотя это название часто применяется ко всем таким таутомеризациям в более общем смысле. Обычно константа равновесия настолько мала, что енол не обнаруживается спектроскопически.
В некоторых соединениях с двумя (или более) карбонилами преобладает енольная форма. Поведение 2,4-пентандиона иллюстрирует этот эффект: [3]
Енолы представляют собой производные винилового спирта со связностью C=C-OH . Депротонирование органических карбонилов дает енолят-анионы , которые являются сильными нуклеофилами . Классический пример предпочтения кето-формы можно увидеть в равновесии между виниловым спиртом и ацетальдегидом (K = [енол]/[кето] ≈ 3 × 10−7 ). В 1,3-дикетонах , таких как ацетилацетон (2,4-пентандион), предпочтительна енольная форма.
Катализируемое кислотой превращение енола в кето-форму протекает путем переноса протона от О к углероду. Процесс не происходит внутримолекулярно, а требует участия растворителя или других медиаторов.
Если R 1 и R 2 (примечание к уравнению вверху страницы) представляют собой разные заместители, в альфа-положении образуется новый стереоцентр, когда енол превращается в свою кето-форму. В зависимости от природы трех групп R полученные продукты в этой ситуации будут диастереомерами или энантиомерами .
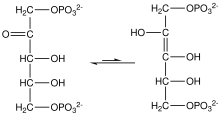
Энедиолы – это алкены с гидроксильной группой на каждом атоме углерода двойной связи C=C. Обычно такие соединения являются нежелательными компонентами в равновесии с ацилоинами . Особым случаем является катехол , где субъединица C=C является частью ароматического кольца. Однако в некоторых других случаях эндиолы стабилизируются фланкирующими карбонильными группами. Эти стабилизированные эндиолы называются редуктонами . Такие виды важны в гликохимии, например, трансформация Лобри де Брюйна-ван Экенштейна . [5]

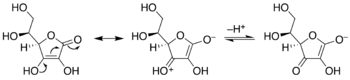
Рибулозо-1,5-бисфосфат является ключевым субстратом цикла фотосинтеза Кальвина . В цикле Кальвина рибулоза уравновешивается эндиолом, который затем связывает углекислый газ . Тот же эндиол также подвержен воздействию кислорода (O 2 ) в ходе (нежелательного) процесса, называемого фотодыханием .
Фенолы представляют собой разновидность енолов. Для некоторых фенолов и родственных соединений важную роль играет кетотаутомер. Например, во многих реакциях резорцина участвует кетотаутомер. Нафталин-1,4-диол существует в наблюдаемом равновесии с дикетоном тетрагидронафталин-1,4-дионом. [6]
Кето-енольная таутомерия важна в нескольких областях биохимии .
Высокий потенциал переноса фосфата фосфоенолпирувата обусловлен тем, что фосфорилированное соединение «захватывается» в менее термодинамически выгодную енольную форму, тогда как после дефосфорилирования оно может принять кето-форму.
Фермент енолаза катализирует дегидратацию 2-фосфоглицериновой кислоты до енолфосфатного эфира. Метаболизм PEP до пировиноградной кислоты под действием пируваткиназы (PK) приводит к образованию аденозинтрифосфата (АТФ) посредством фосфорилирования на уровне субстрата . [7]
Конец двойной связи в енолах нуклеофильный . Его реакции с электрофильными органическими соединениями важны как в биохимии , так и в синтетической органической химии . В первом случае фиксация углекислого газа включает присоединение CO 2 к енолу.
Депротонирование енолизируемых кетонов, альдегидов и сложных эфиров дает еноляты . [8] [9] Еноляты можно улавливать путем добавления электрофилов к кислороду. Силилирование дает эфир силилинола . [10] Ацилирование дает сложные эфиры, такие как винилацетат . [11]
В целом енолы менее стабильны, чем их кето-эквиваленты, из-за преимущества двойной связи C=O над двойной связью C=C. Однако енолы можно стабилизировать кинетически или термодинамически.
Некоторые енолы достаточно кинетически стабилизированы, чтобы их можно было охарактеризовать.
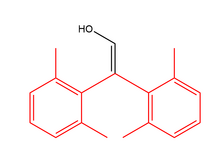
Делокализация может стабилизировать енольный таутомер. Таким образом, очень устойчивыми енолами являются фенолы . [13] Другим стабилизирующим фактором в 1,3-дикарбонилах является внутримолекулярная водородная связь. [14] Оба эти фактора влияют на енол-дионовое равновесие в ацетилацетоне.