Система вознаграждения (мезокортиколимбический контур) представляет собой группу нейронных структур, отвечающих за стимульную значимость (то есть «желание»; желание или тяга к вознаграждению и мотивации ), ассоциативное обучение (в первую очередь положительное подкрепление и классическое обусловливание ) и положительно-валентные эмоции , особенно те, в которых удовольствие является основным компонентом (например, радость , эйфория и экстаз ). [2] [3] Вознаграждение является привлекательным и мотивирующим свойством стимула, которое вызывает аппетитное поведение, также известное как поведение приближения и консуматорное поведение. [2] Вознаграждающий стимул был описан как «любой стимул, объект, событие, деятельность или ситуация, которые имеют потенциал заставить нас приблизиться и потребить его, по определению являются вознаграждением». [2] В оперантном обусловливании вознаграждающие стимулы функционируют как положительные подкрепления ; [1] однако обратное утверждение также верно: положительные подкрепления вознаграждают. [1] [4] Система вознаграждения мотивирует животных приближаться к стимулам или заниматься поведением, которое повышает приспособленность (секс, высококалорийная пища и т. д.). Выживание большинства видов животных зависит от максимизации контакта с полезными стимулами и минимизации контакта с вредными стимулами. Познание вознаграждения служит для увеличения вероятности выживания и размножения, вызывая ассоциативное обучение, вызывая поведение приближения и потребления и запуская позитивно-валентные эмоции. [1] Таким образом, вознаграждение - это механизм, который развился, чтобы помочь повысить адаптивную приспособленность животных. [5] При наркотической зависимости определенные вещества чрезмерно активируют цепь вознаграждения, что приводит к компульсивному поведению поиска веществ в результате синаптической пластичности в цепи. [6]
Первичные вознаграждения — это класс стимулов вознаграждения, которые способствуют выживанию человека и его потомства , и они включают гомеостатические (например, вкусная еда ) и репродуктивные (например, сексуальный контакт и родительские инвестиции ) вознаграждения. [2] [7] Внутренние вознаграждения — это безусловные вознаграждения, которые привлекательны и мотивируют поведение, поскольку они по своей сути приятны. [2] Внешние вознаграждения (например, деньги или наблюдение за победой любимой спортивной команды) — это условные вознаграждения, которые привлекательны и мотивируют поведение, но по своей сути не приятны. [2] [8] Внешние вознаграждения получают свою мотивационную ценность в результате усвоенной ассоциации (т. е. обусловленности) с внутренними вознаграждениями. [2] Внешние вознаграждения также могут вызывать удовольствие (например, эйфорию от выигрыша больших денег в лотерею) после классического обусловления внутренними вознаграждениями. [2]
В нейронауке система вознаграждения представляет собой совокупность мозговых структур и нейронных путей, которые отвечают за познание, связанное с вознаграждением, включая ассоциативное обучение (в первую очередь классическое обусловливание и оперантное подкрепление ), стимульную значимость (т. е. мотивацию и «желание», желание или тягу к вознаграждению) и положительно-валентные эмоции , в частности эмоции, связанные с удовольствием (т. е. гедонистическую «симпатию»). [1] [3]
Термины, которые обычно используются для описания поведения, связанного с компонентом «желания» или желания вознаграждения, включают аппетитное поведение, поведение приближения, подготовительное поведение, инструментальное поведение, предвосхищающее поведение и поиск. [9] Термины, которые обычно используются для описания поведения, связанного с компонентом «симпатии» или удовольствия вознаграждения, включают консуматорное поведение и поведение взятия. [9]
Три основные функции вознаграждений заключаются в их способности:
Структуры мозга, составляющие систему вознаграждения, расположены в основном в кортико-базальных ганглиях-таламо-кортикальной петле ; [10] часть петли, состоящая из базальных ганглиев, управляет активностью в системе вознаграждения. [10] Большинство путей, которые соединяют структуры в системе вознаграждения, представляют собой глутаматергические интернейроны , ГАМКергические средние шипиковые нейроны (MSN) и дофаминергические проекционные нейроны , [10] [11] хотя другие типы проекционных нейронов вносят свой вклад (например, орексинергические проекционные нейроны). Система вознаграждения включает в себя вентральную область покрышки , вентральный полосатый участок (то есть прилежащее ядро и обонятельный бугорок ), дорсальный полосатый участок (то есть хвостатое ядро и скорлупа ), черную субстанцию (то есть компактную и ретикулярную части ), префронтальную кору , переднюю поясную кору , островковую кору , гиппокамп , гипоталамус (в частности, орексинергическое ядро в латеральном гипоталамусе ), таламус (множественные ядра), субталамическое ядро , бледный шар (как наружный, так и внутренний ), вентральный бледный шар , парабрахиальное ядро , миндалевидное тело и оставшуюся часть расширенной миндалевидной железы . [3] [10] [12] [13] [14] Дорсальное ядро шва и мозжечок, по-видимому, модулируют некоторые формы познания, связанного с вознаграждением (например, ассоциативное обучение , мотивационную значимость и положительные эмоции ), а также поведение. [15] [16] [17] Латеродорсальное ядро покрышки (LDT) , ножкомостовое ядро (PPTg) и латеральная габенула (LHb) (как напрямую, так и косвенно через ростромедиальное ядро покрышки (RMTg) ) также способны вызывать аверсивную значимость и стимульную значимость.через свои проекции в вентральную область покрышки (VTA). [18] LDT и PPTg оба посылают глутаминэргические проекции в VTA, которые синапсируют на дофаминергических нейронах, оба из которых могут вызывать стимульную значимость. LHb посылает глутаминэргические проекции, большинство из которых синапсируют на ГАМКергических нейронах RMTg, которые, в свою очередь, вызывают торможение дофаминергических нейронов VTA, хотя некоторые проекции LHb заканчиваются на интернейронах VTA. Эти проекции LHb активируются как аверсивными стимулами, так и отсутствием ожидаемого вознаграждения, и возбуждение LHb может вызывать аверсию. [19] [20] [21]
Большинство дофаминовых путей (т. е. нейронов, которые используют нейротрансмиттер дофамин для связи с другими нейронами), которые выступают из вентральной области покрышки, являются частью системы вознаграждения; [10] в этих путях дофамин действует на D1-подобные рецепторы или D2-подобные рецепторы, чтобы либо стимулировать (D1-подобные), либо ингибировать (D2-подобные) выработку цАМФ . [22] ГАМКергические средние шипиковые нейроны полосатого тела также являются компонентами системы вознаграждения. [10] Глутаматергические проекционные ядра в субталамическом ядре, префронтальной коре, гиппокампе, таламусе и миндалевидном теле связаны с другими частями системы вознаграждения через глутаматные пути. [10] Медиальный пучок переднего мозга , представляющий собой набор множества нейронных путей, которые опосредуют вознаграждение за стимуляцию мозга (т. е. вознаграждение, получаемое в результате прямой электрохимической стимуляции латерального гипоталамуса ), также является компонентом системы вознаграждения. [23]
Существуют две теории относительно активности прилежащего ядра и генерации симпатии и желания. Гипотеза торможения (или гиперполяризации) предполагает, что прилежащее ядро оказывает тоническое ингибирующее действие на нижестоящие структуры, такие как вентральный паллидум, гипоталамус или вентральная область покрышки, и что при торможении MSN в прилежащем ядре (NAcc) эти структуры возбуждаются, «высвобождая» поведение, связанное с вознаграждением. В то время как агонисты рецепторов ГАМК способны вызывать как реакции «нравится», так и «хочет» в прилежащем ядре, глутаминергические входы из базолатеральной миндалины , вентрального гиппокампа и медиальной префронтальной коры могут управлять стимульной заметностью. Кроме того, в то время как большинство исследований показывают, что нейроны NAcc снижают активность в ответ на вознаграждение, ряд исследований показывают противоположную реакцию. Это привело к предложению гипотезы растормаживания (или деполяризации), которая предполагает, что возбуждение нейронов NAcc или, по крайней мере, определенных подгрупп, управляет поведением, связанным с вознаграждением. [3] [24] [25]
После почти 50 лет исследований вознаграждения за стимуляцию мозга эксперты подтвердили, что десятки участков мозга будут поддерживать внутричерепную самостимуляцию . Регионы включают латеральный гипоталамус и медиальные пучки переднего мозга, которые особенно эффективны. Стимуляция там активирует волокна, которые образуют восходящие пути; восходящие пути включают мезолимбический дофаминовый путь , который выступает из вентральной области покрышки в прилежащее ядро . Существует несколько объяснений того, почему мезолимбический дофаминовый путь является центральным для схем, опосредующих вознаграждение. Во-первых, наблюдается заметное увеличение высвобождения дофамина из мезолимбического пути, когда животные занимаются внутричерепной самостимуляцией. [5] Во-вторых, эксперименты последовательно показывают, что вознаграждение за стимуляцию мозга стимулирует усиление путей, которые обычно активируются естественными вознаграждениями , а вознаграждение за наркотики или внутричерепная самостимуляция могут вызывать более мощную активацию центральных механизмов вознаграждения, поскольку они активируют центр вознаграждения напрямую, а не через периферические нервы . [5] [26] [27] В-третьих, когда животным вводят вызывающие привыкание наркотики или они занимаются естественным вознаграждающим поведением, таким как кормление или сексуальная активность, происходит заметное высвобождение дофамина в прилежащем ядре. [5] Однако дофамин — не единственное вознаграждающее соединение в мозге.

Вентральная область покрышки
Полосатое тело (прилежащее ядро)
Префронтальная кора
Гиппокамп
Миндалевидное тело
Удовольствие является компонентом вознаграждения, но не все вознаграждения являются приятными (например, деньги не вызывают удовольствия, если эта реакция не обусловлена). [2] Стимулы, которые по своей природе приятны и, следовательно, привлекательны, известны как внутренние вознаграждения , тогда как стимулы, которые привлекательны и мотивируют поведение подхода, но по своей сути не являются приятными, называются внешними вознаграждениями . [2] Внешние вознаграждения (например, деньги) являются вознаграждающими в результате усвоенной ассоциации с внутренним вознаграждением. [2] Другими словами, внешние вознаграждения действуют как мотивационные магниты, которые вызывают реакции «желания», но не «приязни», как только они были приобретены. [2]
Система вознаграждения содержит центры удовольствия или гедонистические горячие точки , т. е. структуры мозга, которые опосредуют удовольствие или реакции «нравится» от внутренних вознаграждений. По состоянию на октябрь 2017 года [обновлять]гедонистические горячие точки были идентифицированы в субкомпартментах внутри оболочки прилежащего ядра , вентрального паллидума , парабрахиального ядра , орбитофронтальной коры (ОФК) и островковой коры . [3] [14] [36] Горячая точка внутри оболочки прилежащего ядра расположена в ростродорсальном квадранте медиальной оболочки, в то время как гедонистическая холодная точка расположена в более задней области. Задний вентральный паллидум также содержит гедонистическую горячую точку, в то время как передний вентральный паллидум содержит гедонистическую холодную точку. У крыс микроинъекции опиоидов , эндоканнабиноидов и орексина способны усиливать реакции симпатии в этих горячих точках. [3] Было показано, что гедонистические горячие точки, расположенные в передней части OFC и задней части островка, реагируют на орексин и опиоиды у крыс, как и перекрывающаяся гедонистическая холодная точка в передней части островка и задней части OFC. [36] С другой стороны, было показано, что горячая точка парабрахиального ядра реагирует только на агонисты бензодиазепиновых рецепторов. [3]
Гедонистические горячие точки функционально связаны, в том смысле, что активация одной горячей точки приводит к привлечению других, что индексируется индуцированной экспрессией c -Fos , немедленного раннего гена . Более того, ингибирование одной горячей точки приводит к притуплению эффектов активации другой горячей точки. [3] [36] Поэтому одновременная активация каждой гедонистической горячей точки в системе вознаграждения считается необходимой для создания ощущения интенсивной эйфории . [37]

Стимулирующая заметность — это атрибут «желания» или «стремления», включающий мотивационный компонент, который назначается поощрительному стимулу оболочкой прилежащего ядра (оболочкой ПЯ). [2] [38] [39] Степень нейротрансмиссии дофамина в оболочку ПЯ из мезолимбического пути тесно связана с величиной стимулирующей заметности для поощрительных стимулов. [38]
Активация дорсоростральной области прилежащего ядра коррелирует с увеличением желания без сопутствующего увеличения симпатии. [40] Однако дофаминергическая нейротрансмиссия в оболочке прилежащего ядра отвечает не только за привлекательное мотивационное выделение (т. е. стимулирующее выделение) в сторону вознаграждающих стимулов, но и за аверсивное мотивационное выделение, которое направляет поведение в сторону от нежелательных стимулов. [9] [41] [42] В дорсальном полосатом теле активация D1, экспрессирующих MSN, вызывает привлекательное стимулирующее выделение, в то время как активация D2, экспрессирующих MSN, вызывает отвращение. В NAcc такая дихотомия не столь четкая, и активация как D1, так и D2 MSN достаточна для усиления мотивации, [43] [44], вероятно, посредством растормаживания VTA посредством ингибирования вентрального паллидума. [45] [46]
Теория сенсибилизации стимула Робинсона и Берриджа 1993 года предполагает, что вознаграждение содержит разделяемые психологические компоненты: желание (стимул) и симпатия (удовольствие). Чтобы объяснить увеличение контакта с определенным стимулом, таким как шоколад, действуют два независимых фактора — наше желание иметь шоколад (желание) и эффект удовольствия от шоколада (симпатия). По мнению Робинсона и Берриджа, желание и симпатия — это два аспекта одного и того же процесса, поэтому вознаграждения обычно желаемы и любимы в одинаковой степени. Однако желание и симпатия также изменяются независимо при определенных обстоятельствах. Например, крысы, которые не едят после получения дофамина (испытывая потерю желания есть), ведут себя так, как будто они все еще любят еду. В другом примере активированные электроды самостимуляции в латеральном гипоталамусе крыс повышают аппетит, но также вызывают более неблагоприятные реакции на вкусы, такие как сахар и соль; по-видимому, стимуляция увеличивает желание, но не симпатию. Такие результаты показывают, что система вознаграждения крыс включает независимые процессы желания и симпатии. Предполагается, что компонент желания контролируется дофаминергическими путями , тогда как компонент симпатии контролируется системами опиат-ГАМК-эндоканнабиноиды. [5]
Koobs & Le Moal предположили, что существует отдельная схема, ответственная за ослабление поведения, направленного на получение вознаграждения, которую они назвали анти-вознаграждающей схемой. Этот компонент действует как тормоз на вознаграждающей схеме, тем самым предотвращая чрезмерное стремление к еде, сексу и т. д. Эта схема включает в себя несколько частей миндалевидного тела (ядро ложа конечной полоски, центральное ядро), прилежащее ядро и сигнальные молекулы, включая норадреналин, кортикотропин-рилизинг-фактор и динорфин. [47] Также предполагается, что эта схема опосредует неприятные компоненты стресса и, таким образом, считается вовлеченной в зависимость и абстиненцию. В то время как вознаграждающая схема опосредует первоначальное положительное подкрепление, участвующее в развитии зависимости, именно анти-вознаграждающая схема, которая позже доминирует через отрицательное подкрепление, мотивирует стремление к вознаграждающим стимулам. [48]
Вознаграждающие стимулы могут стимулировать обучение как в форме классического обусловливания (обусловливание Павлова) , так и оперантного обусловливания (инструментальное обусловливание) . В классическом обусловливании вознаграждение может действовать как безусловный стимул, который, будучи связанным с условным стимулом, заставляет условный стимул вызывать как мышечно-скелетные (в форме простого поведения приближения и избегания), так и вегетативные реакции. В оперантном обусловливании вознаграждение может действовать как подкрепление, поскольку оно увеличивает или поддерживает действия, которые ведут к нему самому. [1] Выученные поведения могут быть или не быть чувствительными к ценности результатов, к которым они приводят; поведения, которые чувствительны к обусловленности результата при выполнении действия, а также к ценности результата, являются целенаправленными , в то время как вызванные действия, которые нечувствительны к обусловленности или ценности, называются привычками . [49] Считается, что это различие отражает две формы обучения: свободное от моделей и основанное на моделях. Обучение без моделей включает в себя простое кэширование и обновление значений. Напротив, обучение на основе моделей подразумевает хранение и построение внутренней модели событий, которая позволяет делать выводы и гибкие прогнозы. Хотя павловское обусловливание обычно считается свободным от моделей, значимость стимула, приписываемая условному стимулу, является гибкой по отношению к изменениям во внутренних мотивационных состояниях. [50]
Отдельные нейронные системы отвечают за изучение ассоциаций между стимулами и результатами, действиями и результатами, а также стимулами и реакциями. Хотя классическое обусловливание не ограничивается системой вознаграждения, улучшение инструментальной производительности стимулами (т. е. павловско-инструментальный перенос ) требует прилежащего ядра. Привычное и целенаправленное инструментальное обучение зависят от латерального и медиального полосатого тела соответственно. [ 49]
Во время инструментального обучения противоположные изменения в соотношении рецепторов AMPA к NMDA и фосфорилированному ERK происходят в MSN типа D 1 и D 2 , которые составляют прямой и непрямой пути соответственно. [51] [52] Эти изменения синаптической пластичности и сопутствующее обучение зависят от активации стриарных рецепторов D1 и NMDA. Внутриклеточный каскад, активируемый рецепторами D1, включает в себя привлечение протеинкиназы A и посредством результирующего фосфорилирования DARPP-32 , ингибирование фосфатаз, которые дезактивируют ERK. Рецепторы NMDA активируют ERK через другой, но взаимосвязанный путь Ras-Raf-MEK-ERK . Одна только активация ERK, опосредованная NMDA, является самоограниченной, поскольку активация NMDA также ингибирует ингибирование дезактивирующих ERK фосфатаз, опосредованное PKA. Однако, когда каскады D1 и NMDA активируются совместно, они работают синергически, и результирующая активация ERK регулирует синаптическую пластичность в форме реструктуризации шипиков, транспорта рецепторов AMPA, регуляции CREB и повышения клеточной возбудимости посредством ингибирования Kv4.2 . [53] [54] [55]
ΔFosB (DeltaFosB) – фактор транскрипции гена – сверхэкспрессия в средних шипиковых нейронах типа D1 прилежащего ядра является важнейшим общим фактором практически среди всех форм зависимости (т. е. поведенческих зависимостей и наркозависимостей ), который вызывает связанное с зависимостью поведение и нейронную пластичность . [56] [57] [58] [59] В частности, ΔFosB способствует самоупотреблению , сенсибилизации вознаграждением и эффектам перекрестной сенсибилизации вознаграждением среди определенных наркотических веществ и видов поведения, вызывающих зависимость. [56] [57] [58] [60] [61] Также известно, что определенные эпигенетические модификации хвостов гистоновых белков (т. е. модификации гистонов) в определенных областях мозга играют решающую роль в молекулярной основе зависимостей . [ 59] [62] [63] [64]
Наркотики и поведение, вызывающие зависимость , вознаграждают и подкрепляют (т.е. вызывают привыкание ) из-за их воздействия на дофаминовый путь вознаграждения . [13] [65]
Латеральный гипоталамус и медиальный передний мозговой пучок были наиболее часто изучаемым местом вознаграждения за стимуляцию мозга, особенно в исследованиях влияния наркотиков на вознаграждение за стимуляцию мозга. [66] Нейротрансмиттерная система, которая была наиболее четко идентифицирована с действием наркотических веществ, вызывающих привыкание, — это мезолимбическая дофаминовая система с ее эфферентными мишенями в прилежащем ядре и ее локальными ГАМКергическими афферентами. Действия амфетамина и кокаина, связанные с вознаграждением, находятся в дофаминергических синапсах прилежащего ядра и, возможно, медиальной префронтальной коры . Крысы также обучаются нажимать рычаг для инъекций кокаина в медиальную префронтальную кору, что работает за счет увеличения оборота дофамина в прилежащем ядре. [67] [68] Никотин, вводимый непосредственно в прилежащее ядро, также усиливает локальное высвобождение дофамина, предположительно, за счет пресинаптического воздействия на дофаминергические окончания этой области. Никотиновые рецепторы локализуются в телах дофаминергических клеток, а местные инъекции никотина усиливают дофаминергическую активацию клеток, что имеет решающее значение для никотинового вознаграждения. [69] [70] Некоторые дополнительные вызывающие привыкание препараты также, вероятно, снижают выход средних шипиковых нейронов в результате, несмотря на активацию дофаминергических проекций. Для опиатов участок с самым низким порогом для эффектов вознаграждения включает воздействие на ГАМКергические нейроны в вентральной тегментальной области , вторичном участке вознаграждающих опиатов действий на средние шипиковые выходные нейроны прилежащего ядра. Таким образом, следующее составляет ядро в настоящее время характеризуемой схемы вознаграждения за наркотики; ГАМКергические афференты к мезолимбическим дофаминовым нейронам (первичный субстрат опиатного вознаграждения), сами мезолимбические дофаминовые нейроны (первичный субстрат психомоторного стимулирующего вознаграждения) и ГАМКергические эфференты к мезолимбическим дофаминовым нейронам (вторичный участок опиатного вознаграждения). [66]
Дисфункциональная мотивационная заметность проявляется в ряде психиатрических симптомов и расстройств. Ангедония , традиционно определяемая как сниженная способность испытывать удовольствие, была пересмотрена как отражение притупленной стимульной заметности, поскольку большинство ангедонических популяций демонстрируют нетронутую «симпатию». [71] [72] С другой стороны, повышенная стимульная заметность, суженная для определенных стимулов, характерна для поведенческих и наркотических зависимостей. В случае страха или паранойи дисфункция может заключаться в повышенной аверсивной заметности . [73] В современной литературе ангедония связана с предложенными двумя формами удовольствия: «предвосхищающим» и «консумматорным».
Исследования нейровизуализации при диагнозах, связанных с ангедонией, выявили снижение активности в OFC и вентральном полосатом теле. [74] В одном метаанализе сообщалось, что ангедония связана с пониженной нейронной реакцией на ожидание вознаграждения в хвостатом ядре, скорлупе, прилежащем ядре и медиальной префронтальной коре (mPFC). [75]
Определенные типы депрессии связаны со сниженной мотивацией, оцениваемой по готовности прилагать усилия ради вознаграждения. Эти аномалии предварительно связывают со сниженной активностью в областях полосатого тела, и хотя предполагается, что дофаминергические аномалии играют определенную роль, большинство исследований, изучающих функцию дофамина при депрессии, сообщают о противоречивых результатах. [76] [77] Хотя посмертные и нейровизуализационные исследования обнаружили аномалии во многих регионах системы вознаграждения, лишь немногие результаты последовательно воспроизводятся. В некоторых исследованиях сообщается о сниженной активности NAcc, гиппокампа, медиальной префронтальной коры (mPFC) и орбитофронтальной коры (OFC), а также о повышенной активности базолатеральной миндалины и субгенуальной поясной извилины (sgACC) во время задач, связанных с вознаграждением или положительными стимулами. Эти нейровизуализационные аномалии дополняются небольшими посмертными исследованиями, но то немногое исследование, которое было сделано, предполагает снижение возбуждающих синапсов в mPFC. [78] Сниженная активность в mPFC во время задач, связанных с вознаграждением, по-видимому, локализуется в более дорсальных областях (т. е. в прегенуальной поясной извилине ), в то время как более вентральная sgACC гиперактивна при депрессии. [79]
Попытки исследовать лежащую в основе нейронную схему в моделях животных также дали противоречивые результаты. Обычно используются две парадигмы для моделирования депрессии, хронического социального поражения (CSDS) и хронического легкого стресса (CMS), хотя существует множество других. CSDS вызывает снижение предпочтения сахарозы, снижение социальных взаимодействий и увеличение неподвижности в тесте принудительного плавания. CMS аналогичным образом снижает предпочтение сахарозы и поведенческое отчаяние, оцениваемое с помощью тестов подвешивания за хвост и принудительного плавания. Животные, восприимчивые к CSDS, демонстрируют повышенную фазовую активацию VTA, а ингибирование проекций VTA-NAcc ослабляет поведенческие дефициты, вызванные CSDS. [80] Однако ингибирование проекций VTA - mPFC усугубляет социальную отчужденность. С другой стороны, CMS-ассоциированное снижение предпочтения сахарозы и неподвижности ослаблялось и усугублялось возбуждением и ингибированием VTA соответственно. [81] [82] Хотя эти различия могут быть обусловлены различными протоколами стимуляции или плохими трансляционными парадигмами, переменные результаты могут также заключаться в гетерогенной функциональности областей, связанных с вознаграждением. [83]
Оптогенетическая стимуляция mPFC в целом производит антидепрессантные эффекты. Этот эффект, по-видимому, локализован в гомологе pgACC (прелимбической коре) грызунов, поскольку стимуляция гомолога sgACC (инфралимбической коре) грызунов не производит поведенческих эффектов. Более того, глубокая стимуляция мозга в инфралимбической коре, которая, как считается, имеет ингибирующий эффект, также производит антидепрессантный эффект. Это открытие согласуется с наблюдением, что фармакологическое ингибирование инфралимбической коры ослабляет депрессивное поведение. [83]
Шизофрения связана с дефицитом мотивации, обычно группируемым под другими негативными симптомами, такими как сниженная спонтанная речь . Часто сообщается, что опыт «симпатии» остается нетронутым, [84] как поведенческим, так и нейронным, хотя результаты могут быть специфичны для определенных стимулов, таких как денежное вознаграждение. [85] Кроме того, неявное обучение и простые задачи, связанные с вознаграждением, также остаются нетронутыми при шизофрении. [86] Скорее, дефицит в системе вознаграждения становится очевидным во время задач, связанных с вознаграждением, которые являются когнитивно сложными. Эти дефициты связаны как с аномальной активностью полосатого тела и ОФК, так и с аномалиями в областях, связанных с когнитивными функциями, такими как дорсолатеральная префронтальная кора (ДЛПФК). [87]
У людей с СДВГ основные аспекты системы вознаграждения неактивны, что затрудняет получение вознаграждения от регулярных действий. Люди с расстройством испытывают всплеск мотивации после того, как высокостимулирующее поведение запускает выброс дофамина. После этого всплеска и вознаграждения возвращение к исходным уровням приводит к немедленному падению мотивации. [88]
Нарушения дофаминергической и серотонинергической функции считаются ключевыми факторами СДВГ. [89] Эти нарушения могут привести к исполнительной дисфункции, такой как нарушение регуляции обработки вознаграждения и мотивационная дисфункция, включая ангедонию. [90]
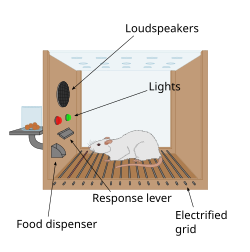
Первая подсказка о наличии системы вознаграждения в мозге появилась благодаря случайному открытию Джеймса Олдса и Питера Милнера в 1954 году. Они обнаружили, что крысы будут выполнять такие действия, как нажатие на рычаг, чтобы нанести кратковременный импульс электрической стимуляции определенным участкам мозга. Это явление называется внутричерепной самостимуляцией или вознаграждением за стимуляцию мозга . Обычно крысы нажимают на рычаг сотни или тысячи раз в час, чтобы получить эту стимуляцию мозга, останавливаясь только тогда, когда они истощаются. При попытке научить крыс решать задачи и проходить лабиринты, стимуляция определенных областей мозга, где была обнаружена стимуляция, казалось, доставляла животным удовольствие. Они попробовали сделать то же самое с людьми, и результаты были похожими. Объяснение того, почему животные проявляют поведение, которое не имеет никакой ценности для выживания ни их самих, ни их вида, заключается в том, что стимуляция мозга активирует систему, лежащую в основе вознаграждения. [91]
В фундаментальном открытии, сделанном в 1954 году, исследователи Джеймс Олдс и Питер Милнер обнаружили, что низковольтная электрическая стимуляция определенных областей мозга крысы действовала как вознаграждение при обучении животных проходить лабиринты и решать задачи. [92] [ не удалось проверить ] [93] Казалось, что стимуляция этих частей мозга доставляла животным удовольствие, [92] и в более поздних работах люди сообщали о приятных ощущениях от такой стимуляции. [ необходима цитата ] Когда крыс тестировали в ящиках Скиннера , где они могли стимулировать систему вознаграждения, нажимая на рычаг, крысы нажимали в течение нескольких часов. [93] Исследования в течение следующих двух десятилетий установили, что дофамин является одним из основных химических веществ, помогающих нейронной сигнализации в этих областях, и было высказано предположение, что дофамин является «химическим веществом удовольствия» мозга. [94]
Иван Павлов был психологом, который использовал систему вознаграждения для изучения классического обусловливания . Павлов использовал систему вознаграждения, вознаграждая собак едой после того, как они слышали звонок или другой стимул. Павлов вознаграждал собак так, чтобы собаки ассоциировали еду, вознаграждение, со звонком, стимулом. [95] Эдвард Л. Торндайк использовал систему вознаграждения для изучения оперантного обусловливания. Он начал с того, что поместил кошек в коробку-головоломку и поместил еду снаружи коробки, так что кошка хотела сбежать. Кошки пытались выбраться из коробки-головоломки, чтобы добраться до еды. Хотя кошки съедали еду после того, как сбегали из коробки, Торндайк узнал, что кошки пытались сбежать из коробки без вознаграждения едой. Торндайк использовал вознаграждение едой и свободой, чтобы стимулировать систему вознаграждения кошек. Торндайк использовал это, чтобы увидеть, как кошки научились сбегать из коробки. [96] Совсем недавно Иван Де Араужо и его коллеги использовали питательные вещества внутри кишечника, чтобы стимулировать систему вознаграждения через блуждающий нерв. [97]
Животные быстро учатся нажимать на рычаг, чтобы получить инъекцию опиатов непосредственно в покрышку среднего мозга или прилежащее ядро . Те же животные не работают, чтобы получить опиаты, если дофаминергические нейроны мезолимбического пути инактивированы. С этой точки зрения животные, как и люди, участвуют в поведении, которое увеличивает выброс дофамина.
Кент Берридж , исследователь в области аффективной нейронауки , обнаружил, что сладкий ( нравится ) и горький ( не нравится ) вкусы вызывают различные орофациальные выражения , и эти выражения были одинаково продемонстрированы новорожденными людьми, орангутанами и крысами. Это было доказательством того, что удовольствие (в частности, симпатия ) имеет объективные характеристики и было по сути одинаковым у разных видов животных. Большинство исследований нейронауки показали, что чем больше дофамина высвобождается вознаграждением, тем оно эффективнее. Это называется гедонистическим воздействием, которое может быть изменено усилием для получения вознаграждения и самим вознаграждением. Берридж обнаружил, что блокирование дофаминовых систем, по-видимому, не изменило положительную реакцию на что-то сладкое (измеряемую по выражению лица). Другими словами, гедонистическое воздействие не менялось в зависимости от количества сахара. Это опровергло общепринятое предположение о том, что дофамин опосредует удовольствие. Даже при более интенсивных изменениях дофамина данные, казалось, оставались неизменными. [98] Однако клиническое исследование, проведенное в январе 2019 года, в котором оценивалось влияние предшественника дофамина ( леводопы ), антагониста ( рисперидона ) и плацебо на реакцию вознаграждения на музыку, включая степень удовольствия, испытываемого во время музыкального озноба , измеряемую по изменениям электродермальной активности , а также субъективным оценкам, показало, что манипулирование нейротрансмиссией дофамина двунаправленно регулирует познание удовольствия (в частности, гедонистическое воздействие музыки ) у людей. [99] [100] Это исследование продемонстрировало, что повышенная нейротрансмиссия дофамина действует как непременное условие для приятных гедонистических реакций на музыку у людей. [99] [100]
Берридж разработал гипотезу значимости стимула , чтобы рассмотреть аспект желания вознаграждения. Она объясняет компульсивное употребление наркотиков наркоманами, даже когда наркотик больше не вызывает эйфории, и тягу, испытываемую даже после того, как человек закончил проходить через абстиненцию. Некоторые наркоманы реагируют на определенные стимулы, включающие нейронные изменения, вызванные наркотиками. Эта сенсибилизация в мозге похожа на эффект дофамина, потому что возникают реакции желания и симпатии . Мозг и поведение человека и животных испытывают схожие изменения в отношении систем вознаграждения, потому что эти системы настолько заметны. [98]
Награды в оперантном обусловливании являются положительными подкрепителями. ... Оперантное поведение дает хорошее определение наградам. Все, что заставляет человека возвращаться за добавкой, является положительным подкрепителем и, следовательно, наградой. Хотя это дает хорошее определение, положительное подкрепление является лишь одной из нескольких функций награды. ... Награды привлекательны. Они мотивируют и заставляют нас прилагать усилия. ... Награды вызывают поведение приближения, также называемое аппетитным или подготовительным поведением, сексуальным поведением и потребительским поведением. ... Таким образом, любой стимул, объект, событие, деятельность или ситуация, которые потенциально могут заставить нас приблизиться и потребить их, по определению являются наградой. ... Наградные стимулы, объекты, события, ситуации и виды деятельности состоят из нескольких основных компонентов. Во-первых, награды имеют основные сенсорные компоненты (зрительные, слуховые, соматосенсорные, вкусовые и обонятельные) ... Во-вторых, награды заметны и, таким образом, вызывают внимание, которое проявляется в виде ориентировочных реакций. Выразительность вознаграждений вытекает из трех основных факторов, а именно, их физической интенсивности и воздействия (физическая заметность), их новизны и неожиданности (выразительность новизны/неожиданности) и их общего мотивационного воздействия, разделяемого с наказаниями (мотивационная заметность). Отдельная форма, не включенная в эту схему, стимулирующая заметность, в первую очередь касается функции дофамина в зависимости и относится только к поведению приближения (в отличие от обучения) ... В-третьих, вознаграждения имеют ценностный компонент, который определяет положительно мотивирующие эффекты вознаграждений и не содержится в сенсорных и внимающих компонентах и не объясняется ими. Этот компонент отражает поведенческие предпочтения и, таким образом, является субъективным и лишь частично определяется физическими параметрами. Только этот компонент составляет то, что мы понимаем как вознаграждение. Он опосредует конкретные поведенческие подкрепляющие, генерирующие приближение и эмоциональные эффекты вознаграждений, которые имеют решающее значение для выживания и воспроизводства организма, тогда как все остальные компоненты только поддерживают эти функции. ... Награды также могут быть присущи поведению. Они контрастируют с внешними вознаграждениями, которые обеспечивают мотивацию поведения и составляют суть оперантного поведения в лабораторных тестах. Внутренние вознаграждения — это действия, которые сами по себе приятны и предпринимаются ради них самих, не являясь средством получения внешних вознаграждений. ... Внутренние вознаграждения сами по себе являются подлинными вознаграждениями, поскольку они вызывают обучение, подход и удовольствие, например, совершенствование, игра и наслаждение игрой на пианино. Хотя они могут служить для обусловливания вознаграждений более высокого порядка, они не являются обусловленными вознаграждениями более высокого порядка, поскольку достижение их свойств вознаграждения не требует сопряжения с безусловным вознаграждением. ... Эти эмоции также называются симпатией (для удовольствия) и желанием (для желания) в исследованиях зависимости и решительно поддерживают функции вознаграждения, генерирующие обучение и подход.
В префронтальной коре последние данные указывают на то, что [орбитофронтальная кора] OFC и островковая кора могут содержать собственные дополнительные горячие точки (DC Castro et al., Soc. Neurosci., аннотация). В определенных субрегионах каждой области микроинъекции, стимулирующие опиоиды или орексины, по-видимому, увеличивают количество реакций
симпатии
, вызванных сладкостью, подобно горячим точкам [nucleus accumbens] NAc и [ventral pallidum] VP. Успешное подтверждение гедонистических горячих точек в OFC или островке было бы важным и, возможно, релевантным для орбитофронтального средне-переднего участка, упомянутого ранее, который особенно отслеживает субъективное удовольствие от пищи у людей (Georgiadis et al., 2012; Kringelbach, 2005; Kringelbach et al., 2003; Small et al., 2001; Veldhuizen et al., 2010). Наконец, в стволе мозга участок заднего мозга около парабрахиального ядра дорсальной части моста также, по-видимому, способен вносить вклад в гедонистические приобретения функций (Söderpalm and Berridge, 2000). Механизм удовольствия в стволе мозга может показаться более удивительным, чем горячие точки переднего мозга, для любого, кто рассматривает ствол мозга как просто рефлекторный, но парабрахиальное ядро моста способствует вкусу, боли и многим висцеральным ощущениям от тела, а также, как предполагается, играет важную роль в мотивации (Wu et al., 2012) и в человеческих эмоциях (особенно связанных с гипотезой соматических маркеров) (Damasio, 2010).
[Полосатое тело] получает дофаминергические входы от вентральной области покрышки (VTA) и черной субстанции (SNr), а также глутаматергические входы от нескольких областей, включая кору, гиппокамп, миндалевидное тело и таламус (Swanson, 1982; Phillipson и Griffiths, 1985; Finch, 1996; Groenewegen et al., 1999; Britt et al., 2012). Эти глутаматергические входы контактируют на головках дендритных шипиков стриатумных ГАМКергических средних шипиковых проекционных нейронов (MSN), тогда как дофаминергические входы синаптически связаны с шейкой позвоночника, что обеспечивает важное и сложное взаимодействие между этими двумя входами в модуляции активности MSN... Следует также отметить, что существует небольшая популяция нейронов в [nucleus accumbens] NAc, которые коэкспрессируют как рецепторы D1, так и D2, хотя это в значительной степени ограничено оболочкой NAc (Bertran-Gonzalez et al., 2008). ... Нейроны в ядре NAc и подразделениях оболочки NAc также функционально различаются. Ядро NAc участвует в обработке условных стимулов, тогда как оболочка NAc более важна в обработке безусловных стимулов; Классически считается, что эти две популяции MSN стриатума оказывают противоположные эффекты на выход базальных ганглиев. Активация dMSN вызывает чистое возбуждение таламуса, что приводит к положительной кортикальной обратной связи; тем самым действуя как сигнал «вперед» для инициирования поведения. Активация iMSN, однако, вызывает чистое торможение таламической активности, что приводит к отрицательной кортикальной обратной связи и, следовательно, служит «тормозом» для торможения поведения ... также появляется все больше доказательств того, что iMSN играют роль в мотивации и зависимости (Lobo and Nestler, 2011; Grueter et al., 2013). Например, оптогенетическая активация ядра и оболочки NAc iMSN подавила развитие кокаинового CPP, тогда как селективная абляция ядра и оболочки NAc iMSN ... усилила развитие и сохранение амфетаминового CPP (Durieux et al., 2009; Lobo et al., 2010). Эти результаты свидетельствуют о том, что iMSN могут двунаправленно модулировать вознаграждение за наркотики. ... В совокупности эти данные свидетельствуют о том, что iMSN обычно действуют, сдерживая поведение, связанное с приемом наркотиков, и активация этих нейронов может фактически защищать от развития компульсивного употребления наркотиков.
Регионы базальных ганглиев, которые включают дорсальный и вентральный стриатум, внутренние и внешние сегменты бледного шара, субталамическое ядро и тела дофаминергических клеток в черной субстанции, в значительной степени вовлечены не только в тонкую моторику, но и в функцию [префронтальной коры] ПФК.43 Из этих регионов [прилежащее ядро] NAc (описано выше) и [дорсальный стриатум] DS (описано ниже) чаще всего исследуются в отношении зависимости. Таким образом, здесь будет упомянуто только краткое описание модуляторной роли базальных ганглиев в цепях, связанных с зависимостью. Общий выход базальных ганглиев осуществляется преимущественно через таламус, который затем проецируется обратно в ПФК, образуя кортико-стриатно-таламо-кортикальные (CSTC) петли. Три петли CSTC предложены для модуляции исполнительной функции, выбора действия и поведенческого торможения. В дорсолатеральной префронтальной цепи базальные ганглии в первую очередь модулируют идентификацию и выбор целей, включая вознаграждения.44 Цепь OFC [орбитофронтальной коры] модулирует принятие решений и импульсивность, а передняя поясная цепь модулирует оценку последствий.44 Эти цепи модулируются дофаминергическими входами из [вентральной тегментальной области] VTA, чтобы в конечном итоге направлять поведение, относящееся к зависимости, включая настойчивость и сужение поведенческого репертуара в сторону поиска наркотиков и продолжающегося употребления наркотиков, несмотря на негативные последствия.43–45
Исследования показали, что тяга подкрепляется активацией цепей вознаграждения и мотивации (McBride et al., 2006, Wang et al., 2007, Wing et al., 2012, Goldman et al., 2013, Jansen et al., 2013 и Volkow et al., 2013). По мнению этих авторов, основными вовлеченными нейронными структурами являются: прилежащее ядро, дорсальный полосатый участок, орбитофронтальная кора, передняя поясная извилина, дорсолатеральная префронтальная кора (ДЛПФК), миндалевидное тело, гиппокамп и островок.
Нейронные субстраты, которые лежат в основе восприятия вознаграждения и феномена положительного подкрепления, представляют собой набор взаимосвязанных структур переднего мозга, называемых путями вознаграждения мозга; они включают прилежащее ядро (NAc; основной компонент вентрального полосатого тела), базальный передний мозг (компоненты которого были названы расширенной миндалиной, как обсуждается далее в этой главе), гиппокамп, гипоталамус и фронтальные области коры головного мозга. Эти структуры получают богатую дофаминергическую иннервацию от вентральной области покрышки (VTA) среднего мозга. Наркотики, вызывающие зависимость, вознаграждают и подкрепляют, потому что они действуют в путях вознаграждения мозга, чтобы усилить либо высвобождение дофамина, либо эффекты дофамина в NAc или связанных структурах, или потому что они производят эффекты, подобные дофамину. ... Макроструктура, постулируемая для интеграции многих функций этой схемы, описывается некоторыми исследователями как расширенная миндалина. Считается, что расширенная миндалина включает в себя несколько базальных структур переднего мозга, которые имеют схожую морфологию, иммуноцитохимические характеристики и связность и которые хорошо подходят для опосредования аспектов функции вознаграждения; к ним относятся ядро ложа терминальной полоски, центральная медиальная миндалина, оболочка NAc и подчечевичное вещество безымянной субстанции.
в орбитофронтальной коре и островке причинно усиливают гедонистические реакции «симпатии» к сладкому и находим третий кортикальный участок, где те же нейрохимические стимуляции снижают положительное гедонистическое воздействие.
Поэтому вполне логично, что настоящие центры удовольствия в мозге — те, которые напрямую отвечают за генерацию приятных ощущений — оказываются в некоторых структурах, ранее идентифицированных как часть цепи вознаграждения. Одна из этих так называемых гедонистических горячих точек лежит в подобласти прилежащего ядра, называемой медиальной оболочкой. Вторая находится в вентральном паллидуме, глубоко расположенной структуре около основания переднего мозга, которая получает большую часть своих сигналов от прилежащего ядра. ...
С другой стороны, интенсивную эйфорию труднее получить, чем повседневные удовольствия. Причина может быть в том, что сильное усиление удовольствия — как химически вызванный всплеск удовольствия, который мы вызывали у лабораторных животных — по-видимому, требует активации всей сети сразу. Отказ любого отдельного компонента ослабляет кайф.
Работает ли контур удовольствия — и в частности вентральный паллидум — таким же образом у людей, неясно.
Здесь я обсуждаю, как мезокортиколимбические механизмы генерируют мотивационный компонент заметности стимула. Значительность стимула принимает павловское обучение и память в качестве одного из входных данных, а в качестве не менее важного входного данных берет нейробиологические факторы состояния (например, состояния наркотических веществ, состояния аппетита, состояния сытости), которые могут меняться независимо от обучения. Изменения нейробиологического состояния могут вызывать невыученные колебания или даже инверсии в способности ранее выученного сигнала вознаграждения вызывать мотивацию. Такие колебания в мотивации, вызванной сигналом, могут значительно отличаться от всех ранее усвоенных значений о соответствующем результате вознаграждения. ... Ассоциативное обучение и прогнозирование являются важными факторами мотивации вознаграждения. Обучение придает стимулирующую ценность произвольным сигналам, таким как павловский условный стимул (CS), который связан с вознаграждением (безусловным стимулом или UCS). Усвоенные сигналы вознаграждения часто являются мощными триггерами желаний. Например, усвоенные сигналы могут вызывать нормальный аппетит у каждого человека, а иногда могут вызывать компульсивные побуждения и рецидив у наркоманов.
«Желание» UCS, вызванное сигналом
Кратковременное столкновение с CS (или краткое столкновение с UCS) часто запускает импульс повышенной мотивации для получения и потребления большего количества вознаграждения UCS. Это характерная черта заметности стимула.
Сигнал как привлекательные мотивационные магниты
Когда павловскому CS+ приписывается заметность стимула, он не только вызывает «желание» его UCS, но часто сам сигнал становится очень привлекательным — даже в иррациональной степени. Это притяжение к сигналу является еще одной характерной чертой заметности стимула... Часто можно увидеть две узнаваемые черты заметности стимула, которые можно использовать в экспериментах по нейронауке: (i) «желание», направленное на UCS — вызванные CS импульсы усиленного «желания» получить награду UCS; и (ii) «желание», направленное на CS — мотивированное влечение к павловскому сигналу, которое превращает произвольный стимул CS в мотивационный магнит.
Нейроны VTA DA играют важную роль в мотивации, поведении, связанном с вознаграждением (глава 15), внимании и множественных формах памяти. Такая организация системы DA, широкая проекция из ограниченного числа клеточных тел, позволяет координировать ответы на новые мощные вознаграждения. Таким образом, действуя в различных терминальных полях, дофамин придает мотивационную значимость («желание») самому вознаграждению или связанным с ним сигналам (область оболочки прилежащего ядра), обновляет значение, придаваемое различным целям в свете этого нового опыта (орбитальная префронтальная кора), помогает консолидировать множественные формы памяти (миндалевидное тело и гиппокамп) и кодирует новые двигательные программы, которые будут способствовать получению этого вознаграждения в будущем (область ядра прилежащего ядра и дорсальный полосатый участок). В этом примере дофамин модулирует обработку сенсомоторной информации в различных нейронных цепях, чтобы максимизировать способность организма получать будущие вознаграждения. ...
Схема вознаграждения мозга, на которую воздействуют вызывающие зависимость препараты, обычно опосредует удовольствие и укрепление поведения, связанного с естественными подкреплениями, такими как еда, вода и сексуальный контакт. Дофаминовые нейроны в VTA активируются пищей и водой, а высвобождение дофамина в NAc стимулируется наличием естественных подкреплений, таких как еда, вода или сексуальный партнер. ...
NAc и VTA являются центральными компонентами схемы, лежащей в основе вознаграждения и памяти о вознаграждении. Как упоминалось ранее, активность дофаминергических нейронов в VTA, по-видимому, связана с прогнозированием вознаграждения. NAc участвует в обучении, связанном с подкреплением и модуляцией двигательных реакций на стимулы, которые удовлетворяют внутренние гомеостатические потребности. Оболочка NAc, по-видимому, особенно важна для начальных действий препарата в схеме вознаграждения; вызывающие зависимость препараты, по-видимому, оказывают большее влияние на высвобождение дофамина в оболочке, чем в ядре NAc.
Например, мезолимбический дофамин, вероятно, самый популярный кандидат на нейромедиатор мозга для удовольствия два десятилетия назад, оказывается, вообще не вызывает удовольствия или симпатии. Скорее дофамин более избирательно опосредует мотивационный процесс стимульной заметности, который является механизмом для желания вознаграждений, но не для симпатии к ним .... Скорее опиоидная стимуляция имеет особую способность усиливать симпатию, только если стимуляция происходит в анатомической горячей точке
Важно, что мы обнаружили доказательства повышенной активности в прямом пути; как внутриклеточные изменения в экспрессии маркера пластичности pERK, так и соотношения AMPA/NMDA, вызванные стимуляцией корковых афферентов, были увеличены в нейронах прямого пути D1. Напротив, нейроны D2 показали противоположное изменение пластичности; Стимуляция корковых афферентов снижала соотношение AMPA/NMDA в этих нейронах (Шан и др., 2014).
Сильная корреляция между хроническим воздействием наркотиков и ΔFosB открывает новые возможности для таргетной терапии при зависимости (118) и предлагает методы анализа их эффективности (119). За последние два десятилетия исследования перешли от выявления индукции ΔFosB к изучению его последующего действия (38). Вероятно, что исследования ΔFosB теперь перейдут в новую эру — использование ΔFosB в качестве биомаркера. ...
Выводы
ΔFosB является важным фактором транскрипции, вовлеченным в молекулярные и поведенческие пути зависимости после многократного воздействия наркотиков. Образование ΔFosB в нескольких областях мозга и молекулярный путь, ведущий к образованию комплексов AP-1, хорошо изучены. Установление функциональной цели ΔFosB позволило дополнительно определить некоторые ключевые аспекты его молекулярных каскадов, включающих такие эффекторы, как GluR2 (87,88), Cdk5 (93) и NFkB (100). Более того, многие из этих идентифицированных молекулярных изменений теперь напрямую связаны со структурными, физиологическими и поведенческими изменениями, наблюдаемыми после хронического воздействия наркотиков (60,95,97,102). Новые рубежи исследований, изучающих молекулярные роли ΔFosB, были открыты эпигенетическими исследованиями, и недавние достижения проиллюстрировали роль ΔFosB, действующего на ДНК и гистоны, действительно как молекулярный
переключатель
(34). В результате нашего улучшенного понимания ΔFosB в зависимости, стало возможным оценить аддиктивный потенциал современных лекарств (119), а также использовать его в качестве биомаркера для оценки эффективности терапевтических вмешательств (121,122,124). Некоторые из этих предлагаемых вмешательств имеют ограничения (125) или находятся в зачаточном состоянии (75). Однако есть надежда, что некоторые из этих предварительных результатов могут привести к инновационным методам лечения, которые крайне необходимы при зависимости.
Исследования функциональной нейровизуализации на людях показали, что азартные игры (Breiter et al, 2001), шопинг (Knutson et al, 2007), оргазм (
Komisaruk
et al, 2004), видеоигры (Koepp et al, 1998; Hoeft et al, 2008) и вид аппетитной еды (Wang et al, 2004a) активируют многие из тех же областей мозга (т. е. мезокортиколимбическую систему и расширенную миндалевидную железу), что и наркотики, вызывающие злоупотребление (Volkow et al, 2004). ... Перекрестная сенсибилизация также двунаправлена, поскольку история приема амфетамина облегчает сексуальное поведение и усиливает связанное с этим увеличение NAc DA ... Как и в случае с пищевым вознаграждением, сексуальный опыт также может приводить к активации каскадов сигналов, связанных с пластичностью. Фактор транскрипции дельта FosB увеличивается в NAc, PFC, дорсальном полосатом теле и VTA после повторяющегося сексуального поведения (Wallace et al., 2008; Pitchers et al., 2010b). Это естественное увеличение дельта FosB или вирусная сверхэкспрессия дельта FosB в NAc модулирует сексуальную активность, а блокада дельта FosB NAc ослабляет это поведение (Hedges et al, 2009; Pitchers et al., 2010b). Кроме того, вирусная сверхэкспрессия дельта FosB усиливает обусловленное предпочтение места для среды, сопряженной с сексуальным опытом (Hedges et al., 2009). ... У некоторых людей наблюдается переход от «нормального» к компульсивному вовлечению в естественные вознаграждения (такие как еда или секс), состояние, которое некоторые называют поведенческой или ненаркотической зависимостью (Holden, 2001; Grant et al., 2006a). ... У людей роль дофаминовой сигнализации в процессах сенсибилизации стимулов недавно была подчеркнута наблюдением синдрома дисрегуляции дофамина у некоторых пациентов, принимающих дофаминергические препараты. Этот синдром характеризуется вызванным лекарствами увеличением (или компульсивным) вовлечения в ненаркотические вознаграждения, такие как азартные игры, шопинг или секс (Evans et al, 2006; Aiken, 2007; Lader, 2008)».
По этим причинам ΔFosB считается первичным и причинным фактором транскрипции в создании новых нейронных связей в центре вознаграждения, префронтальной коре и других регионах лимбической системы. Это отражается в повышенном, стабильном и длительном уровне чувствительности к кокаину и другим наркотикам, а также в тенденции к рецидиву даже после длительных периодов воздержания. Эти вновь созданные сети функционируют очень эффективно через новые пути, как только наркотики, вызывающие злоупотребление, принимаются дальше... Таким образом, индукция экспрессии гена CDK5 происходит вместе с подавлением гена G9A, кодирующего диметилтрансферазу, действующую на гистон H3. Механизм обратной связи можно наблюдать в регуляции этих 2 важнейших факторов, которые определяют адаптивный эпигенетический ответ на кокаин. Это зависит от ΔFosB, ингибирующего экспрессию гена G9a, т.е. синтез H3K9me2, который, в свою очередь, ингибирует факторы транскрипции для ΔFosB. По этой причине наблюдаемая гиперэкспрессия G9a, которая обеспечивает высокие уровни диметилированной формы гистона H3, устраняет структурные и пластичные эффекты нейронов, вызванные кокаином, посредством этой обратной связи, которая блокирует транскрипцию ΔFosB
Наркотики, вызывающие злоупотребление, вызывают нейропластичность в естественном пути вознаграждения, в частности в прилежащем ядре (NAc), тем самым вызывая развитие и проявление аддиктивного поведения. ... В совокупности эти результаты показывают, что злоупотребление наркотиками и естественное поощрительное поведение действуют на общие молекулярные и клеточные механизмы пластичности, которые контролируют уязвимость к наркотической зависимости, и что эта повышенная уязвимость опосредована ΔFosB и его нижестоящими транскрипционными мишенями. ... Сексуальное поведение является высокопоощряющим (Tenk et al., 2009), а сексуальный опыт вызывает сенсибилизированное поведение, связанное с наркотиками, включая перекрестную сенсибилизацию к локомоторной активности, вызванной амфетамином (Amph) (Bradley and Meisel, 2001; Pitchers et al., 2010a) и усиленное поощрение Amph (Pitchers et al., 2010a). Более того, сексуальный опыт вызывает нейронную пластичность в NAc, аналогичную той, которая вызвана воздействием психостимуляторов, включая повышенную плотность дендритных шипиков (Meisel and Mullins, 2006; Pitchers et al., 2010a), измененный трафик рецепторов глутамата и сниженную силу синапсов в реагирующих на префронтальную кору нейронах оболочки NAc (Pitchers et al., 2012). Наконец, было обнаружено, что периоды воздержания от сексуального опыта имеют решающее значение для усиления вознаграждения Amph, спиногенеза NAc (Pitchers et al., 2010a) и трафика рецепторов глутамата (Pitchers et al., 2012). Эти результаты свидетельствуют о том, что естественный и наркотический опыт вознаграждения имеют общие механизмы нейронной пластичности
ΔFosB служит одним из главных контрольных белков, управляющих этой структурной пластичностью. ... ΔFosB также подавляет экспрессию G9a, что приводит к снижению репрессивного метилирования гистонов в гене cdk5. Конечным результатом является активация гена и повышенная экспрессия CDK5. ... Напротив, ΔFosB связывается с геном
c-fos
и привлекает несколько корепрессоров, включая HDAC1 (гистондеацетилаза 1) и SIRT 1 (сиртуин 1). ... Конечным результатом является подавление гена
c-fos
.
{{cite book}}: |journal=проигнорировано ( помощь )В сравнительно недавней литературе исследования мотивации и подкрепления при депрессии в значительной степени последовательны в обнаружении различий по сравнению со здоровыми контрольными лицами (Whitton et al. 2015). В нескольких исследованиях с использованием задачи затрат усилий на вознаграждение (EEfRT) пациенты с БДР тратили меньше усилий на вознаграждение по сравнению с контрольными лицами (Treadway et al. 2012; Yang et al. 2014)
{{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )Они также дают отдельную оценку консумматорной ангедонии (сниженное ощущение удовольствия, получаемого от продолжающихся приятных занятий) и предвосхищающей ангедонии (сниженная способность предвидеть будущее удовольствие). Фактически, первая из них, по-видимому, относительно нетронута при шизофрении, тогда как вторая, по-видимому, нарушена [32 – 34]. Однако также сообщалось о противоречивых данных [35].
{{cite journal}}: CS1 maint: несколько имен: список авторов ( ссылка ) Прослушивание приятной музыки часто сопровождается измеримыми телесными реакциями, такими как мурашки по коже или дрожь по позвоночнику, обычно называемые «ознобом» или «дрожью»... В целом, наши результаты прямо показали, что фармакологические вмешательства двунаправленно модулируют вознаграждение реакции, вызванные музыкой. В частности, мы обнаружили, что рисперидон ухудшает способность участников испытывать музыкальное удовольствие, тогда как леводопа усиливает его. ... Здесь, напротив, изучая реакции на абстрактные вознаграждения у людей, мы показываем, что манипуляция дофаминергической передачей влияет как на удовольствие (т.е. количество времени, в течение которого сообщается о ознобе и эмоциональном возбуждении, измеренном EDA), так и на мотивационные компоненты музыкального вознаграждения (деньги, которые готовы потратить). Эти результаты показывают, что дофаминергическая сигнализация является непременным условием не только для мотивационных реакций , как это было показано на примере первичных и вторичных вознаграждений, но также и на примере гедонистических реакций на музыку. Этот результат подтверждает недавние открытия, показывающие, что дофамин также опосредует воспринимаемую приятность, достигаемую другими типами абстрактных вознаграждений, и ставит под сомнение предыдущие выводы, полученные в животных моделях относительно первичных вознаграждений, таких как еда.
(1) представляют доказательства того, что усиление или ингибирование передачи сигналов дофамина с помощью леводопы или рисперидона модулирует удовольствие, испытываемое во время прослушивания музыки. ... В заключительном заходе, чтобы установить не только корреляционную, но и причинную роль дофамина в музыкальном удовольствии, авторы обратились к непосредственному манипулированию дофаминергической сигнализацией в полосатом теле, сначала путем применения возбуждающей и ингибирующей транскраниальной магнитной стимуляции к левой дорсолатеральной префронтальной коре участников, области, которая, как известно, модулирует функцию полосатого тела (5), и, наконец, в текущем исследовании, путем введения фармацевтических агентов, способных изменять синаптическую доступность дофамина (1), оба из которых влияли на воспринимаемое удовольствие, физиологические показатели возбуждения и денежную стоимость, приписываемую музыке в прогнозируемом направлении. ... Хотя вопрос музыкального выражения эмоций имеет долгую историю исследований, в том числе в PNAS (6), и психофизиологическое направление исследований 1990-х годов уже установило, что музыкальное удовольствие может активировать автономную нервную систему (7), демонстрация авторами роли системы вознаграждения в музыкальных эмоциях была воспринята как первое доказательство того, что это были подлинные эмоции, изучение которых имеет полное право информировать нейробиологию о наших повседневных когнитивных, социальных и аффективных функциях (8). Между прочим, это направление работы, кульминацией которого стала статья Феррери и др. (1), вероятно, сделало больше для привлечения финансирования исследований в области музыкальных наук, чем любое другое в этом сообществе. Доказательства Феррери и др. (1) предоставляют новейшую поддержку убедительной нейробиологической модели, в которой музыкальное удовольствие возникает из взаимодействия древних систем вознаграждения/оценки (стриатно-лимбической-паралимбической) с более филогенетически продвинутыми системами восприятия/предсказания (височно-фронтальной).