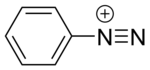
Соединения диазония или соли диазония представляют собой группу органических соединений , имеющих общую функциональную группу [R−N + ≡N]X −, где R может быть любой органической группой, такой как алкил или арил , а X — неорганическим или органическим анионом, таким как галогенид . Исходное соединение, где R — водород, — диазенилий .
Согласно данным рентгеновской кристаллографии, связь C−N + ≡N является линейной в типичных солях диазония. Расстояние связи N + ≡N в тетрафторборате бензолдиазония составляет 1,083(3) Å [1] , что почти идентично таковому для молекулы диазота (N≡N).
Линейные константы свободной энергии σ m и σ p указывают на то, что группа диазония является сильно электроноакцепторной. Таким образом, диазонио-замещенные фенолы и бензойные кислоты имеют значительно сниженные значения p K a по сравнению с их незамещенными аналогами. P K a фенольного протона 4-гидроксибензолдиазония составляет 3,4 [2] по сравнению с 9,9 для самого фенола. Другими словами, группа диазония снижает p K a (увеличивает кислотность) в миллион раз. Это также приводит к тому, что соли арендиазония имеют пониженную реакционную способность, когда электронодонорные группы присутствуют в ароматическом кольце. [3]
Стабильность солей арендиазония очень чувствительна к противоиону. Фенилдиазонийхлорид взрывоопасен, но тетрафторборат бензолдиазония легко обрабатывается на лабораторном столе. [ необходима цитата ]
Соли алкандиазония не имеют синтетического значения из-за их чрезвычайной и неконтролируемой реакционной способности по отношению к замещению S N 2/S N 1/E1. Однако эти катионы представляют теоретический интерес. Кроме того, метилдиазонийкарбоксилат, как полагают, является промежуточным продуктом в метилировании карбоновых кислот диазометаном , распространенном преобразовании. [4] [5]

Потеря N 2 выгодна как с энтальпической, так и с энтропийной точки зрения:
Для вторичных и третичных видов алкандиазония энтальпийное изменение рассчитывается как близкое к нулю или отрицательное, с минимальным барьером активации. Следовательно, вторичные и (особенно) третичные виды алкандиазония являются либо несвязанными, несуществующими видами, либо, в лучшем случае, чрезвычайно мимолетными промежуточными продуктами. [6]
Водный p K a метилдиазония ( [CH 3 N 2 ] + ) оценивается как <10. [ 7]
Процесс образования соединений диазония называется «диазотированием», «диазонированием» или «диазотизацией». Впервые об этой реакции сообщил Питер Грисс в 1858 году, который впоследствии открыл несколько реакций этого нового класса соединений. Чаще всего соли диазония получают обработкой ароматических аминов азотистой кислотой и дополнительной кислотой. Обычно азотистая кислота образуется in situ (в той же колбе) из нитрита натрия и избытка минеральной кислоты (обычно водного раствора HCl, H 2 SO 4 , p - H 3 CC 6 H 4 SO 3 H или H[BF 4 ] ):

Хлоридные соли катиона диазония, традиционно получаемые из анилина, нитрита натрия и соляной кислоты , нестабильны при комнатной температуре и классически готовятся при 0–5 °C. Однако можно выделить соединения диазония в виде солей тетрафторбората или тозилата , [8] которые являются стабильными твердыми веществами при комнатной температуре. [9] Часто предпочитают, чтобы соль диазония оставалась в растворе, но они имеют тенденцию к пересыщению . Операторы были ранены или даже убиты неожиданной кристаллизацией соли, за которой следовала ее детонация. [10]
Из-за этих опасностей соединения диазония часто не изолируются. Вместо этого они используются in situ . Этот подход проиллюстрирован на примере получения аренсульфонильного соединения: [11]
Первое и по-прежнему основное применение солей диазония — азосоединение , которое используется в производстве азокрасителей . [12] [13] В некоторых случаях водостойкие окрашенные ткани просто погружают в водный раствор соединения диазония, а затем погружают в раствор связующего (электронно-богатое кольцо, которое подвергается электрофильному замещению). В этом процессе соединение диазония подвергается атаке, т. е. связывается с электронно-богатыми субстратами. Когда партнерами по связыванию являются арены, такие как анилины и фенолы, процесс является примером электрофильного ароматического замещения :
Глубокие цвета красителей отражают их расширенное сопряжение . Популярный азокраситель — анилиновый желтый , получаемый из анилина . [14] Нафталин-2-ол (бета-нафтол) дает интенсивный оранжево-красный краситель. Метиловый оранжевый — пример азокрасителя, который используется в лаборатории в качестве индикатора pH .. [14]
Другим коммерчески важным классом партнеров по связыванию являются ацетоуксусные амиды, как показано на примере получения пигмента желтого 12, диарилидного пигмента . [15]
Катионы арендиазония вступают в несколько реакций , в которых группа N2 заменяется другой группой или ионом. [16] [17]
При нагревании хлорида бензолдиазония с хлоридом меди или бромидом меди соответственно в растворах HCl или HBr получают хлорбензол или бромбензол соответственно.
В реакции Гаттермана (существуют и другие « реакции Гаттермана ») хлорид бензолдиазония нагревают с медным порошком и HCl или HBr для получения хлорбензола и бромбензола соответственно. [18]
Катионы арендиазония реагируют с иодидом калия, образуя арилиодид: [19]
Фторбензол получают путем термического разложения тетрафторбората бензолдиазония . Превращение называется реакцией Бальца-Шимана . [20]
Традиционная реакция Бальца-Шимана была предметом многих мотиваций, например, использование гексафторфосфата(V) ( [PF 6 ] − ) и гексафторантимоната(V) ( [SbF 6 ] − ) вместо тетрафторбората ( [BF 4 ] − ). Диазотирование может быть осуществлено с помощью солей нитрозония, таких как гексафторантимонат(V) нитрозония [NO] + [SbF 6 ] − . [21]
Пара катионов диазония может быть связана с образованием биарилов . Это превращение иллюстрируется сочетанием соли диазония, полученной из антраниловой кислоты, с образованием дифеновой кислоты ( (C 6 H 4 CO 2 H) 2 ). [22] В родственной реакции та же соль диазония теряет N 2 и CO 2 с образованием бензола . [23]
Восстановление катионов арендиазония фосфорноватистой кислотой [24] , этанолом [25], станнитом натрия [26] или щелочным тиосульфатом натрия [27] дает бензол:
Альтернативный способ, предложенный Байером и Пфитцингером, заключается в замене диазогруппы на H: сначала преобразовать ее в гидразин путем обработки SnCl2 , а затем окислить ее до углеводорода путем кипячения с раствором сульфата меди. [28]
Фенолы получают нагреванием водных растворов солей арендиазония: [29] [30] [31] [32]
Эта реакция известна под немецким названием Phenolverkochung («вываривание с получением фенолов»). Образующийся фенол может реагировать с солью диазония, и, следовательно, реакция осуществляется в присутствии кислоты, которая подавляет эту дальнейшую реакцию. [33] Гидроксилирование типа Зандмейера также возможно с использованием Cu 2 O и Cu 2+ в воде.
Нитробензол может быть получен путем обработки фторбората бензолдиазония нитритом натрия в присутствии меди. Альтернативно, диазотирование анилина может быть проведено в присутствии оксида меди, который генерирует нитрит меди in situ:
Цианогруппа обычно не может быть введена путем нуклеофильного замещения галогенаренов , но такие соединения могут быть легко получены из солей диазония. Показательным является получение бензонитрила с использованием реагента цианида меди :
Эта реакция является особым типом реакции Зандмейера .
Две исследовательские группы сообщили о трифторметилировании солей диазония в 2013 году. Гуссен сообщил о получении комплекса CuCF 3 из CuSCN, TMSCF 3 и Cs 2 CO 3 . Напротив, Фу сообщил о трифторметилировании с использованием реагента Умемото ( тетрафторборат S -трифторметилдибензотиофения) и порошка Cu (условия типа Гаттермана). Их можно описать следующим уравнением:
Скобки указывают на то, что другие лиганды на меди, вероятно, присутствуют, но не указаны.
Соли диазония можно преобразовать в тиолы в двухстадийной процедуре. Обработка хлорида бензолдиазония этилксантогенатом калия с последующим гидролизом промежуточного эфира ксантогената дает тиофенол :
Арильная группа может быть связана с другой с помощью солей арендиазония. Например, обработка хлорида бензолдиазония бензолом (ароматическим соединением) в присутствии гидроксида натрия дает дифенил :
Эта реакция известна как реакция Гомберга-Бахмана . Аналогичное превращение достигается также при обработке хлорида бензолдиазония этанолом и медным порошком.
Группа Bpin (пинаколатобор), используемая в реакциях кросс-сочетания Сузуки-Мияуры , может быть установлена реакцией соли диазония с бис(пинаколато)дибором в присутствии бензоилпероксида (2 мол. %) в качестве инициатора: [34] Альтернативно подобное борилирование может быть достигнуто с использованием карбонильных комплексов переходных металлов, включая декакарбонил димарганца. [35]
Формильную группу , –CHO, можно ввести путем обработки соли арилдиазония формальдоксимом ( H2C = NOH ) с последующим гидролизом арилальдоксима с получением арилальдегида. [36] Эта реакция известна как реакция Бича. [37]
Бензолдиазонийхлорид реагирует с соединениями, содержащими активированные двойные связи , образуя фенилированные продукты. Реакция называется арилированием Меервейна :
В своих реакциях с комплексами металлов катионы диазония ведут себя подобно NO + . Например, комплексы низковалентных металлов присоединяются к солям диазония. Иллюстративные комплексы - [Fe(CO) 2 (PPh 3 ) 2 (N 2 Ph)] + и хиральный-на-металле комплекс Fe(CO)(NO)(PPh 3 )(N 2 Ph) . [39]
В потенциальном применении в нанотехнологии соли диазония 4-хлорбензолдиазоний тетрафторборат очень эффективно функционализирует однослойные нанотрубки . [40] Для того чтобы расслаивать нанотрубки, их смешивают с ионной жидкостью в ступке и пестике . Соль диазония добавляют вместе с карбонатом калия , и после измельчения смеси при комнатной температуре поверхность нанотрубок покрывается хлорфенильными группами с эффективностью 1 на 44 атома углерода. Эти добавленные заместители не позволяют трубкам образовывать тесные пучки из-за больших сил сцепления между ними, что является повторяющейся проблемой в технологии нанотрубок.
Также возможно функционализировать кремниевые пластины солями диазония, образуя арильный монослой. В одном исследовании поверхность кремния промывают фтористым аммонием, оставляя ее покрытой связями кремний-водород (пассивация гидридом). [41] Реакция поверхности с раствором соли диазония в ацетонитриле в течение 2 часов в темноте является спонтанным процессом через свободнорадикальный механизм : [42]

До сих пор прививка солей диазония на металлы была осуществлена на поверхностях железа , кобальта , никеля , платины , палладия , цинка , меди и золота . [43] Также сообщалось о прививке на поверхности алмаза. [44] Один интересный вопрос, поднятый, - это фактическое расположение арильной группы на поверхности. Исследование in silico [45] показывает, что в периоде 4 элементов от титана до меди энергия связи уменьшается слева направо, поскольку увеличивается число d-электронов. Металлы слева от железа расположены наклонно или плашмя на поверхности, благоприятствуя образованию пи-связи металла с углеродом , а металлы справа от железа расположены в вертикальном положении, благоприятствуя образованию сигма-связи металла с углеродом . Это также объясняет, почему прививка солей диазония до сих пор была возможна с металлами справа от железа в периодической таблице .
Соли диазония можно восстановить с помощью хлорида олова ( SnCl2 ) до соответствующих производных гидразина . Эта реакция особенно полезна в синтезе индола Фишера триптановых соединений и индометацина . Использование дитионита натрия является улучшением по сравнению с хлоридом олова, поскольку это более дешевый восстановитель с меньшим количеством экологических проблем.
Ионы алкандиазония , которые редко встречаются в органической химии, считаются возбудителями канцерогенов. В частности, считается , что нитрозамины подвергаются метаболической активации с образованием видов алкандиазония.

Твердые галогениды диазония часто являются взрывоопасными, и сообщалось о смертельных случаях и травмах. [10]
Природа анионов влияет на стабильность соли. Перхлораты арендиазония, такие как нитробензолдиазоний перхлорат, использовались для инициирования взрывчатых веществ.
{{cite book}}: CS1 maint: местоположение ( ссылка )