Химический элемент азот является одним из наиболее распространенных элементов во Вселенной и может образовывать множество соединений. Он может принимать несколько степеней окисления ; но наиболее распространенными степенями окисления являются -3 и +3. Азот может образовывать нитрид- и нитрат -ионы. Он также входит в состав азотной кислоты и нитратных солей. Соединения азота также играют важную роль в органической химии, так как азот входит в состав белков , аминокислот и аденозинтрифосфата .

Первым примером открытого азотистого комплекса был [Ru(NH 3 ) 5 (N 2 )] 2+ (см. рисунок справа), и вскоре было обнаружено множество других таких комплексов. Эти комплексы , в которых молекула азота отдает по крайней мере одну неподеленную пару электронов центральному катиону металла, иллюстрируют, как N 2 может связываться с металлом(ами) в нитрогеназе и катализаторе процесса Габера : эти процессы, включающие активацию динитрога, жизненно важно в биологии и производстве удобрений. [1] [2]
Динитроген способен координироваться с металлами пятью различными способами. Более хорошо охарактеризованными способами являются концевые M ←N≡N ( η 1 ) и M ←N≡N→M ( ц , бис- η 1 ), в которых неподеленные пары атомов азота отдаются в дар катион металла. Менее изученные способы включают пары электронов, отдающих азот из тройной связи, либо в качестве мостикового лиганда к двум катионам металлов ( μ , бис- η 2 ), либо только к одному ( η 2 ). Пятый и уникальный метод включает тройную координацию в качестве мостикового лиганда, отдавая все три пары электронов тройной связи ( μ 3 -N 2 ). Некоторые комплексы содержат несколько лигандов N 2 , а некоторые содержат N 2 , связанный несколькими способами. Поскольку N 2 изоэлектронен монооксиду углерода (СО) и ацетилену (C 2 H 2 ), связь в диазотистых комплексах тесно связана со связью в карбонильных соединениях, хотя N 2 является более слабым σ -донором и π- акцептором, чем CO. Теоретические исследования показывают, что донорство σ является более важным фактором, позволяющим сформировать связь M–N, чем обратное донорство π , которое в основном только ослабляет связь N–N, и донорство с конца ( η 1 ) осуществляется легче, чем побочное ( η 2 ) пожертвование. [3]
Сегодня диазотистые комплексы известны практически для всех переходных металлов , насчитывая несколько сотен соединений. Обычно их готовят тремя способами: [3]
Иногда связь N≡N может образовываться непосредственно внутри металлокомплекса, например, путем непосредственной реакции координированного аммиака (NH 3 ) с азотистой кислотой (HNO 2 ), но это обычно не применимо. Большинство динитрогенных комплексов имеют цвета в диапазоне бело-желтый-оранжевый-красно-коричневый; известно несколько исключений, таких как синий [{Ti( η 5 -C 5 H 5 ) 2 } 2 -(N 2 )]. [3]
Азот связывается почти со всеми элементами таблицы Менделеева, за исключением первых трёх благородных газов , гелия , неона и аргона , а также с некоторыми очень короткоживущими элементами после висмута , создавая огромное разнообразие бинарных соединений с различными свойствами и применением. [3] Известны многие бинарные соединения: за исключением гидридов, оксидов и фторидов азота, их обычно называют нитридами . Для большинства элементов обычно присутствует множество стехиометрических фаз (например, MnN, Mn 6 N 5 , Mn 3 N 2 , Mn 2 N, Mn 4 N и Mn x N для 9,2 < x < 25,3). Их можно классифицировать как «солеподобные» (в основном ионные), ковалентные, «алмазоподобные» и металлические (или межузельные ), хотя эта классификация имеет ограничения, обычно вытекающие из непрерывности типов связи вместо дискретных и отдельных типов. что это подразумевает. Их обычно получают путем прямой реакции металла с азотом или аммиаком (иногда после нагревания) или термическим разложением амидов металлов: [4]
Возможны многие варианты этих процессов. Наиболее ионными из этих нитридов являются нитриды щелочных и щелочноземельных металлов Li 3 N (Na, K, Rb и Cs не образуют устойчивых нитридов по стерическим причинам) и M 3 N 2 (M = Be, Mg, Са, Ср, Ба). Формально их можно рассматривать как соли аниона N 3- , хотя разделение зарядов на самом деле не является полным даже для этих высокоэлектроположительных элементов. Однако азиды щелочных металлов NaN 3 и KN 3 , обладающие линейным N−
3анионы, а также Sr(N 3 ) 2 и Ba(N 3 ) 2 . Азиды металлов B-подгруппы (группы с 11 по 16 ) гораздо менее ионны, имеют более сложную структуру и легко детонируют при ударе. [4]
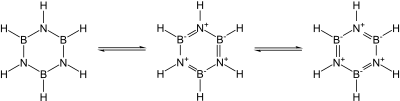
Известно множество ковалентных бинарных нитридов. Примеры включают цианоген ((CN) 2 ), пентанитрид трифосфора (P 3 N 5 ), динитрид дисеры (S 2 N 2 ) и тетранитрид тетрасеры (S 4 N 4 ). Также известны по существу ковалентные нитрид кремния (Si 3 N 4 ) и нитрид германия (Ge 3 N 4 ): нитрид кремния, в частности, мог бы стать многообещающей керамикой, если бы не сложность обработки и спекания с ним. В частности, нитриды группы 13 , большинство из которых являются перспективными полупроводниками , изоэлектронны графиту, алмазу и карбиду кремния и имеют схожие структуры: их связь меняется от ковалентной до частично ионной и металлической по мере нисхождения группы. В частности, поскольку единица B–N изоэлектронна по отношению к C–C, а углерод по существу занимает промежуточное положение по размеру между бором и азотом, большая часть органической химии находит отклик в химии бора и азота, например, в боразине («неорганический бензол »). ). Тем не менее, аналогия не точна из-за легкости нуклеофильной атаки на бор из-за его дефицита электронов, что невозможно в полностью углеродсодержащем кольце. [4]
Самой большой категорией нитридов являются нитриды внедрения формул MN, M 2 N и M 4 N (хотя вполне возможен переменный состав), в которых мелкие атомы азота расположены в промежутках металлической кубической или гексагональной плотноупакованной решетки. . Они непрозрачны, очень тверды и химически инертны и плавятся только при очень высоких температурах (обычно выше 2500 °C). Они имеют металлический блеск и проводят электричество, как металлы. Они очень медленно гидролизуются с образованием аммиака или азота. [4]
Нитрид-анион (N 3- ) является самым сильным донором π , известным среди лигандов (второй по силе - O 2- ). Нитридокомплексы обычно образуются путем термического разложения азидов или депротонирования аммиака и обычно включают концевую группу {≡N} 3- . Линейный азид-анион ( N−
3), будучи изоэлектронным с закисью азота , углекислым газом и цианатом , образует множество координационных комплексов. Дальнейшая цепочка встречается редко, хотя N4−
4(изоэлектронен карбонату и нитрату ). [4]

В промышленности аммиак (NH 3 ) является наиболее важным соединением азота, и его получают в больших количествах, чем любое другое соединение, поскольку он вносит значительный вклад в удовлетворение потребностей в питании наземных организмов, служа предшественником продуктов питания и удобрений. Это бесцветный щелочной газ с характерным резким запахом. Наличие водородных связей оказывает очень существенное влияние на аммиак, придавая ему высокие температуры плавления (-78 ° C) и кипения (-33 ° C). В жидком виде это очень хороший растворитель с высокой теплотой испарения (что позволяет использовать его в вакуумных колбах), который также имеет низкую вязкость и электропроводность, высокую диэлектрическую проницаемость и менее плотен, чем вода. Однако водородная связь в NH 3 слабее, чем в H 2 O, из-за меньшей электроотрицательности азота по сравнению с кислородом и наличия только одной неподеленной пары в NH 3 , а не двух в H 2 O. Это слабое основание. в водном растворе ( p K b 4,74); его сопряженная кислота — аммоний , NH+
4. Он также может действовать как чрезвычайно слабая кислота, теряя протон с образованием амид-аниона NH .−
2. Таким образом, он подвергается самодиссоциации, подобно воде, с образованием аммония и амида. Аммиак горит на воздухе или в кислороде, хотя и с трудом, с образованием газообразного азота; он горит во фторе зеленовато-желтым пламенем с образованием трифторида азота . Реакции с другими неметаллами очень сложны и имеют тенденцию приводить к образованию смеси продуктов. Аммиак при нагревании реагирует с металлами с образованием нитридов. [6]
Известно множество других бинарных гидридов азота, но наиболее важными являются гидразин (N 2 H 4 ) и азид водорода (HN 3 ). Гидроксиламин (NH 2 OH) хотя и не является гидридом азота, но по свойствам и строению также подобен аммиаку и гидразину. Гидразин — дымящая бесцветная жидкость, по запаху напоминающая аммиак. Его физические свойства очень похожи на свойства воды (температура плавления 2,0 °С, температура кипения 113,5 °С, плотность 1,00 г/см 3 ). Несмотря на то, что это эндотермическое соединение, оно кинетически стабильно. Он быстро и полностью сгорает на воздухе очень экзотермически с образованием азота и водяного пара. Это очень полезный и универсальный восстановитель, более слабое основание, чем аммиак. [7] Он также широко используется в качестве ракетного топлива. [8]
Гидразин обычно получают реакцией аммиака со щелочным гипохлоритом натрия в присутствии желатина или клея: [7]
(Атаку гидроксида и аммиака можно обратить вспять, проходя вместо этого через промежуточный NHCl − .) Причина добавления желатина заключается в том, что он удаляет ионы металлов, таких как Cu 2+ , который катализирует разрушение гидразина в результате реакции с монохлорамином (NH 2 Cl) для получения хлорида аммония и азота. [7]
Азид водорода (HN 3 ) был впервые получен в 1890 году окислением водного гидразина азотистой кислотой. Он очень взрывоопасен, и даже разбавленные растворы могут быть опасны. Он имеет неприятный и раздражающий запах и является потенциально смертельным (но не кумулятивным) ядом. Ее можно рассматривать как кислоту, сопряженную с азид-анионом, и она аналогична галогенводородным кислотам . [7]

Известны все четыре простых тригалогенида азота. Известно несколько смешанных галогенидов и гидрогалогенидов, но они в основном нестабильны; примеры включают NClF 2 , NCl 2 F, NBrF 2 , NF 2 H, NFH 2 , NCl 2 H и NClH 2 . [9]
Известны пять фторидов азота. Трифторид азота (NF 3 , впервые полученный в 1928 году) представляет собой бесцветный газ без запаха, который термодинамически стабилен и наиболее легко получается электролизом расплавленного фторида аммония, растворенного в безводном фтористом водороде . Как и тетрафторид углерода , он совсем не реакционноспособен и стабилен в воде или разбавленных водных кислотах или щелочах. Только при нагревании он действует как фторирующий агент, а с медью , мышьяком, сурьмой и висмутом при контакте при высоких температурах реагирует с образованием тетрафторгидразина (N 2 F 4 ). Катионы NF+
4и н
2Ф+
3также известны (последний в результате реакции тетрафторгидразина с сильными акцепторами фторида, такими как пентафторид мышьяка ), как и ONF 3 , который вызвал интерес из-за короткого расстояния NO-O, подразумевающего частичную двойную связь, и высокополярных и длинных N-F связь. Тетрафторгидразин, в отличие от самого гидразина, может диссоциировать при комнатной температуре и выше с образованием радикала NF 2 •. Азид фтора (FN 3 ) очень взрывоопасен и термически нестабилен. Дифторид азота (N 2 F 2 ) существует в виде термически взаимопревращаемых цис- и транс -изомеров и впервые был обнаружен как продукт термического разложения FN 3 . [9]
Трихлорид азота (NCl 3 ) представляет собой плотную, летучую и взрывоопасную жидкость, физические свойства которой аналогичны свойствам четыреххлористого углерода , хотя одно отличие состоит в том, что NCl 3 легко гидролизуется водой, а CCl 4 - нет. Впервые он был синтезирован в 1811 году Пьером Луи Дюлонгом , который потерял три пальца и глаз из-за его взрывных тенденций. В разбавленном состоянии он менее опасен и поэтому используется в промышленности для отбеливания и стерилизации муки. Трибромид азота (NBr 3 ), впервые полученный в 1975 году, представляет собой темно-красное, чувствительное к температуре, летучее твердое вещество, взрывоопасное даже при -100 °C. Трийодид азота (NI 3 ) еще более нестабилен и был получен только в 1990 году. Его аддукт с аммиаком, известный ранее, очень чувствителен к ударам: его можно поджечь прикосновением пера, смещением воздушных потоков или даже альфа-частицы . [9] [10] По этой причине небольшие количества трийодида азота иногда синтезируются в качестве демонстрации студентам-химикам старших классов или в качестве акта «химической магии». [11] Азид хлора (ClN 3 ) и азид брома (BrN 3 ) чрезвычайно чувствительны и взрывоопасны. [12] [13]
Известны две серии оксогалогенидов азота: нитрозилгалогениды (XNO) и нитрилгалогениды (XNO 2 ). Первые представляют собой очень химически активные газы, которые можно получить путем прямого галогенирования закиси азота. Нитрозилфторид (NOF) бесцветен и является сильным фторирующим агентом. Нитрозилфторид может продолжать реагировать с фтором с образованием трифторида оксида азота [14] , который также является сильным фторирующим агентом. Нитрозилхлорид (NOCl) ведет себя примерно таким же образом и часто используется в качестве ионизирующего растворителя. Нитрозилбромид (NOBr) имеет красный цвет. Реакции галогенидов нитрила во многом аналогичны: фторид нитрила (FNO 2 ) и хлорид нитрила (ClNO 2 ) также являются химически активными газами и сильными галогенирующими агентами. [9]

Азот образует девять молекулярных оксидов, некоторые из которых были первыми газами, которые были идентифицированы: N 2 O ( закись азота ), NO ( оксид азота ), N 2 O 3 ( триоксид азота ), NO 2 ( диоксид азота ), N 2 O 4 ( тетроксид диазота ), N 2 O 5 ( пятиокись азота ), N 4 O ( нитрозилазид ), [15] и N(NO 2 ) 3 ( тринитрамид ). [16] Все они термически нестабильны по отношению к разложению на свои элементы. Еще одним возможным оксидом, который еще не синтезирован, является оксатетразол (N 4 O), ароматическое кольцо. [15]
Закись азота (N 2 O), более известная как веселящий газ, получается термическим разложением расплавленного нитрата аммония при 250°C. Это окислительно-восстановительная реакция, поэтому в качестве побочных продуктов также образуются оксид азота и азот. Он в основном используется в качестве пропеллента и аэратора для распыляемых взбитых сливок в банках , а раньше широко использовался в качестве анестетика. Несмотря на внешний вид, его нельзя считать ангидридом азотистой кислоты ( H 2 N 2 O 2 ), поскольку эта кислота не образуется при растворении закиси азота в воде. Он достаточно инертен (не реагирует с галогенами, щелочными металлами и озоном при комнатной температуре, хотя реакционная способность увеличивается при нагревании) и имеет несимметричную структуру N–N–O (N≡N + O − ↔ − N=N + =O): выше 600 °C он диссоциирует, разрывая более слабую связь N–O. [15] Оксид азота (NO) — простейшая стабильная молекула с нечетным числом электронов. У млекопитающих, включая человека, это важная клеточная сигнальная молекула , участвующая во многих физиологических и патологических процессах. [17] Он образуется в результате каталитического окисления аммиака. Это бесцветный парамагнитный газ, который, будучи термодинамически нестабильным, разлагается на газообразный азот и кислород при 1100–1200 °С. Его связь аналогична связи в азоте, но к разрыхляющей орбитали π * добавляется один дополнительный электрон, и, таким образом, порядок связи снижается примерно до 2,5; следовательно, димеризация до O=N–N=O невыгодна, за исключением случаев, когда температура ниже точки кипения (где цис -изомер более стабилен), поскольку она фактически не увеличивает общий порядок связей и поскольку неспаренный электрон делокализуется поперек молекулы NO, что дает возможность стабильность. Есть также свидетельства существования асимметричного красного димера O = N – O = N, когда оксид азота конденсируется с полярными молекулами. Он реагирует с кислородом с образованием коричневого диоксида азота и с галогенами с образованием нитрозилгалогенидов. Он также реагирует с соединениями переходных металлов с образованием нитрозильных комплексов, большинство из которых имеют яркую окраску. [15]
Синий триоксид диазота (N 2 O 3 ) доступен только в твердом виде, поскольку он быстро диссоциирует при температуре выше точки плавления с образованием оксида азота, диоксида азота (NO 2 ) и тетроксида диазота (N 2 O 4 ). Последние два соединения несколько трудно изучать по отдельности из-за равновесия между ними, хотя иногда тетраоксид диазота может реагировать путем гетеролитического деления с образованием нитрозония и нитрата в среде с высокой диэлектрической проницаемостью. Диоксид азота — едкий, едкий коричневый газ. Оба соединения можно легко получить разложением сухого нитрата металла. Оба реагируют с водой с образованием азотной кислоты . Четырехокись азота очень полезна для получения безводных нитратов металлов и нитратокомплексов, и к концу 1950-х годов она стала предпочтительным хранимым окислителем для многих ракет как в Соединенных Штатах, так и в СССР . Это связано с тем, что это гиперголическое топливо в сочетании с ракетным топливом на основе гидразина , и его можно легко хранить, поскольку оно находится в жидком состоянии при комнатной температуре. [15]
Термически нестабильный и очень реакционноспособный пятиокись азота (N 2 O 5 ) представляет собой ангидрид азотной кислоты и может быть получен из нее путем дегидратации пятиокисью фосфора . Представляет интерес для приготовления взрывчатых веществ. [18] Это расплывчатое бесцветное кристаллическое твердое вещество, чувствительное к свету. В твердом состоянии он ионный со структурой [NO 2 ] + [NO 3 ] − ; в газе и в растворе – молекулярный O 2 N–O–NO 2 . Гидратация до азотной кислоты происходит легко, как и аналогичная реакция с перекисью водорода с образованием пероксонитовой кислоты (HOONO 2 ). Это сильный окислитель. Газообразная пятиокись азота разлагается следующим образом: [15]
Известно множество азотистых оксокислот , однако большинство из них в чистом виде нестабильны и известны только в виде водных растворов или солей. Гипонитистая кислота (H 2 N 2 O 2 ) — слабая дипротонная кислота со структурой HON=NOH (p K a1 6,9, p K a2 11,6). Кислые растворы довольно стабильны, но при pH выше 4 происходит разложение, катализируемое основаниями, через [HONNO] - на закись азота и гидроксид-анион. Гипонитриты (с участием N
2О2−
2анион) устойчивы к восстановителям и чаще сами действуют как восстановители. Они являются промежуточной стадией окисления аммиака в нитрит, происходящего в круговороте азота . Гипонитрит может действовать как мостиковый или хелатирующий бидентатный лиганд. [19]
Азотистая кислота (HNO 2 ) не известна как чистое соединение, но является обычным компонентом в газовом равновесии и важным водным реагентом: ее водные растворы могут быть получены путем подкисления холодного водного нитрита ( NO−
2, изогнутые) растворы, хотя уже при комнатной температуре диспропорция нитратов и оксидов азота значительна. Это слабая кислота с pK 3,35 при 18 °C. Их можно анализировать титриметрически по окислению до нитрата перманганатом . Они легко восстанавливаются до закиси азота и оксида азота двуокисью серы , до азотистой кислоты оловом (II) и до аммиака сероводородом . Соли гидразиния N
2ЧАС+
5реагируют с азотистой кислотой с образованием азидов, которые в дальнейшем реагируют с образованием закиси азота и азота. Нитрит натрия умеренно токсичен в концентрациях выше 100 мг/кг, но небольшие количества часто используются для консервирования мяса и в качестве консерванта, чтобы избежать бактериальной порчи. Его также используют для синтеза гидроксиламина и диазотирования первичных ароматических аминов следующим образом: [19]
Нитрит также является распространенным лигандом, который может координироваться пятью способами. Наиболее распространенными являются нитро (связанные с азотом) и нитрито (связанные с кислородом). Распространена изомерия нитро-нитрито, при этом нитрито-форма обычно менее стабильна. [19]

Азотная кислота (HNO 3 ) на сегодняшний день является наиболее важной и наиболее стабильной из азотистых оксокислот. Это одна из трех наиболее часто используемых кислот (две другие — серная кислота и соляная кислота ), впервые обнаруженная алхимиками в 13 веке. Его получают путем каталитического окисления аммиака до оксида азота, который окисляется до диоксида азота, а затем растворяется в воде с образованием концентрированной азотной кислоты. В Соединенных Штатах Америки ежегодно производится более семи миллионов тонн азотной кислоты, большая часть которой используется, среди прочего, для производства нитратов для удобрений и взрывчатых веществ. Безводную азотную кислоту можно получить перегонкой концентрированной азотной кислоты с пятиокисью фосфора при низком давлении в стеклянном аппарате в темноте. Ее можно производить только в твердом состоянии, так как при плавлении она самопроизвольно разлагается на диоксид азота, а жидкая азотная кислота подвергается самоионизации в большей степени, чем любая другая ковалентная жидкость, следующим образом: [19]
Известны два гидрата, HNO 3 ·H 2 O и HNO 3 ·3H 2 O, которые поддаются кристаллизации. Это сильная кислота, а концентрированные растворы являются сильными окислителями, хотя золото , платина , родий и иридий невосприимчивы к воздействию. Смесь концентрированной соляной и азотной кислот в соотношении 3:1, называемая царской водкой , еще сильнее и успешно растворяет золото и платину, поскольку образуются свободный хлор и нитрозилхлорид, а хлорид-анионы могут образовывать прочные комплексы. В концентрированной серной кислоте азотная кислота протонируется с образованием нитрония , который может действовать как электрофил при ароматическом нитровании: [19]
Термическая стабильность нитратов (с участием тригонального плоского NO−
3анион) зависит от основности металла, как и продукты разложения (термолиза), которые могут варьироваться между нитритом (например, натрия), оксидом (калий и свинец ) или даже самим металлом ( серебро ) в зависимости от их относительной стабильности. Нитрат также является обычным лигандом со многими способами координации. [19]
Наконец, хотя ортонитровой кислоты (H 3 NO 4 ), которая была бы аналогом ортофосфорной кислоты , не существует, тетраэдрический ортонитрат- анион NO3−
4известен в виде натриевых и калиевых солей: [19]
Эти белые кристаллические соли очень чувствительны к водяному пару и углекислому газу в воздухе: [19]
Несмотря на ограниченный химический состав, ортонитрат-анион интересен со структурной точки зрения из-за его правильной тетраэдрической формы и короткой длины связи N–O, что предполагает значительный полярный характер связи. [19]
Азот — один из важнейших элементов органической химии . Многие органические функциональные группы включают связь углерод-азот , например амиды (RCONR 2 ), амины (R 3 N), имины (RC(=NR)R), имиды ((RCO) 2 NR), азиды (RN 3 ). , азосоединения (RN 2 R), цианаты и изоцианаты (ROCN или RCNO), нитраты (RONO 2 ), нитрилы и изонитрилы (RCN или RNC), нитриты (RONO), нитросоединения (RNO 2 ), нитрозосоединения (RNO) , оксимы (RCR=NOH) и производные пиридина . Связи C–N сильно поляризованы в сторону азота. В этих соединениях азот обычно трехвалентен (хотя в четвертичных аммониевых солях он может быть четырехвалентным , R 4 N + ) с неподеленной парой, которая может придавать соединению основность, координируясь с протоном. Это может быть компенсировано другими факторами: например, амиды не являются основными, поскольку неподеленная пара делокализована в двойную связь (хотя они могут действовать как кислоты при очень низком pH, будучи протонированными по атому кислорода), а пиррол не является кислотным, потому что неподеленная пара делокализована как часть ароматического кольца. [20] Количество азота в химическом веществе можно определить методом Кьельдаля . [21] В частности, азот является важным компонентом нуклеиновых кислот , аминокислот и, следовательно, белков , а также переносящей энергию молекулы аденозинтрифосфата и, таким образом, жизненно важен для всей жизни на Земле. [20]