

Структура белка представляет собой трехмерное расположение атомов в молекуле аминокислотной цепи . Белки представляют собой полимеры , в частности полипептиды , образованные из последовательностей аминокислот , которые являются мономерами полимера. Отдельный мономер аминокислоты также может называться остатком , что указывает на повторяющуюся единицу полимера. Белки образуются путем проведения реакций конденсации аминокислот , в которых аминокислоты теряют одну молекулу воды за реакцию , чтобы прикрепиться друг к другу с помощью пептидной связи . По соглашению, цепь менее 30 аминокислот часто идентифицируется как пептид , а не белок. [1] Чтобы иметь возможность выполнять свою биологическую функцию, белки сворачиваются в одну или несколько определенных пространственных конформаций, обусловленных рядом нековалентных взаимодействий , таких как водородные связи , ионные взаимодействия , силы Ван-дер-Ваальса и гидрофобная упаковка. Чтобы понять функции белков на молекулярном уровне, часто необходимо определить их трехмерную структуру . Это тема научной области структурной биологии , которая использует такие методы, как рентгеновская кристаллография , ЯМР-спектроскопия , криоэлектронная микроскопия (крио-ЭМ) и двухполяризационная интерферометрия для определения структуры белков.
Размеры белковых структур варьируются от десятков до нескольких тысяч аминокислот. [2] По физическому размеру белки классифицируются как наночастицы , от 1 до 100 нм. Очень большие белковые комплексы могут быть образованы из белковых субъединиц . Например, многие тысячи молекул актина собираются в микрофиламент .
Белок обычно претерпевает обратимые структурные изменения при выполнении своей биологической функции. Альтернативные структуры одного и того же белка называются различными конформациями , а переходы между ними называются конформационными изменениями .
Существует четыре различных уровня структуры белка.
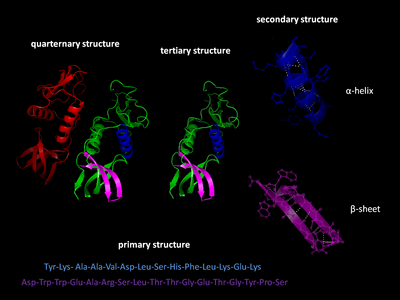
Первичная структура белка относится к последовательности аминокислот в полипептидной цепи. Первичная структура удерживается вместе пептидными связями , которые создаются в процессе биосинтеза белка . Два конца полипептидной цепи называются карбоксильным концом (C-концом) и аминоконцом (N-концом) в зависимости от природы свободной группы на каждом конце. Подсчет остатков всегда начинается с N-конца (NH2 - группа), который является концом, где аминогруппа не участвует в пептидной связи. Первичная структура белка определяется геном, соответствующим белку . Определенная последовательность нуклеотидов в ДНК транскрибируется в мРНК , которая считывается рибосомой в процессе, называемом трансляцией . Последовательность аминокислот в инсулине была открыта Фредериком Сэнгером , установившим, что белки имеют определяющие аминокислотные последовательности. [3] [4] Последовательность белка уникальна для этого белка и определяет структуру и функцию белка. Последовательность белка может быть определена такими методами, как деградация Эдмана или тандемная масс-спектрометрия . Однако часто она считывается непосредственно из последовательности гена с использованием генетического кода . Строго рекомендуется использовать слова «аминокислотные остатки» при обсуждении белков, поскольку при образовании пептидной связи теряется молекула воды , и поэтому белки состоят из аминокислотных остатков. Посттрансляционные модификации , такие как фосфорилирование и гликозилирование , обычно также считаются частью первичной структуры и не могут быть считаны из гена. Например, инсулин состоит из 51 аминокислоты в 2 цепях. Одна цепь имеет 31 аминокислоту, а другая — 20 аминокислот.
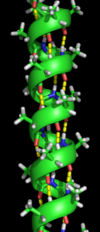
Вторичная структура относится к высокорегулярным локальным подструктурам на фактической полипептидной основной цепи. Два основных типа вторичной структуры, α-спираль и β-нить или β-слои , были предложены в 1951 году Лайнусом Полингом . [5] Эти вторичные структуры определяются моделями водородных связей между пептидными группами основной цепи. Они имеют регулярную геометрию, будучи ограниченными определенными значениями двугранных углов ψ и φ на графике Рамачандрана . Как α-спираль, так и β-слой представляют собой способ насыщения всех доноров и акцепторов водородных связей в пептидной основной цепи. Некоторые части белка упорядочены, но не образуют никаких регулярных структур. Их не следует путать со случайной катушкой , развернутой полипептидной цепью, не имеющей какой-либо фиксированной трехмерной структуры. Несколько последовательных вторичных структур могут образовывать « супервторичную единицу ». [6]
Третичная структура относится к трехмерной структуре, созданной одной молекулой белка (одной полипептидной цепью ). Она может включать один или несколько доменов . α-спирали и β-складчатые листы свернуты в компактную глобулярную структуру . Сворачивание обусловлено неспецифическими гидрофобными взаимодействиями , захоронением гидрофобных остатков из воды , но структура стабильна только тогда, когда части домена белка зафиксированы на месте специфическими третичными взаимодействиями, такими как солевые мостики , водородные связи и плотная упаковка боковых цепей и дисульфидных связей . Дисульфидные связи крайне редки в цитозольных белках, поскольку цитозоль (внутриклеточная жидкость) обычно является восстановительной средой.
Четвертичная структура — это трехмерная структура, состоящая из агрегации двух или более отдельных полипептидных цепей (субъединиц), которые действуют как одна функциональная единица ( мультимер ). Полученный мультимер стабилизируется теми же нековалентными взаимодействиями и дисульфидными связями, что и в третичной структуре. Существует множество возможных организаций четвертичной структуры. [7] Комплексы из двух или более полипептидов (т. е. нескольких субъединиц) называются мультимерами . В частности, он будет называться димером , если он содержит две субъединицы, тримером, если он содержит три субъединицы, тетрамером , если он содержит четыре субъединицы, и пентамером, если он содержит пять субъединиц, и так далее. Субъединицы часто связаны друг с другом операциями симметрии , такими как ось 2-го порядка в димере. Мультимеры, состоящие из идентичных субъединиц, обозначаются префиксом «гомо-», а мультимеры, состоящие из различных субъединиц, обозначаются префиксом «гетеро-», например, гетеротетрамер, такой как две альфа- и две бета-цепи гемоглобина .
Сборку множественных копий определенной полипептидной цепи можно описать как гомомер , мультимер или олигомер . Бертолини и др. в 2021 году [8] представили доказательства того, что образование гомомера может быть обусловлено взаимодействием между зарождающимися полипептидными цепями, поскольку они транслируются с мРНК близлежащими соседними рибосомами . Было идентифицировано, что сотни белков собираются в гомомеры в клетках человека. [8] Процесс сборки часто инициируется взаимодействием N-концевой области полипептидных цепей. Доказательства того, что многочисленные генные продукты образуют гомомеры (мультимеры) в различных организмах, основанные на доказательствах внутригенной комплементарности , были рассмотрены в 1965 году. [9]

Белки часто описываются как состоящие из нескольких структурных единиц. Эти единицы включают домены, мотивы и складки. Несмотря на то, что в эукариотических системах экспрессируется около 100 000 различных белков, существует гораздо меньше различных доменов, структурных мотивов и складок.
Структурный домен — это элемент общей структуры белка, который является самостабилизирующимся и часто сворачивается независимо от остальной части белковой цепи. Многие домены не являются уникальными для белковых продуктов одного гена или одного семейства генов , а вместо этого появляются в различных белках. Домены часто называются и выделяются, потому что они играют видную роль в биологической функции белка, к которому они принадлежат; например, « кальций -связывающий домен кальмодулина ». Поскольку они являются независимо стабильными, домены могут быть «обменены» генной инженерией между одним белком и другим для создания химерных белков. Консервативная комбинация нескольких доменов, которые встречаются в разных белках, таких как домен протеинтирозинфосфатазы и пара доменов C2 , была названа «супердоменом», который может развиваться как единое целое. [10]
Структурные и последовательностные мотивы относятся к коротким сегментам трехмерной структуры белка или аминокислотной последовательности, которые были обнаружены в большом количестве различных белков .
Третичные структуры белков могут иметь несколько вторичных элементов на одной и той же полипептидной цепи. Супервторичная структура относится к определенной комбинации элементов вторичной структуры , таких как β-α-β единицы или мотив спираль-поворот-спираль . Некоторые из них также могут называться структурными мотивами.
Складка белка относится к общей архитектуре белка, такой как спиральный пучок , β-бочка , складка Россмана или различные «складки», представленные в базе данных структурной классификации белков . [11] Связанное понятие — топология белка .
Белки не являются статическими объектами, а скорее заполняют ансамбли конформационных состояний . Переходы между этими состояниями обычно происходят в наномасштабах и связаны с функционально значимыми явлениями, такими как аллостерическая сигнализация [12] и ферментативный катализ . [13] Динамика белков и конформационные изменения позволяют белкам функционировать как наномасштабные биологические машины внутри клеток, часто в форме многобелковых комплексов . [14] Примерами являются моторные белки , такие как миозин , который отвечает за сокращение мышц , кинезин , который перемещает груз внутри клеток от ядра по микротрубочкам , и динеин , который перемещает груз внутри клеток по направлению к ядру и вызывает аксонемальное биение подвижных ресничек и жгутиков . «[В] результате [подвижная ресничка] представляет собой наномашину, состоящую, возможно, из более чем 600 белков в молекулярных комплексах, многие из которых также функционируют независимо как наномашины... Гибкие линкеры позволяют подвижным белковым доменам, соединенным ими, привлекать своих партнеров по связыванию и индуцировать аллостерию на больших расстояниях посредством динамики белковых доменов ». [15]

Белки часто рассматриваются как относительно стабильные третичные структуры , которые испытывают конформационные изменения после воздействия взаимодействий с другими белками или как часть ферментативной активности. Однако белки могут иметь различную степень стабильности, и некоторые из менее стабильных вариантов являются внутренне неупорядоченными белками . Эти белки существуют и функционируют в относительно «неупорядоченном» состоянии, не имея стабильной третичной структуры . В результате их трудно описать одной фиксированной третичной структурой . Конформационные ансамбли были разработаны как способ обеспечить более точное и «динамическое» представление конформационного состояния внутренне неупорядоченных белков . [17] [16]
Файлы ансамбля белков представляют собой представление белка, который можно считать имеющим гибкую структуру. Создание этих файлов требует определения того, какие из различных теоретически возможных конформаций белка существуют на самом деле. Один из подходов заключается в применении вычислительных алгоритмов к данным белка, чтобы попытаться определить наиболее вероятный набор конформаций для файла ансамбля . Существует несколько методов подготовки данных для базы данных ансамбля белков, которые делятся на две общие методологии — подходы пула и молекулярной динамики (МД) (показаны на рисунке). Подход на основе пула использует аминокислотную последовательность белка для создания огромного пула случайных конформаций. Затем этот пул подвергается более сложной вычислительной обработке, которая создает набор теоретических параметров для каждой конформации на основе структуры. Выбираются конформационные подмножества из этого пула, средние теоретические параметры которых близко соответствуют известным экспериментальным данным для этого белка. Альтернативный подход молекулярной динамики берет несколько случайных конформаций одновременно и подвергает все их экспериментальным данным. Здесь экспериментальные данные служат ограничениями, которые накладываются на конформации (например, известные расстояния между атомами). Принимаются только те конформации, которые остаются в пределах, установленных экспериментальными данными. Этот подход часто применяет большие объемы экспериментальных данных к конформациям, что является очень сложной вычислительной задачей. [16]
Конформационные ансамбли были созданы для ряда высокодинамичных и частично развернутых белков, таких как Sic1 / Cdc4 , [18] p15 PAF , [19] MKK7 , [20] бета-синуклеин [21] и P27 [22].
По мере трансляции полипептиды выходят из рибосомы в основном в виде случайной спирали и сворачиваются в свое нативное состояние . [23] [24] Обычно предполагается, что окончательная структура белковой цепи определяется ее аминокислотной последовательностью ( догма Анфинсена ). [25]
Термодинамическая стабильность белков представляет собой разницу свободной энергии между свернутым и развернутым состояниями белка. Эта разница свободной энергии очень чувствительна к температуре, поэтому изменение температуры может привести к развертыванию или денатурации. Денатурация белка может привести к потере функции и потере нативного состояния. Свободная энергия стабилизации растворимых глобулярных белков обычно не превышает 50 кДж/моль. [ необходима цитата ] Принимая во внимание большое количество водородных связей, которые имеют место для стабилизации вторичных структур, и стабилизацию внутреннего ядра посредством гидрофобных взаимодействий, свободная энергия стабилизации возникает как небольшая разница между большими числами. [26]


Около 90% структур белков, доступных в Protein Data Bank, были определены с помощью рентгеновской кристаллографии . [27] Этот метод позволяет измерить трехмерное (3-D) распределение плотности электронов в белке в кристаллизованном состоянии и, таким образом, вывести трехмерные координаты всех атомов , которые должны быть определены с определенным разрешением. Примерно 7% известных структур белков были получены с помощью методов ядерного магнитного резонанса (ЯМР). [28] Для более крупных белковых комплексов криоэлектронная микроскопия может определять структуры белков. Разрешение обычно ниже, чем у рентгеновской кристаллографии, или ЯМР, но максимальное разрешение неуклонно растет. Этот метод по-прежнему особенно ценен для очень больших белковых комплексов, таких как белки оболочки вирусов и амилоидные волокна.
Общий состав вторичной структуры может быть определен с помощью кругового дихроизма . Вибрационная спектроскопия также может быть использована для характеристики конформации пептидов, полипептидов и белков. [29] Двумерная инфракрасная спектроскопия стала ценным методом исследования структур гибких пептидов и белков, которые невозможно изучить другими методами. [30] [31] Более качественная картина структуры белка часто получается с помощью протеолиза , который также полезен для скрининга более кристаллизуемых образцов белка. Новые реализации этого подхода, включая быстрый параллельный протеолиз (FASTpp) , могут исследовать структурированную фракцию и ее стабильность без необходимости очистки. [32] После того, как структура белка была экспериментально определена, дальнейшие подробные исследования могут быть выполнены вычислительно, используя молекулярно-динамическое моделирование этой структуры. [33]
База данных структур белков — это база данных, которая моделируется вокруг различных экспериментально определенных структур белков. Цель большинства баз данных структур белков — организовать и аннотировать структуры белков, предоставляя биологическому сообществу доступ к экспериментальным данным полезным способом. Данные, включенные в базы данных структур белков, часто включают трехмерные координаты, а также экспериментальную информацию, такую как размеры элементарной ячейки и углы для структур, определенных рентгеновской кристаллографией . Хотя в большинстве случаев, в данном случае либо белки, либо конкретные определения структуры белка, также содержат информацию о последовательности, а некоторые базы данных даже предоставляют средства для выполнения запросов на основе последовательностей, основным атрибутом базы данных структур является структурная информация, тогда как базы данных последовательностей фокусируются на информации о последовательности и не содержат структурной информации для большинства записей. Базы данных структур белков имеют решающее значение для многих усилий в вычислительной биологии, таких как дизайн лекарственных препаратов на основе структуры , как при разработке используемых вычислительных методов, так и при предоставлении большого экспериментального набора данных, используемого некоторыми методами для предоставления информации о функции белка. [34]
Структуры белков можно сгруппировать на основе их структурного сходства, топологического класса или общего эволюционного происхождения. База данных структурной классификации белков [35] и база данных CATH [36] предоставляют две различные структурные классификации белков. Когда структурное сходство велико, два белка, возможно, разошлись от общего предка, [37] и общая структура между белками считается доказательством гомологии . Затем структурное сходство можно использовать для группировки белков в суперсемейства белков . [38] Если общая структура значительна, но общая доля мала, общий фрагмент может быть следствием более драматического эволюционного события, такого как горизонтальный перенос генов , и объединение белков, разделяющих эти фрагменты, в суперсемейства белков больше не оправдано. [37] Топология белка также может использоваться для классификации белков. Теория узлов и топология цепей — это две топологические структуры, разработанные для классификации складок белков на основе пересечения цепей и внутрицепочечных контактов соответственно.
Генерация последовательности белка намного проще, чем определение структуры белка. Однако структура белка дает гораздо больше информации о функции белка, чем его последовательность. Поэтому был разработан ряд методов для вычислительного прогнозирования структуры белка по его последовательности. [39] Методы прогнозирования ab initio используют только последовательность белка. Методы моделирования потоков и гомологии могут построить трехмерную модель для белка неизвестной структуры из экспериментальных структур эволюционно связанных белков, называемых семейством белков .
{{cite book}}: |journal=проигнорировано ( помощь )