Кальмодулин ( CaM ) (сокращение от cal cium - modulated protein ) — многофункциональный промежуточный белок-мессенджер, связывающий кальций, экспрессируемый во всех эукариотических клетках . [1] Он является внутриклеточной мишенью вторичного мессенджера Ca 2+ , и связывание Ca 2+ необходимо для активации кальмодулина. После связывания с Ca 2+ кальмодулин действует как часть пути передачи кальциевого сигнала , изменяя свои взаимодействия с различными целевыми белками, такими как киназы или фосфатазы . [2] [3] [4]
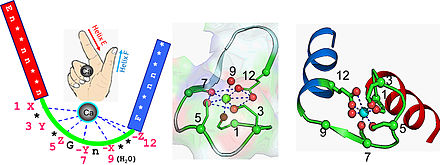
Кальмодулин — небольшой, высококонсервативный белок длиной 148 аминокислот (16,7 кДа). Белок имеет два приблизительно симметричных глобулярных домена (домены N и C), каждый из которых содержит пару мотивов EF-руки [5], разделенных гибкой линкерной областью для четырех участков связывания Ca 2+ , по два в каждом глобулярном домене. [6] В состоянии, свободном от Ca 2+ , спирали, образующие четыре EF-руки, свернуты в компактную ориентацию, а центральный линкер неупорядочен; [5] [6] [7] [8] в состоянии, насыщенном Ca 2+ , спирали EF-руки принимают открытую ориентацию, примерно перпендикулярную друг другу, а центральный линкер образует протяженную альфа-спираль в кристаллической структуре, [5] [6] но остается в значительной степени неупорядоченным в растворе. [9] C-домен имеет более высокую аффинность связывания с Ca 2+ , чем N-домен. [10] [11]
Кальмодулин структурно очень похож на тропонин C , другой связывающий Ca 2+ белок, содержащий четыре мотива EF-hand. [5] [12] Однако тропонин C содержит дополнительную альфа-спираль на своем N-конце и конститутивно связан со своей мишенью, тропонином I. Поэтому он не демонстрирует такого же разнообразия распознавания мишеней, как кальмодулин.
Способность кальмодулина распознавать огромный спектр целевых белков во многом обусловлена его структурной гибкостью. [13] В дополнение к гибкости центрального линкерного домена, N- и C-домены подвергаются открыто-закрытому конформационному циклированию в связанном с Ca2 + состоянии. [9] Кальмодулин также демонстрирует большую структурную изменчивость и претерпевает значительные конформационные колебания при связывании с мишенями. [14] [15] [16] Более того, преимущественно гидрофобная природа связывания между кальмодулином и большинством его мишеней позволяет распознавать широкий спектр последовательностей целевых белков. [14] [17] В совокупности эти особенности позволяют кальмодулину распознавать около 300 целевых белков [18], демонстрирующих различные мотивы последовательностей связывания CaM.



Связывание Ca 2+ с помощью EF-рук вызывает открытие N- и C-доменов, что обнажает гидрофобные поверхности связывания мишени. [6] Эти поверхности взаимодействуют с комплементарными неполярными сегментами на целевых белках, обычно состоящими из групп объемных гидрофобных аминокислот, разделенных 10–16 полярными и/или основными аминокислотами. [18] [14] Гибкий центральный домен кальмодулина позволяет белку оборачиваться вокруг своей цели, хотя известны альтернативные способы связывания. «Канонические» мишени кальмодулина, такие как киназы легкой цепи миозина и CaMKII , связываются только с белком, связанным с Ca 2+ , тогда как некоторые белки, такие как каналы NaV и белки мотива IQ , также связываются с кальмодулином в отсутствие Ca 2+ . [14] Связывание кальмодулина вызывает конформационные перестройки в целевом белке посредством «взаимно индуцированного соответствия», [19] что приводит к изменениям в функции целевого белка.
Связывание кальция кальмодулином демонстрирует значительную кооперативность , [5] [11] что делает кальмодулин необычным примером мономерного (одноцепочечного) кооперативного связывающего белка. Кроме того, связывание с мишенью изменяет связывающее сродство кальмодулина к ионам Ca 2+ , [20] [21] [22] , что допускает сложное аллостерическое взаимодействие между взаимодействиями связывания Ca 2+ и мишени. [23] Считается, что это влияние связывания с мишенью на сродство Ca 2+ допускает активацию Ca 2+ белков, которые конститутивно связаны с кальмодулином, таких как малопроводящие активируемые Ca 2+ калиевые каналы (SK). [24]
Хотя кальмодулин в основном действует как белок, связывающий Ca 2+ , он также координирует другие ионы металлов. Например, в присутствии типичных внутриклеточных концентраций Mg 2+ (0,5–1,0 мМ) и концентраций покоя Ca 2+ (100 нМ) участки связывания Ca 2+ кальмодулина по крайней мере частично насыщаются Mg 2+ . [25] Этот Mg 2+ вытесняется более высокими концентрациями Ca 2+ , генерируемыми сигнальными событиями. Аналогично, Ca 2+ сам по себе может вытесняться другими ионами металлов, такими как трехвалентные лантаноиды, которые связываются с карманами связывания кальмодулина даже сильнее, чем Ca 2+ . [26] [27] Хотя такие ионы искажают структуру кальмодулина [28] [29] и, как правило, не являются физиологически значимыми из-за их редкости in vivo , они, тем не менее, нашли широкое научное применение в качестве репортеров структуры и функции кальмодулина. [30] [31] [26]
Кальмодулин опосредует многие важные процессы, такие как воспаление , метаболизм , апоптоз , сокращение гладких мышц , внутриклеточное движение, кратковременная и долговременная память и иммунный ответ . [32] [33] Кальций участвует во внутриклеточной сигнальной системе, действуя как диффундирующий вторичный мессенджер для начальных стимулов. Он делает это, связывая различные мишени в клетке, включая большое количество ферментов , ионных каналов , аквапоринов и других белков. [4] Кальмодулин экспрессируется во многих типах клеток и может иметь различные субклеточные местоположения, включая цитоплазму , внутри органелл или быть связанным с плазматическими или органелльными мембранами, но он всегда находится внутриклеточно. [33] Многие из белков, которые связывает кальмодулин, сами не способны связывать кальций и используют кальмодулин в качестве сенсора кальция и преобразователя сигнала. Кальмодулин также может использовать запасы кальция в эндоплазматическом ретикулуме и саркоплазматическом ретикулуме . Кальмодулин может подвергаться посттрансляционным модификациям, таким как фосфорилирование , ацетилирование , метилирование и протеолитическое расщепление , каждая из которых может модулировать его действие.

Кальмодулин играет важную роль в сопряжении возбуждения и сокращения (EC) и инициировании цикла поперечных мостиков в гладких мышцах , в конечном итоге вызывая сокращение гладких мышц. [34] Для активации сокращения гладких мышц головка легкой цепи миозина должна быть фосфорилирована. Это фосфорилирование осуществляется киназой легкой цепи миозина (MLC) . Эта киназа MLC активируется кальмодулином, когда он связывается с кальцием, таким образом делая сокращение гладких мышц зависимым от присутствия кальция, через связывание кальмодулина и активацию киназы MLC. [34]
Другой способ, которым кальмодулин влияет на сокращение мышц, заключается в контроле перемещения Ca 2+ как через клеточную мембрану, так и через мембрану саркоплазматического ретикулума . Каналы Ca 2+ , такие как рецептор рианодина саркоплазматического ретикулума, могут быть ингибированы кальмодулином, связанным с кальцием, тем самым влияя на общий уровень кальция в клетке. [35] Кальциевые насосы выводят кальций из цитоплазмы или хранят его в эндоплазматическом ретикулуме , и этот контроль помогает регулировать многие последующие процессы.
Это очень важная функция кальмодулина, поскольку он косвенно участвует в каждом физиологическом процессе, на который влияет сокращение гладких мышц , например, пищеварение и сокращение артерий (что помогает распределять кровь и регулировать кровяное давление ). [36]
Кальмодулин играет важную роль в активации киназы фосфорилазы , что в конечном итоге приводит к расщеплению глюкозы из гликогена гликогенфосфорилазой . [ 37]
Кальмодулин также играет важную роль в липидном обмене веществ , влияя на кальцитонин . Кальцитонин — это полипептидный гормон, который снижает уровень Ca 2+ в крови и активирует каскады белков Gs , что приводит к образованию цАМФ. Действие кальцитонина можно заблокировать, подавляя действие кальмодулина, что позволяет предположить, что кальмодулин играет решающую роль в активации кальцитонина. [37]
Ca 2+ /кальмодулин-зависимая протеинкиназа II (CaMKII) играет решающую роль в типе синаптической пластичности, известной как долгосрочная потенциация (LTP), которая требует присутствия кальция/кальмодулина. CaMKII способствует фосфорилированию рецептора AMPA , что увеличивает чувствительность рецепторов AMPA. [38] Кроме того, исследования показывают, что ингибирование CaMKII мешает LTP. [38]
.jpg/440px-Sorghum_bicolor_(4171536532).jpg)
В то время как у дрожжей есть только один ген CaM, растения и позвоночные содержат эволюционно консервативную форму генов CaM. Разница между растениями и животными в передаче сигналов Ca 2+ заключается в том, что растения содержат расширенное семейство CaM в дополнение к эволюционно консервативной форме. [39] Кальмодулины играют важную роль в развитии растений и адаптации к стимулам окружающей среды.
Кальций играет ключевую роль в структурной целостности клеточной стенки и мембранной системы клетки. Однако высокие уровни кальция могут быть токсичны для клеточного энергетического метаболизма растения, и, следовательно, концентрация Ca 2+ в цитозоле поддерживается на субмикромолярном уровне путем удаления цитозольного Ca 2+ либо в апопласт , либо в просвет внутриклеточных органелл. Импульсы Ca 2+, создаваемые из-за повышенного притока и оттока, действуют как клеточные сигналы в ответ на внешние стимулы, такие как гормоны, свет, гравитация, абиотические стрессовые факторы, а также взаимодействия с патогенами. [40]
Растения содержат белки, связанные с CaM (CML), помимо типичных белков CaM. CML имеют около 15% сходства аминокислот с типичными CaM. Arabidopsis thaliana содержит около 50 различных генов CML, что приводит к вопросу о том, какую цель эти разнообразные диапазоны белков служат в клеточной функции. Все виды растений демонстрируют это разнообразие в генах CML. Различные CaM и CML различаются по своей аффинности к связыванию и активации ферментов, регулируемых CaM in vivo . CaM или CML также обнаруживаются в различных компартментах органелл.
В Arabidopsis белок DWF1 играет ферментативную роль в биосинтезе брассиностероидов, стероидных гормонов в растениях, которые необходимы для роста. Взаимодействие происходит между CaM и DWF1, [ необходимо уточнение ] и DWF1, будучи неспособным связывать CaM, неспособен производить регулярный фенотип роста в растениях. Следовательно, CaM необходим для функции DWF1 в росте растений.
Известно также, что белки, связывающие CaM, регулируют репродуктивное развитие растений. Например, протеинкиназа, связывающая CaM, в табаке действует как отрицательный регулятор цветения. Однако эти протеинкиназы, связывающие CaM, также присутствуют в апикальной меристеме побега табака, и высокая концентрация этих киназ в меристеме вызывает задержку перехода к цветению у растения.
Рецепторная киназа S -локуса (SRK) — еще одна протеинкиназа, которая взаимодействует с CaM. SRK участвует в реакциях самонесовместимости, возникающих при взаимодействии пыльцы и пестика у Brassica .
Цели CaM в Arabidopsis также участвуют в развитии пыльцы и оплодотворении. Транспортеры Ca 2+ необходимы для роста пыльцевой трубки . Следовательно, постоянный градиент Ca 2+ поддерживается на верхушке пыльцевой трубки для удлинения в процессе оплодотворения. Аналогично, CaM также необходим на верхушке пыльцевой трубки, где его основная роль заключается в руководстве ростом пыльцевой трубки.
Ca 2+ играет важную роль в образовании клубеньков у бобовых. Азот является необходимым элементом для растений, и многие бобовые, неспособные фиксировать азот самостоятельно, образуют симбиотические пары с азотфиксирующими бактериями, которые восстанавливают азот до аммиака. Для установления этого взаимодействия бобовых и ризобий требуется фактор Nod, который вырабатывается бактериями Rhizobium . Фактор Nod распознается клетками корневых волосков, которые участвуют в образовании клубеньков у бобовых. Реакции Ca 2+ различной природы характеризуются участием в распознавании фактора Nod. На кончике корневого волоска сначала происходит поток Ca 2+ , за которым сначала следует повторяющееся колебание Ca 2+ в цитозоле, а также вокруг ядра происходит спайк Ca 2+ . DMI3, важный ген для сигнальных функций фактора Nod ниже сигнатуры спайка Ca 2+ , может распознавать сигнатуру Ca 2+ . Кроме того, несколько генов CaM и CML у Medicago и Lotus экспрессируются в клубеньках.
Среди разнообразных защитных стратегий, которые растения используют против патогенов, очень распространена сигнализация Ca 2+ . Уровни свободного Ca 2+ в цитоплазме увеличиваются в ответ на патогенную инфекцию. Сигнатуры Ca 2+ такого рода обычно активируют систему защиты растений, вызывая гены, связанные с защитой, и гиперчувствительную гибель клеток. CaM, CML и связывающие CaM белки являются некоторыми из недавно идентифицированных элементов сигнальных путей защиты растений. Несколько генов CML в табаке , фасоли и томате реагируют на патогены. CML43 — это белок, связанный с CaM, который, как было выделено из гена APR134 в устойчивых к болезням листьях Arabidopsis для анализа экспрессии генов, быстро индуцируется, когда листья инокулируются Pseudomonas syringae . Эти гены также обнаружены в томатах ( Solanum lycopersicum ). CML43 из APR134 также связывается с ионами Ca 2+ in vitro, что показывает, что CML43 и APR134, следовательно, участвуют в Ca 2+ -зависимой сигнализации во время иммунного ответа растений на бактериальные патогены. [41] Экспрессия CML9 в Arabidopsis thaliana быстро индуцируется фитопатогенными бактериями, флагеллином и салициловой кислотой. [42] Экспрессия соевых SCaM4 и SCaM5 в трансгенном табаке и Arabidopsis вызывает активацию генов, связанных с устойчивостью к патогенам, а также приводит к повышенной устойчивости к широкому спектру патогенных инфекций. То же самое не относится к соевым SCaM1 и SCaM2, которые являются высококонсервативными изоформами CaM. Белок At BAG6 является связывающим CaM белком, который связывается с CaM только в отсутствие Ca 2+ , а не в его присутствии. BAG6 отвечает за сверхчувствительную реакцию запрограммированной гибели клеток, чтобы предотвратить распространение патогенной инфекции или ограничить рост патогена. Мутации в связывающих белках CaM могут привести к серьезным последствиям для защитного ответа растений на патогенные инфекции. Циклические нуклеотид-зависимые каналы (CNGC) представляют собой функциональные белковые каналы в плазматической мембране, которые имеют перекрывающиеся сайты связывания CaM, транспортирующие двухвалентные катионы, такие как Ca 2+ . Однако точная роль позиционирования CNGC в этом пути защиты растений до сих пор неясна.
Изменение внутриклеточных уровней Ca 2+ используется в качестве сигнатуры для различных реакций на механические стимулы, осмотическую и солевую обработку, а также холодовой и тепловой шок. Различные типы клеток корней показывают разную реакцию Ca 2+ на осмотический и солевой стрессы, и это подразумевает клеточную специфику моделей Ca 2+ . В ответ на внешний стресс CaM активирует глутаматдекарбоксилазу (GAD), которая катализирует превращение L -глутамата в ГАМК. Жесткий контроль над синтезом ГАМК важен для развития растений, и, следовательно, повышенные уровни ГАМК могут существенно влиять на развитие растений. Таким образом, внешний стресс может влиять на рост и развитие растений, и CaM участвуют в этом пути, контролируя этот эффект. [ необходима цитата ]
Растение сорго является хорошо зарекомендовавшим себя модельным организмом и может адаптироваться к жарким и сухим условиям. По этой причине его используют в качестве модели для изучения роли кальмодулина в растениях. [43] Сорго содержит проростки, которые экспрессируют богатый глицином РНК-связывающий белок , SbGRBP. Этот конкретный белок можно модулировать, используя тепло в качестве стрессора. Его уникальное расположение в ядре клетки и цитозоле демонстрирует взаимодействие с кальмодулином, которое требует использования Ca 2+ . [44] Подвергая растение разнообразным стрессовым условиям, оно может вызывать подавление различных белков , которые позволяют растительным клеткам переносить изменения окружающей среды. Показано, что эти модулированные стрессовые белки взаимодействуют с CaM. Гены CaMBP, экспрессируемые в сорго, изображены как «модельная культура» для исследования устойчивости к стрессу, вызванному жарой и засухой .
В исследовании Arabidopsis thaliana сотни различных белков продемонстрировали возможность связывания с CaM в растениях. [43]
Кальмодулин принадлежит к одной из двух основных групп кальций-связывающих белков, называемых белками руки EF . Другая группа, называемая аннексинами , связывает кальций и фосфолипиды, такие как липокортин . Многие другие белки связывают кальций, хотя связывание кальция может не считаться их основной функцией в клетке.