Цинк — химический элемент ; он имеет символ Zn и атомный номер 30. Цинк является слегка хрупким металлом при комнатной температуре и имеет блестящий сероватый вид после удаления окисления. Это первый элемент в группе 12 (IIB) таблицы Менделеева . В некоторых отношениях цинк химически подобен магнию : оба элемента проявляют только одну нормальную степень окисления (+2), а ионы Zn 2+ и Mg 2+ имеют одинаковый размер. [примечание 1] Цинк является 24-м по распространенности элементом в земной коре и имеет пять стабильных изотопов . Наиболее распространенной цинковой рудой является сфалерит (цинковая обманка), минерал сульфид цинка . Крупнейшие работоспособные залежи находятся в Австралии, Азии и США. Цинк очищается путем пенной флотации руды, обжига и окончательной экстракции с использованием электричества ( электродобыча ).
Цинк является важным микроэлементом для человека, [5] [6] [7] животных, [8] растений [9] и микроорганизмов [10] и необходим для пренатального и постнатального развития. [11] Это второй по распространенности микроэлемент в организме человека после железа и единственный металл, который присутствует во всех классах ферментов . [9] [7] Цинк также является важным питательным элементом для роста кораллов, поскольку он является важным кофактором для многих ферментов. [12]
Дефицит цинка затрагивает около двух миллиардов человек в развивающихся странах и связан со многими заболеваниями. [13] У детей дефицит вызывает задержку роста, задержку полового созревания, восприимчивость к инфекциям и диарею . [11] Ферменты с атомом цинка в реактивном центре широко распространены в биохимии, например, алкогольдегидрогеназа человека. [14] Потребление избытка цинка может вызвать атаксию , вялость и дефицит меди . В морских биомах, особенно в полярных регионах, дефицит цинка может поставить под угрозу жизнеспособность первичных сообществ водорослей, потенциально дестабилизируя сложные морские трофические структуры и, следовательно, влияя на биоразнообразие. [15]
Латунь , сплав меди и цинка в различных пропорциях, использовалась еще в третьем тысячелетии до нашей эры в Эгейском регионе и регионе, который в настоящее время включает Ирак , Объединенные Арабские Эмираты , Калмыкию , Туркменистан и Грузию . Во втором тысячелетии до нашей эры его использовали в таких регионах, как Западная Индия , Узбекистан , Иран , Сирия , Ирак и Израиль . [16] [17] [18] Металлический цинк не производился в больших масштабах до 12 века в Индии, хотя он был известен древним римлянам и грекам. [19] Шахты Раджастана дали убедительные доказательства производства цинка, начиная с 6-го века до нашей эры. [20] На сегодняшний день самые старые свидетельства наличия чистого цинка происходят из Завара, в Раджастане, еще в 9 веке нашей эры, когда для получения чистого цинка использовался процесс дистилляции. [21] Алхимики сжигали цинк на воздухе, образуя то, что они называли « философской шерстью » или «белым снегом».
Элемент, вероятно, был назван алхимиком Парацельсом в честь немецкого слова Zinke (зубец, зуб). Немецкому химику Андреасу Сигизмунду Маргграфу приписывают открытие чистого металлического цинка в 1746 году. Работы Луиджи Гальвани и Алессандро Вольта открыли электрохимические свойства цинка к 1800 году. Коррозионностойкое цинкование железа ( горячее цинкование ) является основным применением цинка. . Другие области применения — электрические батареи , небольшие неконструкционные отливки и сплавы, такие как латунь. Обычно используются различные соединения цинка, такие как карбонат и глюконат цинка (в качестве пищевых добавок), хлорид цинка (в дезодорантах), пиритион цинка (шампуни против перхоти ), сульфид цинка (в люминесцентных красках), а также диметилцинк или диэтилцинк. в органической лаборатории.
Цинк — голубовато-белый, блестящий, диамагнитный металл [22] , хотя наиболее распространенные коммерческие сорта металла имеют матовую поверхность. [23] Он несколько менее плотен, чем железо , и имеет гексагональную кристаллическую структуру с искаженной формой гексагональной плотной упаковки , в которой каждый атом имеет шесть ближайших соседей (в 265,9 пм) в своей плоскости и шесть других на большем расстоянии. 14:00.6. [24] Металл твердый и хрупкий при большинстве температур, но становится податливым при температуре от 100 до 150 °C. [22] [23] При температуре выше 210 °C металл снова становится хрупким и его можно измельчить при избиении. [25] Цинк является хорошим проводником электричества . [22] Для металла цинк имеет относительно низкую температуру плавления (419,5 °C) и температуру кипения (907 °C). [26] Температура плавления самая низкая из всех металлов d-блока , за исключением ртути и кадмия ; по этой причине, среди прочего, цинк, кадмий и ртуть часто не считаются переходными металлами , как остальные металлы d-блока. [26]
Многие сплавы содержат цинк, в том числе латунь. Другими металлами, которые, как давно известно, образуют бинарные сплавы с цинком, являются алюминий , сурьма , висмут , золото , железо, свинец , ртуть , серебро , олово , магний , кобальт , никель , теллур и натрий . [27] Хотя ни цинк, ни цирконий не являются ферромагнитными , их сплав ZrZn
2, проявляет ферромагнетизм ниже 35 К . [22]
Цинк составляет около 75 ppm (0,0075%) земной коры , что делает его 24-м по распространенности элементом. Типичные фоновые концентрации цинка в атмосфере не превышают 1 мкг/м 3 ; 300 мг/кг в почве; 100 мг/кг в растительности; 20 мкг/л в пресной воде и 5 мкг/л в морской воде. [28] Этот элемент обычно встречается в рудах в сочетании с другими недрагоценными металлами , такими как медь и свинец . [29] Цинк является халькофилом , то есть этот элемент чаще всего встречается в минералах вместе с серой и другими тяжелыми халькогенами , а не с легким халькогенным кислородом или с нехалькогенными электроотрицательными элементами, такими как галогены . Сульфиды образовались в результате затвердевания коры в восстановительных условиях ранней атмосферы Земли. [30] Сфалерит , который представляет собой форму сульфида цинка, является наиболее широко добываемой цинксодержащей рудой, поскольку его концентрат содержит 60–62% цинка. [29]
Другие минералы-источники цинка включают смитсонит ( карбонат цинка ), гемиморфит ( силикат цинка ), вюрцит (еще один сульфид цинка) и иногда гидроцинцит (основной карбонат цинка ). [31] За исключением вюрцита, все эти другие минералы образовались в результате выветривания первичных сульфидов цинка. [30]
Выявленные мировые ресурсы цинка составляют около 1,9–2,8 млрд тонн . [32] [33] Крупные месторождения находятся в Австралии, Канаде и США, а крупнейшие запасы - в Иране . [30] [34] [35] Самая последняя оценка базы запасов цинка (соответствует установленным минимальным физическим критериям, связанным с текущей практикой добычи и производства) была сделана в 2009 году и оценивается примерно в 480 млн тонн. [36] Запасы цинка, с другой стороны, это геологически идентифицированные рудные тела, пригодность к извлечению которых экономически обоснована (местоположение, содержание, качество и количество) на момент определения. Поскольку разведка и разработка месторождений являются непрерывным процессом, объем запасов цинка не является фиксированным числом, и об устойчивости поставок цинковой руды нельзя судить, просто экстраполируя совокупный срок службы сегодняшних цинковых рудников. Эта концепция хорошо подтверждается данными Геологической службы США (USGS), которые показывают, что, хотя производство рафинированного цинка увеличилось на 80% в период с 1990 по 2010 год, срок службы запасов цинка остался неизменным. За всю историю до 2002 года было добыто около 346 миллионов тонн, а по оценкам ученых, используется около 109–305 миллионов тонн. [37] [38] [39]

В природе встречаются пять стабильных изотопов цинка, из которых наиболее распространенным изотопом является 64 Zn (49,17% естественного содержания ). [40] [41] Другие изотопы, встречающиеся в природе:66
Цинк (27,73%),67
Цинк (4,04%),68
Zn (18,45%) и70
Цинк (0,61%). [41]
Охарактеризовано несколько десятков радиоизотопов .65
Zn , период полураспада которого составляет 243,66 дней, является наименее активным радиоизотопом, за ним следует72
Zn с периодом полураспада 46,5 часов. [40] Цинк имеет 10 ядерных изомеров , из которых 69m Zn имеет самый длинный период полураспада — 13,76 часа. [40] Верхний индекс m указывает на метастабильный изотоп. Ядро метастабильного изотопа находится в возбужденном состоянии и вернется в основное состояние , испуская фотон в виде гамма-излучения .61
Zn имеет три возбужденных метастабильных состояния и73
У Зна их два. [42] Изотопы65
Зн ,71
Зн ,77
Цинк и78
Каждый Zn имеет только одно возбужденное метастабильное состояние. [40]
Наиболее распространенным способом распада радиоизотопа цинка с массовым числом менее 66 является захват электрона . Продукт распада , возникающий в результате захвата электронов, представляет собой изотоп меди. [40]
Наиболее распространенным способом распада радиоизотопа цинка с массовым числом выше 66 является бета-распад (β- ) , в результате которого образуется изотоп галлия . [40]
Цинк имеет электронную конфигурацию [Ar]3d 10 4s 2 и входит в 12 группу таблицы Менделеева . Это умеренно активный металл и сильный восстановитель . [43] Поверхность чистого металла быстро тускнеет , в конечном итоге образуя защитный пассивирующий слой основного карбоната цинка Zn .
5(ОЙ)
6(СО 3 )
2, в результате реакции с атмосферным углекислым газом . [44]
Цинк горит на воздухе ярким голубовато-зеленым пламенем, выделяя пары оксида цинка . [45] Цинк легко реагирует с кислотами , щелочами и другими неметаллами. [46] Чрезвычайно чистый цинк очень медленно реагирует при комнатной температуре с кислотами. [45] Сильные кислоты, такие как соляная или серная кислота , могут удалить пассивирующий слой, и последующая реакция с кислотой выделяет газообразный водород. [45]
В химии цинка преобладает степень окисления +2. При образовании соединений в этой степени окисления электроны внешней оболочки теряются , образуя голый ион цинка с электронной конфигурацией [Ar]3d 10 . [47] В водном растворе образуется октаэдрический комплекс [Zn(H
2О) 6 ]2+
является преобладающим видом. [48] Испарение цинка в сочетании с хлоридом цинка при температуре выше 285 °C указывает на образование Zn .
2кл
2, соединение цинка со степенью окисления +1. [45] Никакие соединения цинка в положительных степенях окисления, кроме +1 или +2, не известны. [49] Расчеты показывают, что соединение цинка со степенью окисления +4 маловероятно. [50] Предполагается, что Zn(III) существует в присутствии сильно электроотрицательных трианионов; [51] однако существуют некоторые сомнения относительно этой возможности. [52] Но в 2021 году было сообщено о другом соединении с большим количеством доказательств, которое имело степень окисления +3 с формулой ZnBeB 11 (CN) 12 . [53]
Химия цинка аналогична химии поздних переходных металлов первого ряда, никеля и меди, хотя он имеет заполненную d-оболочку, а соединения диамагнитны и в основном бесцветны. [54] Ионные радиусы цинка и магния почти идентичны. Из-за этого некоторые из эквивалентных солей имеют одинаковую кристаллическую структуру [55] , а в других обстоятельствах, когда ионный радиус является определяющим фактором, химический состав цинка имеет много общего с химическим составом магния. [45] В других отношениях сходства с поздними переходными металлами первого ряда мало. Цинк склонен образовывать связи с большей степенью ковалентности и гораздо более устойчивые комплексы с N- и S -донорами. [54] Комплексы цинка преимущественно 4- или 6- координатные , хотя известны и 5-координатные комплексы. [45]
Соединения цинка(I) встречаются очень редко. Ион [Zn 2 ] 2+ участвует в образовании желтого диамагнитного стекла при растворении металлического цинка в расплавленном ZnCl 2 . [56] Ядро [Zn 2 ] 2+ аналогично катиону [Hg 2 ] 2+ , присутствующему в соединениях ртути (I). Диамагнитная природа иона подтверждает его димерную структуру. Первое соединение цинка(I), содержащее связь Zn–Zn, (η 5 -C 5 Me 5 ) 2 Zn 2 .


Бинарные соединения цинка известны для большинства металлоидов и всех неметаллов , кроме благородных газов . Оксид ZnO представляет собой белый порошок, почти нерастворимый в нейтральных водных растворах, но амфотерный , растворяющийся как в сильноосновных, так и в кислых растворах. [45] Другие халькогениды ( ZnS , ZnSe и ZnTe ) имеют различные применения в электронике и оптике. [57] Пниктогениды ( Zn
3Н
2, Зн
3п
2, Зн
3Как
2и цинк
3Сб
2), [58] [59] пероксид ( ZnO2), гидрид ( ZnH2) и карбид ( ZnC
2) также известны. [60] Из четырех галогенидов ZnF2имеет наиболее ионный характер, тогда как остальные ( ZnCl
2, ZnBr
2, и ЗнИ2) имеют относительно низкие температуры плавления и считаются более ковалентными. [61]
В слабых основных растворах, содержащих Zn2+
ионы, гидроксид Zn(OH)
2образуется в виде белого осадка . В более сильнощелочных растворах этот гидроксид растворяется с образованием цинкатов ( [Zn(OH) 4 ]2-
). [45] Нитрат Zn(NO 3 )
2, хлорат Zn(ClO 3 )
2, сульфат ZnSO
4, фосфат Zn
3(ПО 4 )
2, молибдат ZnMoO
4, цианид Zn(CN)
2, арсенит Zn(AsO 2 )
2, арсенат Zn(AsO 4 )
2·8ч
2O и хромат ZnCrO
4(одно из немногих цветных соединений цинка) являются несколькими примерами других распространенных неорганических соединений цинка. [62] [63]
Цинкорганические соединения – это соединения, содержащие ковалентные связи цинк– углерод . Диэтилцинк ( (C
2Н 5 )
2Zn ) — реагент в синтетической химии. Впервые о нем сообщили в 1848 году в результате реакции цинка и этилиодида , и это было первое известное соединение, содержащее сигма-связь металл-углерод . [64]
Кобальтицианидная бумага (тест Риннмана на цинк) может использоваться в качестве химического индикатора цинка. 4 г K 3 Co(CN) 6 и 1 г KClO 3 растворяют в 100 мл воды. Бумагу погружают в раствор и сушат при температуре 100°С. Одну каплю образца капают на сухую бумагу и нагревают. Зеленый диск указывает на наличие цинка. [65]
Были обнаружены различные единичные примеры использования нечистого цинка в древности. Цинковые руды использовались для изготовления латуни из сплава цинка и меди за тысячи лет до открытия цинка как отдельного элемента. Иудейская латунь XIV-X веков до нашей эры содержит 23% цинка. [17]
Знания о том, как производить латунь, распространились в Древнюю Грецию к VII веку до нашей эры, но ее разновидностей было создано мало. [18] Были обнаружены украшения из сплавов , содержащих 80–90% цинка, а остальную часть составляют свинец, железо, сурьма и другие металлы, возраст которых составляет 2500 лет. [29] Возможно, доисторическая статуэтка, содержащая 87,5% цинка, была найдена на дакийском археологическом участке. [66]
Страбон , писавший в I веке до нашей эры (но цитируя ныне утерянную работу историка Теопомпа , жившего в IV веке до нашей эры ), упоминает «капли ложного серебра», которые при смешивании с медью образуют латунь. Это может относиться к небольшим количествам цинка, который является побочным продуктом плавки сульфидных руд. [67] Цинк в таких остатках в плавильных печах обычно выбрасывался, поскольку считался бесполезным. [68]
Производство латуни было известно римлянам примерно к 30 г. до н.э. [69] Они изготавливали латунь, нагревая в тигле порошкообразный каламин ( силикат или карбонат цинка), древесный уголь и медь. [69] Полученную каламиновую латунь затем отливали или заковывали в форму для использования в оружии. [70] Некоторые монеты, отчеканенные римлянами в христианскую эпоху, изготовлены, вероятно, из каламиновой латуни. [71]

Самые старые известные таблетки были изготовлены из карбонатов цинка, гидроцинцита и смитсонита. Таблетки использовались при воспалении глаз и были найдены на борту римского корабля «Релитто дель Поццино», потерпевшего крушение в 140 году до нашей эры. [72] [73]
Бернская цинковая табличка — это вотивная табличка времен Римской Галлии , изготовленная из сплава, состоящего в основном из цинка. [74]
В «Чарака-самхите» , предположительно написанной между 300 и 500 годами нашей эры, [75] упоминается металл, который при окислении образует пушпанджан , предположительно являющийся оксидом цинка. [76] Цинковые рудники в Заваре, недалеко от Удайпура в Индии, действовали еще с периода Маурьев ( ок. 322 и 187 гг. до н. э.). Однако выплавка металлического цинка здесь, по-видимому, началась примерно в 12 веке нашей эры. [77] [78] По одной из оценок, в этом месте с 12 по 16 века производилось около миллиона тонн металлического цинка и оксида цинка. [31] Другая оценка дает общий объем производства 60 000 тонн металлического цинка за этот период. [77] В « Расаратна Самуккая» , написанном примерно в 13 веке нашей эры, упоминаются два типа цинксодержащих руд: один используется для добычи металлов, а другой — в лечебных целях. [78]
Цинк был четко признан металлом под обозначением Ясада или Джасада в медицинском лексиконе, приписываемом индуистскому королю Маданапале (династия Така) и написанном около 1374 года. [79] Плавка и извлечение нечистого цинка путем восстановления каламина шерстью. и других органических веществ было осуществлено в 13 веке в Индии. [22] [80] Китайцы не изучали эту технику до 17 века. [80]

Алхимики сжигали металлический цинк на воздухе и собирали полученный оксид цинка на конденсаторе . Некоторые алхимики называли этот оксид цинка lana philosophica , что по латыни означает «шерсть философа», потому что он собирался в шерстяные пучки, тогда как другие считали, что он похож на белый снег, и называли его nix album . [81]
Название металла, вероятно, впервые было задокументировано Парацельсом , немецким алхимиком швейцарского происхождения, который называл этот металл «цинком» или «цинкеном» в своей книге « Liber Mineralium II» в 16 веке. [80] [82] Это слово, вероятно, происходит от немецкого zinke и предположительно означает «зубчатый, заостренный или зазубренный» (металлические кристаллы цинка имеют игольчатый вид). [83] Цинк также может означать «оловянный» из-за его родства с немецким zinn , означающим олово. [84] Еще одна возможность состоит в том, что это слово происходит от персидского слова سنگ seng , означающего камень. [85] Металл также называли индийским оловом , тутанего , каламином и прядением . [29]
Немецкий металлург Андреас Либавиус получил некоторое количество того, что он назвал «калай» (от малайского или хинди слова, обозначающего олово), происходящего из Малабара с грузового корабля, захваченного у португальцев в 1596 году. [86] Либавиус описал свойства образца. , который мог быть цинком. Цинк регулярно импортировался в Европу с Востока в 17 и начале 18 веков [80] , но временами был очень дорогим. [заметка 2]

Металлический цинк был выделен в Индии к 1300 году нашей эры. [87] [88] [89] Прежде чем он был изолирован в Европе, он был импортирован из Индии примерно в 1600 году нашей эры. [90] Универсальный словарь Постлуэйта , современный источник технологической информации в Европе, не упоминал цинк до 1751 года, но этот элемент изучался и раньше. [78] [91]
Фламандский металлург и алхимик П. М. де Респур сообщил, что он извлек металлический цинк из оксида цинка в 1668 году. [31] В начале 18 века Этьен Франсуа Жоффруа описал, как оксид цинка конденсируется в виде желтых кристаллов на железных слитках, помещенных над цинковой рудой. это плавят. [31] Говорят , что в Великобритании Джон Лейн проводил эксперименты по выплавке цинка, вероятно, в Ландоре , до своего банкротства в 1726 году. [92]
В 1738 году в Великобритании Уильям Чемпион запатентовал процесс извлечения цинка из каламина в плавильной печи с вертикальной ретортой . [93] Его техника напоминала ту, что использовалась на цинковых рудниках Завар в Раджастане , но нет никаких доказательств того, что он посещал Восток. [90] Процесс Чемпиона использовался до 1851 года. [80]
Немецкому химику Андреасу Маргграфу обычно приписывают выделение чистого металлического цинка на Западе, хотя шведский химик Антон фон Сваб четыре года назад перегнал цинк из каламина. [80] В своем эксперименте 1746 года Маргграф нагрел смесь каламина и древесного угля в закрытом сосуде без меди, чтобы получить металл. [94] [68] Эта процедура стала коммерчески практичной к 1752 году. [95]

Брат Уильяма Чемпиона, Джон, в 1758 году запатентовал процесс обжига сульфида цинка до оксида, пригодного для использования в автоклаве. [29] До этого для производства цинка можно было использовать только каламин. В 1798 году Иоганн Кристиан Руберг усовершенствовал процесс плавки, построив первую горизонтальную ретортную печь. [96] Жан-Жак Даниэль Дони построил в Бельгии горизонтальный цинковый завод другого типа, который перерабатывал еще больше цинка. [80] Итальянский врач Луиджи Гальвани обнаружил в 1780 году, что соединение спинного мозга только что препарированной лягушки с железной перекладиной, прикрепленной латунным крюком, заставляет ногу лягушки подергиваться. [97] Он ошибочно полагал, что открыл способность нервов и мышц создавать электричество , и назвал этот эффект « животным электричеством ». [98] Гальванический элемент и процесс гальванизации были названы в честь Луиджи Гальвани, и его открытия проложили путь к электрическим батареям , гальванизации и катодной защите . [98]
Друг Гальвани, Алессандро Вольта , продолжил исследования этого эффекта и изобрел Вольтову батарею в 1800 году . [97] Батарея Вольта состояла из стопки упрощенных гальванических элементов , каждая из которых представляла собой одну пластину из меди и одну из цинка, соединенных электролитом . При последовательном соединении этих блоков гальваническая батарея (или «батарея») в целом имела более высокое напряжение, и ее можно было использовать легче, чем отдельные элементы. Электричество вырабатывается потому, что потенциал Вольта между двумя металлическими пластинами заставляет электроны течь из цинка в медь и разъедать цинк. [97]
Немагнитный характер цинка и отсутствие цвета в растворе задержали открытие его важности для биохимии и питания. [99] Ситуация изменилась в 1940 году, когда было показано, что карбоангидраза , фермент, очищающий кровь от углекислого газа, содержит цинк в активном центре . [99] Пищеварительный фермент карбоксипептидаза стал вторым известным цинксодержащим ферментом в 1955 году. [99]
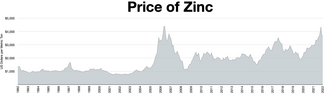


Цинк является четвертым по распространенности используемым металлом, уступая только железу , алюминию и меди , годовой объем производства которого составляет около 13 миллионов тонн. [32] Крупнейшим в мире производителем цинка является компания Nyrstar , образовавшаяся в результате слияния австралийской OZ Minerals и бельгийской Umicore . [101] Около 70% цинка в мире производится в результате добычи полезных ископаемых, а остальные 30% — в результате переработки вторичного цинка. [102]
Коммерчески чистый цинк известен как Special High Grade, часто сокращенно SHG , и имеет чистоту 99,995%. [103]
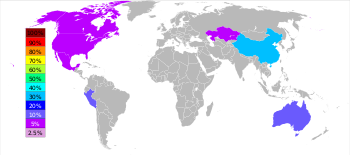
Во всем мире 95% нового цинка добывается из месторождений сульфидных руд, в которых сфалерит (ZnS) почти всегда смешан с сульфидами меди, свинца и железа. [104] : 6 цинковых рудников разбросаны по всему миру, основные районы — Китай, Австралия и Перу. В 2014 году Китай произвел 38% мирового производства цинка. [32]
Цинк металлический производят с помощью добывающей металлургии . [105] : 7 Руда тонко измельчается, затем подвергается пенной флотации для отделения минералов от пустой породы (по свойству гидрофобности ), с получением концентрата сульфидной цинковой руды [105] : 16 , состоящего примерно из 50 % цинка, 32 % сера, 13% железа и 5% SiO.
2. [105] : 16
Обжиг превращает концентрат сульфида цинка в оксид цинка: [104]
Диоксид серы используется для производства серной кислоты, необходимой для процесса выщелачивания. Если для производства цинка используются месторождения карбоната цинка , силиката цинка или цинк-шпинелида (например, месторождение Скорпион в Намибии ), то обжиг можно не проводить. [106]
Для дальнейшей переработки используются два основных метода: пирометаллургия или электролиз . Пирометаллургия восстанавливает оксид цинка углеродом или окисью углерода при 950 ° C (1740 ° F) до металла, который перегоняется в виде паров цинка, чтобы отделить его от других металлов, которые не летучие при этих температурах. [107] Пары цинка собираются в конденсаторе. [104] Приведенные ниже уравнения описывают этот процесс: [104]
При электролизе цинк выщелачивается из рудного концентрата серной кислотой и осаждаются примеси: [108]
Наконец, цинк восстанавливается электролизом . [104]
Серная кислота регенерируется и возвращается на стадию выщелачивания.
Когда оцинкованное сырье подается в электродуговую печь , цинк извлекается из пыли с помощью ряда процессов, преимущественно вельц-процесса (90% по состоянию на 2014 год). [109]
При переработке сульфидных цинковых руд образуются большие объемы диоксида серы и паров кадмия . Металлургический шлак и другие отходы содержат значительное количество металлов. В период с 1806 по 1882 год в бельгийских городах Ла-Каламин и Пломбьер было добыто и выплавлено около 1,1 миллиона тонн металлического цинка и 130 тысяч тонн свинца. [110] Отвалы прошлых горных работ выщелачивают цинк и кадмий, а отложения Река Гёль содержит нетривиальные количества металлов. [110] Около двух тысяч лет назад выбросы цинка в результате горнодобывающей и плавильной промышленности составляли 10 тысяч тонн в год. После увеличения в 10 раз по сравнению с 1850 годом выбросы цинка достигли пика в 3,4 миллиона тонн в год в 1980-х годах и снизились до 2,7 миллиона тонн в 1990-х годах, хотя исследование арктической тропосферы в 2005 году показало, что концентрации там не отражают снижения. Техногенные и естественные выбросы происходят в соотношении 20 к 1. [9]
Содержание цинка в реках, протекающих через промышленные и горнодобывающие районы, может достигать 20 частей на миллион. [111] Эффективная очистка сточных вод значительно снижает эту проблему; например, обработка вдоль Рейна привела к снижению уровня цинка до 50 частей на миллиард. [111] Концентрация цинка всего в 2 ppm отрицательно влияет на количество кислорода, которое рыбы могут переносить в крови. [112]
Почвы, загрязненные цинком в результате добычи, переработки или удобрения цинксодержащим илом, могут содержать несколько граммов цинка на килограмм сухой почвы. Уровни цинка, превышающие 500 частей на миллион в почве, мешают растениям поглощать другие важные металлы , такие как железо и марганец . В некоторых образцах почвы были зафиксированы уровни цинка от 2000 до 180 000 частей на миллион (18%). [111]
Основные области применения цинка включают, с процентами, указанными для США [115]:


Цинк чаще всего используется в качестве антикоррозионного средства [116] , а наиболее распространенной формой является гальванизация (покрытие железа или стали ). В 2009 году в США для гальванизации было использовано 55% или 893 000 тонн металлического цинка. [115]
Цинк более реакционноспособен, чем железо или сталь, и поэтому будет притягивать почти все местные окисления, пока не полностью корродирует. [117] Защитный поверхностный слой из оксида и карбоната ( Zn
5(ОЙ)
6(КО
3)
2) образуется при коррозии цинка. [118] Эта защита сохраняется даже после того, как слой цинка поцарапается, но со временем ухудшается по мере коррозии цинка. [118] Цинк наносится электрохимически или в виде расплавленного цинка путем горячего цинкования или распыления. Гальванизация применяется при изготовлении сетчатых ограждений, ограждений, подвесных мостов, фонарных столбов, металлических крыш, теплообменников и кузовов автомобилей. [119]
Относительная реакционная способность цинка и его способность притягивать к себе окисление делают его эффективным жертвенным анодом в катодной защите (КП). Например, катодную защиту заглубленного трубопровода можно обеспечить, подключив к трубе аноды из цинка. [118] Цинк действует как анод (отрицательный конец), медленно разъедаясь при прохождении электрического тока по стальному трубопроводу. [118] [примечание 3] Цинк также используется для катодной защиты металлов, подвергающихся воздействию морской воды. [120] Цинковый диск, прикрепленный к железному рулю корабля, будет медленно корродировать, пока руль останется неповрежденным. [117] Аналогичным образом временную защиту обеспечивает цинковая пробка, прикрепленная к гребному винту, или металлическое защитное ограждение киля корабля.
При стандартном электродном потенциале (SEP) -0,76 В цинк используется в качестве анодного материала для батарей. (Более реактивный литий (SEP -3,04 В) используется для анодов в литиевых батареях ). Порошок цинка используется таким образом в щелочных батареях , а корпус (который также служит анодом) цинк-угольных батарей изготавливается из листового цинка. [121] [122] Цинк используется в качестве анода или топлива воздушно-цинковой батареи /топливного элемента. [123] [124] [125] В проточной цинк-цериевой батарее также используется отрицательная полуэлементная батарея на основе цинка. [126]
Широко используемым цинковым сплавом является латунь, в которой медь легирована от 3% до 45% цинка, в зависимости от типа латуни. [118] Латунь, как правило, более пластична и прочна, чем медь, и обладает превосходной коррозионной стойкостью . [118] Эти свойства делают его полезным в коммуникационном оборудовании, оборудовании, музыкальных инструментах и водяных клапанах. [118]

Другие широко используемые сплавы цинка включают нейзильбер , металл пишущей машинки, мягкий и алюминиевый припой , а также техническую бронзу . [22] Цинк также используется в современных органах в качестве заменителя традиционного сплава свинца и олова в трубках. [127] Сплавы 85–88% цинка, 4–10% меди и 2–8% алюминия находят ограниченное применение в некоторых типах машинных подшипников. Цинк является основным металлом в американских монетах в один цент (пенни) с 1982 года. [128] Цинковая сердцевина покрыта тонким слоем меди, чтобы придать внешний вид медной монеты. В 1994 году 33 200 тонн (36 600 коротких тонн) цинка было использовано для производства 13,6 миллиардов пенни в Соединенных Штатах. [129]
Сплавы цинка с небольшим количеством меди, алюминия и магния полезны при литье под давлением , а также центробежном литье , особенно в автомобильной, электротехнической и аппаратной промышленности. [22] Эти сплавы продаются под названием Zamak . [130] Примером этого является цинк-алюминий . Низкая температура плавления в сочетании с низкой вязкостью сплава делает возможным производство небольших и сложных форм. Низкая рабочая температура приводит к быстрому охлаждению отлитых изделий и быстрой подготовке к сборке. [22] [131] Другой сплав, продаваемый под торговой маркой Prestal, содержит 78% цинка и 22% алюминия и, как сообщается, почти так же прочен, как сталь, но столь же податлив, как пластик. [22] [132] Эта сверхпластичность сплава позволяет формовать его с использованием литья под давлением из керамики и цемента. [22]
Подобные сплавы с добавлением небольшого количества свинца можно подвергать холодной прокатке в листы. Сплав, состоящий из 96% цинка и 4% алюминия, используется для изготовления штампов для мелкосерийного производства, для которых штампы из черных металлов были бы слишком дорогими. [133] Для фасадов зданий, кровли и других применений листового металла , полученного путем глубокой вытяжки , профилирования или гибки , используются сплавы цинка с титаном и медью. [134] Нелегированный цинк слишком хрупок для таких производственных процессов. [134]
Как плотный, недорогой и легко обрабатываемый материал, цинк используется в качестве заменителя свинца . В связи с проблемами со свинцом цинк появляется в гирях для различных применений, начиная от рыбалки [135] и заканчивая балансирами шин и маховиками. [136]
Теллурид кадмия-цинка (CZT) представляет собой полупроводниковый сплав, который можно разделить на множество небольших сенсорных устройств. [137] Эти устройства похожи на интегральные схемы и могут определять энергию входящих гамма- фотонов. [137] Находясь за поглощающей маской, массив датчиков CZT может определять направление лучей. [137]

Примерно четверть всего производства цинка в США в 2009 году потреблялась в виде соединений цинка; [115] различные из которых используются в промышленности. Оксид цинка широко используется в качестве белого пигмента в красках и в качестве катализатора при производстве резины для рассеивания тепла. Оксид цинка используется для защиты резиновых полимеров и пластмасс от ультрафиолетового излучения (УФ). [119] Полупроводниковые свойства оксида цинка делают его полезным в варисторах и фотокопировальных устройствах. [138] Цикл цинк-оксид цинка представляет собой двухэтапный термохимический процесс, основанный на использовании цинка и оксида цинка для производства водорода . [139]
Хлорид цинка часто добавляют в пиломатериалы в качестве антипирена [140] , а иногда и в качестве консерванта древесины . [141] Он используется при производстве других химикатов. [140] Цинк метил ( Zn(CH 3 )
2) используется в ряде органических синтезов . [142] Сульфид цинка (ZnS) используется в люминесцентных пигментах, таких как стрелки часов, рентгеновские и телевизионные экраны, а также в светящихся красках . [143] Кристаллы ZnS используются в лазерах , работающих в средней инфракрасной части спектра. [144] Сульфат цинка входит в состав красителей и пигментов. [140] Пиритион цинка используется в необрастающих красках. [145]
Цинковый порошок иногда используется в качестве топлива в моделях ракет . [146] При воспламенении сжатой смеси порошка из 70% цинка и 30% серы происходит бурная химическая реакция. [146] При этом образуется сульфид цинка вместе с большим количеством горячего газа, тепла и света. [146]
Листовой цинк используется в качестве прочного покрытия для крыш, стен и столешниц, последний часто встречается в бистро и устричных барах , и известен своим деревенским видом, придаваемым окислением его поверхности при использовании до сине-серой патины и восприимчивостью к царапая. [147] [148] [149] [150]
64
Zn , наиболее распространенный изотоп цинка, очень восприимчив к нейтронной активации , превращаясь в высокорадиоактивный элемент.65
Zn , который имеет период полураспада 244 дня и производит интенсивное гамма-излучение . Из-за этого оксид цинка, используемый в ядерных реакторах в качестве антикоррозионного средства, обеднен64
Zn перед использованием называется обедненным оксидом цинка . По той же причине цинк был предложен в качестве посола для ядерного оружия ( кобальт – еще один, более известный посол). [151] Куртка из изотопно-обогащенного 64
Zn будет облучен интенсивным потоком нейтронов высокой энергии от взрыва термоядерного оружия, образуя большое количество65
Zn значительно увеличивает радиоактивность осадков оружия . [151] Неизвестно, было ли когда-либо создано, испытано или использовано такое оружие. [151]
65
Zn используется в качестве индикатора для изучения того, как изнашиваются сплавы, содержащие цинк, или пути и роли цинка в организмах. [152]
Комплексы дитиокарбамата цинка применяют в качестве сельскохозяйственных фунгицидов ; к ним относятся Зинеб , Метирам, Пропинеб и Зирам. [153] Нафтенат цинка используется в качестве консерванта для древесины. [154] Цинк в форме ZDDP используется в качестве противоизносной присадки для металлических деталей в моторном масле. [155]

Цинкорганическая химия — это наука о соединениях, содержащих связи углерод-цинк, описывающая физические свойства, синтез и химические реакции. Многие цинкорганические соединения имеют коммерческое значение. [157] [158] [159] [160] Среди важных применений:
Цинк нашел множество применений в катализе органического синтеза, включая энантиоселективный синтез , будучи дешевой и легкодоступной альтернативой комплексам драгоценных металлов. Количественные результаты (выход и энантиомерный избыток ), полученные с использованием хиральных цинковых катализаторов, могут быть сопоставимы с результатами, полученными с палладием, рутением, иридием и другими. [163]


В большинстве витаминных и минеральных добавок , отпускаемых без рецепта , цинк содержится в таких формах, как оксид цинка , ацетат цинка , глюконат цинка или хелат аминокислоты цинка. [164] [165]
Как правило, добавки цинка рекомендуются там, где существует высокий риск дефицита цинка (например, в странах с низким и средним уровнем дохода) в качестве профилактической меры. [166] Хотя сульфат цинка является широко используемой формой цинка, цитрат, глюконат и пиколинат цинка также могут быть приемлемыми вариантами. Эти формы усваиваются лучше, чем оксид цинка. [167]
Цинк является недорогим и эффективным средством лечения диареи у детей в развивающихся странах. Цинк в организме истощается во время диареи, и восполнение запасов цинка в течение 10–14-дневного курса лечения может уменьшить продолжительность и тяжесть эпизодов диареи, а также предотвратить будущие эпизоды на срок до трех месяцев. [168] Гастроэнтерит сильно ослабляется при приеме внутрь цинка, возможно, за счет прямого противомикробного действия ионов в желудочно-кишечном тракте , или за счет абсорбции цинка и повторного высвобождения из иммунных клеток (все гранулоциты секретируют цинк), или того и другого. [169] [170]
Добавки цинка (часто таблетки для рассасывания ацетата цинка или глюконата цинка ) представляют собой группу пищевых добавок , которые обычно используются для лечения простуды . [171] Было показано, что прием добавок цинка в дозах, превышающих 75 мг/день, в течение 24 часов после появления симптомов сокращает продолжительность симптомов простуды примерно на 1 день у взрослых. [171] [172] Побочные эффекты перорального приема добавок цинка включают неприятный привкус и тошноту . [171] [172] Интраназальное использование цинксодержащих назальных спреев было связано с потерей обоняния ; [171] следовательно, в июне 2009 года Управление по контролю за продуктами и лекарствами США (USFDA) предупредило потребителей прекратить использование интраназального цинка. [171]
Риновирус человека – наиболее распространенный вирусный патоген у человека – является основной причиной простуды. [173] Предполагаемый механизм действия , посредством которого цинк снижает тяжесть и/или продолжительность симптомов простуды, заключается в подавлении воспаления носа и прямом ингибировании связывания риновирусных рецепторов и репликации риновируса в слизистой оболочке носа . [171]Дефицит цинка может привести к потере аппетита. [174] Использование цинка в лечении анорексии пропагандируется с 1979 года. По крайней мере, 15 клинических исследований показали, что цинк улучшает набор веса при анорексии. Исследование 1994 года показало, что цинк удвоил скорость увеличения массы тела при лечении нервной анорексии. Дефицит других питательных веществ, таких как тирозин, триптофан и тиамин, может способствовать этому явлению «недоедания, вызванного недоеданием». [175] Метаанализ 33 проспективных интервенционных исследований, посвященных добавкам цинка и его влиянию на рост детей во многих странах, показал, что добавки цинка сами по себе оказывают статистически значимое влияние на линейный рост и увеличение массы тела, указывая на то, что другие недостатки, которые могут присутствовали, не были ответственны за задержку роста. [176]
Кокрейновский обзор 2023 года показал, что у людей, принимающих добавки цинка, вероятность развития возрастной дегенерации желтого пятна может быть меньше . [177] Добавки цинка являются эффективным средством лечения энтеропатического акродерматита , генетического заболевания, влияющего на всасывание цинка, которое ранее было смертельным для больных младенцев. [69] Дефицит цинка связан с большим депрессивным расстройством (БДР), и добавки цинка могут быть эффективным средством лечения. [178] Цинк может помочь людям лучше спать. [7]
К препаратам цинка для местного применения относятся препараты, наносимые на кожу, часто в форме оксида цинка . Оксид цинка обычно признается FDA безопасным и эффективным [179] и считается очень фотостабильным. [180] Оксид цинка является одним из наиболее распространенных активных ингредиентов, входящих в состав солнцезащитных кремов для смягчения солнечных ожогов . [69] Наносится тонким слоем на область подгузника ребенка ( промежность ) при каждой смене подгузника и защищает от опрелостей . [69]
Хелатный цинк используется в зубных пастах и средствах для полоскания рта для предотвращения неприятного запаха изо рта ; Цитрат цинка помогает уменьшить образование зубного камня (зубного камня). [181] [182]
Цинк-пиритион широко включается в шампуни для предотвращения перхоти. [183]
Также было показано, что местное применение цинка эффективно лечит и продлевает ремиссию генитального герпеса . [184]
Цинк является важным микроэлементом для человека [185] [5] [6] [7] и других животных, [8] для растений [9] и для микроорганизмов . [10] Цинк необходим для функционирования более 300 ферментов и 1000 факторов транскрипции , [7] и хранится и переносится в металлотионеинах . [186] [187] Это второй по распространенности микроэлемент в организме человека после железа и единственный металл, который присутствует во всех классах ферментов . [9] [7]
В белках ионы цинка часто координируются с боковыми цепями аминокислот аспарагиновой кислоты , глутаминовой кислоты , цистеина и гистидина . Теоретическое и вычислительное описание связывания цинка в белках (а также других переходных металлов) затруднено. [188]
Примерно 2–4 грамма цинка [189] распределяются по всему телу человека. Больше всего цинка содержится в мозге, мышцах, костях, почках и печени, а самые высокие концентрации — в простате и частях глаз. [190] Сперма особенно богата цинком, ключевым фактором в функционировании предстательной железы и росте репродуктивных органов . [191]
Гомеостаз цинка в организме в основном контролируется кишечником. Здесь ZIP4 и особенно TRPM7 были связаны с поглощением цинка в кишечнике, необходимым для постнатального выживания. [192] [193]
У людей биологическая роль цинка повсеместна. [11] [6] Он взаимодействует с «широким спектром органических лигандов », [11] и играет роль в метаболизме РНК и ДНК, передаче сигналов и экспрессии генов . Он также регулирует апоптоз . Обзор 2015 года показал, что около 10% белков человека (около 3000) связывают цинк, [194] в дополнение к сотням других белков, которые транспортируют и транспортируют цинк; аналогичное исследование in silico на растении Arabidopsis thaliana обнаружило 2367 белков, связанных с цинком. [9]
В мозге цинк хранится в специфических синаптических пузырьках глутаматергических нейронов и может модулировать возбудимость нейронов . [6] [7] [195] Он играет ключевую роль в синаптической пластичности и, следовательно, в обучении. [6] [196] Гомеостаз цинка также играет решающую роль в функциональной регуляции центральной нервной системы . [6] [195] [7] Считается, что нарушение регуляции гомеостаза цинка в центральной нервной системе, приводящее к чрезмерным синаптическим концентрациям цинка, вызывает нейротоксичность вследствие митохондриального окислительного стресса (например, путем разрушения определенных ферментов, участвующих в цепи переноса электронов , включая сложные I , комплекс III и α-кетоглутаратдегидрогеназа ), нарушение регуляции гомеостаза кальция, глутаматергическая нейрональная эксайтотоксичность и вмешательство в внутринейрональную передачу сигнала . [6] [197] L- и D-гистидин способствуют усвоению цинка мозгом. [198] SLC30A3 является основным переносчиком цинка , участвующим в церебральном гомеостазе цинка. [6]


Цинк является эффективной кислотой Льюиса , что делает его полезным каталитическим агентом в гидроксилировании и других ферментативных реакциях. [199] Металл также имеет гибкую координационную геометрию , которая позволяет белкам, использующим его, быстро менять конформации для выполнения биологических реакций. [200] Двумя примерами цинксодержащих ферментов являются карбоангидраза и карбоксипептидаза , которые жизненно важны для процессов выделения углекислого газа ( CO
2) регуляция и переваривание белков соответственно. [201]
В крови позвоночных карбоангидраза превращает CO
2в бикарбонат, и тот же фермент превращает бикарбонат обратно в CO.
2для выдоха через легкие. [202] Без этого фермента это преобразование происходило бы примерно в миллион раз медленнее [203] при нормальном pH крови 7 или требовало бы pH 10 или более. [204] Неродственная β-карбоангидраза необходима растениям для формирования листьев, синтеза индолуксусной кислоты (ауксина) и спиртового брожения . [205]
Карбоксипептидаза расщепляет пептидные связи во время переваривания белков. Между концевым пептидом и группой C=O, присоединенной к цинку, образуется координационная ковалентная связь , которая придает углероду положительный заряд. Это помогает создать гидрофобный карман на ферменте рядом с цинком, который притягивает неполярную часть перевариваемого белка. [201]
Цинк признан посланником, способным активировать сигнальные пути. Многие из этих путей являются движущей силой аберрантного роста рака. Их можно атаковать через ZIP-транспортеры . [206]
Цинк выполняет чисто структурную роль в цинковых пальцах , скрутках и группах. [207] Цинковые пальцы образуют части некоторых факторов транскрипции , которые представляют собой белки, которые распознают последовательности оснований ДНК во время репликации и транскрипции ДНК . Каждый из девяти или десяти Zn2+
Ионы цинкового пальца помогают поддерживать структуру пальца, координируя связывание с четырьмя аминокислотами в факторе транскрипции. [203]
В плазме крови цинк связывается и транспортируется альбумином ( 60%, низкоаффинное) и трансферрином (10%). [189] Поскольку трансферрин также транспортирует железо, избыток железа снижает абсорбцию цинка, и наоборот. Аналогичный антагонизм существует и с медью. [208] Концентрация цинка в плазме крови остается относительно постоянной независимо от приема цинка. [199] Клетки слюнной железы, предстательной железы, иммунной системы и кишечника используют передачу сигналов цинка для связи с другими клетками. [209]
Цинк может содержаться в запасах металлотионеина внутри микроорганизмов, кишечника или печени животных. [210] Металлотионеин в клетках кишечника способен регулировать всасывание цинка на 15–40%. [211] Однако недостаточное или чрезмерное потребление цинка может быть вредным; избыток цинка особенно ухудшает абсорбцию меди, поскольку металлотионеин абсорбирует оба металла. [212]
Транспортер дофамина человека содержит высокоаффинный внеклеточный сайт связывания цинка , который при связывании цинка ингибирует обратный захват дофамина и усиливает индуцированный амфетамином отток дофамина in vitro . [213] [214] [215] Человеческий переносчик серотонина и переносчик норадреналина не содержат сайтов связывания цинка. [215] Некоторые EF- связывающие кальций белки , такие как S100 или NCS-1, также способны связывать ионы цинка. [216]
Институт медицины США (МОМ) обновил расчетные средние потребности (EAR) и рекомендуемые диетические нормы (RDA) цинка в 2001 году. Текущие нормы EAR для цинка для женщин и мужчин в возрасте от 14 лет и старше составляют 6,8 и 9,4 мг/день соответственно. Рекомендуемые дозы составляют 8 и 11 мг/день. RDA выше, чем EAR, чтобы определить суммы, которые покроют людей с потребностями выше среднего. Рекомендуемая суточная доза для беременных составляет 11 мг/день. Рекомендуемая суточная доза для лактации составляет 12 мг/день. Для младенцев до 12 месяцев рекомендуемая суточная доза составляет 3 мг/день. Для детей в возрасте 1–13 лет рекомендуемая суточная норма увеличивается с возрастом от 3 до 8 мг/день. Что касается безопасности, МОМ устанавливает допустимые верхние уровни потребления (UL) для витаминов и минералов, когда есть достаточные доказательства. В случае цинка UL для взрослых составляет 40 мг/день, включая пищу и добавки (ниже для детей). В совокупности EAR, RDA, AI и UL называются эталонными диетическими нормами потребления (DRI). [199]
Европейское управление по безопасности пищевых продуктов (EFSA) называет совокупный набор информации эталонными диетическими значениями, с эталонным потреблением для населения (PRI) вместо RDA и средней потребностью вместо EAR. AI и UL определяются так же, как и в США. Для людей в возрасте 18 лет и старше расчеты PRI сложны, поскольку EFSA устанавливает все более высокие значения по мере увеличения содержания фитатов в рационе. Для женщин доза ИПП увеличивается с 7,5 до 12,7 мг/день по мере увеличения потребления фитатов с 300 до 1200 мг/день; для мужчин диапазон составляет от 9,4 до 16,3 мг/день. Эти PRI выше, чем RDA в США. [217] EFSA рассмотрело тот же вопрос безопасности и установило предельно допустимую дозу в 25 мг/день, что намного ниже, чем значение в США. [218]
Для целей маркировки пищевых продуктов и пищевых добавок в США количество в порции выражается в процентах от дневной нормы (% ДВ). Для целей маркировки цинка 100% дневной нормы составляло 15 мг, но 27 мая 2016 г. она была пересмотрена до 11 мг. [219] [220] Таблица старых и новых дневных норм для взрослых представлена в разделе «Справочная суточная норма» .

Продукты животного происхождения, такие как мясо, рыба, моллюски, птица, яйца и молочные продукты, содержат цинк. Концентрация цинка в растениях зависит от его уровня в почве. При достаточном количестве цинка в почве пищевыми растениями, которые содержат больше всего цинка, являются пшеница (зародыши и отруби) и различные семена, включая кунжут , мак , люцерну , сельдерей и горчицу . [221] Цинк также содержится в фасоли , орехах , миндале , цельнозерновых продуктах , семенах тыквы , семечках подсолнечника и черной смородине . [222]
Другие источники включают обогащенные продукты питания и пищевые добавки в различных формах. Обзор 1998 года пришел к выводу, что оксид цинка, одна из наиболее распространенных добавок в Соединенных Штатах, и карбонат цинка практически нерастворимы и плохо усваиваются в организме. [223] В этом обзоре приводятся исследования, которые обнаружили более низкие концентрации цинка в плазме у субъектов, которые потребляли оксид цинка и карбонат цинка, чем у тех, кто принимал ацетат и сульфат цинка. [223] Однако в обзоре 2003 года для обогащения были рекомендованы злаки (содержащие оксид цинка) как дешевый и стабильный источник, который так же легко усваивается, как и более дорогие формы. [224] Исследование 2005 года показало, что различные соединения цинка, включая оксид и сульфат, не показали статистически значимых различий в абсорбции при добавлении в качестве обогатителей в кукурузные лепешки. [225]
Почти два миллиарда человек в развивающихся странах испытывают дефицит цинка. В группы риска входят дети из развивающихся стран и пожилые люди с хроническими заболеваниями. [13] У детей это вызывает рост инфекций и диареи и способствует смерти около 800 000 детей во всем мире в год. [11] Всемирная организация здравоохранения выступает за прием добавок цинка при тяжелом недоедании и диарее. [226] Добавки цинка помогают предотвратить заболевания и снизить смертность, особенно среди детей с низким весом при рождении или задержкой роста. [226] Однако добавки цинка не следует принимать отдельно, поскольку многие жители развивающихся стран имеют некоторые недостатки, а цинк взаимодействует с другими микроэлементами. [227] Хотя дефицит цинка обычно возникает из-за недостаточного потребления с пищей, он может быть связан с нарушением всасывания , энтеропатическим акродерматитом , хроническим заболеванием печени, хроническим заболеванием почек, серповидно-клеточной анемией , диабетом , злокачественными новообразованиями и другими хроническими заболеваниями. [13]
В Соединенных Штатах федеральное исследование потребления продуктов питания показало, что для женщин и мужчин старше 19 лет среднее потребление составляло 9,7 и 14,2 мг/день соответственно. У женщин 17% потребляли меньше EAR, у мужчин - 11%. Процент ниже EAR увеличивался с возрастом. [228] В последнем опубликованном обновлении исследования (NHANES 2013–2014) сообщается о более низких средних показателях – 9,3 и 13,2 мг/день – опять же, причем потребление снижается с возрастом. [229]
Симптомы легкого дефицита цинка разнообразны. [199] Клинические исходы включают угнетение роста, диарею, импотенцию и задержку полового созревания, алопецию , поражения глаз и кожи, нарушение аппетита, изменение когнитивных функций, нарушение иммунных функций, дефекты в использовании углеводов и репродуктивный тератогенез . [199] Дефицит цинка подавляет иммунитет, [230] но и избыток цинка тоже действует. [189]
Несмотря на некоторые опасения, [231] западные вегетарианцы и веганы страдают от явного дефицита цинка не больше, чем мясоеды. [232] Основные растительные источники цинка включают вареные сушеные бобы, морские овощи, обогащенные крупы, соевые продукты, орехи, горох и семена. [231] Однако фитаты во многих цельнозерновых продуктах и клетчатке могут препятствовать усвоению цинка, а влияние незначительного потребления цинка плохо изучено. Фитат -хелатор цинка , содержащийся в семенах и зерновых отрубях , может способствовать мальабсорбции цинка. [13] Некоторые данные свидетельствуют о том, что тем, чья диета богата фитатами, например некоторым вегетарианцам, может потребоваться больше, чем рекомендованная в США рекомендуемая суточная норма (8 мг/день для взрослых женщин; 11 мг/день для взрослых мужчин). [231] Рекомендации Европейского агентства по безопасности пищевых продуктов (EFSA) пытаются компенсировать это, рекомендуя более высокое потребление цинка при большем потреблении фитатов с пищей. [217] Эти соображения должны быть сбалансированы с учетом нехватки адекватных биомаркеров цинка , а наиболее широко используемый индикатор, цинк в плазме, имеет низкую чувствительность и специфичность . [233]
Виды Calluna , Erica и Vaccinium могут расти на цинк-металлоносных почвах, поскольку транслокация токсичных ионов предотвращается действием эрикоидных микоризных грибов . [234]
Дефицит цинка, по-видимому, является наиболее распространенным дефицитом микроэлементов у сельскохозяйственных растений; это особенно распространено в почвах с высоким pH. [235] Почвы с дефицитом цинка возделываются на пахотных землях примерно половины Турции и Индии, трети Китая и большей части Западной Австралии. В этих областях сообщалось о существенной реакции на внесение цинковых удобрений. [9] Растения, растущие на почвах с дефицитом цинка, более восприимчивы к болезням. Цинк добавляется в почву в основном в результате выветривания горных пород, но люди добавляют цинк в результате сжигания ископаемого топлива, отходов шахт, фосфатных удобрений, пестицидов ( фосфида цинка ), известняка, навоза, осадка сточных вод и частиц с оцинкованных поверхностей. Избыток цинка токсичен для растений, хотя токсичность цинка распространена гораздо менее широко. [9]
Хотя цинк является важным требованием для хорошего здоровья, избыток цинка может быть вредным. Чрезмерное всасывание цинка подавляет всасывание меди и железа. [212] Свободный ион цинка в растворе очень токсичен для растений, беспозвоночных и даже позвоночных рыб. [236] Модель активности свободных ионов хорошо известна в литературе и показывает, что даже микромолярные количества свободных ионов убивают некоторые организмы. Недавний пример показал, что 6 микромолярей убивают 93% всех дафний в воде. [237]
Свободный ион цинка является мощной кислотой Льюиса , вплоть до коррозионной активности . Желудочная кислота содержит соляную кислоту , в которой металлический цинк легко растворяется с образованием едкого хлорида цинка. Проглатывание американской монеты в один цент , выпущенной после 1982 года (97,5% цинка), может привести к повреждению слизистой оболочки желудка из-за высокой растворимости ионов цинка в кислой среде желудка. [238]
Данные показывают, что люди, принимающие 100–300 мг цинка в день, могут страдать от дефицита меди . Исследование 2007 года показало, что пожилые мужчины, принимавшие 80 мг ежедневно, чаще госпитализировались из-за осложнений со стороны мочевыделительной системы, чем те, кто принимал плацебо. [239] Уровни 100–300 мг могут мешать использованию меди и железа или отрицательно влиять на уровень холестерина. [212] Цинк, превышающий 500 ppm в почве, препятствует усвоению растениями других важных металлов, таких как железо и марганец. [111] Состояние, называемое «цинковым сотрясением » или «цинковым ознобом», может быть вызвано вдыханием паров цинка во время пайки или сварки оцинкованных материалов. [143] Цинк является распространенным ингредиентом крема для зубных протезов , который может содержать от 17 до 38 мг цинка на грамм. Сообщалось об инвалидности и даже смерти в результате чрезмерного употребления этих продуктов. [240]
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) заявляет, что цинк повреждает нервные рецепторы в носу, вызывая аносмию . Сообщения об аносмии наблюдались также в 1930-х годах, когда препараты цинка использовались в неудачной попытке предотвратить инфекцию полиомиелита . [241] 16 июня 2009 г. FDA распорядилось убрать с полок магазинов средства для интраназальной простуды на основе цинка. В FDA заявили, что потеря обоняния может быть опасной для жизни, поскольку люди с нарушенным обонянием не могут обнаружить утечку газа или дыма и не могут определить, испортилась ли еда, прежде чем съесть ее. [242]
Недавние исследования показывают, что местный противомикробный пиритион цинка является мощным индуктором реакции на тепловой шок , который может нарушать целостность генома, вызывая PARP -зависимый энергетический кризис в культивируемых кератиноцитах и меланоцитах человека . [243]
В 1982 году Монетный двор США начал чеканить монеты , покрытые медью, но содержащие в основном цинк. Цинковые монеты создают риск цинкового токсикоза, который может привести к летальному исходу. Один зарегистрированный случай хронического проглатывания 425 монет (более 1 кг цинка) привел к смерти из-за желудочно-кишечного бактериального и грибкового сепсиса . У другого пациента, принявшего 12 граммов цинка, наблюдались только летаргия и атаксия (выраженное отсутствие координации мышечных движений). [244] Сообщалось о нескольких других случаях, когда люди страдали от интоксикации цинком в результате проглатывания цинковых монет. [245] [246]
Пенни и другие мелкие монеты иногда проглатываются собаками, что требует ветеринарного удаления посторонних предметов. Содержание цинка в некоторых монетах может вызвать токсичность цинка, которая обычно приводит к летальному исходу у собак из-за тяжелой гемолитической анемии и повреждения печени или почек; возможные симптомы – рвота и диарея. [247] Цинк очень токсичен для попугаев , и отравление часто может привести к летальному исходу. [248] Потребление фруктовых соков, хранящихся в оцинкованных банках, привело к массовым отравлениям попугаев цинком. [69]
Цинк является вторым по распространенности микроэлементом в организме человека и необходим для многих биологических процессов. ... Следовой металл цинк является важным кофактором более чем 300 ферментов и 1000 транскрипционных факторов [16]. ... В центральной нервной системе цинк является вторым по распространенности микроэлементом и участвует во многих процессах. Помимо своей роли в ферментативной активности, он также играет важную роль в передаче сигналов клетками и модуляции активности нейронов.
Zn присутствует примерно в 10% белков протеома человека, и компьютерный анализ показал, что ~30% из этих ~3000 Zn-содержащих белков являются важнейшими клеточными ферментами, такими как гидролазы, лигазы, трансферазы, оксидоредуктазы и изомеразы. (42,43).
Транспортер дофамина человека (hDAT) содержит эндогенный сайт связывания Zn
2+
с высоким сродством с тремя координационными остатками на его внеклеточной поверхности (His193, His375 и Glu396). ... Таким образом, когда Zn
2+
высвобождается совместно с глутаматом, это может значительно увеличить отток дофамина.