Тантал — химический элемент ; он имеет символ Ta и атомный номер 73. Ранее известный как танталий , [ требуется ссылка ] он назван в честь Тантала , персонажа греческой мифологии. [8] Тантал — очень твёрдый, пластичный , блестящий , сине-серый переходный металл , обладающий высокой коррозионной стойкостью. Он входит в группу тугоплавких металлов , которые широко используются в качестве компонентов прочных тугоплавких сплавов . Это элемент 5-й группы , наряду с ванадием и ниобием , и он всегда встречается в геологических источниках вместе с химически подобным ниобием, в основном в минеральных группах танталита , колумбита и колтана .
Химическая инертность и очень высокая температура плавления тантала делают его ценным для лабораторного и промышленного оборудования, такого как реакционные сосуды и вакуумные печи . Он используется в танталовых конденсаторах для электронного оборудования, такого как компьютеры . [9] Он исследуется для использования в качестве материала для высококачественных сверхпроводящих резонаторов в квантовых процессорах. [10] [11] Европейская комиссия считает тантал критически важным для технологий элементом . [12]
Тантал был открыт в Швеции в 1802 году Андерсом Экебергом в двух образцах минералов — один из Швеции, а другой из Финляндии. [13] [14] Годом ранее Чарльз Хэтчетт открыл колумбий (ныне ниобий). [15] В 1809 году английский химик Уильям Хайд Волластон сравнил оксиды колумбия и тантала, колумбит и танталит . Хотя два оксида имели разные измеренные плотности 5,918 г/см 3 и 7,935 г/см 3 , он пришел к выводу, что они идентичны, и сохранил название тантал. [16] После того, как Фридрих Вёлер подтвердил эти результаты, считалось, что колумбий и тантал — один и тот же элемент. Это заключение было оспорено в 1846 году немецким химиком Генрихом Розе , который утверждал, что в образце танталита было два дополнительных элемента, и он назвал их в честь детей Тантала : ниобий (от Ниобы , богини слез), и пелопий (от Пелопса ). [17] [18] Предполагаемый элемент «пелопий» был позже идентифицирован как смесь тантала и ниобия, и было обнаружено, что ниобий был идентичен колумбию, уже открытому в 1801 году Хэтчеттом. [ необходима цитата ]
Различия между танталом и ниобием были недвусмысленно продемонстрированы в 1864 году Кристианом Вильгельмом Бломстрандом [ 19] и Анри Этьеном Сент-Клером Девилем , а также Луи Ж. Троостом , который определил эмпирические формулы некоторых из их соединений в 1865 году. [19] [20] Дальнейшее подтверждение пришло от швейцарского химика Жана Шарля Галиссара де Мариньяка [ 21] в 1866 году, который доказал, что существует только два элемента. Эти открытия не помешали ученым публиковать статьи о так называемом ильмениуме до 1871 года. [22] Де Мариньяк был первым, кто получил металлическую форму тантала в 1864 году, когда он восстановил хлорид тантала, нагревая его в атмосфере водорода . [23] Ранние исследователи могли производить только нечистый тантал, а первый относительно чистый пластичный металл был получен Вернером фон Болтоном в Шарлоттенбурге в 1903 году. Провода, изготовленные из металлического тантала, использовались для нитей накаливания лампочек, пока вольфрам не заменил его в широком использовании. [24]
Название тантал произошло от имени мифологического Тантала, отца Ниобы в греческой мифологии . В этой истории он был наказан после смерти, будучи приговоренным стоять по колено в воде с прекрасными плодами, растущими над его головой, и оба эти явления вечно мучили его. (Если он наклонялся, чтобы выпить воды, она опускалась ниже уровня, до которого он мог дотянуться, а если он тянулся за фруктами, ветви выскальзывали из его рук.) [25] Андерс Экеберг писал: «Этот металл я называю танталом ... отчасти в намеке на его неспособность, будучи погруженным в кислоту, поглощать ее и насыщаться ею». [26]
В течение десятилетий коммерческая технология отделения тантала от ниобия включала фракционную кристаллизацию гептафторотанталата калия из моногидрата оксипентафторниобата калия, процесс, открытый Жаном Шарлем Галиссаром де Мариньяком в 1866 году. Этот метод был вытеснен экстракцией растворителем из фторидсодержащих растворов тантала. [20]
Тантал тёмный (серо-голубой), [27] плотный, пластичный, очень твёрдый, легко поддаётся обработке и обладает высокой проводимостью тепла и электричества. Металл обладает высокой устойчивостью к коррозии кислотами : при температурах ниже 150 ° C тантал почти полностью невосприимчив к воздействию обычно агрессивной царской водки . Его можно растворить плавиковой кислотой или кислыми растворами, содержащими ион фтора и триоксид серы , а также расплавленным гидроксидом калия . Высокая температура плавления тантала 3017 °C (температура кипения 5458 °C) среди элементов уступает только вольфраму , рению и осмию для металлов и углероду .
Тантал существует в двух кристаллических фазах, альфа и бета. Альфа-фаза стабильна при всех температурах вплоть до точки плавления и имеет объемно-центрированную кубическую структуру с постоянной решетки a = 0,33029 нм при 20 °C. [3] Она относительно пластична , имеет твердость по Кнупу 200–400 HN и электрическое сопротивление 15–60 мкОм⋅см. Бета-фаза твердая и хрупкая; ее кристаллическая симметрия тетрагональная (пространственная группа P42/mnm , a = 1,0194 нм, c = 0,5313 нм), твердость по Кнупу составляет 1000–1300 HN, а электрическое сопротивление относительно высокое и составляет 170–210 мкОм⋅см. Бета-фаза метастабильна и переходит в альфа-фазу при нагревании до 750–775 °C. Основная масса тантала почти полностью состоит из альфа-фазы, а бета-фаза обычно существует в виде тонких пленок [28], полученных методом магнетронного распыления , химического осаждения из паровой фазы или электрохимического осаждения из эвтектического расплавленного солевого раствора. [29]
Природный тантал состоит из двух стабильных изотопов : 180m Ta (0,012%) и 181 Ta (99,988%). 180m Ta ( m обозначает метастабильное состояние) предположительно распадается тремя способами: изомерный переход в основное состояние 180 Ta , бета-распад до 180 W или захват электронов до 180 Hf . Однако радиоактивность этого ядерного изомера никогда не наблюдалась, и только нижний предел его периода полураспада составляет 2,9 × 10 Установлено 17 лет. [30] Основное состояние 180 Ta имеет период полураспада всего 8 часов. 180m Ta — единственный встречающийся в природе ядерный изомер (исключая радиогенные и космогенные короткоживущие нуклиды). Это также самый редкий первичный изотоп во Вселенной, принимая во внимание элементарное содержание тантала и изотопное содержание 180m Ta в естественной смеси изотопов (и снова исключая радиогенные и космогенные короткоживущие нуклиды). [31]
Тантал теоретически рассматривался как « солевой » материал для ядерного оружия ( кобальт — более известный гипотетический солевой материал). Внешняя оболочка 181 Ta будет облучена интенсивным потоком высокоэнергетических нейтронов от гипотетического взрыва ядерного оружия. Это трансмутирует тантал в радиоактивный изотоп 182 Ta, который имеет период полураспада 114,4 дня и производит гамма-лучи с приблизительно 1,12 миллиона электрон-вольт (МэВ) энергии каждый, что значительно увеличит радиоактивность ядерных осадков от взрыва на несколько месяцев. Такое «соленное» оружие никогда не было построено или испытано, насколько это известно общественности, и, конечно, никогда не использовалось в качестве оружия. [32]
Тантал может быть использован в качестве мишенного материала для ускоренных протонных пучков для производства различных короткоживущих изотопов, включая 8 Li, 80 Rb и 160 Yb. [33]
Тантал образует соединения в степенях окисления от −III до +V. Наиболее часто встречаются оксиды Ta(V), которые включают все минералы. Химические свойства Ta и Nb очень похожи. В водных средах Ta проявляет только степень окисления +V. Как и ниобий, тантал едва растворим в разбавленных растворах соляной , серной , азотной и фосфорной кислот из-за осаждения водного оксида Ta(V). [34] В основных средах Ta может быть растворен из-за образования видов полиоксотанталата. [35]
Пентаоксид тантала (Ta 2 O 5 ) является наиболее важным соединением с точки зрения приложений. Оксиды тантала в более низких степенях окисления многочисленны, включая множество дефектных структур , и мало изучены или плохо охарактеризованы. [36]
Танталаты, соединения, содержащие [TaO 4 ] 3- или [TaO 3 ] -, многочисленны. Танталат лития (LiTaO 3 ) имеет структуру перовскита. Танталат лантана (LaTaO 4 ) содержит изолированный TaO.3−
4тетраэдры. [37]
Как и в случае с другими тугоплавкими металлами , самые твердые известные соединения тантала — это нитриды и карбиды. Карбид тантала , TaC, как и более часто используемый карбид вольфрама , представляет собой твердую керамику , которая используется в режущих инструментах. Нитрид тантала (III) используется в качестве тонкопленочного изолятора в некоторых процессах производства микроэлектроники. [38]
Наиболее изученным халькогенидом является сульфид тантала (TaS2 ) , слоистый полупроводник , как и для других дихалькогенидов переходных металлов . Сплав тантала с теллуром образует квазикристаллы . [37]
Галогениды тантала охватывают степени окисления +5, +4 и +3. Пентафторид тантала (TaF 5 ) представляет собой белое твердое вещество с температурой плавления 97,0 °C. Анион [TaF 7 ] 2- используется для его отделения от ниобия. [39] Хлорид TaCl
5, существующий в виде димера, является основным реагентом в синтезе новых соединений Ta. Он легко гидролизуется до оксихлорида . Низшие галогениды TaX
4и налоги
3, имеют связи Ta-Ta. [37] [34]
К органотанталоорганическим соединениям относятся пентаметилтантал , смешанные алкилтанталхлориды, алкилтанталгидриды, алкилиденовые комплексы, а также их циклопентадиенильные производные. [40] [41] Известны разнообразные соли и замещенные производные гексакарбонила [Ta(CO) 6 ] − и родственных ему изоцианидов .


По оценкам, тантал составляет около 1 ppm [42] или 2 ppm [34] земной коры по весу . Существует много видов танталовых минералов, только некоторые из которых до сих пор используются промышленностью в качестве сырья: танталит (серия, состоящая из танталита-(Fe), танталита-(Mn) и танталита-(Mg)), микролит (теперь групповое название), воджинит , эвксенит (фактически эвксенит-(Y)) и поликраз (фактически поликраз-(Y)). [43] Танталит ( Fe , Mn ) Ta2O6 является важнейшим минералом для извлечения тантала. Танталит имеет ту же минеральную структуру, что и колумбит ( Fe , Mn ) ( Ta , Nb ) 2O6 ; когда тантала больше, чем ниобия, он называется танталитом, а когда ниобия больше, чем тантала, он называется колумбитом (или ниобитом ). Высокая плотность танталита и других содержащих тантал минералов делает использование гравитационного разделения лучшим методом. Другие минералы включают самарскит и фергусонит .
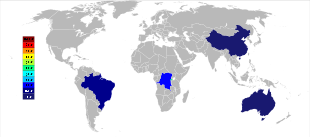
Австралия была основным производителем тантала до 2010-х годов, а Global Advanced Metals (ранее известная как Talison Minerals ) была крупнейшей компанией по добыче тантала в этой стране. Они управляют двумя рудниками в Западной Австралии, Greenbushes на юго-западе и Wodgina в регионе Пилбара . Шахта Wodgina была вновь открыта в январе 2011 года после того, как добыча на ней была приостановлена в конце 2008 года из-за мирового финансового кризиса . [44] Менее чем через год после ее повторного открытия Global Advanced Metals объявила, что из-за очередного «... снижения спроса на тантал ...» и других факторов добыча тантала должна была прекратиться в конце февраля 2012 года. [45] Wodgina производит первичный танталовый концентрат, который далее модернизируется на предприятии Greenbushes перед продажей клиентам. [46] В то время как крупные производители ниобия находятся в Бразилии и Канаде , руда там также дает небольшой процент тантала. Некоторые другие страны, такие как Китай , Эфиопия и Мозамбик, добывают руду с более высоким процентом тантала, и они производят значительный процент его мирового производства. Тантал также производится в Таиланде и Малайзии как побочный продукт добычи олова там. Во время гравитационного разделения руд из россыпных месторождений обнаруживается не только касситерит (SnO 2 ), но также включается небольшой процент танталита. Шлак из оловянных плавильных печей затем содержит экономически полезные количества тантала, который выщелачивается из шлака. [20] [47]
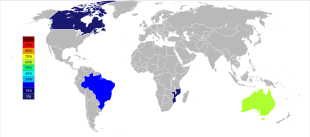
Мировая добыча тантала претерпела важный географический сдвиг с начала 21-го века, когда добыча велась преимущественно в Австралии и Бразилии. Начиная с 2007 года и до 2014 года основные источники добычи тантала из шахт резко переместились в Демократическую Республику Конго , Руанду и некоторые другие африканские страны. [48] Будущие источники поставок тантала, в порядке предполагаемого размера, изучаются в Саудовской Аравии , Египте , Гренландии , Китае, Мозамбике, Канаде, Австралии, Соединенных Штатах , Финляндии и Бразилии. [49] [50]
Тантал считается конфликтным ресурсом . Колтан , промышленное название минерала колумбита - танталита , из которого извлекаются ниобий и тантал, [51] также можно найти в Центральной Африке , поэтому тантал связывают с войной в Демократической Республике Конго (ранее Заир ). Согласно отчету Организации Объединенных Наций от 23 октября 2003 года , [52] контрабанда и экспорт колтана помогли разжечь войну в Конго, кризис, который привел к примерно 5,4 миллионам смертей с 1998 года [53] - что делает его самым смертоносным задокументированным конфликтом в мире со времен Второй мировой войны . Были подняты этические вопросы об ответственном корпоративном поведении, правах человека и угрозе дикой природе из-за эксплуатации таких ресурсов, как колтан, в районах вооруженного конфликта в бассейне реки Конго . [54] [55] [56] [57] Геологическая служба США сообщает в своем ежегоднике, что этот регион производил чуть менее 1% мирового производства тантала в 2002–2006 годах, достигнув пика в 10% в 2000 и 2008 годах. [47] Данные USGS, опубликованные в январе 2021 года, показали, что около 40% мирового производства тантала приходилось на Демократическую Республику Конго, а еще 18% — на соседние Руанду и Бурунди . [58]

Извлечение тантала из танталита происходит в несколько этапов. Сначала минерал измельчается и концентрируется методом гравитационного разделения . Обычно это делается вблизи места добычи .
Очистка тантала от его руд является одним из наиболее сложных процессов разделения в промышленной металлургии. Главная проблема заключается в том, что танталовые руды содержат значительные количества ниобия , химические свойства которого почти идентичны свойствам Ta. Для решения этой проблемы было разработано большое количество процедур.
В наше время разделение достигается с помощью гидрометаллургии . [60] Извлечение начинается с выщелачивания руды плавиковой кислотой вместе с серной кислотой или соляной кислотой . Этот шаг позволяет отделить тантал и ниобий от различных неметаллических примесей в породе. Хотя Ta встречается в виде различных минералов, его удобно представлять в виде пентоксида, поскольку большинство оксидов тантала(V) ведут себя аналогично в этих условиях. Упрощенное уравнение для его извлечения выглядит следующим образом:
Для ниобиевого компонента протекают совершенно аналогичные реакции, однако в условиях экстракции преобладающим обычно оказывается гексафторид.
Эти уравнения упрощены: предполагается, что бисульфат (HSO 4 − ) и хлорид конкурируют в качестве лигандов для ионов Nb(V) и Ta(V), когда используются серная и соляная кислоты, соответственно. [60] Затем комплексы фторидов тантала и ниобия удаляются из водного раствора путем экстракции жидкость-жидкость в органические растворители , такие как циклогексанон , октанол и метилизобутилкетон . Эта простая процедура позволяет удалить большинство примесей, содержащих металлы (например, железо, марганец, титан, цирконий), которые остаются в водной фазе в виде их фторидов и других комплексов.
Затем разделение тантала и ниобия достигается путем снижения ионной силы кислотной смеси, что приводит к растворению ниобия в водной фазе. Предполагается, что в этих условиях образуется оксифторид H 2 [NbOF 5 ]. После удаления ниобия раствор очищенного H 2 [TaF 7 ] нейтрализуют водным аммиаком для осаждения гидратированного оксида тантала в виде твердого вещества, которое можно прокалить до пентаоксида тантала (Ta 2 O 5 ). [61]
Вместо гидролиза H 2 [TaF 7 ] можно обработать фторидом калия для получения гептафторотанталата калия :
В отличие от H2 [ TaF7 ] , калиевая соль легко кристаллизуется и обрабатывается как твердое вещество.
K 2 [TaF 7 ] можно преобразовать в металлический тантал путем восстановления натрием при температуре около 800 ° C в расплавленной соли . [62]
В более старом методе, называемом процессом Мариньяка , смесь H 2 [TaF 7 ] и H 2 [NbOF 5 ] преобразовывалась в смесь K 2 [TaF 7 ] и K 2 [NbOF 5 ], которую затем разделяли путем фракционной кристаллизации , используя их различную растворимость в воде.
Тантал также может быть очищен электролизом, используя модифицированную версию процесса Холла-Эру . Вместо того, чтобы требовать, чтобы входной оксид и выходной металл были в жидкой форме, электролиз тантала работает на нежидких порошкообразных оксидах. Первоначальное открытие произошло в 1997 году, когда исследователи Кембриджского университета погрузили небольшие образцы определенных оксидов в ванны с расплавленной солью и восстановили оксид электрическим током. Катод использует порошкообразный оксид металла. Анод сделан из углерода. Расплавленная соль при 1000 °C (1830 °F) является электролитом. Первый завод имеет достаточную мощность, чтобы обеспечить 3–4% годового мирового спроса. [63]
Вся сварка тантала должна производиться в инертной атмосфере аргона или гелия , чтобы защитить его от загрязнения атмосферными газами. Тантал не паяется . Измельчение тантала затруднено, особенно отожженного тантала. В отожженном состоянии тантал чрезвычайно пластичен и может быть легко сформирован в виде металлических листов. [64]

Основное применение тантала, как металлического порошка, заключается в производстве электронных компонентов, в основном конденсаторов и некоторых мощных резисторов . Танталовые электролитические конденсаторы используют тенденцию тантала образовывать защитный оксидный поверхностный слой, используя танталовый порошок, спрессованный в форму таблетки, в качестве одной «пластины» конденсатора, оксид в качестве диэлектрика и электролитический раствор или проводящее твердое вещество в качестве другой «пластины». Поскольку диэлектрический слой может быть очень тонким (тоньше, чем аналогичный слой, например, в алюминиевом электролитическом конденсаторе), можно достичь высокой емкости в небольшом объеме. Благодаря преимуществам размера и веса танталовые конденсаторы привлекательны для портативных телефонов , персональных компьютеров , автомобильной электроники и камер . [65]
Тантал также используется для производства различных сплавов , которые имеют высокие температуры плавления, прочность и пластичность. Сплавленный с другими металлами, он также используется для изготовления твердосплавных инструментов для металлообрабатывающего оборудования и в производстве суперсплавов для компонентов реактивных двигателей, химического технологического оборудования, ядерных реакторов , деталей ракет, теплообменников, резервуаров и сосудов. [66] [65] [67] Благодаря своей пластичности тантал можно вытягивать в тонкие проволоки или нити, которые используются для испарения металлов, таких как алюминий . Поскольку он устойчив к воздействию биологических жидкостей и не вызывает раздражения, тантал широко используется при изготовлении хирургических инструментов и имплантатов. Например, пористые танталовые покрытия используются при изготовлении ортопедических имплантатов из-за способности тантала образовывать прямую связь с твердыми тканями. [68]
Тантал инертен по отношению к большинству кислот, за исключением плавиковой и горячей серной кислот , а горячие щелочные растворы также вызывают коррозию тантала. Это свойство делает его полезным металлом для сосудов для химических реакций и труб для едких жидкостей. Теплообменные змеевики для парового нагрева соляной кислоты изготавливаются из тантала. [69] Тантал широко использовался в производстве сверхвысокочастотных электронных ламп для радиопередатчиков. Тантал способен захватывать кислород и азот, образуя нитриды и оксиды, и поэтому помогал поддерживать высокий вакуум, необходимый для трубок при использовании для внутренних деталей, таких как решетки и пластины. [39] [69]

Тантал использовался NASA для защиты компонентов космических аппаратов, таких как Voyager 1 и Voyager 2 , от радиации. [70] Высокая температура плавления и стойкость к окислению привели к использованию металла в производстве деталей вакуумных печей . Тантал чрезвычайно инертен и поэтому формируется в различные коррозионно-стойкие детали, такие как термокарманы , корпуса клапанов и танталовые крепежи. Благодаря своей высокой плотности, кумулятивные заряды и взрывные пенетраторные вкладыши были изготовлены из тантала. [71] Тантал значительно увеличивает бронепробиваемость кумулятивного заряда из-за своей высокой плотности и высокой температуры плавления. [72] [73]
Он также иногда используется в драгоценных часах , например, от Audemars Piguet , FP Journe , Hublot , Montblanc , Omega и Panerai . Медицинский исследователь Джеральд Л. Берк впервые заметил в 1940 году, что тантал также является высоко биоинертным и может безопасно использоваться в качестве материала для ортопедических имплантатов. [74] Высокая жесткость тантала делает необходимым использование его в качестве высокопористой пены или каркаса с более низкой жесткостью для имплантатов для замены тазобедренного сустава, чтобы избежать экранирования напряжения . [75] Поскольку тантал является цветным, немагнитным металлом, эти имплантаты считаются приемлемыми для пациентов, проходящих процедуры МРТ. [76] Оксид используется для изготовления специального стекла с высоким показателем преломления для объективов камер . [77] Сферический порошок тантала, полученный путем распыления расплавленного тантала с использованием газа или жидкости, обычно используется в аддитивном производстве благодаря своей однородной форме, превосходной текучести и высокой температуре плавления. [78] [79]
Танталу уделяется гораздо меньше внимания в области охраны окружающей среды, чем в других науках о Земле. Концентрация в верхней коре (UCC) и отношение Nb/Ta в верхней коре и в минералах доступны, поскольку эти измерения полезны в качестве геохимического инструмента. [80] Последнее значение концентрации в верхней коре составляет 0,92 ppm, а отношение Nb/Ta (w/w) составляет 12,7. [81]
Мало данных доступно о концентрациях тантала в различных экологических отсеках, особенно в природных водах, где надежные оценки концентраций «растворенного» тантала в морской и пресной воде даже не были получены. [82] Некоторые значения концентраций растворенного тантала в океанах были опубликованы, но они противоречивы. Значения в пресных водах немного лучше, но во всех случаях они, вероятно, ниже 1 нг л −1 , поскольку «растворенные» концентрации в природных водах значительно ниже большинства современных аналитических возможностей. [83] Анализ требует процедур предварительной концентрации, которые на данный момент не дают последовательных результатов. И в любом случае тантал, по-видимому, присутствует в природных водах в основном в виде твердых частиц, а не растворенного. [82]
Значения концентраций в почвах, донных отложениях и атмосферных аэрозолях получить легче. [82] Значения в почвах близки к 1 ppm и, следовательно, к значениям UCC. Это указывает на детритное происхождение. Для атмосферных аэрозолей доступные значения разбросаны и ограничены. Когда наблюдается обогащение танталом, это, вероятно, связано с потерей большего количества водорастворимых элементов в аэрозолях в облаках. [84]
Загрязнения, связанного с использованием этого элемента человеком, не обнаружено. [85] Тантал, по-видимому, является очень консервативным элементом в биогеохимическом отношении, но его цикличность и реакционная способность до сих пор не полностью изучены.
Соединения, содержащие тантал, редко встречаются в лабораторных условиях. Металл обладает высокой биосовместимостью [74] и используется для имплантатов и покрытий тела , поэтому внимание может быть сосредоточено на других элементах или физической природе химического соединения . [86]
Люди могут подвергаться воздействию тантала на рабочем месте при вдыхании, контакте с кожей или контакте с глазами. Управление по охране труда и промышленной гигиене (OSHA) установило допустимый предел ( допустимый предел воздействия ) для воздействия тантала на рабочем месте в размере 5 мг/ м3 в течение 8-часового рабочего дня. Национальный институт охраны труда и промышленной гигиене (NIOSH) установил рекомендуемый предел воздействия (REL) в размере 5 мг/м3 в течение 8-часового рабочего дня и краткосрочный предел в размере 10 мг/м3 . При уровнях 2500 мг/м3 танталовая пыль немедленно становится опасной для жизни и здоровья . [87]
спроса на тантал во всем мире и задержки в получении правительственного разрешения на установку необходимого дробильного оборудования являются одними из факторов, способствовавших принятию этого решения.
{{cite book}}: |journal=проигнорировано ( помощь )