Эпигенетика рака — это изучение эпигенетических модификаций ДНК раковых клеток , которые не подразумевают изменения в последовательности нуклеотидов, но вместо этого подразумевают изменение способа экспрессии генетического кода. Эпигенетические механизмы необходимы для поддержания нормальных последовательностей экспрессии специфичных для ткани генов и имеют решающее значение для нормального развития. [1] Они могут быть столь же важны, если не более важны, чем генетические мутации при трансформации клетки в рак. Нарушение эпигенетических процессов при раке может привести к потере экспрессии генов , что происходит примерно в 10 раз чаще из-за подавления транскрипции (вызванного гиперметилированием эпигенетического промотора CpG-островков ), чем из-за мутаций. Как указывают Фогельштейн и др., при колоректальном раке обычно наблюдается около 3–6 мутаций-драйверов и от 33 до 66 мутаций- автостопщиков или пассажиров. [2] Однако в опухолях толстой кишки по сравнению с прилегающей нормальной слизистой оболочкой толстой кишки имеется около 600–800 сильно метилированных CpG-островков в промоторах генов в опухолях, тогда как эти CpG-островки не метилированы в прилегающей слизистой оболочке. [3] [4] [5] Манипуляции с эпигенетическими изменениями открывают большие перспективы для профилактики, обнаружения и терапии рака. [6] [7] При различных типах рака могут быть нарушены различные эпигенетические механизмы, такие как подавление генов-супрессоров опухолей и активация онкогенов путем изменения паттернов метилирования CpG-островков , модификации гистонов и нарушение регуляции ДНК-связывающих белков . Существует несколько лекарств , которые оказывают эпигенетическое воздействие, и которые в настоящее время используются при ряде этих заболеваний.


В соматических клетках паттерны метилирования ДНК в целом передаются дочерним клеткам с высокой точностью. [8] Обычно это метилирование происходит только в цитозинах, которые расположены 5' к гуанозину в динуклеотидах CpG эукариот высшего порядка. [9] Однако эпигенетическое метилирование ДНК отличается между нормальными клетками и опухолевыми клетками у людей. «Нормальный» профиль метилирования CpG часто инвертируется в клетках, которые становятся опухолеобразующими. [10] В нормальных клетках островки CpG , предшествующие промоторам генов , как правило, неметилированы и, как правило, транскрипционно активны, в то время как другие отдельные динуклеотиды CpG по всему геному, как правило, метилированы. Однако в раковых клетках островки CpG , предшествующие промоторам генов-супрессоров опухолей , часто гиперметилированы, в то время как метилирование CpG областей промотора онкогена и паразитарных повторных последовательностей часто снижено. [11]
Гиперметилирование областей промотора гена-супрессора опухоли может привести к подавлению этих генов. Этот тип эпигенетической мутации позволяет клеткам расти и размножаться бесконтрольно, что приводит к возникновению опухолей. [10] Добавление метильных групп к цитозинам приводит к тому, что ДНК плотно скручивается вокруг гистоновых белков, в результате чего ДНК не может подвергаться транскрипции (транскрипционно подавленная ДНК). Гены, которые обычно подавляются транскрипцией из-за гиперметилирования промотора, включают: ингибитор циклинзависимой киназы p16 , ингибитор клеточного цикла; MGMT , ген репарации ДНК ; APC , регулятор клеточного цикла; MLH1 , ген репарации ДНК; и BRCA1 , еще один ген репарации ДНК. [10] [12] Действительно, раковые клетки могут привыкнуть к транскрипционному подавлению из-за гиперметилирования промотора некоторых ключевых генов-супрессоров опухоли, процесс, известный как эпигенетическая зависимость. [13]
Гипометилирование динуклеотидов CpG в других частях генома приводит к нестабильности хромосом из-за таких механизмов, как потеря импринтинга и реактивация мобильных элементов . [14] [15] [16] [17] Потеря импринтинга гена инсулиноподобного фактора роста (IGF2) увеличивает риск колоректального рака и связана с синдромом Беквита-Видеманна , который значительно увеличивает риск рака у новорожденных. [18] В здоровых клетках динуклеотиды CpG более низкой плотности находятся в кодирующих и некодирующих межгенных областях. Экспрессия некоторых повторяющихся последовательностей и мейотическая рекомбинация в центромерах подавляются посредством метилирования [19]
Весь геном раковой клетки содержит значительно меньше метилцитозина , чем геном здоровой клетки. Фактически, геномы раковых клеток имеют на 20-50% меньше метилирования в отдельных динуклеотидах CpG по всему геному. [14] [15] [16] [17] Островки CpG, обнаруженные в промоторных областях, обычно защищены от метилирования ДНК. В раковых клетках островки CpG гипометилированы [20] Регионы, фланкирующие островки CpG, называемые берегами островков CpG, являются тем местом, где происходит большая часть метилирования ДНК в контексте динуклеотидов CpG. Раковые клетки метилированы преимущественно на берегах островков CpG. В раковых клетках гиперметилирование в берегах островков CpG перемещается в островки CpG, или гипометилирование островков CpG перемещается в берега островков CpG, устраняя резкие эпигенетические границы между этими генетическими элементами. [21] В раковых клетках «глобальное гипометилирование» из-за нарушения работы ДНК-метилтрансфераз (DNMT) может способствовать митотической рекомбинации и перестройке хромосом , что в конечном итоге приводит к анеуплоидии , когда хромосомы не могут правильно разделиться во время митоза . [14] [15] [16] [17]
Метилирование CpG-островков важно для регуляции экспрессии генов, однако метилирование цитозина может напрямую приводить к дестабилизирующим генетическим мутациям и предраковому клеточному состоянию. Метилированные цитозины делают гидролиз аминогруппы и спонтанное преобразование в тимин более благоприятными. Они могут вызывать аберрантный набор хроматиновых белков. Метилирование цитозина изменяет количество поглощения УФ-света нуклеотидной основой, создавая пиримидиновые димеры . Когда мутация приводит к потере гетерозиготности в участках генов- супрессоров опухолей, эти гены могут стать неактивными. Мутации одной пары оснований во время репликации также могут иметь пагубные последствия. [12]
Эукариотическая ДНК имеет сложную структуру. Она обычно оборачивается вокруг специальных белков, называемых гистонами, образуя структуру, называемую нуклеосомой . Нуклеосома состоит из 2 наборов из 4 гистонов: H2A , H2B , H3 и H4 . Кроме того, гистон H1 участвует в упаковке ДНК за пределами нуклеосомы. Некоторые ферменты, модифицирующие гистоны, могут добавлять или удалять функциональные группы к гистонам, и эти модификации влияют на уровень транскрипции генов, обернутых вокруг этих гистонов, и уровень репликации ДНК. Профили модификации гистонов здоровых и раковых клеток, как правило, различаются.
По сравнению со здоровыми клетками, раковые клетки демонстрируют снижение моноацетилированных и триметилированных форм гистона H4 (снижение H4ac и H4me3). [22] Кроме того, мышиные модели показали, что снижение асимметричного диметилирования гистона H4R3 (H4R3me2a) промотора p19ARF коррелирует с более запущенными случаями опухолегенеза и метастазирования. [23] В мышиных моделях потеря ацетилирования и триметилирования гистона H4 увеличивается по мере продолжения роста опухоли. [22] Потеря ацетилирования лизина 16 гистона H4 ( H4K16ac ), которая является признаком старения теломер , в частности, теряет свое ацетилирование. Некоторые ученые надеются, что эта конкретная потеря ацетилирования гистона может быть предотвращена с помощью ингибитора гистондеацетилазы (HDAC), специфичного для SIRT1 , HDAC, специфичного для H4K16. [10] [24]
Другие гистоновые метки, связанные с онкогенезом, включают повышенное деацетилирование (пониженное ацетилирование) гистонов H3 и H4, пониженное триметилирование гистона H3 лизина 4 ( H3K4me3 ), повышенное монометилирование гистона H3 лизина 9 (H3K9me1) и триметилирование гистона H3 лизина 27 ( H3K27me3 ). Эти модификации гистонов могут подавлять гены-супрессоры опухолей, несмотря на снижение метилирования CpG-островка гена (событие, которое обычно активирует гены). [25] [26]
Некоторые исследования были сосредоточены на блокировании действия BRD4 на ацетилированные гистоны, что, как было показано, увеличивает экспрессию белка Myc , вовлеченного в несколько видов рака. Процесс разработки препарата для связывания с BRD4 примечателен совместным, открытым подходом, который использует команда. [27]
Ген-супрессор опухолей p53 регулирует репарацию ДНК и может вызывать апоптоз в нерегулируемых клетках. E Soto-Reyes и F Recillas-Targa выяснили важность белка CTCF в регуляции экспрессии p53. [28] CTCF, или фактор связывания CCCTC, представляет собой белок с цинковыми пальцами , который изолирует промотор p53 от накопления репрессивных гистоновых меток. В некоторых типах раковых клеток белок CTCF не связывается нормально, а промотор p53 накапливает репрессивные гистоновые метки, что приводит к снижению экспрессии p53. [28]
Мутации в самом эпигенетическом механизме также могут происходить, потенциально ответственные за изменение эпигенетических профилей раковых клеток. Варианты гистонов семейства H2A высококонсервативны у млекопитающих, играя критически важную роль в регуляции многих ядерных процессов путем изменения структуры хроматина . Один из ключевых вариантов H2A, H2A.X, маркирует повреждение ДНК, способствуя привлечению белков репарации ДНК для восстановления целостности генома. Другой вариант, H2A.Z, играет важную роль как в активации, так и в репрессии генов. Высокий уровень экспрессии H2A.Z обнаруживается при многих видах рака и в значительной степени связан с клеточной пролиферацией и геномной нестабильностью. [11] Вариант гистона macroH2A1 важен в патогенезе многих типов рака, например, при гепатоцеллюлярной карциноме. [29] Другие механизмы включают снижение H4K16ac, которое может быть вызвано либо снижением активности гистоновых ацетилтрансфераз (HATs), либо увеличением деацетилирования SIRT1. [10] Аналогично, инактивирующая мутация сдвига рамки в HDAC2 , гистоновой деацетилазы , которая действует на многие лизины гистонов-хвостов , была связана с раком, показывающим измененные паттерны ацетилирования гистонов. [30] Эти результаты указывают на многообещающий механизм изменения эпигенетических профилей посредством ферментативного ингибирования или усиления. Новой развивающейся областью, которая охватывает токсикологические эпигенетические изменения в результате воздействия различных соединений (лекарств, пищи и окружающей среды), является токсикоэпигенетика. В этой области растет интерес к картированию изменений в модификациях гистонов и их возможных последствий. [31]
Повреждение ДНК , вызванное ультрафиолетовым светом, ионизирующим излучением , экологическими токсинами и метаболическими химикатами, также может привести к геномной нестабильности и раку. Реакция повреждения ДНК на двухцепочечные разрывы ДНК (DSB) частично опосредована модификациями гистонов. При DSB комплекс белков MRE11 - RAD50 - NBS1 (MRN) рекрутирует мутированную киназу атаксии-телеангиэктазии (ATM), которая фосфорилирует серин 129 гистона 2A. MDC1, медиатор контрольной точки повреждения ДНК 1, связывается с фосфопептидом, и фосфорилирование H2AX может распространяться по положительной обратной связи рекрутирования и фосфорилирования MRN-ATM. TIP60 ацетилирует γH2AX, который затем полиубиквитинируется. RAP80, субъединица комплекса белка восприимчивости к репарации ДНК рака молочной железы 1 типа ( BRCA1 -A), связывает убиквитин, прикрепленный к гистонам. Активность BRCA1-A останавливает клеточный цикл в контрольной точке G2/M , давая время для репарации ДНК, или может быть инициирован апоптоз . [32]
У млекопитающих микроРНК (miRNA) регулируют около 60% транскрипционной активности генов, кодирующих белки. [33] Некоторые miRNA также подвергаются подавлению, связанному с метилированием, в раковых клетках. [34] [35] Let-7 и miR15/16 играют важную роль в подавлении онкогенов RAS и BCL2 , и их подавление происходит в раковых клетках. [18] Снижение экспрессии miR-125b1, miRNA, которая функционирует как супрессор опухолей , наблюдалось при раке простаты, яичников , молочной железы и глиальных клетках. Эксперименты in vitro показали, что miR-125b1 нацелена на два гена, HER2/neu и ESR1 , которые связаны с раком молочной железы. Метилирование ДНК, в частности гиперметилирование, является одним из основных способов эпигенетического подавления miR-125b1. У пациентов с раком молочной железы наблюдалось гиперметилирование CpG-островков, расположенных проксимальнее сайта начала транскрипции. Потеря связывания CTCF и увеличение репрессивных гистоновых меток, H3K9me3 и H3K27me3, коррелирует с метилированием ДНК и подавлением miR-125b1. Механистически CTCF может функционировать как пограничный элемент, останавливающий распространение метилирования ДНК. Результаты экспериментов, проведенных Сото-Рейесом и соавторами [36] , указывают на отрицательное влияние метилирования на функцию и экспрессию miR-125b1. Поэтому они пришли к выводу, что метилирование ДНК играет роль в подавлении гена. Кроме того, некоторые miRNA эпигенетически подавлены на ранней стадии рака молочной железы, и поэтому эти miRNA потенциально могут быть полезны в качестве опухолевых маркеров. [36] Эпигенетическое подавление генов miRNA аберрантным метилированием ДНК является частым явлением в раковых клетках; Почти треть промоторов miRNA, активных в нормальных клетках молочной железы, были обнаружены гиперметилированными в клетках рака молочной железы, что в несколько раз превышает долю, обычно наблюдаемую для генов, кодирующих белки. [37]
Дисрегуляция метаболизма позволяет опухолевым клеткам генерировать необходимые строительные блоки, а также модулировать эпигенетические метки для поддержки возникновения и прогрессирования рака. Метаболические изменения, вызванные раком, изменяют эпигенетический ландшафт, особенно модификации гистонов и ДНК, тем самым способствуя злокачественной трансформации, адаптации к недостаточному питанию и метастазированию. Для того чтобы удовлетворить биосинтетические потребности раковых клеток, метаболические пути изменяются путем одновременного манипулирования онкогенами и генами, подавляющими опухоль. [38] Накопление определенных метаболитов в раке может нацеливать эпигенетические ферменты на глобальное изменение эпигенетического ландшафта. Связанные с раком метаболические изменения приводят к локус-специфическому перекодированию эпигенетических меток. Эпигенетика рака может быть точно перепрограммирована клеточным метаболизмом посредством 1) дозозависимой модуляции эпигенетики рака метаболитами; 2) последовательности-специфического набора метаболических ферментов; и 3) нацеливания эпигенетических ферментов пищевыми сигналами. [38] В дополнение к модуляции метаболического программирования на молекулярном уровне, существуют микросредовые факторы, которые могут влиять и влиять на метаболическое перекодирование. Эти влияния включают питание, воспаление и иммунный ответ злокачественных тканей.
Повреждение ДНК, по-видимому, является основной причиной рака. [39] [40] Если репарация ДНК недостаточна, повреждения ДНК имеют тенденцию накапливаться. Такое избыточное повреждение ДНК может увеличить мутационные ошибки во время репликации ДНК из-за подверженного ошибкам синтеза транслезиона . Избыточное повреждение ДНК также может увеличить эпигенетические изменения из-за ошибок во время репарации ДНК. [41] [42] Такие мутации и эпигенетические изменения могут привести к раку (см. злокачественные новообразования ).
Мутации зародышевой линии в генах репарации ДНК вызывают лишь 2–5% случаев рака толстой кишки . [43] Однако измененная экспрессия микроРНК, вызывающая дефицит репарации ДНК, часто связана с раковыми заболеваниями и может быть важным причинным фактором для этих видов рака.
Повышенная экспрессия определенных miRNA может напрямую снижать экспрессию определенных белков репарации ДНК. Ван и др. [44] сослались на 6 генов репарации ДНК, на которые напрямую нацелены miRNA, указанные в скобках: ATM (miR-421), RAD52 (miR-210, miR-373), RAD23B (miR-373), MSH2 (miR-21), BRCA1 (miR-182) и P53 (miR-504, miR-125b). Совсем недавно Тесситоре и др. [45] перечислили дополнительные гены репарации ДНК, которые напрямую нацелены на дополнительные miRNA, включая ATM (miR-18a, miR-101), DNA-PK (miR-101), ATR (miR-185), Wip1 (miR-16), MLH1, MSH2 и MSH6 (miR-155), ERCC3 и ERCC4 (miR-192) и UNG2 (mir-16, miR-34c и miR-199a). Из этих miRNA, miR-16, miR-18a, miR-21, miR-34c, miR-125b, miR-101, miR-155, miR-182, miR-185 и miR-192 входят в число тех, которые были идентифицированы Шнекенбургером и Дидерихом [46] как сверхэкспрессируемые при раке толстой кишки через эпигенетическое гипометилирование. Повышенная экспрессия любой из этих микроРНК может привести к снижению экспрессии целевого гена репарации ДНК.
До 15% дефицитов MLH1 при спорадических формах рака толстой кишки, по-видимому, были вызваны чрезмерной экспрессией микроРНК miR-155 , которая подавляет экспрессию MLH1. [47] Однако большинство из 68 спорадических форм рака толстой кишки со сниженной экспрессией белка репарации несоответствий ДНК MLH1 оказались дефицитными из-за эпигенетического метилирования острова CpG гена MLH1 . [48]
В 28% глиобластом белок репарации ДНК MGMT дефицитен, но промотор MGMT не метилирован. [49] В глиобластомах без метилированных промоторов MGMT уровень микроРНК miR-181d обратно коррелирует с экспрессией белка MGMT, а прямой целью miR-181d является 3'UTR мРНК MGMT ( три основных нетранслируемых региона мРНК MGMT). [49] Таким образом, в 28% глиобластом повышенная экспрессия miR-181d и сниженная экспрессия фермента репарации ДНК MGMT могут быть причинным фактором. В 29–66% [49] [50] глиобластом репарация ДНК дефицитна из-за эпигенетического метилирования гена MGMT , что снижает экспрессию белка MGMT.
Группа белков высокой мобильности A ( HMGA ), характеризующаяся наличием AT-крючка , представляет собой небольшие, негистоновые, ассоциированные с хроматином белки, которые могут модулировать транскрипцию. МикроРНК контролируют экспрессию белков HMGA , и эти белки ( HMGA1 и HMGA2 ) являются архитектурными элементами, контролирующими транскрипцию хроматина. Пальмиери и др. [51] показали, что в нормальных тканях гены HGMA1 и HMGA2 являются мишенями (и, таким образом, их экспрессия сильно снижена) для miR-15 , miR-16 , miR-26a , miR-196a2 и Let-7a .
Экспрессия HMGA практически не обнаруживается в дифференцированных взрослых тканях, но повышена при многих видах рака. Белки HGMA представляют собой полипептиды из ~100 аминокислотных остатков, характеризующиеся модульной организацией последовательностей. Эти белки имеют три высокоположительно заряженных региона, называемых крючками AT , которые связывают малую бороздку участков ДНК, богатых AT, в определенных регионах ДНК. Человеческие новообразования, включая рак щитовидной железы, предстательной железы, шейки матки, колоректальный рак, рак поджелудочной железы и яичников, показывают сильное увеличение белков HMGA1a и HMGA1b. [52] Трансгенные мыши с HMGA1, нацеленным на лимфоидные клетки, развивают агрессивную лимфому, показывая, что высокая экспрессия HMGA1 связана не только с раком, но и что ген HMGA1 может действовать как онкоген, вызывая рак. [53] Балдассарре и др., [54] показали, что белок HMGA1 связывается с промоторной областью гена репарации ДНК BRCA1 и ингибирует активность промотора BRCA1 . Они также показали, что, хотя только 11% опухолей молочной железы имели гиперметилирование гена BRCA1 , 82% агрессивных форм рака молочной железы имели низкую экспрессию белка BRCA1, и большинство этих снижений были обусловлены ремоделированием хроматина за счет высоких уровней белка HMGA1.
Белок HMGA2 специфически воздействует на промотор ERCC1 , тем самым снижая экспрессию этого гена репарации ДНК. [55] Экспрессия белка ERCC1 была недостаточной в 100% из 47 оцененных случаев рака толстой кишки (хотя степень участия HGMA2 неизвестна). [56]
Palmieri et al. [51] показали, что каждая из miRNA, нацеленных на гены HMGA, резко снижена почти во всех изученных аденомах гипофиза человека по сравнению с нормальным гипофизом. В соответствии с подавлением этих miRNA, нацеленных на HMGA, наблюдалось увеличение мРНК, специфичных для HMGA1 и HMGA2. Три из этих микроРНК (miR-16, miR-196a и Let-7a) [46] [57] имеют метилированные промоторы и, следовательно, низкую экспрессию при раке толстой кишки. Для двух из них, miR-15 и miR-16, кодирующие области эпигенетически подавлены при раке из-за активности гистондеацетилазы . [58] Когда эти микроРНК экспрессируются на низком уровне, тогда белки HMGA1 и HMGA2 экспрессируются на высоком уровне. HMGA1 и HMGA2 нацелены (снижают экспрессию) на гены репарации ДНК BRCA1 и ERCC1 . Таким образом, репарация ДНК может быть снижена, что, вероятно, способствует прогрессированию рака. [40]
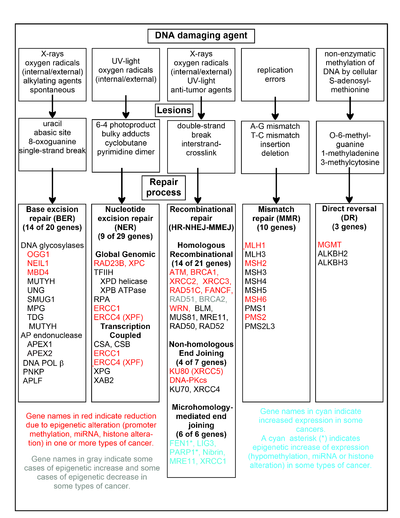
На диаграмме в этом разделе показаны некоторые часто встречающиеся агенты, повреждающие ДНК, примеры повреждений ДНК, которые они вызывают, и пути, которые справляются с этими повреждениями ДНК. По крайней мере 169 ферментов либо напрямую задействованы в восстановлении ДНК, либо влияют на процессы восстановления ДНК. [59] Из них 83 напрямую задействованы в восстановлении 5 типов повреждений ДНК, показанных на диаграмме.
Некоторые из наиболее хорошо изученных генов, центральных для этих процессов восстановления, показаны на диаграмме. Обозначения генов, показанные красным, серым или голубым цветом, указывают на гены, часто эпигенетически измененные при различных типах рака. Статьи Википедии по каждому из генов, выделенных красным, серым или голубым цветом, описывают эпигенетические изменения и рак, при котором эти эпимутации обнаружены. Две обширные экспериментальные обзорные статьи [60] [61] также документируют большинство этих эпигенетических дефектов репарации ДНК при раке.
Выделенные красным гены часто сокращаются или подавляются эпигенетическими механизмами при различных видах рака. Когда эти гены имеют низкую или отсутствующую экспрессию, повреждения ДНК могут накапливаться. Ошибки репликации за пределами этих повреждений (см. синтез транслезии ) могут привести к увеличению мутаций и, в конечном итоге, к раку. Эпигенетическая репрессия генов репарации ДНК в точных путях репарации ДНК, по-видимому, играет центральную роль в канцерогенезе .
Два выделенных серым гена RAD51 и BRCA2 необходимы для гомологичной рекомбинационной репарации. Иногда они эпигенетически сверхэкспрессированы, а иногда недостаточно экспрессированы при определенных видах рака. Как указано в статьях Википедии о RAD51 и BRCA2 , такие виды рака обычно имеют эпигенетические дефициты в других генах репарации ДНК. Эти дефициты репарации, вероятно, приведут к увеличению нерепарированных повреждений ДНК. Сверхэкспрессия RAD51 и BRCA2, наблюдаемая при этих видах рака, может отражать селективное давление для компенсаторной сверхэкспрессии RAD51 или BRCA2 и увеличенной гомологичной рекомбинационной репарации, чтобы хотя бы частично справиться с такими избыточными повреждениями ДНК. В тех случаях, когда RAD51 или BRCA2 недостаточно экспрессированы, это само по себе приведет к увеличению нерепарированных повреждений ДНК. Ошибки репликации, выходящие за рамки этих повреждений (см. синтез через повреждение ), могут привести к увеличению числа мутаций и рака, поэтому недостаточная экспрессия RAD51 или BRCA2 сама по себе может быть канцерогенной.
Гены, выделенные цианом, находятся в пути микрогомологически-опосредованного соединения концов (MMEJ) и активируются при раке. MMEJ — это дополнительный подверженный ошибкам неточный путь репарации для двухцепочечных разрывов. При репарации двухцепочечного разрыва MMEJ гомологии 5-25 комплементарных пар оснований между обеими парными цепями достаточно для выравнивания цепей, но обычно присутствуют несовпадающие концы (лоскуты). MMEJ удаляет дополнительные нуклеотиды (лоскуты) в местах соединения цепей, а затем лигирует цепи для создания неповрежденной двойной спирали ДНК. MMEJ почти всегда включает по крайней мере небольшую делецию, так что это мутагенный путь. [62] FEN1 , эндонуклеаза лоскута в MMEJ, эпигенетически увеличивается за счет гипометилирования промотора и сверхэкспрессируется в большинстве видов рака молочной железы, [63] простаты, [64] желудка, [65] [66] нейробластом, [67] поджелудочной железы, [68] и легких. [69] PARP1 также сверхэкспрессируется, когда его участок промотора ETS эпигенетически гипометилирован, и это способствует прогрессированию рака эндометрия, [70] рака яичников с мутацией BRCA, [71] и серозного рака яичников с мутацией BRCA. [72] Другие гены в пути MMEJ также сверхэкспрессируются в ряде видов рака (см. сводку в MMEJ ) и также показаны синим цветом.
Дефицит белков репарации ДНК, которые функционируют в точных путях репарации ДНК, увеличивает риск мутации. Скорость мутаций значительно увеличивается в клетках с мутациями в репарации несоответствий ДНК [73] [74] или в гомологичной рекомбинационной репарации (HRR). [75] Люди с унаследованными мутациями в любом из 34 генов репарации ДНК подвержены повышенному риску рака (см. Дефекты репарации ДНК и повышенный риск рака ).
При спорадических видах рака дефицит репарации ДНК иногда обнаруживается из-за мутации в гене репарации ДНК, но гораздо чаще сниженная или отсутствующая экспрессия генов репарации ДНК обусловлена эпигенетическими изменениями, которые снижают или подавляют экспрессию генов. Например, из 113 случаев колоректального рака, исследованных последовательно, только четыре имели миссенс-мутацию в гене репарации ДНК MGMT , в то время как большинство имели сниженную экспрессию MGMT из-за метилирования промотора MGMT (эпигенетическое изменение). [76] Аналогично, из 119 случаев колоректального рака с дефицитом репарации несоответствий, в которых отсутствовала экспрессия гена репарации ДНК PMS2 , белок PMS2 был дефицитным в 6 из-за мутаций в гене PMS2 , в то время как в 103 случаях экспрессия PMS2 была дефицитной, потому что его партнер по спариванию MLH1 был подавлен из-за метилирования промотора (белок PMS2 нестабилен при отсутствии MLH1). [48] В других 10 случаях потеря экспрессии PMS2, вероятно, была вызвана эпигенетической сверхэкспрессией микроРНК miR-155, которая подавляет MLH1. [47]
Эпигенетические дефекты в генах репарации ДНК часто встречаются при раке. В таблице несколько видов рака были оценены на предмет сниженной или отсутствующей экспрессии интересующего гена репарации ДНК, а показанная частота — это частота, с которой рак имел эпигенетический дефицит экспрессии гена. Такие эпигенетические дефекты, вероятно, возникают на ранних стадиях канцерогенеза , поскольку они также часто встречаются (хотя и с несколько меньшей частотой) в дефекте поля , окружающем рак, из которого, вероятно, возник рак (см. таблицу).
Похоже, что рак часто может быть инициирован эпигенетическим снижением экспрессии одного или нескольких ферментов репарации ДНК. Сниженная репарация ДНК, вероятно, позволяет накапливать повреждения ДНК. Ошибочно-подверженный синтез транслезиона после некоторых из этих повреждений ДНК может привести к мутации с селективным преимуществом. Клональный участок с селективным преимуществом может расти и вытеснять соседние клетки, образуя дефект поля . Хотя нет очевидного селективного преимущества для клетки иметь сниженную репарацию ДНК, эпимутация гена репарации ДНК может переноситься как пассажир, когда клетки с селективно выгодной мутацией реплицируются. В клетках, несущих как эпимутацию гена репарации ДНК, так и мутацию с селективным преимуществом, будут накапливаться дальнейшие повреждения ДНК, и они, в свою очередь, могут привести к дальнейшим мутациям с еще большими селективными преимуществами. Таким образом, эпигенетические дефекты в репарации ДНК могут способствовать характерной высокой частоте мутаций в геномах раковых заболеваний и вызывать их канцерогенное прогрессирование.
Раковые заболевания имеют высокий уровень нестабильности генома , связанный с высокой частотой мутаций . Высокая частота геномных мутаций увеличивает вероятность возникновения определенных мутаций, которые активируют онкогены и инактивируют гены-супрессоры опухолей, что приводит к канцерогенезу . На основе секвенирования всего генома обнаружено, что раковые заболевания имеют тысячи или сотни тысяч мутаций во всех своих геномах. [87] (Также см. Частоты мутаций при раковых заболеваниях .) Для сравнения, частота мутаций во всем геноме между поколениями для людей (от родителя к ребенку) составляет около 70 новых мутаций на поколение. [88] [89] В кодирующих белок областях генома существует всего около 0,35 мутаций между поколениями родителей/детей (менее одного мутировавшего белка на поколение). [90] Полное секвенирование генома в клетках крови у пары идентичных близнецов в возрасте 100 лет выявило только 8 соматических различий, хотя соматические вариации, встречающиеся менее чем в 20% клеток крови, остались бы необнаруженными. [91]
В то время как повреждения ДНК могут приводить к мутациям через подверженный ошибкам синтез транслезии , повреждения ДНК также могут приводить к эпигенетическим изменениям во время ошибочных процессов репарации ДНК. [41] [42] [92] [93] Повреждения ДНК, которые накапливаются из-за дефектов эпигенетической репарации ДНК, могут быть источником повышенных эпигенетических изменений, обнаруженных во многих генах при раке. В раннем исследовании, изучающем ограниченный набор транскрипционных промоторов, Фернандес и др. [94] изучили профили метилирования ДНК 855 первичных опухолей. Сравнивая каждый тип опухоли с соответствующей ему нормальной тканью, 729 сайтов CpG-островков (55% из 1322 оцененных сайтов CpG) показали дифференциальное метилирование ДНК. Из этих сайтов 496 были гиперметилированы (репрессированы), а 233 были гипометилированы (активированы). Таким образом, в опухолях наблюдается высокий уровень изменений метилирования эпигенетических промоторов. Некоторые из этих эпигенетических изменений могут способствовать прогрессированию рака.
Различные соединения считаются эпигенетическими канцерогенами — они приводят к увеличению частоты опухолей, но не проявляют мутагенной активности (токсичные соединения или патогены, вызывающие опухоли, склонные к повышенной регенерации, также следует исключить). Примерами служат диэтилстильбестрол , арсенит , гексахлорбензол и соединения никеля .
Многие тератогены оказывают специфическое воздействие на плод посредством эпигенетических механизмов. [95] [96] Хотя эпигенетические эффекты могут сохранять эффект тератогена, такого как диэтилстильбэстрол, на протяжении всей жизни пораженного ребенка, возможность врожденных дефектов в результате воздействия на отцов или во втором и последующих поколениях потомства, как правило, отвергалась по теоретическим соображениям и из-за отсутствия доказательств. [97] Тем не менее, был продемонстрирован ряд аномалий, опосредованных самцами, и, вероятно, их будет больше. [98] Информация на этикетке FDA для Vidaza, формулы 5-азацитидина (неметилируемый аналог цитидина, который вызывает гипометилирование при включении в ДНК), гласит, что «мужчинам следует рекомендовать не становиться отцами» во время использования препарата, ссылаясь на доказательства у леченных самцов мышей сниженной фертильности, повышенной потери эмбрионов и аномального развития эмбрионов. [99] У крыс эндокринные различия наблюдались у потомства самцов, подвергшихся воздействию морфина. [100] У мышей описаны эффекты второго поколения диэтилстильбестерола, возникающие посредством эпигенетических механизмов. [101]
Меланома — смертельный рак кожи, который возникает из меланоцитов. Известно, что несколько эпигенетических изменений играют роль в переходе меланоцитов в клетки меланомы. Это включает метилирование ДНК, которое может быть унаследовано без внесения изменений в последовательность ДНК, а также подавление генов-супрессоров опухолей в эпидермисе, который подвергался воздействию УФ-излучения в течение определенного периода времени. [102] Подавление генов-супрессоров опухолей приводит к фотоканцерогенезу , который связан с эпигенетическими изменениями в метилировании ДНК, ДНК-метилтрансферазах и ацетилировании гистонов. [102] Эти изменения являются следствием нарушения регуляции соответствующих им ферментов. Среди этих ферментов есть несколько гистон-метилтрансфераз и деметилаз. [103]
Рак предстательной железы убивает около 35 000 мужчин ежегодно, и около 220 000 мужчин ежегодно диагностируются с раком предстательной железы, только в Северной Америке. [104] Рак предстательной железы является второй по значимости причиной смертности от рака у мужчин, и в течение жизни мужчины у одного из шести мужчин будет это заболевание. [104] Изменения в ацетилировании гистонов и метилировании ДНК происходят в различных генах, влияющих на рак предстательной железы, и были замечены в генах, участвующих в гормональном ответе. [105] Более 90% случаев рака предстательной железы демонстрируют подавление генов за счет гиперметилирования CpG-островка промотора гена GSTP1 , который защищает клетки предстательной железы от геномного повреждения, вызванного различными окислителями или канцерогенами . [106] Полимеразная цепная реакция (ПЦР) в реальном времени, специфичная для метилирования, предполагает , что многие другие гены также гиперметилированы. [106] Экспрессия генов в простате может модулироваться путем изменения питания и образа жизни. [107]
Вторая по распространенности злокачественная опухоль у женщин — инвазивный рак шейки матки (ИРШМ), и более 50% всех случаев инвазивного рака шейки матки (ИРШМ) вызваны онкогенным вирусом папилломы человека 16 ( ВПЧ16 ). [108] Кроме того, интраэпителиальная неоплазия шейки матки (ИНШМ) в первую очередь вызвана онкогенным ВПЧ16. [108] Как и во многих случаях, причинный фактор рака не всегда идет прямым путем от инфекции к развитию рака. Геномные паттерны метилирования были связаны с инвазивным раком шейки матки. В регионе HPV16L1 14 протестированных сайтов CpG имеют значительно более высокое метилирование в CIN3+, чем в геномах HPV16 женщин без CIN3 . [108] Было обнаружено, что только 2/16 сайтов CpG, протестированных в восходящей регуляторной области HPV16, связаны с повышенным метилированием в CIN3+. [108] Это говорит о том, что прямой путь от инфекции к раку иногда ведет к предраковому состоянию при интраэпителиальной неоплазии шейки матки. Кроме того, повышенное метилирование сайтов CpG было обнаружено на низких уровнях в большинстве из пяти изученных ядерных генов хозяина, включая 5/5 TERT , 1/4 DAPK1 , 2/5 RARB , MAL и CADM1 . [108] Кроме того, 1/3 сайтов CpG в митохондриальной ДНК были связаны с повышенным метилированием в CIN3+. [108] Таким образом, существует корреляция между CIN3+ и повышенным метилированием сайтов CpG в открытой рамке считывания HPV16 L1. [108] Это может быть потенциальным биомаркером для будущих скринингов раковых и предраковых заболеваний шейки матки. [108]
Недавние исследования показали, что ген лейкемии смешанной линии (MLL) вызывает лейкемию путем перестройки и слияния с другими генами в разных хромосомах, что является процессом, находящимся под эпигенетическим контролем. [109] Мутации в MLL блокируют правильные регуляторные области в транслокациях или вставках, связанных с лейкемией, вызывая злокачественную трансформацию, контролируемую генами HOX. [110] Это то, что приводит к увеличению количества лейкоцитов. Гены, связанные с лейкемией, управляются теми же путями, которые контролируют эпигенетику, сигнальную трансдукцию, транскрипционную регуляцию и энергетический метаболизм. Было указано, что инфекции, электромагнитные поля и повышенный вес при рождении могут способствовать возникновению лейкемии. [111]
В США ежегодно регистрируется около 15 000 новых случаев саркомы, и в 2014 году в США, по прогнозам, от саркомы умрет около 6 200 человек. [112] Саркомы включают большое количество редких, гистогенетически гетерогенных мезенхимальных опухолей, которые, например, включают хондросаркому, саркому Юинга, лейомиосаркому, липосаркому, остеосаркому, синовиальную саркому и (альвеолярную и эмбриональную) рабдомиосаркому. Несколько онкогенов и генов-супрессоров опухолей эпигенетически изменены в саркомах. К ним относятся APC, CDKN1A, CDKN2A, CDKN2B, Ezrin, FGFR1, GADD45A, MGMT, STK3, STK4, PTEN, RASSF1A, WIF1, а также несколько микроРНК. [113] Экспрессия эпигенетических модификаторов, таких как компонент BMI1 комплекса PRC1, дерегулирована при хондросаркоме, саркоме Юинга и остеосаркоме, а экспрессия компонента EZH2 комплекса PRC2 изменена при саркоме Юинга и рабдомиосаркоме. Аналогичным образом экспрессия другого эпигенетического модификатора, гистондеметилазы LSD1, увеличивается при хондросаркоме, саркоме Юинга, остеосаркоме и рабдомиосаркоме. Нацеливание лекарственных средств и ингибирование EZH2 при саркоме Юинга [114] или LSD1 при некоторых саркомах [115] подавляет рост опухолевых клеток в этих саркомах.
Рак легких является вторым по распространенности типом рака и основной причиной смерти среди мужчин и женщин в Соединенных Штатах. По оценкам, около 216 000 новых случаев заболевания и 160 000 смертей из-за рака легких. [116]
Инициация и прогрессирование карциномы легких является результатом взаимодействия генетических, эпигенетических и экологических факторов. Большинство случаев рака легких вызваны генетическими мутациями в EGFR , KRAS , STK11 (также известном как LKB1 ), TP53 (также известном как p53 ) и CDKN2A (также известном как p16 или INK4a ) [117] [118] [119] причем наиболее распространенным типом рака легких является инактивация в p16. p16 является белком-супрессором опухолей, который встречается в основном у людей функциональная значимость мутаций была проверена на многих других видах, включая мышей, кошек, собак, обезьян и коров идентификация этих множественных неперекрывающихся клонов не была полностью удивительной, так как гибридизация с пониженной строгостью зооблота с тем же зондом также выявила 10-15 положительных фрагментов EcoRI у всех протестированных видов. [120]
Ранее эпигенетические профили ограничивались отдельными генами, находящимися под пристальным вниманием определенной исследовательской группы. Однако в последнее время ученые переходят к более геномному подходу, чтобы определить весь геномный профиль для раковых и здоровых клеток. [10]
Популярные подходы к измерению метилирования CpG в клетках включают:
Поскольку бисульфитное секвенирование считается золотым стандартом для измерения метилирования CpG, при использовании одного из других методов результаты обычно подтверждаются с помощью бисульфитного секвенирования[1]. Популярные подходы для определения профилей модификации гистонов в раковых клетках по сравнению со здоровыми включают: [10]
Исследователи надеются идентифицировать конкретные эпигенетические профили различных типов и подтипов рака с целью использования этих профилей в качестве инструментов для более точной и точной диагностики людей. [10] Поскольку эпигенетические профили изменяются, ученые хотели бы использовать различные эпигеномные профили для определения стадии развития или уровня агрессивности конкретного рака у пациентов. Например, гиперметилирование генов, кодирующих ассоциированную со смертью протеинкиназу (DAPK), p16 и эпителиальный мембранный белок 3 (EMP3), было связано с более агрессивными формами рака легких , колоректального рака и рака мозга . [17] Этот тип знаний может повлиять на то, как врачи будут диагностировать и выбирать лечение своих пациентов.
Другим фактором, который будет влиять на лечение пациентов, является знание того, насколько хорошо они будут реагировать на определенные виды лечения. Персонализированные эпигеномные профили раковых клеток могут дать представление об этой области. Например, MGMT — это фермент, который обращает добавление алкильных групп к нуклеотиду гуанину . [121] Однако алкилирование гуанина — это механизм, с помощью которого действуют несколько химиотерапевтических препаратов , чтобы разрушить ДНК и вызвать гибель клеток . [122] [123] [124] [125] Следовательно, если ген, кодирующий MGMT в раковых клетках, гиперметилирован и фактически подавлен или репрессирован, химиотерапевтические препараты, которые действуют путем метилирования гуанина, будут более эффективными, чем в раковых клетках, которые имеют функциональный фермент MGMT.
Эпигенетические биомаркеры также могут быть использованы в качестве инструментов для молекулярного прогнозирования. В образцах биопсии первичной опухоли и средостенных лимфатических узлов гиперметилирование как CDKN2A , так и CDH13 служит маркером повышенного риска более быстрого рецидива рака и более высокой смертности пациентов. [126]
Эпигенетический контроль протоонкорегионов и последовательностей супрессоров опухолей посредством конформационных изменений в гистонах играет роль в формировании и прогрессировании рака. [127] Фармацевтические препараты, которые обращают вспять эпигенетические изменения, могут играть роль в различных видах рака. [105] [127] [128]
Недавно стало очевидно, что ассоциации между определенными гистотипами рака и эпигенетическими изменениями могут способствовать разработке новых эпи-препаратов. [129] Разработка лекарств была сосредоточена в основном на модификации ДНК-метилтрансферазы , гистонацетилтрансферазы (HAT) и гистондеацетилазы (HDAC). [130]
Препараты, которые специально нацелены на инвертированный паттерн метилирования раковых клеток, включают ингибиторы ДНК-метилтрансферазы азацитидин [131] [132] и децитабин . [133] [134] Эти гипометилирующие агенты используются для лечения миелодиспластического синдрома [ 135] рака крови , вызванного аномальными стволовыми клетками костного мозга [12] Эти агенты ингибируют все три типа активных ДНК-метилтрансфераз и считались высокотоксичными, но оказались эффективными при использовании в низких дозировках, снижая прогрессирование миелодиспластического синдрома до лейкемии [136 ]
Ингибиторы гистондеацетилазы (HDAC) показывают эффективность в лечении Т-клеточной лимфомы . Два ингибитора HDAC, вориностат и ромидепсин , были одобрены Управлением по контролю за продуктами и лекарствами . [137] [138] Однако, поскольку эти ингибиторы HDAC изменяют состояние ацетилирования многих белков в дополнение к интересующему гистону, для повышения эффективности использования таких ингибиторов в качестве лечения необходимо знание основного механизма на молекулярном уровне реакции пациента. [18] Было обнаружено, что лечение ингибиторами HDAC способствует реактивации генов после того, как ингибиторы ДНК-метилтрансфераз подавили транскрипцию. [139] Панобиностат одобрен для определенных ситуаций при миеломе . [140]
Другие фармацевтические цели в исследовании - это гистоновые лизиновые метилтрансферазы (КМТ) и протеиновые аргининовые метилтрансферазы (ПРМТ). [141] Доклинические исследования показали, что луназин может иметь потенциально полезные эпигенетические эффекты. [142]
Эпигенетическая терапия рака показала себя как многообещающее и возможное лечение раковых клеток. Эпигенетическая инактивация является идеальной целью для раковых клеток, поскольку она нацелена на гены, необходимые для контроля роста клеток, в частности, роста раковых клеток. Крайне важно, чтобы эти гены были реактивированы, чтобы подавить рост опухоли и сделать клетки чувствительными к терапии, излечивающей рак. [143] Типичная химиотерапия направлена на уничтожение и устранение раковых клеток в организме. Рак, вызванный генетическими изменениями клеток, как правило, является постоянным и практически необратимым, это отличается от эпигенетического рака, поскольку эпигенетические аберрации, вызывающие рак, могут быть обращены вспять, и клетки возвращаются к нормальной функции. Возможность обращения вспять эпигенетических механизмов объясняется тем фактом, что кодирование генов, подавляемых посредством модификации гистонов и ДНК, не изменяется. [144]
Существует два основных типа эпигенетических изменений в раковых клетках, они известны как метилирование ДНК и модификация гистонов. Цель эпигенетической терапии — ингибировать эти изменения. ДНК-метилтрансферазы (DNMT) и гистондеацетилазы (HDAC) являются основными катализаторами эпигенетических модификаций раковых клеток. [145] Цель эпигенетической терапии — подавить это метилирование и обратить эти модификации вспять, чтобы создать новый эпигеном, в котором раковые клетки больше не будут процветать, а подавление опухоли станет новой функцией. Синтетические препараты используются в качестве инструментов в эпигенетической терапии из-за их способности ингибировать ферменты, вызывающие модификации гистонов и метилирование ДНК. Комбинированная терапия — один из методов эпигенетической терапии, который включает использование более одного синтетического препарата, эти препараты включают в себя ингибитор DNMT в низкой дозе, а также ингибитор HDAC. Вместе эти препараты способны воздействовать на связь между метилированием ДНК и модификацией гистонов. [146]
Цель эпигенетической терапии рака в отношении метилирования ДНК заключается как в снижении метилирования ДНК, так и в снижении подавления генов, связанных с подавлением опухоли. [147] Термин, связанный с уменьшением метилирования ДНК, будет известен как гипометилирование. Управление по контролю за продуктами и лекарствами (FDA) в настоящее время одобрило один гипометилирующий агент, который, благодаря проведению клинических испытаний, показал многообещающие результаты при использовании для лечения пациентов с миелодиспластическим синдромом (МДС). [148] Этот гипометилирующий агент известен как аналог doozy 5-азацитидина и работает, способствуя гипометилированию, нацеливаясь на все ДНК-метилтрансферазы для деградации. [147]