Аммиак – неорганическое химическое соединение азота и водорода с формулой N H 3 . Стабильный бинарный гидрид и простейший гидрид пниктогена , аммиак представляет собой бесцветный газ с отчетливым резким запахом. С биологической точки зрения это обычные азотистые отходы , которые вносят значительный вклад в удовлетворение потребностей в питании наземных организмов, служа предшественником удобрений . [12] Около 70% аммиака, производимого промышленным способом, используется для производства удобрений [13] в различных формах и составе, таких как мочевина и диаммонийфосфат . Аммиак в чистом виде также вносится непосредственно в почву.
Аммиак прямо или косвенно также является строительным блоком для синтеза многих фармацевтических продуктов и используется во многих коммерческих чистящих средствах. В основном он собирается путем смещения вниз воздуха и воды.
Несмотря на то, что аммиак широко распространен в природе – как на Земле, так и на внешних планетах Солнечной системы – и широко используется, он одновременно едкий и опасный в своей концентрированной форме. Во многих странах оно классифицируется как чрезвычайно опасное вещество и подлежит строгим требованиям отчетности со стороны предприятий, которые производят, хранят или используют его в значительных количествах. [14]
Мировое промышленное производство аммиака в 2021 году составило 235 млн тонн. [15] [16] Промышленный аммиак продается либо в виде аммиачного раствора (обычно 28% аммиака в воде), либо в виде сжатого или охлажденного безводного жидкого аммиака, транспортируемого в цистернах или баллонах. [17]
Из-за химической инертности газообразного азота производство аммиака из атмосферного азота затруднено. Биологическую азотфиксацию осуществляют лишь некоторые семейства микроорганизмов — диазотрофы . Процесс Габера , сделавший возможным промышленное производство, был изобретен в начале 20-го века, произведя революцию в сельском хозяйстве.
NH 3 кипит при -33,34 °C (-28,012 °F) при давлении в одну атмосферу , поэтому жидкость необходимо хранить под давлением или при низкой температуре. Бытовой аммиак или гидроксид аммония представляет собой раствор NH 3 в воде. Концентрация таких растворов измеряется в единицах шкалы Боме ( плотность ), при этом 26 градусов Боме (около 30% аммиака по весу при 15,5 ° C или 59,9 ° F) являются типичным коммерческим продуктом с высокой концентрацией. [18]
Плиний в книге XXXI своей « Естественной истории » упоминает соль, названную аммониакумом , названную так из-за близости ее источника к храму Юпитера Амона ( греч. Ἄμμων Аммон ) в римской провинции Киренаика . [19] Однако описание соли, которое дает Плиний, не соответствует свойствам хлорида аммония . Согласно комментарию Герберта Гувера к его английскому переводу книги Георгиуса Агриколы «De re Metallica» , это, вероятно, была обычная морская соль. [20] В любом случае, эта соль в конечном итоге дала название аммиаку и аммониевым соединениям.
Следы аммиака/аммония также обнаруживаются в дождевой воде. Хлорид аммония ( sal ammonic ) и сульфат аммония встречаются в вулканических районах. Кристаллы бикарбоната аммония были обнаружены в гуано Патагонии . [21]
Аммиак также встречается по всей Солнечной системе на Марсе , Юпитере , Сатурне , Уране , Нептуне и Плутоне , а также в других местах: на более мелких ледяных телах , таких как Плутон, аммиак может действовать как геологически важный антифриз, как смесь воды и аммиак может иметь температуру плавления всего -100 ° C (-148 ° F; 173 K), если концентрация аммиака достаточно высока и, таким образом, позволяет таким телам сохранять внутренние океаны и активную геологию при гораздо более низкой температуре, чем это было бы возможно. только с водой. [22] [23] Вещества, содержащие аммиак или подобные ему, называются аммиачными .
Аммиак — бесцветный газ с характерным резким запахом . Он легче воздуха , его плотность в 0,589 раза больше плотности воздуха . Он легко сжижается благодаря прочным водородным связям между молекулами. Газообразный аммиак превращается в бесцветную жидкость , которая кипит при -33,1 °C (-27,58 °F) и замерзает до бесцветных кристаллов [21] при -77,7 °C (-107,86 °F). Доступно мало данных об очень высоких температурах и давлениях, таких как сверхкритические условия . [24]
Симметрия кристалла кубическая, символ Пирсона cP16, пространственная группа P2 1 3 №198, постоянная решетки 0,5125 нм . [25]
Жидкий аммиак обладает сильной ионизирующей способностью, что отражает его высокое значение ε , равное 22. Жидкий аммиак имеет очень высокое стандартное изменение энтальпии испарения (23,35 кДж/моль ; для сравнения, вода составляет 40,65 кДж/моль, метан 8,19 кДж/моль и фосфин 14,6). кДж/моль) и поэтому может использоваться в лабораториях в неизолированных сосудах без дополнительного охлаждения. Рассматривайте жидкий аммиак как растворитель.
Аммиак легко растворяется в воде. В водном растворе его можно удалить при кипячении. Водный раствор аммиака является основным . Максимальная концентрация аммиака в воде ( насыщенный раствор ) имеет плотность 0,880 г/см 3 и часто известна как «0,880 аммиака».
Таблица теплофизических свойств насыщенного жидкого аммиака: [26] [27]
Таблица теплофизических свойств аммиака ( NH 3 ) при атмосферном давлении: [26] [27]
Жидкий аммиак — широко изученный неводный ионизирующий растворитель. Его наиболее заметным свойством является способность растворять щелочные металлы с образованием ярко окрашенных электропроводящих растворов, содержащих сольватированные электроны . Помимо этих замечательных решений, большая часть химии жидкого аммиака может быть классифицирована по аналогии с соответствующими реакциями в водных растворах . Сравнение физических свойств NH 3 со свойствами воды показывает, что NH 3 имеет более низкую температуру плавления, температуру кипения, плотность, вязкость , диэлектрическую проницаемость и электропроводность . Эти различия объясняются, по крайней мере частично, более слабой водородной связью в NH 3 . Константа ионной самодиссоциации жидкого NH 3 при -50 °С составляет около 10 -33 .

Жидкий аммиак является ионизирующим растворителем, хотя и в меньшей степени, чем вода, и растворяет ряд ионных соединений, включая многие нитраты , нитриты , цианиды , тиоцианаты , циклопентадиенильные комплексы металлов и бис(триметилсилил)амиды металлов . [26] Большинство солей аммония растворимы и действуют как кислоты в жидких растворах аммиака. Растворимость галоидных солей увеличивается от фторида к йодиду . Насыщенный раствор нитрата аммония ( раствор Дайверса , названный в честь Эдварда Дайверса ) содержит 0,83 моль растворенного вещества на моль аммиака и имеет давление пара менее 1 бар даже при 25 ° C (77 ° F).
Жидкий аммиак растворяет все щелочные металлы и другие электроположительные металлы, такие как Ca , [28] Sr , Ba , Eu и Yb (также Mg с использованием электролитического процесса [27] ). При низких концентрациях (<0,06 моль/л) образуются темно-синие растворы: они содержат катионы металлов и сольватированные электроны , свободные электроны, окруженные клеткой из молекул аммиака.
Эти растворы являются сильными восстановителями. При более высоких концентрациях растворы имеют металлический вид и электропроводность. При низких температурах оба типа растворов могут сосуществовать в виде несмешивающихся фаз.
Диапазон термодинамической устойчивости жидких растворов аммиака очень узок, так как потенциал окисления до диазота E ° ( N 2 + 6 [NH 4 ] + + 6 e − ⇌ 8 NH 3 ) составляет всего +0,04 В. В На практике как окисление до динитрога, так и восстановление до диводорода происходят медленно. Особенно это касается восстановительных растворов: растворы упомянутых выше щелочных металлов устойчивы в течение нескольких дней, медленно разлагаясь на амид металла и дигидроген. Большинство исследований с использованием жидких растворов аммиака проводится в восстановительных условиях; хотя окисление жидкого аммиака обычно происходит медленно, все же существует риск взрыва, особенно если в качестве возможных катализаторов присутствуют ионы переходных металлов .

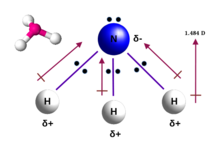

Молекула аммиака имеет тригональную пирамидальную форму, как предсказывает теория отталкивания электронных пар валентной оболочки (теория VSEPR) с экспериментально определенным валентным углом 106,7 °. [29] Центральный атом азота имеет пять внешних электронов и по одному электрону от каждого атома водорода. Всего это дает восемь электронов или четыре пары электронов, расположенных тетраэдрически . Три из этих пар электронов используются в качестве пар связи, в результате чего остается одна неподеленная пара электронов. Неподеленная пара отталкивается сильнее, чем пары связей; следовательно, валентный угол составляет не 109,5 °, как ожидалось для правильного тетраэдрического расположения, а 106,8 °. [29] Такая форма придает молекуле дипольный момент и делает ее полярной . Полярность молекулы и особенно ее способность образовывать водородные связи делают аммиак легко смешиваемым с водой. Неподеленная пара делает аммиак основанием , акцептором протонов. Аммиак умеренно основной; 1,0 М водный раствор имеет рН 11,6, и если к такому раствору добавить сильную кислоту до тех пор, пока раствор не станет нейтральным ( рН = 7 ), 99,4% молекул аммиака протонируются . Температура и соленость также влияют на долю аммония [NH 4 ] + . Последний имеет форму правильного тетраэдра и изоэлектронен метану .
Молекула аммиака легко подвергается инверсии азота при комнатной температуре; полезная аналогия — зонтик , выворачивающийся наизнанку при сильном ветре. Энергетический барьер этой инверсии составляет 24,7 кДж/моль, а резонансная частота — 23,79 ГГц , что соответствует микроволновому излучению с длиной волны 1,260 см. Поглощение на этой частоте было первым наблюдаемым микроволновым спектром [30] и использовалось в первом мазере .
Одним из наиболее характерных свойств аммиака является его основность . Аммиак считается слабым основанием. Он соединяется с кислотами , образуя соли аммония ; так, с соляной кислотой образует хлорид аммония (аммиачный раствор); с азотной кислотой , аммиачной селитрой и т. д. Идеально сухой газообразный аммиак не будет сочетаться с идеально сухим газообразным хлористым водородом; Для осуществления реакции необходима влага. [31] [32]
В качестве демонстрационного эксперимента на воздухе с окружающей влажностью открытые бутылки с концентрированными растворами аммиака и соляной кислоты образуют облако хлорида аммония , которое, кажется, появляется «из ничего», поскольку соляной аэрозоль образуется там, где два рассеивающихся облака реагентов встречаются между две бутылки.
Соли, образующиеся при действии аммиака на кислоты, известны как соли аммония и все содержат ион аммония ( [NH 4 ] + ). [31]
Хотя аммиак хорошо известен как слабое основание, он также может действовать как чрезвычайно слабая кислота. Это протонное вещество , способное образовывать амиды (содержащие ион NH - 2 ). Например, литий растворяется в жидком аммиаке с образованием синего раствора ( сольватированного электрона ) амида лития :
Как и вода, жидкий аммиак подвергается молекулярной автоионизации с образованием кислотных и основных конъюгатов :
Аммиак часто действует как слабое основание , поэтому он обладает некоторой буферной способностью. Сдвиги pH приводят к появлению в растворе большего или меньшего количества катионов аммония ( NH + 4 ) и амид-анионов ( NH - 2 ) . При стандартном давлении и температуре
Аммиак не горит легко и не поддерживает горение , за исключением узких топливно-воздушных смесей, содержащих 15–25% воздуха по объему. [33] При смешивании с кислородом горит бледным желтовато-зеленым пламенем. Возгорание происходит при переходе хлора в аммиак с образованием азота и хлористого водорода ; если хлор присутствует в избытке, то образуется также взрывоопасный трихлорид азота ( NCl 3 ).
Горение аммиака с образованием азота и воды является экзотермическим :
Стандартное изменение энтальпии сгорания ΔH ° c , выраженное на моль аммиака и при конденсации образовавшейся воды, составляет -382,81 кДж/моль. Диазот является термодинамическим продуктом сгорания : все оксиды азота нестабильны по отношению к N 2 и O 2 , что и является принципом работы каталитического нейтрализатора . Оксиды азота могут образовываться как кинетические продукты в присутствии соответствующих катализаторов — реакции, имеющей большое промышленное значение при производстве азотной кислоты :
Последующая реакция приводит к NO 2 :
Горение аммиака на воздухе очень затруднено при отсутствии катализатора ( например, платиновой сетки или теплого оксида хрома(III) ), из-за относительно низкой теплоты сгорания , меньшей ламинарной скорости горения, высокой температуры самовоспламенения , высокая теплота парообразования и узкий диапазон воспламеняемости . Однако недавние исследования показали, что эффективное и стабильное сжигание аммиака может быть достигнуто с использованием вихревых горелок, тем самым возрождая исследовательский интерес к аммиаку как топливу для производства тепловой энергии. [34] Диапазон воспламеняемости аммиака в сухом воздухе составляет 15,15–27,35 %, а в воздухе при 100 % относительной влажности – 15,95–26,55 %. [35] [ необходимы разъяснения ] Для изучения кинетики сгорания аммиака необходимо знание подробного надежного механизма реакции, но получить его было сложно. [36]
Аммиак является прямым или косвенным предшественником большинства производимых азотсодержащих соединений. Это предшественник азотной кислоты, которая является источником большинства N-замещенных ароматических соединений.
Амины могут образовываться в результате реакции аммиака с алкилгалогенидами или, чаще, со спиртами :
Его реакция раскрытия кольца с оксидом этилена дает этаноламин , диэтаноламин и триэтаноламин .
Амиды можно получить реакцией аммиака с карбоновой кислотой и их производными. Например, аммиак реагирует с муравьиной кислотой (HCOOH) с образованием формамида ( HCONH 2 ) при нагревании. Наиболее реакционноспособны ацилхлориды , но для нейтрализации образующегося хлористого водорода необходимо присутствие аммиака как минимум в двукратном избытке . Эфиры и ангидриды также реагируют с аммиаком с образованием амидов. Аммониевые соли карбоновых кислот можно дегидратировать до амидов при нагревании до 150–200 °C, если в них нет термочувствительных групп.
Другие азоторганические соединения включают алпразолам , этаноламин , этилкарбамат и гексаметилентетрамин .
Азотная кислота образуется по процессу Оствальда путем окисления аммиака воздухом на платиновом катализаторе при температуре 700–850 ° C (1292–1562 ° F), ≈9 атм. Оксид азота и диоксид азота занимают промежуточное положение в этом превращении: [37]
Азотная кислота используется для производства удобрений , взрывчатых веществ и многих азоторганических соединений.
Водород в аммиаке может быть заменен множеством заместителей. Газообразный аммиак реагирует с металлическим натрием с образованием натрида NaNH 2 . [31]
С хлором образуется монохлорамин .
Пятивалентный аммиак известен как λ 5 -амин, пентагидрид азота самопроизвольно разлагается на трехвалентный аммиак (λ 3 -амин) и газообразный водород при нормальных условиях. Это вещество когда-то исследовалось как возможное твердое ракетное топливо в 1966 году. [38]
Аммиак также используется для производства следующих соединений:
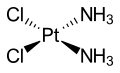
Аммиак – лиганд , образующий металлоамминные комплексы . По историческим причинам аммиак в номенклатуре координационных соединений называется аммиаком . Одним из примечательных амминных комплексов является цисплатин ( Pt(NH 3 ) 2 Cl 2 , широко используемый противораковый препарат. Амминные комплексы хрома (III) легли в основу революционной теории Альфреда Вернера о структуре координационных соединений. Вернер отметил только два изомеры ( fac- и mer- ) комплекса [CrCl 3 (NH 3 ) 3 ] могли образовываться, и пришли к выводу, что лиганды должны располагаться вокруг иона металла в вершинах октаэдра .
Аммиак образует аддукты 1:1 с различными кислотами Льюиса, такими как I 2 , фенол и Al(CH 3 ) 3 . Аммиак является твердым основанием (теория HSAB), и его параметры E и C составляют EB = 2,31 и CB = 2,04. Его относительная донорная сила по отношению к ряду кислот по сравнению с другими основаниями Льюиса может быть проиллюстрирована графиками CB .
Аммиак и соли аммония можно легко обнаружить по очень мелким следам, добавив раствор Несслера , который дает отчетливое желтое окрашивание в присутствии малейших следов аммиака или солей аммония. Количество аммиака в солях аммония можно оценить количественно путем перегонки солей с гидроксидом натрия (NaOH) или калия (KOH), при этом выделившийся аммиак абсорбируется известным объемом стандартной серной кислоты , а избыток кислоты затем определяют объемно ; или аммиак может быть абсорбирован соляной кислотой , и образовавшийся таким образом хлорид аммония выпадет в осадок в виде гексахлорплатината аммония , [NH 4 ] 2 [PtCl 6 ] . [39]
Серные палочки сжигают для обнаружения небольших утечек в промышленных холодильных системах с аммиаком. Большие количества можно обнаружить, нагревая соли с едкой щелочью или негашеной известью , при этом сразу же станет заметен характерный запах аммиака. [39] Аммиак является раздражителем, и раздражение усиливается с увеличением концентрации; допустимый предел воздействия составляет 25 частей на миллион , смертельная концентрация выше 500 частей на миллион. [40] [ необходимы разъяснения ] Более высокие концентрации с трудом обнаруживаются обычными детекторами, тип детектора выбирается в соответствии с требуемой чувствительностью (например, полупроводниковый, каталитический, электрохимический). Предложены голографические датчики для обнаружения концентраций до 12,5% по объему. [41]
Аммиачный азот (NH 3 –N) – это мера, обычно используемая для определения количества ионов аммония , полученных естественным путем из аммиака и возвращающихся в аммиак посредством органических процессов в воде или сточных жидкостях. Это мера, используемая в основном для количественной оценки значений в системах очистки сточных вод и воды , а также в качестве меры состояния природных и искусственных запасов воды. Измеряется в единицах мг/л ( миллиграмм на литр ).


Древнегреческий историк Геродот упоминал, что в районе Ливии, населенном народом, называемым «аммонийцами», были обнажения соли (ныне оазис Сива на северо-западе Египта, где до сих пор существуют соленые озера). [42] [43] Греческий географ Страбон также упомянул соль из этого региона. Однако древние авторы Диоскорид , Апиций , Арриан , Синезий и Аэций из Амиды описали эту соль как образующую прозрачные кристаллы, которые можно было использовать для приготовления пищи и которые по сути представляли собой каменную соль . [44] Hammoniacus sal появляется в трудах Плиния , [45] хотя неизвестно, идентичен ли этот термин более современному аммиачному сала (хлориду аммония). [21] [46] [47]
В результате ферментации мочи бактериями образуется раствор аммиака ; поэтому ферментированная моча использовалась в классической античности для стирки тканей и одежды, для удаления волос со шкур при подготовке к дублению, в качестве протравы для окраски ткани и для удаления ржавчины с железа. [48] Древние стоматологи также использовали его для мытья зубов. [49] [50] [51]
В форме нашатырного спирта (نشادر, нушадир ) аммиак имел важное значение для мусульманских алхимиков . Он упоминается в «Книге камней» , вероятно, написанной в 9 веке и приписываемой Джабиру ибн Хайяну . [52] Это было также важно для европейских алхимиков 13-го века, о чем упоминал Альберт Великий . [21] В средние века его также использовали красильщики в виде ферментированной мочи для изменения цвета растительных красителей. В XV веке Василий Валентин показал, что аммиак можно получить действием щелочей на нашатырный спирт. [53] В более поздний период, когда нашатырный спирт был получен путем перегонки копыт и рогов быков и нейтрализации полученного карбоната соляной кислотой , к аммиаку стали применять название «дух оленьего рога». [21] [54]
Газообразный аммиак был впервые выделен Джозефом Блэком в 1756 году путем реакции нашатырного спирта ( хлорида аммония ) с прокаленной магнезией ( оксидом магния ). [55] [56] Он был снова выделен Питером Вульфом в 1767 году, [57] [58] Карлом Вильгельмом Шееле в 1770 году [59] и Джозефом Пристли в 1773 году и назван им «щелочным воздухом». [21] [60] Одиннадцать лет спустя, в 1785 году, Клод Луи Бертолле установил его состав. [61] [21]
Процесс Габера -Боша для производства аммиака из азота воздуха был разработан Фрицем Хабером и Карлом Бошем в 1909 году и запатентован в 1910 году . Впервые он был использован в промышленном масштабе в Германии во время Первой мировой войны [62] после союзнических исследований. блокада, прекратившая поставки нитратов из Чили . Аммиак использовался для производства взрывчатых веществ для поддержания военных действий. [63]
До появления природного газа водород в качестве предшественника производства аммиака производился электролизом воды или с использованием хлорщелочного процесса .
С появлением сталелитейной промышленности в 20 веке аммиак стал побочным продуктом производства коксующегося угля.
В США по состоянию на 2019 год [обновлять]около 88% аммиака использовалось в качестве удобрений в виде его солей, растворов или безводно. [64] При внесении в почву он помогает повысить урожайность таких культур , как кукуруза и пшеница . [65] 30% сельскохозяйственного азота, применяемого в США, находится в форме безводного аммиака, а во всем мире ежегодно вносится 110 миллионов тонн. [66] Растворы аммиака в концентрации от 16% до 25% используются в бродильной промышленности в качестве источника азота для микроорганизмов и для регулирования pH во время ферментации. [67]
Благодаря свойствам испарения аммиака он является полезным хладагентом . [62] Он широко использовался до популяризации хлорфторуглеродов (фреонов). Безводный аммиак широко используется в промышленных холодильных установках и на хоккейных катках из-за его высокой энергоэффективности и низкой стоимости. Он страдает от недостатка токсичности и требует наличия устойчивых к коррозии компонентов, что ограничивает его бытовое и мелкомасштабное использование. Наряду с применением в современной парокомпрессионной холодильной технике он применяется в смеси с водородом и водой в абсорбционных холодильниках . Цикл Калины , который приобретает все большее значение для геотермальных электростанций, зависит от широкого диапазона кипения смеси аммиака и воды.
Аммиачная охлаждающая жидкость также используется в радиаторах на борту Международной космической станции в контурах, которые используются для регулирования внутренней температуры и позволяют проводить температурно-зависимые эксперименты. [68] [69] Аммиак находится под достаточным давлением, чтобы оставаться жидким на протяжении всего процесса. Однофазные системы аммиачного охлаждения также обслуживают силовую электронику в каждой паре солнечных батарей.
Потенциальная важность аммиака как хладагента возросла с открытием того, что выделяемые ХФУ и ГФУ являются мощными и стабильными парниковыми газами. [70]
Еще в 1895 году было известно, что аммиак является «сильным антисептиком ... для консервации говяжьего чая (бульона) требуется 1,4 грамма на литр ». [71] В одном исследовании безводный аммиак уничтожил 99,999% зоонозных бактерий в трех типах кормов для животных , но не в силосе . [72] [73] Безводный аммиак в настоящее время используется в коммерческих целях для уменьшения или устранения микробного загрязнения говядины . [74] [75] Нежирная говядина с мелкой текстурой (широко известная как « розовая слизь ») в мясной промышленности изготавливается из жирных говяжьих обрезков (около 50–70% жира) путем удаления жира с помощью нагревания и центрифугирования , а затем его обработки. с аммиаком для уничтожения кишечной палочки . Министерство сельского хозяйства США признало этот процесс эффективным и безопасным на основании исследования, которое показало, что лечение снижает количество кишечной палочки до необнаружимого уровня. [76] Были опасения по поводу безопасности этого процесса, а также жалобы потребителей на вкус и запах говядины, обработанной аммиаком. [77]

Аммиак использовался в качестве топлива и является предлагаемой альтернативой ископаемому топливу и водороду. Будучи жидким при температуре окружающей среды под собственным давлением паров и обладая высокой объемной и весовой плотностью энергии, аммиак считается подходящим носителем водорода [78] и может быть дешевле, чем прямая транспортировка жидкого водорода. [79]
По сравнению с водородом аммиак легче хранить. По сравнению с водородом в качестве топлива , аммиак гораздо более энергоэффективен, и его можно производить, хранить и доставлять с гораздо меньшими затратами, чем водород, который необходимо хранить в сжатом виде или в виде криогенной жидкости. [80] [81] Плотность сырой энергии жидкого аммиака составляет 11,5 МДж/л, [80] что составляет примерно треть плотности дизельного топлива .
Аммиак можно преобразовать обратно в водород для использования в водородных топливных элементах, или его можно использовать непосредственно в высокотемпературных твердооксидных топливных элементах с прямым аммиаком, чтобы обеспечить эффективные источники энергии, не выделяющие парниковых газов . [82] [83] Конверсия аммиака в водород может быть достигнута с помощью процесса амида натрия [84] или каталитического разложения аммиака с использованием твердых катализаторов. [85]

Были предложены и иногда используются аммиачные двигатели или аммиачные двигатели, использующие аммиак в качестве рабочей жидкости . [86] Принцип аналогичен тому, который используется в беспожарном локомотиве , но в качестве рабочей жидкости используется аммиак, а не пар или сжатый воздух. Аммиачные двигатели экспериментально использовались в 19 веке Голдсуорси Герни в Великобритании и на трамвайной линии Сент-Чарльз-авеню в Новом Орлеане в 1870-х и 1880-х годах [87] , а во время Второй мировой войны аммиак использовался для питания автобусов в Бельгии . [88]
Аммиак иногда предлагается в качестве практической альтернативы ископаемому топливу для двигателей внутреннего сгорания . [88] [89] [90] [91] Однако аммиак не может быть легко использован в существующих двигателях с циклом Отто из-за его очень узкого диапазона воспламеняемости. Несмотря на это, было проведено несколько тестов. [92] [93] [94] Высокое октановое число 120 [95] и низкая температура пламени [96] позволяют использовать высокие степени сжатия без ущерба для высокого образования NO x . Поскольку аммиак не содержит углерода, при его сжигании не могут образовываться углекислый газ , окись углерода , углеводороды или сажа .
Производство аммиака в настоящее время создает 1,8% мировых выбросов CO2 . «Зеленый аммиак» — это аммиак, полученный с использованием зеленого водорода (водород, полученный путем электролиза), тогда как «синий аммиак» — это аммиак, полученный с использованием синего водорода (водород, полученный путем паровой конверсии метана, при котором углекислый газ улавливается и хранится). [97]
Ракетные двигатели также работают на аммиаке. Ракетный двигатель Reaction Motors XLR99 , который приводил в действие гиперзвуковой исследовательский самолет X-15, использовал жидкий аммиак. Хоть и не такое мощное, как другие виды топлива, оно не оставляло сажи в многоразовом ракетном двигателе, а его плотность примерно соответствовала плотности окислителя — жидкого кислорода , что упрощало конструкцию самолета.
В 2020 году Саудовская Аравия отправила в Японию 40 тонн жидкого «голубого аммиака» для использования в качестве топлива. [98] Он производится как побочный продукт нефтехимической промышленности и может сжигаться без выделения парниковых газов . Его плотность энергии по объему почти вдвое превышает плотность жидкого водорода. Если процесс его создания можно будет масштабировать за счет использования исключительно возобновляемых ресурсов, производства зеленого аммиака, это может существенно повлиять на предотвращение изменения климата . [99] Компания ACWA Power и город Неом объявили о строительстве в 2020 году завода по производству экологически чистого водорода и аммиака. [100]
Зеленый аммиак рассматривается как потенциальное топливо для будущих контейнеровозов. В 2020 году компании DSME и MAN Energy Solutions объявили о строительстве корабля на основе аммиака, DSME планирует коммерциализировать его к 2025 году. [101] Также изучается возможность использования аммиака в качестве потенциального альтернативного топлива для авиационных реактивных двигателей . [102]
Япония намерена реализовать план по разработке технологии совместного сжигания аммиака, которая может увеличить использование аммиака в производстве электроэнергии, в рамках усилий по оказанию помощи отечественным и другим азиатским коммунальным предприятиям в ускорении их перехода к углеродной нейтральности . [103] В октябре 2021 года состоялась первая Международная конференция по топливному аммиаку (ICFA2021). [104] [105]
В июне 2022 года корпорации IHI удалось сократить выбросы парниковых газов более чем на 99% при сжигании жидкого аммиака в газовой турбине мощностью 2000 киловатт, обеспечив производство электроэнергии без выбросов CO2 . [106] В июле 2022 года на первом энергетическом совещании группы безопасности страны «четверки» : Япония, США, Австралия и Индия договорились содействовать технологическому развитию чистого сжигания водорода и аммиака в качестве топлива. [107] Однако по состоянию на 2022 год будут производиться [обновлять]значительные количества NO x . [108] Закись азота также может быть проблемой. [109]
При высокой температуре и в присутствии подходящего катализатора аммиак разлагается на составляющие элементы. [110] Разложение аммиака представляет собой слегка эндотермический процесс, требующий 23 кДж/моль (5,5 ккал/моль ) аммиака и приводящий к образованию газообразного водорода и азота .

Бытовой «аммиак» представляет собой раствор NH 3 в воде и используется в качестве универсального очистителя для многих поверхностей. Поскольку аммиак придает блеск относительно без разводов, одним из наиболее распространенных способов его применения является очистка стекла , фарфора и нержавеющей стали . Его также часто используют для чистки духовок и замачивания предметов, чтобы удалить засохшую грязь. Концентрация бытового аммиака по весу варьируется от 5% до 10% аммиака. [111] Производители чистящих средств в США обязаны предоставлять паспорт безопасности продукта , в котором указана используемая концентрация. [112]
Растворы аммиака (5–10% по массе) используются в качестве бытовых чистящих средств, особенно для стекла. Эти растворы раздражают глаза и слизистые оболочки (дыхательных и пищеварительных путей) и в меньшей степени кожу. Эксперты советуют соблюдать осторожность и не смешивать химическое вещество с жидкостью, содержащей отбеливатель , из-за опасности образования токсичного газа хлорамина. Смешивание с хлорсодержащими продуктами или сильными окислителями, такими как бытовой отбеливатель, может привести к образованию токсичных паров хлорамина . [113]
Эксперты также предупреждают, что не следует использовать чистящие средства на основе аммиака (например, средства для мытья стекол или окон) для очистки сенсорных экранов автомобилей из-за риска повреждения антибликового покрытия и покрытия, защищающего от отпечатков пальцев. [114]
Аммиак используется для очистки SO 2 от сжигания ископаемого топлива, а полученный продукт преобразуется в сульфат аммония для использования в качестве удобрения. Аммиак нейтрализует загрязняющие вещества оксиды азота ( NOx ) , выбрасываемые дизельными двигателями. Эта технология, называемая SCR ( селективное каталитическое восстановление ), основана на катализаторе на основе ванадия . [115]
Аммиак можно использовать для смягчения последствий газообразных разливов фосгена . [116]

Аммиак, как пар, выделяемый нюхательными солями , нашел широкое применение в качестве стимулятора дыхания. Аммиак обычно используется при незаконном производстве метамфетамина посредством восстановления по методу Берча . [118] Метод Берча получения метамфетамина опасен, поскольку щелочной металл и жидкий аммиак чрезвычайно реакционноспособны, а температура жидкого аммиака делает его восприимчивым к взрывному кипению при добавлении реагентов. [119]
Жидкий аммиак применяют для обработки хлопчатобумажных материалов, придавая им свойства, подобные мерсеризации , с помощью щелочей. В частности, его используют для предварительной стирки шерсти. [120]
При стандартной температуре и давлении аммиак менее плотен, чем атмосфера, и его подъемная сила составляет примерно 45–48% от подъемной силы водорода или гелия . Аммиак иногда использовался для наполнения воздушных шаров в качестве подъемного газа . Из-за относительно высокой температуры кипения (по сравнению с гелием и водородом) аммиак потенциально можно охлаждать и сжижать на борту дирижабля для уменьшения подъемной силы и добавления балласта (и возвращать в газ для увеличения подъемной силы и уменьшения балласта). [121]
Аммиак использовался для затемнения распиленного белого дуба в мебели в стиле «Искусство и ремесло» и «Миссия». Пары аммиака вступают в реакцию с натуральными дубильными веществами древесины , вызывая ее изменение цвета. [122]

Управление по охране труда США (OSHA) установило 15-минутный предел воздействия газообразного аммиака в размере 35 частей на миллион по объему в окружающем воздухе и 8-часовой предел воздействия 25 частей на миллион по объему. [124] Национальный институт охраны труда (NIOSH) недавно снизил IDLH (непосредственно опасный для жизни и здоровья, уровень, которому здоровый работник может подвергаться воздействию в течение 30 минут, не испытывая необратимых последствий для здоровья) с 500 до 300 на основе на недавних, более консервативных интерпретациях оригинального исследования 1943 года. Другие организации имеют разные уровни воздействия. Стандарты ВМС США [Бюро судоходства США, 1962] максимально допустимые концентрации (ПДК): при непрерывном воздействии (60 дней) — 25 частей на миллион; для экспозиции 1 час составляет 400 ppm. [125]
Пары аммиака имеют резкий, раздражающий, резкий запах, который предупреждает о потенциально опасном воздействии. Средний порог запаха составляет 5 частей на миллион, что значительно ниже любой опасности или ущерба. Воздействие очень высоких концентраций газообразного аммиака может привести к повреждению легких и смерти. [124] Аммиак регулируется в США как негорючий газ, но он соответствует определению материала, токсичного при вдыхании, и требует разрешения на опасную безопасность при транспортировке в количествах, превышающих 3500 галлонов США (13000 л; 2900 имп. Гал). [126]
Жидкий аммиак опасен тем, что он гигроскопичен и может вызвать едкие ожоги . Дополнительную информацию см. в разделе Газовоз § Влияние на здоровье конкретных грузов, перевозимых на газовозах .
Токсичность растворов аммиака обычно не вызывает проблем у людей и других млекопитающих, поскольку существует особый механизм предотвращения его накопления в кровотоке. Аммиак преобразуется в карбамоилфосфат под действием фермента карбамоилфосфатсинтетазы , а затем поступает в цикл мочевины , где либо включается в аминокислоты , либо выводится с мочой. [127] У рыб и земноводных этот механизм отсутствует, поскольку они обычно могут выводить аммиак из своего организма путем прямого выведения. Аммиак даже в разбавленных концентрациях высокотоксичен для водных животных, поэтому его относят к опасным для окружающей среды . Атмосферный аммиак играет ключевую роль в образовании мелких твердых частиц . [128]
Аммиак входит в состав табачного дыма . [129]
Аммиак присутствует в потоках сточных вод коксования как жидкий побочный продукт производства кокса из угля . [130] В некоторых случаях аммиак сбрасывается в морскую среду , где он действует как загрязнитель. Сталелитейный завод Уайалла в Южной Австралии является одним из примеров предприятия по производству кокса, которое сбрасывает аммиак в морские воды. [131]
Считается, что токсичность аммиака является причиной необъяснимых потерь в рыбоводных заводах . Избыток аммиака может накапливаться и вызывать изменение обмена веществ или повышение pH организма подвергшегося воздействию организма. Толерантность варьируется в зависимости от вида рыб. [132] При более низких концентрациях, около 0,05 мг/л, неионизированный аммиак вреден для видов рыб и может привести к замедлению роста и конверсии корма, снижению плодовитости и фертильности, а также увеличению стресса и восприимчивости к бактериальным инфекциям и заболеваниям. [133] Под воздействием избытка аммиака рыбы могут страдать от потери равновесия, повышенной возбудимости, повышенной дыхательной активности и поглощения кислорода, а также учащенного сердцебиения. [132] При концентрациях, превышающих 2,0 мг/л, аммиак вызывает повреждение жабр и тканей, сильную летаргию, судороги, кому и смерть. [132] [134] Эксперименты показали, что смертельная концентрация для различных видов рыб колеблется от 0,2 до 2,0 мг/л. [134]
Зимой, когда животным аквакультуры вводят уменьшенное количество корма, уровень аммиака может быть выше. Более низкие температуры окружающей среды снижают скорость фотосинтеза водорослей, поэтому присутствующие водоросли удаляют меньше аммиака. В условиях аквакультуры, особенно в крупных масштабах, не существует быстродействующего средства борьбы с повышенным уровнем аммиака. Для уменьшения вреда, наносимого выращиваемой рыбе [134] и окружающей среде в системах открытой воды, рекомендуется применять профилактику, а не исправление .
Подобно пропану , безводный аммиак кипит при температуре ниже комнатной при атмосферном давлении. Для хранения жидкости подходит резервуар для хранения, рассчитанный на давление 250 фунтов на квадратный дюйм (1,7 МПа ). [135] Аммиак используется во многих различных промышленных применениях, требующих резервуаров для хранения из углеродистой или нержавеющей стали. Аммиак с содержанием воды не менее 0,2% по весу не вызывает коррозии углеродистой стали. Резервуары для хранения из углеродистой стали NH 3 с содержанием воды 0,2% по весу или более могут прослужить более 50 лет. [136] Эксперты предупреждают, что соединения аммония не должны вступать в контакт с основаниями (кроме случаев запланированной и ограниченной реакции), так как могут быть выброшены опасные количества газообразного аммиака.
.jpg/440px-Ammonia_solution_(25-28%).jpg)
Опасность растворов аммиака зависит от концентрации: «разбавленные» растворы аммиака обычно составляют 5–10% по массе (< 5,62 моль/л); «концентрированные» растворы обычно готовят с концентрацией >25% по весу. 25%-ный (по массе) раствор имеет плотность 0,907 г/см 3 , а раствор с меньшей плотностью будет более концентрированным. Классификация растворов аммиака Европейского Союза приведена в таблице.
Пары аммиака из концентрированных растворов аммиака сильно раздражают глаза и дыхательные пути , и эксперты предупреждают, что с этими растворами следует обращаться только в вытяжном шкафу . Насыщенные растворы ('0,880' - см. § Свойства ) могут создавать значительное давление внутри закрытой бутылки в теплую погоду, поэтому эксперты также предупреждают, что бутылку следует открывать с осторожностью. Обычно это не проблема для решений 25% («0,900»).
Специалисты предупреждают, что растворы аммиака нельзя смешивать с галогенами , так как образуются токсичные и/или взрывоопасные продукты. Специалисты также предупреждают, что длительный контакт растворов аммиака с солями серебра , ртути или йодида также может привести к образованию взрывоопасных продуктов: такие смеси часто образуются при качественном неорганическом анализе , и их необходимо слегка подкислять, но не концентрировать (<6% по массе). v) перед утилизацией после завершения испытания.
Безводный аммиак относят к токсичным ( Т ) и опасным для окружающей среды ( Н ). Газ горюч ( температура самовоспламенения : 651 °С) и может образовывать взрывоопасные смеси с воздухом (16–25%). Допустимый предел воздействия (PEL) в США составляет 50 частей на миллион (35 мг/м 3 ), тогда как концентрация IDLH оценивается в 300 частей на миллион. Повторное воздействие аммиака снижает чувствительность к запаху газа: обычно запах можно обнаружить при концентрации менее 50 частей на миллион, но люди с десенсибилизацией могут не обнаружить его даже при концентрации 100 частей на миллион. Безводный аммиак разъедает медь и цинксодержащие сплавы , что делает латунные фитинги непригодными для работы с газом. Жидкий аммиак также может разъедать резину и некоторые пластмассы.
Аммиак бурно реагирует с галогенами . Трийодид азота , первичное взрывчатое вещество , образуется при контакте аммиака с йодом . Аммиак вызывает взрывную полимеризацию оксида этилена . Он также образует взрывчатые гремящие соединения с соединениями золота , серебра , ртути , германия или теллура и со стибином . Сообщалось также о сильных реакциях с ацетальдегидом , растворами гипохлорита , феррицианидом калия и пероксидами .
Аммиак имеет один из самых высоких показателей производства среди всех неорганических химических веществ. Производство иногда выражается в терминах «фиксированного азота». Мировое производство оценивается в 160 миллионов тонн в 2020 году (147 тонн фиксированного азота). [138] На долю Китая пришлось 26,5% от этого показателя, за ним следуют Россия с 11,0%, США с 9,5% и Индия с 8,3%. [138]
До начала Первой мировой войны большая часть аммиака получалась путем сухой перегонки [139] азотистых отходов растительного и животного происхождения, в том числе верблюжьего навоза , где его перегоняли восстановлением азотистой кислоты и нитритов водородом; кроме того, его получали перегонкой угля , а также разложением солей аммония щелочными гидроксидами [140] , такими как негашеная известь : [21]
Для мелкомасштабного лабораторного синтеза можно нагреть мочевину и гидроксид кальция или гидроксид натрия :

Процесс Габера , [ 141] также называемый процессом Габера-Боша, является основным промышленным методом производства аммиака . [142] [143] Немецкие химики Фриц Габер и Карл Бош разработали его в первом десятилетии 20-го века. В этом процессе атмосферный азот (N 2 ) преобразуется в аммиак (NH 3 ) путем реакции с водородом (H 2 ) с использованием металлического железо-катализатора при высоких температурах и давлениях. Эта реакция является слегка экзотермической (т.е. она выделяет энергию), а это означает, что реакция протекает при более низких температурах [144] и более высоких давлениях. [145] Это уменьшает энтропию , усложняя процесс. Водород производится посредством парового риформинга с последующим итеративным замкнутым циклом реакции водорода с азотом с получением аммиака.
Первичная реакция:
Аммиак можно синтезировать электрохимически. Единственными необходимыми ресурсами являются источники азота (потенциально атмосферного) и водорода (воды), позволяющие производить их в месте использования. Доступность возобновляемых источников энергии создает возможность производства с нулевым уровнем выбросов. [149] [150]
« Зеленый аммиак» — это название аммиака, получаемого из водорода, который, в свою очередь, производится из безуглеродных источников, таких как электролиз воды. Аммиак из этого источника можно использовать в качестве жидкого топлива с нулевым вкладом в глобальное изменение климата .
Другой режим электрохимического синтеза включает восстановительное образование нитрида лития , который при наличии источника протонов может протонироваться до аммиака . В качестве такого источника использовался этанол , хотя он может разлагаться. О первом использовании этой химии было сообщено в 1930 году, когда растворы лития в этаноле использовались для производства аммиака при давлении до 1000 бар. [151] В 1994 году Цунето и др. использовал электроосаждение лития в тетрагидрофуране для синтеза аммиака при более умеренных давлениях с разумной фарадеевской эффективностью . [152] С тех пор другие исследования использовали систему этанол-тетрагидрофуран для электрохимического синтеза аммиака. [153] [154] В 2019 году Лазовский и др. предложил механизм, объясняющий наблюдаемую кинетику образования аммиака. [153]
В 2020 году Лазовский и др. разработали газодиффузионный электрод , независимый от растворителей, для улучшения транспорта азота к химически активному литию. В ходе исследования наблюдалась скорость производства NH 3 до 30 ± 5 нмоль/с/см 2 и фарадеевская эффективность до 47,5 ± 4% при температуре окружающей среды и давлении 1 бар. [155]
В 2021 году Сурианто и др. заменил этанол тетраалкилфосфониевой солью . Этот катион может стабильно подвергаться циклам депротонирования-репротонации, одновременно повышая ионную проводимость среды . [156] В ходе исследования наблюдалась скорость производства NH 3 53 ± 1 нмоль/с/см 2 при фарадеевской эффективности 69 ± 1% при парциальном давлении водорода 0,5 бар и азоте 19,5 бар при температуре окружающей среды. [156]

Аммиак необходим для жизни. [158] Например, он необходим для образования аминокислот и нуклеиновых кислот , фундаментальных строительных блоков жизни. Однако аммиак весьма токсичен. Таким образом, природа использует носители аммиака. Внутри клетки эту роль выполняет глутамат . В кровотоке глютамин является источником аммиака. [159]
Этаноламин, необходимый для клеточных мембран, является субстратом этаноламин-аммиак-лиазы , которая производит аммиак: [160]
Аммиак является одновременно метаболическими отходами и метаболическим вкладом во всей биосфере . Это важный источник азота для живых систем. Хотя атмосферный азот в изобилии (более 75%), немногие живые существа способны использовать атмосферный азот в его двухатомной форме — газе N 2 . Следовательно, фиксация азота необходима для синтеза аминокислот , которые являются строительными блоками белка . Некоторые растения полагаются на аммиак и другие азотистые отходы, попадающие в почву в результате разложения веществ. Другие, такие как азотфиксирующие бобовые , извлекают выгоду из симбиотических отношений с бактериями -ризобиями , которые создают аммиак из атмосферного азота. [161]
Для человека вдыхание аммиака в высоких концентрациях может быть смертельным. Воздействие аммиака может вызвать головные боли , отеки , нарушение памяти, судороги и кому , поскольку он нейротоксичен по своей природе. [162]
У некоторых организмов аммиак вырабатывается из атмосферного азота с помощью ферментов, называемых нитрогеназами . Общий процесс называется азотфиксацией . Интенсивные усилия были направлены на понимание механизма биологической фиксации азота. Научный интерес к этой проблеме обусловлен необычной структурой активного центра фермента, состоящего из ансамбля Fe 7 MoS 9 . [163]
Аммиак также является метаболическим продуктом дезаминирования аминокислот , катализируемого такими ферментами, как глутаматдегидрогеназа 1 . Выделение аммиака характерно для водных животных. У людей он быстро превращается в мочевину (в печени ), которая гораздо менее токсична, особенно менее щелочна. Эта мочевина является основным компонентом сухой массы мочи . Большинство рептилий, птиц, насекомых и улиток выделяют мочевую кислоту исключительно в виде азотистых отходов.
Аммиак играет роль как в нормальной, так и в аномальной физиологии животных . Он биосинтезируется в ходе нормального метаболизма аминокислот и токсичен в высоких концентрациях. Печень преобразует аммиак в мочевину посредством серии реакций, известных как цикл мочевины . Дисфункция печени, например, наблюдаемая при циррозе печени , может привести к повышенному количеству аммиака в крови ( гипераммониемии ). Аналогично, дефекты ферментов, ответственных за цикл мочевины, таких как орнитинтранскарбамилаза , приводят к гипераммониемии . Гипераммониемия способствует спутанности сознания и коме при печеночной энцефалопатии , а также неврологических заболеваниях, часто встречающихся у людей с нарушениями цикла мочевины и органической ацидурией . [164]
Аммиак важен для нормального кислотно-щелочного баланса животных. После образования аммония из глутамина α-кетоглутарат может разлагаться с образованием двух ионов бикарбоната , которые затем становятся буферами для пищевых кислот. Аммоний выводится с мочой, что приводит к чистой потере кислоты. Аммиак сам по себе может диффундировать через почечные канальцы , соединяться с ионами водорода и, таким образом, способствовать дальнейшему выведению кислоты . [165]
Ионы аммония являются токсичными отходами обмена веществ у животных . У рыб и водных беспозвоночных он выделяется непосредственно в воду. У млекопитающих, акул и земноводных он превращается в цикле мочевины в мочевину , которая менее токсична и может храниться более эффективно. У птиц, рептилий и наземных улиток метаболический аммоний превращается в мочевую кислоту , которая является твердой и поэтому может выводиться из организма с минимальной потерей воды. [166]

Аммиак был обнаружен в атмосферах планет- гигантов Юпитера , Сатурна , Урана и Нептуна , наряду с другими газами, такими как метан , водород и гелий . Недра Сатурна могут содержать замороженные кристаллы аммиака. [167] Он находится на Деймосе и Фобосе – двух лунах Марса .
Аммиак был впервые обнаружен в межзвездном пространстве в 1968 году по микроволновому излучению со стороны ядра галактики . [168] Это была первая многоатомная молекула, обнаруженная таким образом. Чувствительность молекулы к широкому диапазону возбуждений и легкость ее наблюдения в ряде областей сделали аммиак одной из важнейших молекул для изучения молекулярных облаков . [169] Относительная интенсивность линий аммиака может быть использована для измерения температуры излучающей среды.
Обнаружены следующие изотопные разновидности аммиака: NH 3 , 15 NH 3 , NH 2 D , NHD 2 и ND 3 . Обнаружение трижды дейтерированного аммиака считалось неожиданностью, поскольку дейтерия относительно мало. Считается, что низкотемпературные условия позволяют этой молекуле выживать и накапливаться. [170]
С момента своего межзвездного открытия NH 3 оказался бесценным спектроскопическим инструментом в изучении межзвездной среды. Благодаря большому количеству переходов, чувствительных к широкому диапазону условий возбуждения, NH 3 широко обнаружен в астрономии – о его обнаружении сообщалось в сотнях журнальных статей. Ниже приведен образец журнальных статей, в которых освещается диапазон детекторов, которые использовались для идентификации аммиака.
Изучение межзвездного аммиака имело важное значение для ряда областей исследований в последние несколько десятилетий. Некоторые из них описаны ниже и в основном связаны с использованием аммиака в качестве межзвездного термометра.
Межзвездное содержание аммиака было измерено для различных сред. По оценкам, соотношение [ NH 3 ]/[ H 2 ] находится в диапазоне от 10 -7 в небольших темных облаках [171] до 10 -5 в плотном ядре комплекса молекулярных облаков Ориона . [172] Хотя всего было предложено 18 маршрутов образования, [173] основным механизмом образования межзвездного NH 3 является реакция:
Константа скорости k этой реакции зависит от температуры окружающей среды и имеет значение при 10 К. [174] Константу скорости рассчитывали по формуле . Для реакции первичного образования a = 1,05 × 10 −6 и B = −0,47 . Если предположитьсодержание NH + 4 и содержание электронов 10 -7 , то образование будет происходить со скоростью1,6 × 10–9 см – 3 с –1 в молекулярном облаке полной плотности10 5 см -3 . [175]
Все остальные предполагаемые реакции образования имеют константы скорости на 2–13 порядков меньше, что делает их вклад в содержание аммиака относительно незначительным. [176] В качестве примера незначительного вклада других реакций образования можно привести реакцию:
имеет константу скорости 2,2 × 10 -15 . Если предположить, что плотность H 2 равна 10 5 и соотношение [ NH 2 ]/[ H 2 ] равно 10 -7 , эта реакция протекает со скоростью 2,2 × 10 -12 , что более чем на три порядка медленнее, чем первичная реакция, описанная выше.
Некоторые из других возможных реакций образования:
Всего предложено 113 реакций, ведущих к разрушению NH 3 . Из них 39 были сведены в обширные таблицы химии соединений C, N и O. [177] В обзоре межзвездного аммиака в качестве основных механизмов диссоциации упоминаются следующие реакции: [169]
с константами скорости 4,39×10–9 [ 178] и 2,2× 10–9 [179] соответственно . Вышеупомянутые уравнения ( 1 , 2 ) выполняются со скоростью 8,8×10 -9 и 4,4×10 -13 соответственно. В этих расчетах принимались заданные константы скорости и содержания [ NH 3 ]/[ H 2 ] = 10 -5 , [ [ H 3 ] + ]/[ H 2 ] = 2×10 -5 , [ HCO + ]/[ H 2 ] = 2×10 −9 и полная плотность n = 10 5 , типичная для холодных плотных молекулярных облаков. [180] Очевидно, что среди этих двух первичных реакций уравнение ( 1 ) является доминирующей реакцией разрушения со скоростью в ≈10 000 раз быстрее, чем уравнение ( 2 ). Это связано с относительно высоким содержанием [H 3 ] + .
Радионаблюдения NH 3 на 100-метровом радиотелескопе Эффельсберг показывают, что линия аммиака разделена на две компоненты – фоновый гребень и неразрешенное ядро. Фон хорошо соответствует ранее обнаруженным местам CO. [181] 25-метровый телескоп Чилболтона в Англии обнаружил радиосигнатуры аммиака в областях H II , мазеры HNH 2 O , объекты H–H и другие объекты, связанные со звездообразованием. Сравнение ширины эмиссионных линий показывает, что турбулентные или систематические скорости не увеличиваются в центральных ядрах молекулярных облаков. [182]
Микроволновое излучение аммиака наблюдалось в нескольких галактических объектах, включая W3(OH), Орион А , W43 , W51 и пяти источниках в галактическом центре. Высокая скорость обнаружения указывает на то, что это обычная молекула в межзвездной среде и что в галактике распространены области с высокой плотностью. [183]
Наблюдения NH 3 на VLA в семи регионах с высокоскоростными газовыми истечениями выявили конденсации менее 0,1 пк в L1551, S140 и Цефее A. В Цефее А обнаружено три отдельных сгущения, одно из них имеет сильно вытянутую форму. Они могут сыграть важную роль в создании биполярного оттока в регионе. [184]
Внегалактический аммиак был получен с помощью VLA в IC 342 . Горячий газ имеет температуру выше 70 К, что было установлено по соотношению линий аммиака и, по-видимому, тесно связано с самыми внутренними частями ядерного бара, наблюдаемого в CO. [185] NH 3 также отслеживался VLA в направлении выборки из четырех галактических галактик. ультракомпактные области HII: G9,62+0,19, G10,47+0,03, G29,96-0,02 и G31,41+0,31. На основании диагностики температуры и плотности делается вывод, что в целом такие сгустки, вероятно, являются местами массивного звездообразования на ранней стадии эволюции, до развития ультракомпактной области HII. [186]
Поглощение на длине волны 2,97 микрометра, обусловленное твердым аммиаком, было зарегистрировано в межзвездных зернах объекта Беклина-Нойгебауэра и, вероятно, также в NGC 2264-IR. Это обнаружение помогло объяснить физическую форму ранее плохо изученных и связанных с ними линий поглощения льда. [187]
Спектр диска Юпитера был получен из Воздушной обсерватории Койпера и охватывает спектральный диапазон от 100 до 300 см -1 . Анализ спектра предоставляет информацию о глобальных средних свойствах газообразного аммиака и аммиачной ледяной дымки. [188]
Всего было исследовано 149 позиций темных облаков на предмет наличия «плотных ядер» с использованием вращающейся инверсионной линии (J,K) = (1,1) NH 3 . Как правило, ядра не имеют сферической формы, а соотношение сторон варьируется от 1,1 до 4,4. Также обнаружено, что ядра со звездами имеют более широкие линии, чем ядра без звезд. [189]
Аммиак был обнаружен в туманности Дракон и в одном или, возможно, двух молекулярных облаках, которые связаны с высокоширотными галактическими инфракрасными перистыми облаками . Это открытие важно, поскольку они могут представлять собой места рождения звезд B-типа с металличностью Популяции I в галактическом гало, которые могли возникнуть в галактическом диске. [190]
Балансируя вынужденное излучение со спонтанным излучением, можно построить связь между температурой возбуждения и плотностью. Более того, поскольку переходные уровни аммиака при низких температурах можно аппроксимировать двухуровневой системой, этот расчет достаточно прост. Это предположение можно применить к темным облакам, областям, предположительно имеющим чрезвычайно низкие температуры, и возможным местам будущего звездообразования. Обнаружения аммиака в темных облаках показывают очень узкие линии, что указывает не только на низкие температуры, но и на низкий уровень турбулентности внутри облаков. Расчеты соотношения линий обеспечивают измерение температуры облаков, которое не зависит от предыдущих наблюдений CO. Наблюдения за аммиаком согласуются с измерениями CO при температуре вращения ≈10 К. Благодаря этому можно определить плотности, которые, как было рассчитано, находятся в диапазоне от 10 4 до 10 5 см -3 в темных облаках. Картирование NH 3 дает типичные размеры облаков 0,1 пк и массу около 1 солнечной массы. Эти холодные, плотные ядра являются местами будущего звездообразования.
Ультракомпактные области HII являются одними из лучших индикаторов звездообразования большой массы. Плотный материал, окружающий области UCHII, вероятно, в основном молекулярный. Поскольку полное изучение процесса формирования массивных звезд обязательно включает в себя облако, из которого образовалась звезда, аммиак является бесценным инструментом в понимании окружающего ее молекулярного материала. Поскольку этот молекулярный материал можно пространственно разрешить, можно ограничить источники нагрева/ионизации, температуру, массу и размеры областей. Компоненты скорости с доплеровским сдвигом позволяют разделить отдельные области молекулярного газа, которые могут отслеживать потоки и горячие ядра, возникающие из формирующихся звезд.
Аммиак был обнаружен во внешних галактиках [191] [192] и, измеряя одновременно несколько линий, можно напрямую измерить температуру газа в этих галактиках. Отношения линий подразумевают, что температура газа теплая (≈50 К), происходящая из плотных облаков размером в десятки парсеков. Эта картина согласуется с картиной внутри нашей галактики Млечный Путь – вокруг вновь формирующихся звезд формируются горячие плотные молекулярные ядра, заключенные в более крупные облака молекулярного материала размером в несколько сотен парсеков (гигантские молекулярные облака; GMC).