В биомедицинском контексте биомаркер или биологический маркер — это измеримый индикатор некоторого биологического состояния или состояния. Биомаркеры часто измеряются и оцениваются с использованием крови, мочи или мягких тканей [1] для изучения нормальных биологических процессов , патогенных процессов или фармакологических реакций на терапевтическое вмешательство . [2] Биомаркеры используются во многих научных областях .
Биомаркеры, используемые в медицинской сфере, являются частью относительно нового клинического инструментария, классифицированного по их клиническому применению. Четыре основных класса — это молекулярные, физиологические, гистологические и рентгенографические биомаркеры. [3] Все четыре типа биомаркеров играют клиническую роль в сужении или руководстве решениями о лечении и следуют подкатегории предиктивных, прогностических или диагностических.
Прогностические молекулярные, клеточные или визуализирующие биомаркеры, прошедшие проверку, могут служить методом прогнозирования клинических результатов. Прогностические биомаркеры используются для оптимизации идеальных методов лечения и часто указывают на вероятность получения пользы от определенной терапии. Например, молекулярные биомаркеры, расположенные на стыке молекулярной архитектуры процесса, специфичной для патологии, и механизма действия препарата, обещают улавливать аспекты, позволяющие оценить индивидуальный ответ на лечение. [4] Это предлагает двойной подход как к наблюдению тенденций в ретроспективных исследованиях, так и к использованию биомаркеров для прогнозирования результатов. Например, при метастатическом колоректальном раке прогностические биомаркеры могут служить способом оценки и улучшения показателей выживаемости пациентов, а в индивидуальном сценарии они могут служить способом избавления пациентов от ненужной токсичности, которая возникает из-за планов лечения рака. [5]
Распространенными примерами прогностических биомаркеров являются такие гены, как ER, PR и HER2/neu при раке молочной железы, белок слияния BCR-ABL при хроническом миелоидном лейкозе, мутации c-KIT при опухолях GIST и мутации EGFR1 при немелкоклеточном раке легких. [6]
Диагностические биомаркеры, которые соответствуют бремени доказательства, могут сыграть роль в сужении диагноза. Это может привести к диагностике, которая будет значительно более специфична для отдельных пациентов.
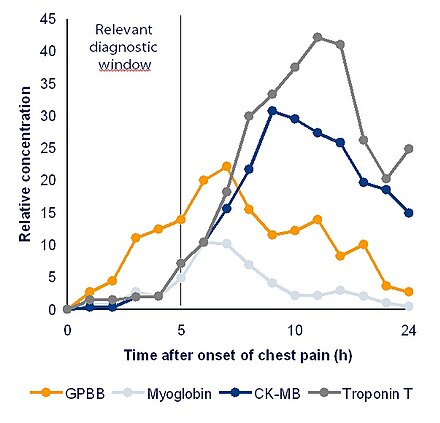
Биомаркер может быть отслеживаемым веществом, которое вводится в организм как средство для изучения функции органа или других аспектов здоровья. [7]
Это также может быть вещество, обнаружение которого указывает на определенное состояние заболевания, например, наличие антитела может указывать на инфекцию . [7] Более конкретно, биомаркер указывает на изменение экспрессии или состояния белка, которое коррелирует с риском или прогрессированием заболевания, или с восприимчивостью заболевания к данному лечению. [7]
Одним из примеров часто используемого биомаркера в медицине является простатический специфический антиген (ПСА). Этот маркер можно измерить как показатель размера простаты, при этом быстрые изменения могут указывать на рак. Самым крайним случаем было бы обнаружение мутантных белков в качестве специфичных для рака биомаркеров с помощью мониторинга селективных реакций (SRM), поскольку мутантные белки могут исходить только из существующей опухоли, что в конечном итоге обеспечивает наилучшую специфичность для медицинских целей. [8]
Примером может служить биомаркерный тест на черепно-мозговую травму (ЧМТ) в крови, состоящий из измерения уровней нейрональной убиквитин-карбокситерминальной гидролазы L1 (UCH-L1) и глиального фибриллярного кислого белка (GFAP) для помощи в диагностике наличия черепных повреждений у пациентов с черепно-мозговой травмой средней и легкой степени тяжести, которые в противном случае можно диагностировать только с помощью КТ головы. [9]
Другим примером является KRAS, онкоген , который кодирует ГТФазу, участвующую в нескольких путях передачи сигнала . Биомаркеры для точной онкологии обычно используются в молекулярной диагностике хронического миелоидного лейкоза , рака толстой кишки , молочной железы и легких , а также меланомы . [10]
Цифровые биомаркеры — это новая развивающаяся область биомаркеров, в основном собираемая интеллектуальными биосенсорами . [11] До сих пор цифровые биомаркеры были сосредоточены на мониторинге жизненно важных параметров, таких как данные акселерометра и частота сердечных сокращений [12] [13] , а также речи . [14] Новые неинвазивные молекулярные цифровые биомаркеры становятся все более доступными, например, с помощью анализа пота на коже ( интернет-судорология ), которые можно рассматривать как цифровые биомаркеры следующего поколения. [15] Сбор и отслеживание цифровых биомаркеров стали более доступными с развитием смартфонов и носимых устройств . Например, при болезни Паркинсона (БП) постукивание пальцем по мобильному телефону с помощью приложений для подсчета использовалось в качестве метода (само)оценки брадикинезии и эффективности лекарств. [16]
Цифровые биомаркеры в настоящее время используются в сочетании с искусственным интеллектом (ИИ) для распознавания симптомов легкого когнитивного нарушения (ЛКР). [17] Одним из основных современных применений цифровых биомаркеров является отслеживание регулярной мозговой активности. Конкретные нейронные показатели могут быть измерены устройствами для оценки пациентов на предмет любых нейроаномалий. Собранные данные могут определить вероятность заболевания или состояние пациента. [18] Пока пациенты выполняют повседневные задачи (ППР), компьютеры используют машинное обучение для наблюдения и обнаружения любых отклонений от нормального поведения. Эти маркеры используются в качестве признаков или индикаторов когнитивного снижения. [17]
Прогностический биомаркер предоставляет информацию об общем результате для пациента, независимо от какого-либо лечения или терапевтического вмешательства. [6] Одним из примеров прогностических биомаркеров в клинических исследованиях является использование мутировавшего PIK3CA при изучении метастатического рака молочной железы. Как показано на графике , мутация является прогностической, поскольку ее присутствие у пациента приводит к одному и тому же результату независимо от используемого метода лечения. Женщины, у которых была мутация PIK3CA до лечения, имели самый низкий средний показатель выживаемости. Снижение в группах, содержащих мутант, происходило быстрее и гораздо более круто. Независимая природа прогностического фактора позволяет исследователю изучать заболевание или состояние в его естественном состоянии. Это облегчает наблюдение за этими аномальными биологическими процессами и размышления о том, как их исправить. Прогностические факторы часто используются в сочетании с прогностическими переменными в терапевтических исследованиях, чтобы изучить, насколько эффективны различные методы лечения при лечении определенных заболеваний или рака. В отличие от предиктивных биомаркеров, прогностические не опираются на какие-либо объясняющие переменные, что позволяет проводить независимое исследование основного заболевания или состояния. [19]
Пищевые биомаркеры (биохимические маркеры потребления) используются для оценки потребления пищи в исследованиях питания , в частности, в эпидемиологии питания , а также в других дисциплинах, таких как археология , где требуется надежная информация о питании. [20] [21] Пищевым биомаркером может быть любой образец, который отражает потребление пищевых компонентов и является достаточно специфичным. [22] [23] Многие биомаркеры получены из соединений, содержащихся в пищевых продуктах, таких как сахар или фитохимические вещества, или их комбинаций с использованием метаболомики . [20] [24] Другим типом пищевых биомаркеров, в частности, распространенных в археологии , являются стабильные изотопные соотношения . [25]
Биомаркеры для точной медицины являются частью относительно нового поведенческого и клинического инструментария. С точки зрения поведенческого инструментария биомаркеры все чаще используются для мотивации изменения поведения в отношении здоровья, особенно в исследованиях диабета , сердечно-сосудистых заболеваний и ожирения . [26] Большинство исследований на сегодняшний день используют биомаркеры, которые легко измерить, включая вес, артериальное давление и уровень глюкозы; эти биомаркеры могут отражать влияние диеты, физической активности и сокращения курения. Однако методы, с помощью которых обратная связь от биомаркеров используется в интервенционных исследованиях, различны, и их эффективность остается неясной. [26]
Что касается клинического инструментария, то только два прогностических биомаркера применяются клинически в случае метастатического колоректального рака. [5] В этом случае отсутствие данных, выходящих за рамки ретроспективных исследований и успешных подходов, основанных на биомаркерах, может быть фактором при использовании исследований биомаркеров из-за отсева субъектов в клинических испытаниях . [27]
Область исследования биомаркеров также расширяется, включая комбинаторный подход к идентификации биомаркеров из нескольких источников. Объединение биомаркеров из различных данных позволяет разрабатывать панели, которые оценивают ответ на лечение на основе многих биомаркеров одновременно. Одной из таких областей расширения исследований многофакторных биомаркеров является секвенирование митохондриальной ДНК. Было показано, что мутации в митохондриальной ДНК коррелируют с риском, прогрессированием и ответом на лечение плоскоклеточного рака головы и шеи . [28] В этом примере было показано, что относительно недорогой конвейер секвенирования способен обнаруживать низкочастотные мутации в клетках, связанных с опухолью. Это подчеркивает общую способность моментального снимка биомаркеров на основе митохондриальной ДНК в захвате гетерогенности среди людей. [28]
Сеть исследований раннего выявления заболеваний (EDRN) составила список из семи критериев, по которым можно оценивать биомаркеры, чтобы упростить клиническую проверку. [29]
Ранее используемый для определения конкретных характеристик биомаркера, этот шаг необходим для проведения проверки этих преимуществ in situ . Биологическое обоснование исследования должно быть оценено в небольшом масштабе, прежде чем могут быть проведены какие-либо крупномасштабные исследования. [29] Многие кандидаты должны быть протестированы, чтобы выбрать наиболее подходящие. [30]
Один из самых важных шагов, он служит для определения конкретных характеристик потенциального биомаркера перед разработкой рутинного теста. [31] Рассматриваются несколько параметров, в том числе:
Это оптимизирует проверенный протокол для повседневного использования, включая анализ критических точек путем сканирования всей процедуры для выявления и контроля потенциальных рисков.
В 1997 году Национальный институт здравоохранения указал на необходимость разработки руководств и законодательства, которые регулировали бы этические аспекты исследований биомаркеров. [29]
Обеспечение того, чтобы все участники, которые включены на каждом этапе проекта (т. е. планирование, реализация и компиляция результатов), были обеспечены защитой этических принципов, которые были введены до начала проекта. Эти этические меры защиты должны защищать не только участников исследования, но и не участников, исследователей, спонсоров, регулирующие органы и всех других лиц или группы, вовлеченных в исследование. [29] Некоторые этические меры защиты могут включать, но не ограничиваться: [29]
В клеточной биологии биомаркер — это молекула , которая позволяет обнаруживать и изолировать определенный тип клеток (например, белок Oct-4 используется в качестве биомаркера для идентификации эмбриональных стволовых клеток ). [33]
В генетике биомаркер (идентифицируемый как генетический маркер ) — это последовательность ДНК , которая вызывает заболевание или связана с восприимчивостью к заболеванию. Их можно использовать для создания генетических карт любого изучаемого организма.
Биомаркером может быть любой вид молекулы, указывающей на существование, прошлое или настоящее, живых организмов. В областях геологии и астробиологии биомаркеры, в отличие от геомаркеров, также известны как биосигнатуры . Термин биомаркер также используется для описания биологического участия в образовании нефти . Биомаркеры использовались в геохимическом исследовании разлива нефти в заливе Сан-Франциско, Калифорния, в 1988 году. [34] 22–23 апреля около 400 000 галлонов сырой нефти были случайно слиты в долину Сан-Хоакин нефтеперерабатывающим заводом и производственным комплексом компании Shell Oil . Нефть затронула многие прилегающие районы. Образцы сырой нефти были собраны в различных регионах, где она распространилась, и сравнены с образцами, которые не были слиты, в попытке отличить разлитую нефть от петрогенного фона, присутствующего в зоне разлива. [34] Масс-спектр был выполнен для идентификации биомаркеров и циклических алифатических углеводородов в образцах. Были обнаружены изменения в концентрации компонентов образцов сырой нефти и осадков. [34]
Биомаркеры используются для определения влияния загрязнения воды на водные организмы. Бентосные макробеспозвоночные обитают в осадке на дне ручьев, где оседает много загрязняющих веществ. Эти организмы сильно подвержены загрязнению, что делает их хорошими видами для изучения при обнаружении концентраций загрязняющих веществ и воздействия загрязнения на экосистему. [35] В водном организме есть множество биомаркеров, которые можно измерить в зависимости от загрязняющего вещества или рассматриваемой реакции. В водоемах также есть множество загрязняющих веществ. Чтобы проанализировать влияние загрязняющего вещества на организм, биомаркер должен реагировать на определенное загрязняющее вещество в течение определенного периода времени или при определенной концентрации. [36] Биомаркеры, используемые для обнаружения загрязнения в водных организмах, могут быть ферментативными или неферментативными. [37] [38]
Рейчел Карсон , автор книги « Безмолвная весна» , подняла вопрос об использовании хлорорганических пестицидов и обсудила возможные негативные эффекты, которые эти пестициды оказывают на живые организмы. [39] В своей книге она подняла этические вопросы против химических корпораций, которые контролировали общее восприятие воздействия пестицидов на окружающую среду, что стало пионером в необходимости проведения экотоксикологических исследований. Экотоксикологические исследования можно считать предшественниками исследований биомаркеров. [40] Биомаркеры используются для указания воздействия или эффекта ксенобиотиков , которые присутствуют в окружающей среде и в организмах. Биомаркером может быть само внешнее вещество (например, частицы асбеста или ННК из табака) или вариант внешнего вещества, перерабатываемый организмом ( метаболит ), который обычно можно количественно определить.
Широкое использование термина «биомаркер» датируется еще 1980 годом. [41] Способ, которым окружающая среда контролировалась и изучалась ближе к концу 1980-х годов, все еще в основном зависел от изучения химических веществ, которые считались опасными или токсичными при обнаружении в умеренных концентрациях в воде, отложениях и водных организмах. [40] Методами, используемыми для идентификации этих химических соединений, были хроматография, спектрофотометрия, электрохимия и радиохимия. [40] Хотя эти методы были успешными в выяснении химического состава и концентраций, присутствующих в окружающей среде загрязняющих веществ и рассматриваемых соединений, тесты не предоставили данных, которые были бы информативными о влиянии определенного загрязнителя или химического вещества на живой организм или экосистему. Было предложено, что характеристика биомаркеров могла бы создать систему оповещения для проверки благополучия популяции или экосистемы до того, как загрязнитель или соединение смогут нанести ущерб системе. Теперь, благодаря развитию исследований биомаркеров, биомаркеры могут использоваться и применяться в областях медицины человека и для выявления заболеваний. [40]
Термин «биологический маркер» был введен в 1950-х годах. [42] [43]
Де Кок и Крамер разработали концепцию активного биомониторинга в 1994 году. Активный биомониторинг представляет собой сравнение химических/биологических свойств образца, перемещенного в новую среду, содержащую условия, отличные от исходной среды. [50]