
Вирусология — это научное изучение биологических вирусов . Это подраздел микробиологии , который фокусируется на их обнаружении, структуре, классификации и эволюции, их методах заражения и эксплуатации клеток хозяина для размножения, их взаимодействии с физиологией и иммунитетом организма хозяина, заболеваниях, которые они вызывают, методах их изоляции и культивирования, а также их использовании в исследованиях и терапии.
Идентификация возбудителя табачной мозаики (TMV) как нового патогена Мартинусом Бейеринком (1898) теперь признана официальным началом области вирусологии как дисциплины, отличной от бактериологии . Он понял, что источником была не бактериальная и не грибковая инфекция , а нечто совершенно иное. Бейеринк использовал слово «вирус» для описания таинственного агента в своем « contagium vivum fluidum » («заразная живая жидкость»). Розалинд Франклин предложила полную структуру вируса табачной мозаики в 1955 году.
Одной из главных причин изучения вирусов является то, что они вызывают множество инфекционных заболеваний растений и животных. [1] Изучение того, каким образом вирусы вызывают заболевания, называется вирусным патогенезом . Степень, в которой вирус вызывает заболевания, называется его вирулентностью . [2] Эти области изучения называются вирусологией растений , вирусологией животных и человеческой или медицинской вирусологией . [3]
Вирусология началась, когда не было методов размножения или визуализации вирусов или специальных лабораторных тестов на вирусные инфекции. Методов разделения вирусных нуклеиновых кислот ( РНК и ДНК ) и белков , которые сейчас являются основой вирусологии, не существовало. Сейчас существует множество методов наблюдения за структурой и функциями вирусов и их составных частей. Сейчас известны тысячи различных вирусов, и вирусологи часто специализируются либо на вирусах, которые заражают растения, либо на бактериях и других микроорганизмах , либо на животных. Вирусы, которые заражают людей, сейчас изучаются медицинскими вирусологами. Вирусология — это широкая дисциплина, охватывающая биологию, здравоохранение, благополучие животных, сельское хозяйство и экологию.

Луи Пастер не смог найти возбудителя бешенства и предположил, что патоген слишком мал, чтобы его можно было обнаружить с помощью микроскопов. [4] В 1884 году французский микробиолог Шарль Шамберлан изобрел фильтр Шамберлана (или фильтр Пастера-Шамберлана) с порами, достаточно малыми, чтобы удалить все бактерии из раствора, прошедшего через него. [5] В 1892 году русский биолог Дмитрий Ивановский использовал этот фильтр для изучения того, что сейчас известно как вирус табачной мозаики : измельченные экстракты листьев инфицированных растений табака оставались инфекционными даже после фильтрации для удаления бактерий. Ивановский предположил, что инфекция может быть вызвана токсином, вырабатываемым бактериями, но он не стал развивать эту идею. [6] В то время считалось, что все инфекционные агенты могут быть удержаны фильтрами и выращены на питательной среде — это было частью микробной теории болезней . [7]
В 1898 году голландский микробиолог Мартинус Бейеринк повторил эксперименты и убедился, что отфильтрованный раствор содержал новую форму инфекционного агента. [8] Он заметил, что агент размножался только в делящихся клетках, но поскольку его эксперименты не показали, что он состоял из частиц, он назвал его contagium vivum fluidum (растворимый живой микроб) и вновь ввел слово вирус . Бейеринк утверждал, что вирусы были жидкими по своей природе, теория, позже опровергнутая Венделлом Стэнли , который доказал, что они были частицами. [6] В том же году Фридрих Леффлер и Пауль Фрош пропустили первый вирус животных, афтовирус (возбудитель ящура ), через аналогичный фильтр. [9]
В начале 20 века английский бактериолог Фредерик Творт открыл группу вирусов, которые заражают бактерии, теперь называемых бактериофагами [10] (или обычно «фагами»), а франко-канадский микробиолог Феликс д'Эрелль описал вирусы, которые при добавлении к бактериям на агаровой пластине создавали области мертвых бактерий. Он аккуратно разбавил суспензию этих вирусов и обнаружил, что самые высокие разбавления (самые низкие концентрации вирусов), вместо того чтобы убивать все бактерии, образовывали отдельные области мертвых организмов. Подсчет этих областей и умножение на коэффициент разбавления позволило ему вычислить количество вирусов в исходной суспензии. [11] Фаги были объявлены потенциальным средством лечения таких заболеваний, как брюшной тиф и холера , но их обещание было забыто с разработкой пенициллина . Развитие устойчивости бактерий к антибиотикам возобновило интерес к терапевтическому использованию бактериофагов. [12]
К концу 19 века вирусы были определены с точки зрения их инфекционности , их способности проходить через фильтры и их потребности в живых хозяевах. Вирусы выращивались только на растениях и животных. В 1906 году Росс Грэнвилл Харрисон изобрел метод выращивания ткани в лимфе , а в 1913 году Э. Стейнхардт, К. Израэли и РА Ламберт использовали этот метод для выращивания вируса вакцинии во фрагментах роговичной ткани морской свинки. [13] В 1928 году Х. Б. Мейтленд и М. К. Мейтленд вырастили вирус вакцинии в суспензии измельченных почек кур. Их метод не был широко принят до 1950-х годов, когда полиовирус был выращен в больших масштабах для производства вакцин. [14]
Еще один прорыв произошел в 1931 году, когда американский патолог Эрнест Уильям Гудпасчер и Элис Майлз Вудрафф вырастили грипп и несколько других вирусов в оплодотворенных куриных яйцах. [15] В 1949 году Джон Франклин Эндерс , Томас Уэллер и Фредерик Роббинс вырастили полиовирус в культивируемых клетках из абортированной человеческой эмбриональной ткани, [16] первый вирус, выращенный без использования твердых тканей животных или яиц. Эта работа позволила Хилари Копровски , а затем Джонасу Солку создать эффективную вакцину против полиомиелита . [17]
Первые изображения вирусов были получены после изобретения электронной микроскопии в 1931 году немецкими инженерами Эрнстом Руской и Максом Кноллем . [18] В 1935 году американский биохимик и вирусолог Венделл Мередит Стэнли исследовал вирус табачной мозаики и обнаружил, что он в основном состоит из белка. [19] Вскоре этот вирус был разделен на белковую и РНК-части. [20] Вирус табачной мозаики был первым, кто был кристаллизован , и поэтому его структура могла быть выяснена в деталях. Первые рентгеновские дифракционные снимки кристаллизованного вируса были получены Берналом и Фанкухен в 1941 году. На основе своих рентгеновских кристаллографических снимков Розалинд Франклин открыла полную структуру вируса в 1955 году. [21] В том же году Хайнц Френкель-Конрат и Робли Уильямс показали, что очищенная РНК вируса табачной мозаики и ее белковая оболочка могут собираться сами по себе, образуя функциональные вирусы, что позволяет предположить, что этот простой механизм, вероятно, был средством, с помощью которого вирусы создавались внутри своих клеток-хозяев. [22]
Вторая половина 20-го века была золотым веком открытия вирусов, и большинство задокументированных видов вирусов животных, растений и бактерий были открыты в эти годы. [23] В 1957 году были открыты лошадиный артеривирус и причина диареи крупного рогатого скота ( пестивирус ). В 1963 году вирус гепатита B был открыт Барухом Блумбергом , [24] а в 1965 году Говард Темин описал первый ретровирус . Обратная транскриптаза , фермент , который ретровирусы используют для создания копий ДНК своей РНК, была впервые описана в 1970 году Темином и Дэвидом Балтимором независимо друг от друга. [25] В 1983 году группа Люка Монтанье в Институте Пастера во Франции впервые выделила ретровирус, который теперь называется ВИЧ. [26] В 1989 году группа Майкла Хоутона в корпорации Chiron обнаружила гепатит C. [ 27] [28]

Существует несколько подходов к обнаружению вирусов, в том числе обнаружение вирусных частиц (вирионов) или их антигенов или нуклеиновых кислот, а также анализы на инфекционность.

Вирусы были впервые обнаружены в 1930-х годах, когда были изобретены электронные микроскопы. Эти микроскопы используют пучки электронов вместо света, которые имеют гораздо более короткую длину волны и могут обнаруживать объекты, которые невозможно увидеть с помощью световых микроскопов. Наибольшее увеличение, которое можно получить с помощью электронных микроскопов, составляет до 10 000 000 раз [29] , тогда как для световых микроскопов оно составляет около 1500 раз. [30]
Вирусологи часто используют негативное окрашивание, чтобы визуализировать вирусы. В этой процедуре вирусы суспендируются в растворе солей металлов, таких как ацетат урана. Атомы металла непрозрачны для электронов, и вирусы видны как суспендированные на темном фоне атомов металла. [29] Эта техника используется с 1950-х годов. [31] Многие вирусы были обнаружены с помощью этой техники, и негативное окрашивание электронной микроскопии по-прежнему является ценным оружием в арсенале вирусолога. [32]
Традиционная электронная микроскопия имеет недостатки, заключающиеся в том, что вирусы повреждаются при высыхании в высоком вакууме внутри электронного микроскопа, а сам электронный луч является деструктивным. [29] В криогенной электронной микроскопии структура вирусов сохраняется путем их помещения в среду стекловидной воды . [33] Это позволяет определять биомолекулярные структуры с разрешением, близким к атомарному, [34] и привлекло широкое внимание к подходу как к альтернативе рентгеновской кристаллографии или ЯМР-спектроскопии для определения структуры вирусов. [35]
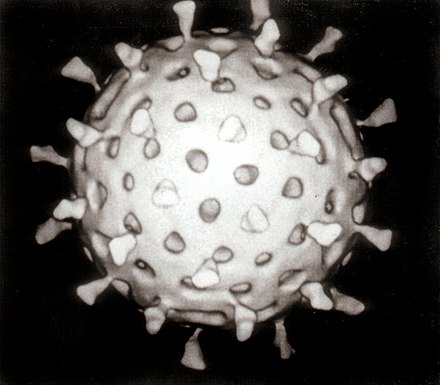
Вирусы являются облигатными внутриклеточными паразитами, и поскольку они размножаются только внутри живых клеток хозяина, эти клетки необходимы для их выращивания в лаборатории. Для вирусов, которые заражают животных (обычно называемых «животными вирусами»), используются клетки, выращенные в лабораторных клеточных культурах . В прошлом использовались оплодотворенные куриные яйца, а вирусы выращивались на мембранах, окружающих эмбрион. Этот метод до сих пор используется при производстве некоторых вакцин. Для вирусов, которые заражают бактерии, бактериофаги , бактерии, растущие в пробирках, могут использоваться напрямую. Для растительных вирусов могут использоваться естественные растения-хозяева или, особенно когда инфекция не очевидна, так называемые растения-индикаторы, которые более четко показывают признаки инфекции. [36] [37]

Вирусы, выросшие в клеточных культурах, можно косвенно обнаружить по пагубному эффекту, который они оказывают на клетку-хозяина. Эти цитопатические эффекты часто характерны для данного типа вируса. Например, вирусы простого герпеса вызывают характерное «раздувание» клеток, обычно человеческих фибробластов . Некоторые вирусы, такие как вирус эпидемического паротита, заставляют эритроциты кур прочно прикрепляться к инфицированным клеткам. Это называется «гемадсорбцией» или «гемадсорбцией». Некоторые вирусы вызывают локализованные «повреждения» в клеточных слоях, называемые бляшками , которые полезны в количественных анализах и для идентификации вида вируса с помощью анализов на уменьшение бляшек . [38] [39]
Вирусы, растущие в клеточных культурах, используются для измерения их восприимчивости к проверенным и новым противовирусным препаратам . [40]
Вирусы — это антигены , которые вызывают выработку антител , и эти антитела могут использоваться в лабораториях для изучения вирусов. Родственные вирусы часто реагируют с антителами друг друга, и некоторые вирусы могут быть названы на основе антител, с которыми они реагируют. Использование антител, которые когда-то были получены исключительно из сыворотки (кровяной жидкости) животных, называется серологией . [41] После того, как в тесте произошла реакция антител, для ее подтверждения необходимы другие методы. Старые методы включали реакции связывания комплемента , [42] ингибирование гемагглютинации и нейтрализацию вируса . [43] Более новые методы используют иммуноферментный анализ (ИФА). [44]
До изобретения ПЦР иммунофлуоресценция использовалась для быстрого подтверждения вирусных инфекций. Это анализ инфекционности, который является специфическим для вида вируса, поскольку используются антитела. Антитела помечены красителем, который является люминесцентным, и при использовании оптического микроскопа с модифицированным источником света инфицированные клетки светятся в темноте. [45]
ПЦР является основным методом обнаружения вирусов у всех видов, включая растения и животных. Он работает путем обнаружения следов вирусспецифической РНК или ДНК. Он очень чувствителен и специфичен, но может быть легко скомпрометирован загрязнением. Большинство тестов, используемых в ветеринарной вирусологии и медицинской вирусологии, основаны на ПЦР или аналогичных методах, таких как амплификация, опосредованная транскрипцией . Когда появляется новый вирус, такой как коронавирус covid, можно быстро разработать специальный тест, если вирусный геном был секвенирован и уникальные области вирусной ДНК или РНК идентифицированы. [46] Изобретение микрофлюидных тестов позволило автоматизировать большинство этих тестов, [47] Несмотря на свою специфичность и чувствительность, ПЦР имеет недостаток, заключающийся в том, что она не различает инфекционные и неинфекционные вирусы, и «тесты на излечение» приходится откладывать на срок до 21 дня, чтобы остаточная вирусная нуклеиновая кислота могла очиститься от места заражения. [48]
В лабораториях многие диагностические тесты для обнаружения вирусов являются методами амплификации нуклеиновых кислот, такими как ПЦР. Некоторые тесты обнаруживают вирусы или их компоненты, например, электронную микроскопию и иммуноферментный анализ . Так называемые «домашние» или «само»-тестирующие гаджеты обычно представляют собой тесты бокового потока , которые обнаруживают вирус с помощью меченого моноклонального антитела . [49] Они также используются в сельском хозяйстве, пищевой промышленности и науках об окружающей среде. [50]
Подсчет вирусов (количественное определение) всегда играл важную роль в вирусологии и стал центральным для контроля некоторых инфекций у людей, где измеряется вирусная нагрузка . [51] Существует два основных метода: те, которые подсчитывают полностью инфекционные вирусные частицы, которые называются анализами инфекционности, и те, которые подсчитывают все частицы, включая дефектные. [29]

Анализы инфекционности измеряют количество (концентрацию) инфекционных вирусов в образце известного объема. [52] Для клеток-хозяев используются растения или культуры бактериальных или животных клеток. Лабораторные животные, такие как мыши, также использовались, в частности, в ветеринарной вирусологии. [53] Эти анализы являются либо количественными, где результаты находятся в непрерывном масштабе, либо квантовыми, где событие либо происходит, либо нет. Количественные анализы дают абсолютные значения , а квантовые анализы дают статистическую вероятность, такую как объем тестового образца, необходимый для обеспечения заражения 50% клеток-хозяев, растений или животных. Это называется средней инфекционной дозой или ИД 50 . [54] Инфекционные бактериофаги можно подсчитать, посеяв их на «лужайки» бактерий в чашках Петри. При низких концентрациях вирусы образуют отверстия в лужайке, которые можно подсчитать. Затем количество вирусов выражается в единицах бляшкообразования . Для бактериофагов, которые размножаются в бактериях, которые невозможно вырастить в культурах, используются анализы вирусной нагрузки. [55]

Анализ формирования фокуса (FFA) является разновидностью анализа бляшек, но вместо того, чтобы полагаться на лизис клеток для обнаружения образования бляшек, FFA использует методы иммуноокрашивания с использованием флуоресцентно меченых антител, специфичных для вирусного антигена, для обнаружения инфицированных клеток хозяина и инфекционных вирусных частиц до образования фактической бляшки. FFA особенно полезен для количественной оценки классов вирусов, которые не лизируют клеточные мембраны, поскольку эти вирусы не поддаются анализу бляшек. Как и в анализе бляшек, монослои клеток хозяина заражаются различными разведениями образца вируса и инкубируются в течение относительно короткого инкубационного периода (например, 24–72 часа) под полутвердой покровной средой, которая ограничивает распространение инфекционного вируса, создавая локализованные кластеры (очаги) инфицированных клеток. Затем пластины зондируются флуоресцентно мечеными антителами против вирусного антигена, а для подсчета и количественной оценки количества очагов используется флуоресцентная микроскопия. Метод FFA обычно дает результаты за меньшее время, чем анализы бляшек или пятидесятипроцентной инфекционной дозы культуры ткани (TCID 50 ), но он может быть более дорогим с точки зрения требуемых реагентов и оборудования. Время завершения анализа также зависит от размера области, которую подсчитывает пользователь. Большая область потребует больше времени, но может обеспечить более точное представление образца. Результаты FFA выражаются в единицах формирования фокуса на миллилитр, или FFU/ [56]
Когда проводится анализ для измерения инфекционных вирусных частиц (анализ бляшек, анализ фокуса), вирусный титр часто относится к концентрации инфекционных вирусных частиц, которая отличается от общего количества вирусных частиц. Анализы вирусной нагрузки обычно подсчитывают количество присутствующих вирусных геномов, а не количество частиц, и используют методы, похожие на ПЦР . [57] Тесты на вирусную нагрузку важны в контроле инфекций, вызванных ВИЧ. [58] Этот универсальный метод может использоваться для вирусов растений. [59] [60]
Молекулярная вирусология — это изучение вирусов на уровне нуклеиновых кислот и белков. Методы, изобретенные молекулярными биологами, оказались полезными в вирусологии. Их небольшие размеры и относительно простая структура делают вирусы идеальным кандидатом для изучения этими методами.

Для дальнейшего изучения вирусы, выращенные в лаборатории, нуждаются в очистке для удаления загрязнений из клеток-хозяев. Преимущество используемых методов часто заключается в концентрации вирусов, что облегчает их исследование.
Центрифуги часто используются для очистки вирусов. Низкоскоростные центрифуги, т. е. те, у которых максимальная скорость составляет 10 000 оборотов в минуту (об/мин), недостаточно мощны для концентрации вирусов, но ультрацентрифуги с максимальной скоростью около 100 000 об/мин достаточно мощные, и эта разница используется в методе, называемом дифференциальным центрифугированием . В этом методе более крупные и тяжелые загрязнители удаляются из вирусной смеси с помощью низкоскоростного центрифугирования. Вирусы, которые являются маленькими и легкими и остаются во взвешенном состоянии, затем концентрируются с помощью высокоскоростного центрифугирования. [62]
После дифференциального центрифугирования вирусные суспензии часто остаются загрязненными детритом, который имеет тот же коэффициент седиментации и не удаляется в ходе процедуры. В этих случаях используется модификация центрифугирования, называемая центрифугированием с плавучей плотностью . В этом методе вирусы, извлеченные из дифференциального центрифугирования, снова центрифугируются на очень высокой скорости в течение нескольких часов в плотных растворах сахаров или солей, которые образуют градиент плотности от низкого до высокого в пробирке во время центрифугирования. В некоторых случаях используются предварительно сформированные градиенты, где растворы с постепенно уменьшающейся плотностью аккуратно накладываются друг на друга. Подобно объекту в Мертвом море , несмотря на центробежную силу, вирусные частицы не могут погрузиться в растворы, которые плотнее их самих, и они образуют дискретные слои, часто видимых, концентрированных вирусов в пробирке. Хлорид цезия часто используется для этих растворов, поскольку он относительно инертен, но легко самостоятельно образует градиент при центрифугировании на высокой скорости в ультрацентрифуге. [61] Центрифугирование с плавучей плотностью также можно использовать для очистки компонентов вирусов, таких как их нуклеиновые кислоты или белки. [63]
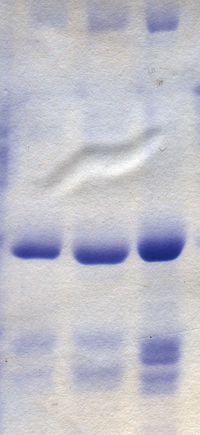
Разделение молекул на основе их электрического заряда называется электрофорезом . Вирусы и все их компоненты могут быть разделены и очищены с помощью этого метода. Обычно это делается в поддерживающей среде, такой как агароза и полиакриламидные гели . Разделенные молекулы выявляются с помощью красителей, таких как кумасси синий для белков или бромистый этидий для нуклеиновых кислот. В некоторых случаях вирусные компоненты становятся радиоактивными перед электрофорезом и выявляются с помощью фотографической пленки в процессе, известном как авторадиография . [64]
Поскольку большинство вирусов слишком малы, чтобы их можно было увидеть с помощью светового микроскопа, секвенирование является одним из основных инструментов в вирусологии для идентификации и изучения вируса. Традиционное секвенирование по Сэнгеру и секвенирование следующего поколения (NGS) используются для секвенирования вирусов в фундаментальных и клинических исследованиях, а также для диагностики новых вирусных инфекций, молекулярной эпидемиологии вирусных патогенов и тестирования устойчивости к лекарственным препаратам. В GenBank имеется более 2,3 миллиона уникальных вирусных последовательностей. [65] NGS превзошел традиционный метод Сэнгера как самый популярный подход к созданию вирусных геномов. [65] Секвенирование вирусного генома стало центральным методом в вирусной эпидемиологии и вирусной классификации .
Данные секвенирования вирусных геномов могут быть использованы для определения эволюционных связей, и это называется филогенетическим анализом . [66] Программное обеспечение, такое как PHYLIP , используется для рисования филогенетических деревьев . Этот анализ также используется при изучении распространения вирусных инфекций в сообществах ( эпидемиология ). [67]
Когда для диагностических тестов или вакцин требуются очищенные вирусы или вирусные компоненты, вместо выращивания вирусов можно использовать клонирование. [68] В начале пандемии COVID-19 доступность последовательности РНК коронавируса тяжелого острого респираторного синдрома 2 позволила быстро изготавливать тесты. [69] Существует несколько проверенных методов клонирования вирусов и их компонентов. Часто используются небольшие фрагменты ДНК, называемые векторами клонирования , и наиболее распространенными из них являются лабораторно модифицированные плазмиды (небольшие кольцевые молекулы ДНК, продуцируемые бактериями). Вирусная нуклеиновая кислота или ее часть вставляется в плазмиду, которая многократно копируется бактериями. Затем эту рекомбинантную ДНК можно использовать для производства вирусных компонентов без необходимости в нативных вирусах. [70]
Вирусы, которые размножаются в бактериях, археях и грибах, неофициально называются «фагами» [71] , а те, которые заражают бактерии – бактериофаги – в частности, полезны в вирусологии и биологии в целом. [72] Бактериофаги были одними из первых вирусов, которые были обнаружены в начале двадцатого века [73] , и поскольку их относительно легко и быстро выращивать в лабораториях, большая часть нашего понимания вирусов возникла в результате их изучения. [73] Бактериофаги, давно известные своим положительным воздействием на окружающую среду, используются в методах фагового дисплея для скрининга последовательностей ДНК белков. Они являются мощным инструментом в молекулярной биологии [74] .
Все вирусы имеют гены , которые изучаются с помощью генетики . [75] Все методы, используемые в молекулярной биологии, такие как клонирование, создание мутаций, подавление РНК, используются в вирусной генетике. [76]
Реассортация — это переключение генов от разных родителей, и это особенно полезно при изучении генетики вирусов, которые имеют сегментированные геномы (фрагментированные на две или более молекул нуклеиновой кислоты), такие как вирусы гриппа и ротавирусы . Гены, которые кодируют такие свойства, как серотип, могут быть идентифицированы таким образом. [77]
Часто путаемая с реассортацией, рекомбинация также является смешиванием генов, но механизм отличается тем, что участки молекул ДНК или РНК, в отличие от полных молекул, соединяются во время цикла репликации РНК или ДНК. Рекомбинация не так распространена в природе, как реассортация, но это мощный инструмент в лабораториях для изучения структуры и функций вирусных генов. [78]
Обратная генетика — мощный метод исследования в вирусологии. [79] В этой процедуре комплементарные ДНК-копии (кДНК) вирусных геномов, называемые «инфекционными клонами», используются для получения генетически модифицированных вирусов, которые затем можно проверить на предмет изменений, например, вирулентности или заразности. [80]
Основным разделом вирусологии является классификация вирусов . Она искусственна, поскольку не основана на эволюционной филогенетике , а основана на общих или отличительных свойствах вирусов. [81] [82] Она стремится описать разнообразие вирусов, называя и группируя их на основе сходства. [83] В 1962 году Андре Львофф , Роберт Хорн и Поль Турнье были первыми, кто разработал способ классификации вирусов, основанный на иерархической системе Линнея . [84] Эта система основывалась на классификации по типу , классу , порядку , семейству , роду и виду . Вирусы были сгруппированы в соответствии с их общими свойствами (а не свойствами их хозяев) и типом нуклеиновой кислоты, образующей их геномы. [85] В 1966 году был сформирован Международный комитет по таксономии вирусов (ICTV). Система, предложенная Львоффом, Хорном и Турнье, изначально не была принята ICTV, поскольку небольшой размер генома вирусов и их высокая скорость мутации затрудняли определение их происхождения за пределами порядка. Таким образом, система классификации Балтимора стала использоваться для дополнения более традиционной иерархии. [86] Начиная с 2018 года, ICTV начала признавать более глубокие эволюционные связи между вирусами, которые были обнаружены с течением времени, и приняла 15-ранговую систему классификации, варьирующуюся от области до вида. [87] Кроме того, некоторые виды в пределах одного рода сгруппированы в геногруппу . [88] [89]
ICTV разработала текущую систему классификации и написала руководящие принципы, которые придают больший вес определенным свойствам вирусов для поддержания единообразия семейств. Была создана единая таксономия (универсальная система классификации вирусов). Была изучена лишь небольшая часть общего разнообразия вирусов. [90] По состоянию на 2021 год ICTV определила 6 областей, 10 царств, 17 типов, 2 подтипа, 39 классов, 65 отрядов, 8 подотрядов, 233 семейства, 168 подсемейств , 2606 родов, 84 подрода и 10 434 вида вирусов. [91]
Общая таксономическая структура таксономических диапазонов и суффиксы, используемые в таксономических названиях, показаны ниже. По состоянию на 2021 год ранги подцарства, подцарства и подкласса не используются, тогда как все остальные ранги используются. [91]

Лауреат Нобелевской премии биолог Дэвид Балтимор разработал систему классификации Балтимора . [92]
Балтиморская классификация вирусов основана на механизме производства мРНК . Вирусы должны генерировать мРНК из своих геномов для производства белков и самореплицирования, но для достижения этого в каждом семействе вирусов используются разные механизмы. Вирусные геномы могут быть одноцепочечными (ss) или двухцепочечными (ds), РНК или ДНК, и могут использовать или не использовать обратную транскриптазу (RT). Кроме того, вирусы ssRNA могут быть как смысловыми (+), так и антисмысловыми (−). Эта классификация делит вирусы на семь групп:
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка )