Масс-спектрометрия ( МС ) — это аналитический метод, который используется для измерения отношения массы к заряду ионов . Результаты представлены в виде масс-спектра , графика интенсивности как функции отношения массы к заряду. Масс-спектрометрия используется во многих различных областях и применяется как к чистым образцам, так и к сложным смесям.
Масс-спектр — это тип графика ионного сигнала как функции отношения массы к заряду. Эти спектры используются для определения элементной или изотопной сигнатуры образца, масс частиц и молекул , а также для выяснения химической идентичности или структуры молекул и других химических соединений .

В типичной процедуре МС образец, который может быть твердым, жидким или газообразным, ионизируется , например, путем бомбардировки его пучком электронов . Это может привести к тому, что некоторые молекулы образца распадутся на положительно заряженные фрагменты или просто станут положительно заряженными без фрагментации. Затем эти ионы (фрагменты) разделяются в соответствии с их отношением массы к заряду, например, путем ускорения их и воздействия на них электрическим или магнитным полем: ионы с одинаковым отношением массы к заряду будут испытывать одинаковое количество отклонения. [1] Ионы обнаруживаются с помощью механизма, способного обнаруживать заряженные частицы, такого как электронный умножитель . Результаты отображаются в виде спектров интенсивности сигнала обнаруженных ионов в зависимости от отношения массы к заряду. Атомы или молекулы в образце могут быть идентифицированы путем корреляции известных масс (например, целой молекулы) с идентифицированными массами или с помощью характерного паттерна фрагментации.
.jpg/440px-Early_Mass_Spectrometer_(replica).jpg)
В 1886 году Ойген Гольдштейн наблюдал лучи в газовых разрядах при низком давлении, которые двигались от анода и через каналы в перфорированном катоде , противоположно направлению отрицательно заряженных катодных лучей (которые движутся от катода к аноду). Гольдштейн назвал эти положительно заряженные анодные лучи «Kanalstrahlen»; стандартный перевод этого термина на английский язык — « каналовые лучи ». Вильгельм Вин обнаружил, что сильные электрические или магнитные поля отклоняют канальные лучи, и в 1899 году сконструировал устройство с перпендикулярными электрическими и магнитными полями, которые разделяли положительные лучи в соответствии с их отношением заряда к массе ( Q/m ). Вин обнаружил, что отношение заряда к массе зависит от природы газа в разрядной трубке. Английский ученый Дж. Дж. Томсон позже улучшил работу Вина, уменьшив давление, чтобы создать масс-спектрограф.

Слово спектрограф вошло в международный научный словарь к 1884 году. [2] [3] Ранние спектрометрические устройства, измерявшие отношение массы к заряду ионов, назывались масс-спектрографами , которые состояли из приборов, которые регистрировали спектр массовых значений на фотографической пластине . [4] [5] Масс -спектроскоп похож на масс-спектрограф, за исключением того, что пучок ионов направляется на фосфорный экран. [6] Конфигурация масс-спектроскопа использовалась в ранних приборах, когда требовалось быстро наблюдать эффекты регулировок. После того, как прибор был правильно настроен, вставлялась и экспонировалась фотопластинка. Термин масс-спектроскоп продолжал использоваться, хотя прямое освещение фосфорного экрана было заменено косвенными измерениями с помощью осциллографа . [ 7] Использование термина масс-спектроскопия в настоящее время не рекомендуется из-за возможности путаницы со световой спектроскопией . [1] [8] Масс-спектрометрию часто сокращают до масс-спектрометрии или просто до МС . [1]
Современные методы масс-спектрометрии были разработаны Артуром Джеффри Демпстером и Ф. У. Астоном в 1918 и 1919 годах соответственно.
Секторные масс-спектрометры, известные как калютроны, были разработаны Эрнестом О. Лоуренсом и использовались для разделения изотопов урана во время Манхэттенского проекта . [9] Калютронные масс-спектрометры использовались для обогащения урана на заводе Y-12 в Оук-Ридже, штат Теннесси, построенном во время Второй мировой войны.
В 1989 году половина Нобелевской премии по физике была присуждена Гансу Демельту и Вольфгангу Паулю за разработку метода ионной ловушки в 1950-х и 1960-х годах.
В 2002 году Нобелевская премия по химии была присуждена Джону Беннету Фенну за разработку электрораспылительной ионизации (ESI) и Коичи Танаке за разработку мягкой лазерной десорбции (SLD) и ее применение для ионизации биологических макромолекул , особенно белков . [10]
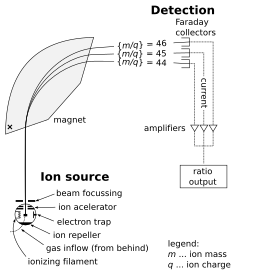
Масс-спектрометр состоит из трех компонентов: источника ионов, масс-анализатора и детектора. Ионизатор преобразует часть образца в ионы. Существует большое разнообразие методов ионизации в зависимости от фазы (твердое тело, жидкость, газ) образца и эффективности различных механизмов ионизации для неизвестных видов. Система извлечения удаляет ионы из образца, которые затем направляются через масс-анализатор в детектор . Различия в массах фрагментов позволяют масс-анализатору сортировать ионы по их отношению массы к заряду. Детектор измеряет значение индикаторной величины и, таким образом, предоставляет данные для расчета распространенности каждого присутствующего иона. Некоторые детекторы также дают пространственную информацию, например, многоканальная пластина.
Далее описывается работа спектрометрического масс-анализатора секторного типа . (Другие типы анализаторов рассматриваются ниже.) Рассмотрим образец хлорида натрия (поваренной соли). В источнике ионов образец испаряется (превращается в газ ) и ионизируется (превращается в электрически заряженные частицы) в ионы натрия (Na + ) и хлорида (Cl − ). Атомы и ионы натрия являются моноизотопными с массой около 23 дальтон (символ: Da или более старый символ: u). Атомы и ионы хлорида поставляются в двух стабильных изотопах с массами около 35 u (при естественной распространенности около 75 процентов) и около 37 u (при естественной распространенности около 25 процентов). Анализаторная часть спектрометра содержит электрические и магнитные поля, которые оказывают силы на ионы, проходящие через эти поля. Скорость заряженной частицы может увеличиваться или уменьшаться при прохождении через электрическое поле, а ее направление может изменяться магнитным полем. Величина отклонения траектории движущегося иона зависит от отношения его массы к заряду. Более легкие ионы отклоняются магнитной силой в большей степени, чем более тяжелые ионы (на основе второго закона движения Ньютона , F = ma ). Потоки магнитно-отсортированных ионов проходят от анализатора к детектору, который регистрирует относительное содержание каждого типа ионов. Эта информация используется для определения химического элементного состава исходного образца (т. е. того, что в образце присутствуют как натрий, так и хлор) и изотопного состава его компонентов (отношение 35 Cl к 37 Cl).

Источник ионов — это часть масс-спектрометра, которая ионизирует анализируемый материал (аналит). Затем ионы транспортируются магнитными или электрическими полями в масс-анализатор.
Методы ионизации стали ключом к определению того, какие типы образцов можно анализировать с помощью масс-спектрометрии. Электронная ионизация и химическая ионизация используются для газов и паров . В источниках химической ионизации аналит ионизируется химическими ионно-молекулярными реакциями во время столкновений в источнике. Два метода, часто используемые с жидкими и твердыми биологическими образцами, включают ионизацию электрораспылением (изобретенную Джоном Фенном [11] ) и лазерную десорбцию/ионизацию с матрицей (MALDI, первоначально разработанную как похожая техника «Мягкая лазерная десорбция (SLD)» К. Танакой [12], за которую была присуждена Нобелевская премия, и как MALDI М. Карасом и Ф. Хилленкампом [13] ).

В масс-спектрометрии ионизация относится к получению ионов газовой фазы, подходящих для разрешения в масс-анализаторе или масс-фильтре. Ионизация происходит в источнике ионов . Существует несколько доступных источников ионов ; каждый из них имеет свои преимущества и недостатки для конкретных применений. Например, электронная ионизация (EI) дает высокую степень фрагментации, что дает высокодетализированные масс-спектры, которые при умелом анализе могут предоставить важную информацию для структурного выяснения/характеристики и облегчить идентификацию неизвестных соединений путем сравнения с библиотеками масс-спектров, полученными в идентичных рабочих условиях. Однако EI не подходит для сопряжения с HPLC , т. е. LC-MS , поскольку при атмосферном давлении нити, используемые для генерации электронов, быстро сгорают. Таким образом, EI преимущественно сопряжена с GC , т. е. GC-MS , где вся система находится под высоким вакуумом.
Методы жесткой ионизации — это процессы, которые придают большое количество остаточной энергии в молекуле объекта, вызывая большую степень фрагментации (т. е. систематический разрыв связей действует для удаления избыточной энергии, восстанавливая стабильность полученного иона). Полученные ионы, как правило, имеют m/z ниже, чем у молекулярного иона (за исключением случая переноса протона и не включая изотопные пики). Наиболее распространенным примером жесткой ионизации является электронная ионизация (EI).
Мягкая ионизация относится к процессам, которые передают мало остаточной энергии молекуле субъекта и, как таковые, приводят к малой фрагментации. Примерами являются бомбардировка быстрыми атомами (FAB), химическая ионизация (CI), химическая ионизация при атмосферном давлении (APCI), фотоионизация при атмосферном давлении (APPI), ионизация электрораспылением (ESI), десорбционная ионизация электрораспылением (DESI) и матрично-ассистированная лазерная десорбция/ионизация (MALDI).

Источники индуктивно связанной плазмы (ИСП) используются в основном для катионного анализа широкого спектра типов образцов. В этом источнике плазма, которая в целом электрически нейтральна, но в которой значительная часть ее атомов ионизирована высокой температурой, используется для распыления введенных молекул образца и для дальнейшего удаления внешних электронов из этих атомов. Плазма обычно генерируется из газа аргона, поскольку первая энергия ионизации атомов аргона выше, чем первая у любых других элементов, кроме He, F и Ne, но ниже, чем вторая энергия ионизации всех, кроме самых электроположительных металлов. Нагрев достигается с помощью радиочастотного тока, проходящего через катушку, окружающую плазму.
Фотоионизация может использоваться в экспериментах, которые стремятся использовать масс-спектрометрию как средство разрешения механизмов химической кинетики и разветвления изомерных продуктов. [14] В таких случаях фотон высокой энергии, либо рентгеновский, либо ультрафиолетовый, используется для диссоциации стабильных газообразных молекул в газе-носителе He или Ar. В случаях, когда используется источник синхротронного света, настраиваемая энергия фотона может использоваться для получения кривой эффективности фотоионизации, которая может использоваться в сочетании с отношением заряда m/z для идентификации молекулярных и ионных видов. Совсем недавно была разработана фотоионизация при атмосферном давлении (APPI) для ионизации молекул, в основном как стоков систем LC-MS.
Некоторые приложения для ионизации окружающей среды включают экологические приложения, а также клинические приложения. В этих методах ионы образуются в источнике ионов вне масс-спектрометра. Отбор проб становится простым, поскольку образцы не требуют предварительного разделения или подготовки. Некоторые примеры методов ионизации окружающей среды включают прямой анализ в реальном времени (DART), DESI , SESI , LAESI , десорбционную химическую ионизацию при атмосферном давлении (DAPCI), мягкую ионизацию химической реакцией при переносе (SICRT) и десорбционную фотоионизацию при атмосферном давлении DAPPI и другие.
Другие методы включают тлеющий разряд , полевую десорбцию (FD), бомбардировку быстрыми атомами (FAB), термораспыление , десорбцию/ионизацию на кремнии (DIOS), химическую ионизацию при атмосферном давлении (APCI), масс-спектрометрию вторичных ионов (SIMS), искровую ионизацию и термическую ионизацию (TIMS). [15]
Масс-анализаторы разделяют ионы в соответствии с их отношением массы к заряду . Следующие два закона управляют динамикой заряженных частиц в электрических и магнитных полях в вакууме:
Здесь F — сила, приложенная к иону, m — масса иона, a — ускорение, Q — заряд иона, E — электрическое поле, а v × B — векторное векторное произведение скорости иона и магнитного поля.
Приравнивая приведенные выше выражения для силы, приложенной к иону, получаем:
Это дифференциальное уравнение является классическим уравнением движения заряженных частиц . Вместе с начальными условиями частицы оно полностью определяет движение частицы в пространстве и времени в терминах m/Q . Таким образом, масс-спектрометры можно рассматривать как «спектрометры массы к заряду». При представлении данных принято использовать (официально) безразмерную величину m/z , где z — число элементарных зарядов ( e ) на ионе (z=Q/e). Эта величина, хотя ее неофициально называют отношением массы к заряду, точнее говоря, представляет собой отношение массового числа к зарядовому числу z .
Существует много типов масс-анализаторов, использующих статические или динамические поля, а также магнитные или электрические поля, но все они работают в соответствии с приведенным выше дифференциальным уравнением. Каждый тип анализатора имеет свои сильные и слабые стороны. Многие масс-спектрометры используют два или более масс-анализаторов для тандемной масс-спектрометрии (МС/МС) . Помимо более распространенных масс-анализаторов, перечисленных ниже, существуют и другие, предназначенные для особых ситуаций.
Анализатор имеет несколько важных характеристик. Разрешающая способность по массе — это мера способности различать два пика с немного отличающимся m/z . Точность массы — это отношение ошибки измерения m/z к истинному m/z . Точность массы обычно измеряется в ppm или миллимассовых единицах . Диапазон масс — это диапазон m/z , поддающийся анализу данным анализатором. Линейный динамический диапазон — это диапазон, в котором ионный сигнал линеен с концентрацией аналита. Скорость относится к временным рамкам эксперимента и в конечном итоге используется для определения количества спектров за единицу времени, которые могут быть сгенерированы.

Масс-анализатор поля сектора использует статическое электрическое и/или магнитное поле, чтобы каким-то образом повлиять на путь и/или скорость заряженных частиц. Как показано выше, секторные приборы изгибают траектории ионов, когда они проходят через масс-анализатор , в соответствии с их отношениями массы к заряду, отклоняя более заряженные и быстро движущиеся, более легкие ионы сильнее. Анализатор можно использовать для выбора узкого диапазона m/z или для сканирования диапазона m/z с целью каталогизации присутствующих ионов. [16]
Анализатор времени пролета (TOF) использует электрическое поле для ускорения ионов через тот же потенциал , а затем измеряет время, которое им требуется, чтобы достичь детектора. Если все частицы имеют одинаковый заряд , их кинетическая энергия будет одинаковой, а их скорости будут зависеть только от их масс . Например, ионы с меньшей массой будут двигаться быстрее, достигая детектора первыми. [17] Ионы обычно движутся до того, как их ускоряет электрическое поле , это приводит к тому, что частицы с одинаковым m/z прибывают к детектору в разное время. Эта разница в начальных скоростях часто не зависит от массы иона и превратится в разницу в конечной скорости. Это распределение скоростей расширяет пики, показанные на графике подсчета против m/z , но, как правило, не изменяет центрального расположения пиков, поскольку начальная скорость ионов, как правило, центрирована на нуле. Чтобы решить эту проблему, фокусировка с задержкой по времени/ задержанное извлечение были объединены с TOF-MS. [18]
Квадрупольные масс-анализаторы используют осциллирующие электрические поля для избирательной стабилизации или дестабилизации путей ионов, проходящих через радиочастотное (РЧ) квадрупольное поле, созданное между четырьмя параллельными стержнями. Только ионы в определенном диапазоне отношения массы к заряду пропускаются через систему в любой момент времени, но изменения потенциалов на стержнях позволяют быстро проносить широкий диапазон значений m/z , либо непрерывно, либо в последовательности дискретных скачков. Квадрупольный масс-анализатор действует как масс-селективный фильтр и тесно связан с квадрупольной ионной ловушкой , в частности с линейной квадрупольной ионной ловушкой, за исключением того, что он предназначен для пропускания незахваченных ионов, а не для сбора захваченных, и по этой причине называется пропускающим квадруполем. Магнитно-усиленный квадрупольный масс-анализатор включает добавление магнитного поля, либо приложенного аксиально, либо поперечно. Этот новый тип прибора приводит к дополнительному повышению производительности с точки зрения разрешения и/или чувствительности в зависимости от величины и ориентации приложенного магнитного поля. [19] [20] Распространенной разновидностью квадруполя пропускания является тройной квадрупольный масс-спектрометр. «Тройной квадруполь» имеет три последовательных квадрупольных этапа, первый из которых действует как массовый фильтр для передачи определенного входящего иона второму квадруполю, камере столкновений, в которой этот ион может быть разбит на фрагменты. Третий квадруполь также действует как массовый фильтр для передачи определенного фрагментного иона детектору. Если квадруполь заставить быстро и многократно проходить цикл через ряд настроек массового фильтра, можно получить полные спектры. Аналогично, тройной квадруполь может быть создан для выполнения различных типов сканирования, характерных для тандемной масс-спектрометрии .
Квадрупольная ионная ловушка работает на тех же физических принципах, что и квадрупольный масс-анализатор, но ионы захватываются и последовательно выбрасываются. Ионы захватываются в основном квадрупольным РЧ-полем, в пространстве, определяемом кольцевым электродом (обычно подключенным к основному РЧ-потенциалу) между двумя торцевыми электродами (обычно подключенными к постоянному току или вспомогательному переменному потенциалу). Образец ионизируется либо изнутри (например, электронным или лазерным лучом), либо снаружи, в этом случае ионы часто вводятся через отверстие в торцевом электроде.
Существует множество методов разделения и изоляции массы/заряда, но наиболее часто используемым является режим нестабильности массы, в котором потенциал ВЧ увеличивается так, что орбита ионов с массой a > b становится стабильной, в то время как ионы с массой b становятся нестабильными и выбрасываются по оси z на детектор. Существуют также методы неразрушающего анализа.
Ионы также могут быть выброшены методом резонансного возбуждения, при котором к торцевым электродам прикладывается дополнительное колебательное возбуждающее напряжение, а амплитуда напряжения захвата и/или частота возбуждающего напряжения изменяются для приведения ионов в состояние резонанса в порядке их соотношения массы/заряда. [21] [22]
Масс-спектрометр с цилиндрической ионной ловушкой (CIT) является производной от квадрупольной ионной ловушки, где электроды сформированы из плоских колец, а не из гиперболических электродов. Архитектура хорошо поддается миниатюризации, поскольку при уменьшении размера ловушки форма электрического поля вблизи центра ловушки, области, где захватываются ионы, образует форму, похожую на форму гиперболической ловушки.
Линейная квадрупольная ионная ловушка похожа на квадрупольную ионную ловушку, но она захватывает ионы в двумерном квадрупольном поле, а не в трехмерном квадрупольном поле, как в 3D квадрупольной ионной ловушке. LTQ компании Thermo Fisher («линейная ловушка-квадруполь») является примером линейной ионной ловушки. [23]
Тороидальная ионная ловушка может быть визуализирована как линейный квадруполь, изогнутый вокруг и соединенный на концах, или как поперечное сечение трехмерной ионной ловушки, повернутой на ребре для формирования тороидальной, пончиковой ловушки. Ловушка может хранить большие объемы ионов, распределяя их по всей кольцевой структуре ловушки. Эта тороидальная ловушка представляет собой конфигурацию, которая позволяет увеличить миниатюризацию масс-анализатора ионной ловушки. Кроме того, все ионы хранятся в одном и том же поле захвата и выбрасываются вместе, упрощая обнаружение, которое может быть усложнено конфигурациями массивов из-за изменений в выравнивании детектора и обработке массивов. [24]
Как и в случае с тороидальной ловушкой, линейные ловушки и 3D-квадрупольные ионные ловушки являются наиболее часто используемыми миниатюрными масс-анализаторами из-за их высокой чувствительности, устойчивости к давлению в мТорр и возможностей для тандемной масс-спектрометрии с одним анализатором (например, сканирование ионов-продуктов). [25]

Инструменты Orbitrap похожи на масс-спектрометры с ионным циклотронным резонансом на основе преобразования Фурье (см. текст ниже). Ионы электростатически захватываются на орбите вокруг центрального электрода в форме шпинделя. Электрод удерживает ионы так, что они оба вращаются вокруг центрального электрода и колеблются вперед и назад вдоль длинной оси центрального электрода. Эти колебания генерируют ток изображения в пластинах детектора, который регистрируется инструментом. Частоты этих токов изображения зависят от соотношений массы и заряда ионов. Масс-спектры получаются путем преобразования Фурье записанных токов изображения.
Орбитальные ловушки имеют высокую точность определения массы, высокую чувствительность и хороший динамический диапазон. [26]
_Mass_spectrometer.jpg/440px-IonSpec_FT-ICR_(Fourier_transform_Ion_cyclotron_resonance)_Mass_spectrometer.jpg)
Масс-спектрометрия с преобразованием Фурье (FTMS), или точнее ионно-циклотронный резонансный резонанс с преобразованием Фурье (МС), измеряет массу путем обнаружения тока изображения, создаваемого циклотронированием ионов в присутствии магнитного поля. Вместо измерения отклонения ионов с помощью детектора, такого как электронный умножитель , ионы вводятся в ловушку Пеннинга (статическую электрическую/магнитную ионную ловушку ), где они эффективно образуют часть цепи. Детекторы в фиксированных положениях в пространстве измеряют электрический сигнал ионов, которые проходят рядом с ними с течением времени, создавая периодический сигнал. Поскольку частота циклирования иона определяется его отношением массы к заряду, это можно деконволюцировать , выполнив преобразование Фурье над сигналом. FTMS имеет преимущество высокой чувствительности (поскольку каждый ион «подсчитывается» более одного раза) и гораздо более высокого разрешения и, следовательно, точности. [27] [28]
Ионный циклотронный резонанс (ИЦР) — это более старая методика анализа масс, похожая на FTMS, за исключением того, что ионы обнаруживаются с помощью традиционного детектора. Ионы, захваченные в ловушку Пеннинга, возбуждаются электрическим полем ВЧ до тех пор, пока они не ударятся о стенку ловушки, где расположен детектор. Ионы разной массы разделяются в соответствии со временем удара.

Последний элемент масс-спектрометра — детектор. Детектор регистрирует либо индуцированный заряд, либо ток, возникающий при прохождении иона мимо поверхности или ударе о нее. В сканирующем приборе сигнал, создаваемый детектором в ходе сканирования в зависимости от того, где находится прибор в сканировании (при каком m/Q ), даст масс-спектр , запись ионов как функции m/Q .
Обычно используется какой-либо тип электронного умножителя , хотя также используются и другие детекторы, включая цилиндры Фарадея и ионно-фотонные детекторы . Поскольку количество ионов, покидающих масс-анализатор в определенный момент времени, обычно довольно мало, для получения сигнала часто требуется значительное усиление. Микроканальные пластинчатые детекторы обычно используются в современных коммерческих приборах. [29] В FTMS и Orbitraps детектор состоит из пары металлических поверхностей в области масс-анализатора/ионной ловушки, которую ионы проходят только вблизи, когда они колеблются. Постоянный ток не производится, только слабый переменный ток изображения производится в цепи между электродами. Также использовались другие индуктивные детекторы. [30]
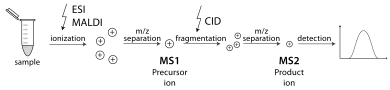
Тандемный масс-спектрометр — это тот, который способен проводить несколько раундов масс-спектрометрии, обычно разделенных некоторой формой фрагментации молекул. Например, один масс-анализатор может изолировать один пептид из многих, поступающих в масс-спектрометр. Затем ячейка столкновений стабилизирует ионы пептида, пока они сталкиваются с газом, заставляя их фрагментироваться посредством диссоциации, вызванной столкновениями (CID). Затем еще один масс-анализатор сортирует фрагменты, полученные из пептидов. Тандемную масс-спектрометрию также можно проводить в одном масс-анализаторе с течением времени, как в квадрупольной ионной ловушке . Существуют различные методы фрагментации молекул для тандемной масс-спектрометрии, включая диссоциацию, вызванную столкновениями (CID), диссоциацию с захватом электронов (ECD), диссоциацию с переносом электронов (ETD), инфракрасную многофотонную диссоциацию (IRMPD), инфракрасную радиационную диссоциацию черного тела (BIRD), диссоциацию с отрывом электронов (EDD) и поверхностно-индуцированную диссоциацию (SID). Важное применение тандемной масс-спектрометрии — идентификация белков. [31]
Тандемная масс-спектрометрия позволяет проводить различные экспериментальные последовательности. Многие коммерческие масс-спектрометры разработаны для ускорения выполнения таких рутинных последовательностей, как мониторинг выбранных реакций (SRM), сканирование ионов-предшественников, сканирование ионов-продуктов и сканирование нейтральных потерь. [32]
Другим типом тандемной масс-спектрометрии, используемым для радиоуглеродного датирования , является ускорительная масс-спектрометрия (УМС), которая использует очень высокие напряжения, обычно в диапазоне мегавольт, для ускорения отрицательных ионов в своего рода тандемном масс-спектрометре.
База данных метаболитов и химических сущностей METLIN [33] [34] [35] [36] является крупнейшим хранилищем экспериментальных данных тандемной масс-спектрометрии , полученных из стандартов. Данные тандемной масс-спектрометрии по более чем 930 000 молекулярных стандартов (по состоянию на январь 2024 г.) [33] [36] предоставляются для облегчения идентификации химических сущностей из экспериментов тандемной масс-спектрометрии. [37] В дополнение к идентификации известных молекул она также полезна для идентификации неизвестных с помощью поиска/анализа сходства. [38] Все данные тандемной масс-спектрометрии получены из экспериментального анализа стандартов при множественных энергиях столкновения и в режимах как положительной, так и отрицательной ионизации. [33]
Когда конкретная комбинация источника, анализатора и детектора становится общепринятой на практике, может возникнуть составная аббревиатура для ее краткого обозначения. Одним из примеров является MALDI-TOF , которая относится к комбинации источника лазерной десорбции/ионизации с матричным ассистированием и времяпролетного масс-анализатора. Другие примеры включают индуктивно связанную плазму-масс-спектрометрию (ИСП-МС) , ускорительную масс-спектрометрию (АМС) , термическую ионизацию-масс-спектрометрию (ТИМС) и искровую масс-спектрометрию (ССМС) .
Некоторые приложения масс-спектрометрии разработали прозвища, которые, хотя, строго говоря, казалось бы, относятся к широкому приложению, на практике стали обозначать определенное или ограниченное количество конфигураций приборов. Примером этого является изотопно-масс-спектрометрия (IRMS), которая на практике относится к использованию ограниченного количества секторных масс-анализаторов; это название используется для обозначения как приложения, так и прибора, используемого для приложения.
Важным улучшением возможностей масс-спектрометрии по разрешению и определению масс является ее использование в сочетании с хроматографическими и другими методами разделения.

Распространенной комбинацией является газовая хроматография-масс-спектрометрия (ГХ/МС или ГХ-МС). В этой технике газовый хроматограф используется для разделения различных соединений. Этот поток разделенных соединений подается в режиме онлайн в источник ионов , металлическую нить, к которой приложено напряжение . Эта нить испускает электроны, которые ионизируют соединения. Затем ионы могут далее фрагментироваться, давая предсказуемые закономерности. Неповрежденные ионы и фрагменты попадают в анализатор масс-спектрометра и в конечном итоге обнаруживаются. [39] Однако высокие температуры (300 °C), используемые в порту ввода ГХ-МС (и печи), могут привести к термической деградации введенных молекул, что приводит к измерению продуктов деградации вместо фактических интересующих молекул. [40]

Подобно газовой хроматографии МС (ГХ-МС), жидкостная хроматография-масс-спектрометрия (ЖХ/МС или ЖХ-МС) разделяет соединения хроматографически до того, как они попадают в источник ионов и масс-спектрометр. Она отличается от ГХ-МС тем, что подвижная фаза представляет собой жидкость, обычно смесь воды и органических растворителей , а не газ. Чаще всего в ЖХ-МС используется источник ионизации электрораспылением . Другими популярными и коммерчески доступными источниками ионов ЖХ-МС являются химическая ионизация при атмосферном давлении и фотоионизация при атмосферном давлении . Существуют также некоторые недавно разработанные методы ионизации, такие как лазерное распыление .
Капиллярный электрофорез-масс-спектрометрия (КЭ-МС) — это метод, который объединяет процесс разделения жидкости капиллярным электрофорезом с масс-спектрометрией. [41] КЭ-МС обычно сочетается с ионизацией электрораспылением. [42]
Спектрометрия подвижности ионов-масс-спектрометрия (IMS/MS или IMMS) - это метод, в котором ионы сначала разделяются по времени дрейфа через некоторый нейтральный газ под приложенным градиентом электрического потенциала, прежде чем они будут введены в масс-спектрометр. [43] Время дрейфа - это мера сечения столкновения относительно заряда иона. Рабочий цикл IMS (время, в течение которого происходит эксперимент) длиннее, чем у большинства масс-спектрометрических методов, так что масс-спектрометр может производить отбор проб в ходе разделения IMS. Это дает данные о разделении IMS и отношении массы к заряду ионов способом, аналогичным LC-MS . [44]
Рабочий цикл ИМС короче по сравнению с жидкостной хроматографией или газовой хроматографией разделения и, таким образом, может быть объединен с такими методами, создавая тройные модальности, такие как ЖХ/ИМС/МС. [45]

Масс-спектрометрия производит различные типы данных. Наиболее распространенным представлением данных является масс-спектр .
Определенные типы данных масс-спектрометрии лучше всего представлять в виде масс-хроматограммы . Типы хроматограмм включают в себя мониторинг выбранных ионов (SIM), полный ионный ток (TIC) и мониторинг выбранных реакций (SRM), среди многих других.
Другие типы данных масс-спектрометрии хорошо представляются в виде трехмерной контурной карты . В этой форме отношение массы к заряду, m/z, находится на оси x , интенсивность — на оси y , а дополнительный экспериментальный параметр, такой как время, записывается на оси z .
Анализ данных масс-спектрометрии специфичен для типа эксперимента, производящего данные. Общие подразделения данных имеют основополагающее значение для понимания любых данных.
Многие масс-спектрометры работают либо в режиме отрицательных ионов , либо в режиме положительных ионов . Очень важно знать, заряжены ли наблюдаемые ионы отрицательно или положительно. Это часто важно для определения нейтральной массы, но также указывает на что-то о природе молекул.
Различные типы источников ионов приводят к различным массивам фрагментов, полученных из исходных молекул. Источник электронной ионизации производит много фрагментов и в основном однозарядные (1-) радикалы (нечетное число электронов), тогда как источник электрораспыления обычно производит нерадикальные квазимолекулярные ионы, которые часто являются многозарядными. Тандемная масс-спектрометрия намеренно производит фрагментарные ионы после источника и может радикально изменить вид данных, полученных в ходе эксперимента.
Знание происхождения образца может дать представление о молекулах-компонентах образца и их фрагментации. Образец из процесса синтеза/производства, вероятно, будет содержать примеси, химически связанные с целевым компонентом. Грубо приготовленный биологический образец, вероятно, будет содержать определенное количество соли, которая может образовывать аддукты с молекулами аналита в определенных анализах.
Результаты также могут сильно зависеть от подготовки образца и того, как он был запущен/введен. Важным примером является вопрос о том, какая матрица используется для MALDI-пятнения, поскольку большая часть энергетики события десорбции/ионизации контролируется матрицей, а не мощностью лазера. Иногда образцы обогащаются натрием или другими видами, переносящими ионы, для получения аддуктов, а не протонированных видов.
Масс-спектрометрия может измерять молярную массу, молекулярную структуру и чистоту образца. Каждый из этих вопросов требует отдельной экспериментальной процедуры; поэтому адекватное определение экспериментальной цели является предпосылкой для сбора правильных данных и их успешной интерпретации.
Поскольку точная структура или пептидная последовательность молекулы расшифровывается через набор масс фрагментов, интерпретация масс-спектров требует комбинированного использования различных методов. Обычно первой стратегией для идентификации неизвестного соединения является сравнение его экспериментального масс-спектра с библиотекой масс-спектров. Если в результате поиска не найдено совпадений, необходимо выполнить ручную интерпретацию [46] или интерпретацию масс-спектров с помощью программного обеспечения . Компьютерное моделирование процессов ионизации и фрагментации, происходящих в масс-спектрометре, является основным инструментом для назначения структуры или пептидной последовательности молекуле. Априорная структурная информация фрагментируется in silico , и полученный шаблон сравнивается с наблюдаемым спектром. Такое моделирование часто поддерживается библиотекой фрагментации [47] , которая содержит опубликованные шаблоны известных реакций разложения. Программное обеспечение , использующее эту идею, было разработано как для малых молекул, так и для белков .
Анализ масс-спектров также может быть спектрами с точной массой . Значение отношения массы к заряду ( m/z ) с точностью только до целого числа может представлять огромное количество теоретически возможных ионных структур; однако более точные значения массы значительно сокращают количество потенциальных молекулярных формул . Компьютерный алгоритм, называемый генератором формул, вычисляет все молекулярные формулы, которые теоретически соответствуют заданной массе с указанным допуском.
Новейший метод выяснения структуры в масс-спектрометрии, называемый фингерпринтингом ионов-предшественников, идентифицирует отдельные фрагменты структурной информации путем проведения поиска тандемных спектров исследуемой молекулы по библиотеке спектров ионов-продуктов структурно охарактеризованных ионов-предшественников. [48]

Масс-спектрометрия имеет как качественное , так и количественное применение. К ним относятся идентификация неизвестных соединений, определение изотопного состава элементов в молекуле и определение структуры соединения путем наблюдения за его фрагментацией. Другие применения включают количественное определение количества соединения в образце или изучение основ газофазной ионной химии (химии ионов и нейтралов в вакууме). МС в настоящее время широко используется в аналитических лабораториях, которые изучают физические, химические или биологические свойства большого разнообразия соединений. Количественное определение может быть относительным (анализируется относительно эталонного образца) или абсолютным (анализируется с использованием метода стандартной кривой). [49] [50]
Как аналитический метод он обладает явными преимуществами, такими как: Повышенная чувствительность по сравнению с большинством других аналитических методов, поскольку анализатор, как фильтр массы-заряда, снижает фоновые помехи, Превосходная специфичность характерных паттернов фрагментации для идентификации неизвестных или подтверждения присутствия предполагаемых соединений, Информация о молекулярной массе, Информация об изотопном составе элементов, Временно разрешенные химические данные.
Недостатком метода является то, что он часто не различает оптические и геометрические изомеры и положения заместителя в о-, м- и п-положениях в ароматическом кольце. Кроме того, его область применения ограничена в идентификации углеводородов, которые производят подобные фрагментированные ионы.

Масс-спектрометрия также используется для определения изотопного состава элементов в образце. Различия в массе между изотопами элемента очень малы, а менее распространенные изотопы элемента обычно очень редки, поэтому требуется очень чувствительный прибор. Эти приборы, иногда называемые масс-спектрометрами изотопного отношения (ИК-МС), обычно используют один магнит для изгиба пучка ионизированных частиц в направлении серии цилиндров Фарадея , которые преобразуют удары частиц в электрический ток . Быстрый онлайн-анализ содержания дейтерия в воде можно выполнить с помощью масс-спектрометрии с проточным послесвечением , FA-MS. Вероятно, самым чувствительным и точным масс-спектрометром для этой цели является ускорительный масс-спектрометр (AMS). Это связано с тем, что он обеспечивает максимальную чувствительность, способную измерять отдельные атомы и измерять нуклиды с динамическим диапазоном ~10 15 относительно основного стабильного изотопа. [51] Изотопные отношения являются важными маркерами различных процессов. Некоторые изотопные соотношения используются для определения возраста материалов, например, при углеродном датировании . Маркировка стабильными изотопами также используется для количественной оценки белков. (см. характеристику белков ниже)
Масс-спектрометрия с введением мембраны объединяет изотопное отношение MS с реакционной камерой/ячейкой, разделенной газопроницаемой мембраной. Этот метод позволяет изучать газы по мере их выделения в растворе. Этот метод широко использовался для изучения производства кислорода фотосистемой II . [52]
В нескольких методах используются ионы, созданные в специальном источнике ионов, вводимом в проточную или дрейфовую трубку: выбранная проточная трубка с ионами (SIFT-MS) и реакция переноса протонов (PTR-MS) — это варианты химической ионизации, предназначенные для анализа следов газа в воздухе, дыхании или свободном пространстве жидкости с использованием четко определенного времени реакции, что позволяет рассчитывать концентрации аналитов на основе известной кинетики реакции без необходимости использования внутреннего стандарта или калибровки.
Другой метод, применяемый в области анализа следов газа, — это вторичная электрораспылительная ионизация (SESI-MS), которая является вариантом электрораспылительной ионизации . SESI состоит из электрораспылительной струи чистого подкисленного растворителя, который взаимодействует с нейтральными парами. Молекулы пара ионизируются при атмосферном давлении, когда заряд передается от ионов, образованных в электрораспылении, к молекулам. Одним из преимуществ этого подхода является то, что он совместим с большинством систем ESI-MS. [53] [54]

Анализатор остаточного газа (RGA) представляет собой небольшой и обычно прочный масс-спектрометр , обычно предназначенный для управления процессами и мониторинга загрязнений в вакуумных системах . При конструкции квадрупольного масс-анализатора существуют две реализации, использующие либо открытый источник ионов (OIS), либо закрытый источник ионов (CIS). RGA можно найти в приложениях с высоким вакуумом, таких как исследовательские камеры, установки для изучения поверхности , ускорители , сканирующие микроскопы и т. д. RGA используются в большинстве случаев для контроля качества вакуума и легкого обнаружения мельчайших следов примесей в газовой среде низкого давления. Эти примеси можно измерить вплоть до уровней Торр , обладая обнаруживаемостью ниже ppm при отсутствии фоновых помех.
RGA также могут использоваться в качестве чувствительных детекторов утечек in situ, обычно использующих гелий , изопропиловый спирт или другие молекулы-индикаторы. При откачке вакуумных систем ниже Торр — проверка целостности вакуумных уплотнений и качества вакуума — утечки воздуха, виртуальные утечки и другие загрязняющие вещества на низких уровнях могут быть обнаружены до начала процесса.Атомный зонд — это прибор, который объединяет времяпролетную масс-спектрометрию и микроскопию полевого испарения для картирования местоположения отдельных атомов.
Фармакокинетика часто изучается с помощью масс-спектрометрии из-за сложной природы матрицы (часто крови или мочи) и необходимости высокой чувствительности для наблюдения за данными низкой дозы и длительных временных точек. Наиболее распространенным прибором, используемым в этом приложении, является ЖХ-МС с тройным квадрупольным масс-спектрометром . Тандемная масс-спектрометрия обычно используется для дополнительной специфичности. Стандартные кривые и внутренние стандарты используются для количественного определения обычно одного фармацевтического препарата в образцах. Образцы представляют различные временные точки, когда фармацевтический препарат вводится, а затем метаболизируется или выводится из организма. Пустые или t=0 образцы, взятые перед введением, важны для определения фона и обеспечения целостности данных с такими сложными матрицами образцов. Большое внимание уделяется линейности стандартной кривой; однако нередко используют подгонку кривой с более сложными функциями, такими как квадратичные, поскольку отклик большинства масс-спектрометров менее линейный в больших диапазонах концентраций. [55] [56] [57]
В настоящее время наблюдается значительный интерес к использованию высокочувствительной масс-спектрометрии для исследований микродозирования , которые рассматриваются как многообещающая альтернатива экспериментам на животных .
Недавние исследования показывают, что вторичная электрораспылительная ионизация (SESI) является мощным методом мониторинга кинетики лекарственных средств с помощью анализа дыхания. [58] [59] Поскольку дыхание вырабатывается естественным образом, можно легко собрать несколько точек данных. Это позволяет значительно увеличить количество собранных точек данных. [60] В исследованиях на животных этот подход SESI может сократить количество жертвоприношений животных. [59] У людей неинвазивный анализ дыхания SESI-MS может помочь изучить кинетику лекарственных средств на персонализированном уровне. [58] [61] [62]
Масс-спектрометрия является важным методом для характеристики и секвенирования белков. Два основных метода ионизации целых белков - это электрораспылительная ионизация (ESI) и матрично-ассистированная лазерная десорбция/ионизация (MALDI). В соответствии с производительностью и массовым диапазоном доступных масс-спектрометров, для характеристики белков используются два подхода. В первом случае интактные белки ионизируются одним из двух методов, описанных выше, а затем вводятся в масс-анализатор. Этот подход называется стратегией анализа белков " сверху вниз ". Однако подход "сверху вниз" в значительной степени ограничен низкопроизводительными исследованиями отдельных белков. Во втором случае белки ферментативно расщепляются на более мелкие пептиды с использованием протеаз, таких как трипсин или пепсин , либо в растворе , либо в геле после электрофоретического разделения. Также используются другие протеолитические агенты. Сбор пептидных продуктов часто разделяется хроматографией перед введением в масс-анализатор. Когда характерный рисунок пептидов используется для идентификации белка, метод называется пептидной масс-фингерпринтингом (PMF), если идентификация выполняется с использованием данных последовательности, определенных в тандемном MS- анализе, это называется de novo пептидным секвенированием . Эти процедуры анализа белка также называются подходом « снизу вверх » и также использовались для анализа распределения и положения посттрансляционных модификаций, таких как фосфорилирование белков. [63] Третий подход также начинает использоваться, этот промежуточный подход «среднего вниз» включает анализ протеолитических пептидов, которые больше типичного триптического пептида. [64]

В качестве стандартного метода анализа масс-спектрометры достигли других планет и лун. Два были доставлены на Марс программой Viking . В начале 2005 года миссия Cassini-Huygens доставила специализированный прибор GC-MS на борту зонда Huygens через атмосферу Титана , крупнейшего спутника планеты Сатурн . Этот прибор анализировал атмосферные образцы по траектории его спуска и смог испарять и анализировать образцы замороженной, покрытой углеводородами поверхности Титана после приземления зонда. Эти измерения сравнивают обилие изотопа(ов) каждой частицы с естественным обилием на Земле. [65] Также на борту космического аппарата Cassini-Huygens был ионный и нейтральный масс-спектрометр, который проводил измерения состава атмосферы Титана, а также состава шлейфов Энцелада . Масс-спектрометр Thermal and Evolved Gas Analyzer был установлен на Mars Phoenix Lander, запущенном в 2007 году. [66]
Масс-спектрометры также широко используются в космических миссиях для измерения состава плазмы. Например, космический аппарат Кассини нес плазменный спектрометр Кассини (CAPS), [67] который измерял массу ионов в магнитосфере Сатурна .
Масс-спектрометры использовались в больницах для анализа дыхательных газов с 1975 года до конца века. Некоторые из них, вероятно, все еще используются, но ни один из них в настоящее время не производится. [68]
Находясь в основном в операционной , они были частью сложной системы, в которой образцы вдыхаемого газа пациентов, находящихся под наркозом, втягивались в прибор через клапанный механизм, предназначенный для последовательного подключения до 32 комнат к масс-спектрометру. Компьютер управлял всеми операциями системы. Данные, собранные с масс-спектрометра, доставлялись в отдельные комнаты для использования анестезиологом.
Уникальность этого магнитного секторного масс-спектрометра, возможно, заключалась в том, что плоскость детекторов, каждый из которых был специально расположен для сбора всех видов ионов, которые, как ожидалось, должны были быть в образцах, позволяла прибору одновременно сообщать обо всех газах, вдыхаемых пациентом. Хотя диапазон масс был ограничен немногим более 120 а.е.м. , фрагментация некоторых более тяжелых молекул свела на нет необходимость в более высоком пределе обнаружения. [69]
Основная функция масс-спектрометрии — быть инструментом для химического анализа, основанного на обнаружении и количественной оценке ионов в соответствии с их отношением массы к заряду. Однако масс-спектрометрия также показывает перспективы для синтеза материалов. [51] Мягкая посадка ионов характеризуется осаждением целых видов на поверхности при низких кинетических энергиях, что исключает фрагментацию падающих видов. [70] Метод мягкой посадки был впервые описан в 1977 году для реакции низкоэнергетических серосодержащих ионов на поверхности свинца. [71]