Меланома — самый опасный вид рака кожи ; он развивается из клеток, производящих меланин , известных как меланоциты . [1] Обычно она возникает на коже, но редко может возникать во рту, кишечнике или глазах ( увеальная меланома ). [1] [2] У женщин меланомы чаще всего возникают на ногах; а у мужчин - на спине. [2] Меланому часто называют злокачественной меланомой . Однако медицинское сообщество подчеркивает, что не существует такого понятия, как «доброкачественная меланома», и рекомендует избегать термина «злокачественная меланома» как излишнего . [7] [8] [9]
Около 25% меланом развиваются из родинок . [2] Изменения в родинке, которые могут указывать на меланому, включают увеличение (особенно быстрое) размера, неровные края, изменение цвета, зуд или повреждение кожи . [1]
Основной причиной меланомы является воздействие ультрафиолетового света (УФ) у людей с низким уровнем кожного пигмента меланина . [2] [10] УФ-излучение может исходить от солнца или других источников, например, от устройств для загара . [2] Те, у кого много родинок, больные члены семьи в анамнезе и плохая иммунная функция, подвергаются большему риску. [1] Ряд редких генетических заболеваний , таких как пигментная ксеродермия , также повышают риск. [11] Диагноз ставится на основе биопсии и анализа любого поражения кожи, имеющего признаки потенциально ракового заболевания. [1]
Избегание ультрафиолетового излучения и использование солнцезащитного крема в условиях яркого ультрафиолетового излучения может предотвратить меланому. [2] Лечение обычно заключается в хирургическом удалении меланомы и потенциально пораженных прилегающих тканей, граничащих с меланомой. [1] У пациентов с раком немного большего размера можно проверить близлежащие лимфатические узлы на предмет распространения ( метастазирования ). [1] Большинство людей излечиваются, если не появилось метастазов. [1] Для тех, у кого меланома распространилась, иммунотерапия , биологическая терапия , лучевая терапия или химиотерапия могут улучшить выживаемость. [1] [12] При лечении пятилетняя выживаемость в Соединенных Штатах составляет 99% среди лиц с локализованным заболеванием, 65%, когда заболевание распространилось на лимфатические узлы, и 25% среди лиц с отдаленным распространением. [4] Вероятность повторного возникновения или распространения меланомы зависит от ее толщины , скорости деления клеток и того, разрушилась ли лежащая над ней кожа. [2]
Меланома – самый опасный вид рака кожи. [2] Во всем мире в 2012 году это заболевание впервые произошло у 232 000 человек. [2] В 2015 году у 3,1 миллиона человек было активное заболевание, в результате которого 59 800 человек умерли. [5] [6] Австралия и Новая Зеландия имеют самый высокий уровень заболеваемости меланомой в мире. [2] Высокие показатели также наблюдаются в Северной Европе и Северной Америке, тогда как в Азии, Африке и Латинской Америке это встречается реже. [2] В США меланома встречается примерно в 1,6 раза чаще у мужчин, чем у женщин. [13] Меланома стала более распространенной с 1960-х годов в районах, в основном населенных людьми европейского происхождения . [2] [11]
Ранними признаками меланомы являются изменения формы или цвета существующих родинок или, в случае узловой меланомы , появление новой шишки в любом месте кожи. На более поздних стадиях родинка может чесаться , изъязвляться или кровоточить. Ранние признаки меланомы обобщаются мнемоникой «ABCDEEFG»: [14] [15]
Эта классификация не распространяется на узловую меланому, которая имеет свои классификации: [16]
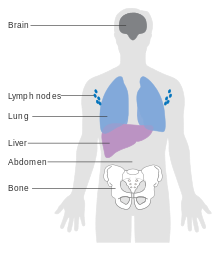
Метастатическая меланома может вызывать неспецифические паранеопластические симптомы , включая потерю аппетита, тошноту , рвоту и усталость. Метастазирование (распространение) ранней меланомы возможно, но сравнительно редко; менее одной пятой меланомы, диагностированной на ранней стадии, становятся метастатическими. Метастазы в головной мозг особенно часто встречаются у пациентов с метастатической меланомой. [17] Он также может распространиться на печень, кости, брюшную полость или отдаленные лимфатические узлы. [ нужна цитата ]
Меланомы обычно возникают в результате повреждения ДНК в результате воздействия ультрафиолетового излучения солнца. Генетика также играет роль. [18] [19] Меланома также может возникать на участках кожи, мало подвергающихся воздействию солнечных лучей (например, рот, подошвы ног, ладони, области гениталий). [20] Люди с синдромом диспластического невуса , также известным как семейная атипичная меланома множественных родинок, подвергаются повышенному риску развития меланомы. [21]
Наличие более 50 родинок указывает на повышенный риск возникновения меланомы. Ослабленная иммунная система облегчает развитие рака из-за ослабленной способности организма бороться с раковыми клетками. [18]
Воздействие ультрафиолетового излучения соляриев увеличивает риск развития меланомы. [22] Международное агентство по изучению рака обнаружило, что солярии «канцерогенны для человека» и что люди, которые начинают использовать устройства для загара в возрасте до тридцати лет, имеют на 75% больше шансов заболеть меланомой. [23]
Те, кто работает в самолетах, также подвергаются повышенному риску, предположительно из-за большего воздействия ультрафиолета. [24]
Свет UVB , исходящий от солнца с длиной волны от 315 до 280 нм, поглощается непосредственно ДНК в клетках кожи. что приводит к типу прямого повреждения ДНК , называемому димерами циклобутан-пиримидина . Димеры тимина , цитозина или цитозин-тимина образуются путем соединения двух соседних пиримидиновых оснований внутри цепи ДНК. Свет UVA имеет длину волны больше, чем UVB (от 400 до 315 нм); и он также может поглощаться непосредственно ДНК в клетках кожи, но с более низкой эффективностью — примерно от 1/100 до 1/1000 от UVB. [25]
Воздействие радиации (UVA и UVB) является основным фактором развития меланомы. [26] Периодическое чрезмерное пребывание на солнце, приводящее к « солнечным ожогам » на участках человеческого тела, причинно связано с меланомой; [27] , и такие области лишь периодического воздействия, по-видимому, объясняют, почему меланома чаще встречается на спине у мужчин и на ногах у женщин. Судя по всему, на риск сильно влияют социально-экономические условия, а не занятия в помещении или на открытом воздухе; это чаще встречается у профессиональных и административных работников, чем у неквалифицированных рабочих. [28] [29] Другими факторами являются мутации (или полная потеря) генов-супрессоров опухоли . Использование соляриев с глубоко проникающими лучами UVA связано с развитием рака кожи, включая меланому. [30]
Возможные важные элементы, определяющие риск, включают интенсивность и продолжительность пребывания на солнце, возраст, в котором происходит пребывание на солнце, и степень пигментации кожи . Заболеваемость меланомой, как правило, самая высокая в странах, заселенных мигрантами из Северной Европы, где много прямого и интенсивного солнечного света, к которому кожа поселенцев не адаптирована, особенно в Австралии. Воздействие в детстве является более важным фактором риска, чем воздействие во взрослом возрасте. Это видно из миграционных исследований в Австралии. [31]
Многократные серьезные солнечные ожоги увеличивают вероятность того, что в будущем солнечные ожоги перерастут в меланому из-за кумулятивного повреждения. [18] Солнечный свет с высоким содержанием УФ-излучения и солярии являются основными источниками УФ-излучения, которые увеличивают риск развития меланомы [32] , а жизнь вблизи экватора увеличивает воздействие УФ-излучения. [18]
Ряд редких мутаций, которые часто передаются в семьях, значительно повышают восприимчивость к меланоме. [33] Некоторые гены повышают риск. Некоторые редкие гены имеют относительно высокий риск возникновения меланомы; некоторые более распространенные гены, такие как ген MC1R , вызывающий рыжие волосы, имеют относительно меньший повышенный риск. Для поиска мутаций можно использовать генетическое тестирование . [ нужна цитата ]
Один класс мутаций затрагивает ген CDKN2A . Альтернативная мутация рамки считывания в этом гене приводит к дестабилизации р53 , фактора транскрипции , участвующего в апоптозе и в 50% случаев рака у человека. Другая мутация в том же гене приводит к образованию нефункционального ингибитора CDK4 , циклин - зависимой киназы , которая способствует делению клеток . Мутации, вызывающие пигментную ксеродерму (XP), также повышают восприимчивость к меланоме. Разбросанные по всему геному, эти мутации снижают способность клетки восстанавливать ДНК. Мутации CDKN2A и XP обладают высокой проникающей способностью (шансы носителя проявить фенотип высоки). [ нужна цитата ]
Семейная меланома генетически гетерогенна [19] , и локусы семейной меланомы появляются на плечах хромосомы 1p, 9p и 12q. С патогенезом (развитием заболевания) меланомы связаны многочисленные генетические события . [34] Ген множественного супрессора опухолей 1 (CDKN2A/MTS1) кодирует p16INK4a – низкомолекулярный белковый ингибитор циклин-зависимых протеинкиназ (CDK) – который локализован в области p21 человеческой хромосомы 9 . [35] FAMMM обычно характеризуется наличием 50 или более комбинированных родинок в дополнение к семейному анамнезу меланомы. [20] Он передается аутосомно-доминантно и в основном связан с мутациями CDKN2A . [20] У людей с мутацией CDKN2A, связанной с FAMMM, риск развития рака поджелудочной железы увеличивается в 38 раз. [36]
Другие мутации представляют меньший риск, но более распространены в популяции. У людей с мутациями в гене MC1R вероятность развития меланомы в два-четыре раза выше, чем у людей с двумя копиями дикого типа (типичный незатронутый тип). Мутации MC1R очень распространены, и у всех рыжеволосых людей есть мутированная копия. [ нужна цитация ] Мутация гена MDM2 SNP309 связана с повышенным риском для молодых женщин. [37]
В группу повышенного риска входят светловолосые и рыжеволосые люди, лица с множественными атипичными или диспластическими невусами и лица, родившиеся с гигантскими врожденными меланоцитарными невусами . [38]
Семейный анамнез меланомы значительно увеличивает риск для человека, поскольку в семьях, склонных к меланоме, обнаружены мутации в нескольких генах. [39] [18] Люди с одной меланомой в анамнезе подвергаются повышенному риску развития второй первичной опухоли. [40]
Светлая кожа является результатом меньшего количества меланина в коже, что означает меньшую защиту от УФ-излучения. [18]


Самая ранняя стадия меланомы начинается, когда меланоциты начинают неконтролируемый рост. Меланоциты находятся между внешним слоем кожи (эпидермисом ) и следующим слоем ( дермой ). Эта ранняя стадия заболевания называется фазой радиального роста, когда опухоль имеет толщину менее 1 мм и распространяется на уровне базального эпидермиса. [41] Поскольку раковые клетки еще не достигли кровеносных сосудов, расположенных глубже в коже, маловероятно, что меланома на ранней стадии распространится на другие части тела. Если меланома обнаруживается на этой стадии, ее обычно можно полностью удалить хирургическим путем. [ нужна цитата ]
Когда опухолевые клетки начинают двигаться в другом направлении – вертикально вверх в эпидермис и в сосочковую дерму – поведение клеток резко меняется. [42]
Следующим шагом в эволюции является фаза инвазивного радиального роста, во время которой отдельные клетки начинают приобретать инвазивный потенциал. С этого момента меланома способна распространяться. [ нужна цитация ] Глубина поражения по Бреслоу обычно составляет менее 1 мм (0,04 дюйма ), тогда как уровень Кларка обычно составляет 2.
Следующей фазой вертикального роста (VGP) является инвазивная меланома. Опухоль становится способной прорастать в окружающие ткани и распространяться по организму через кровеносные или лимфатические сосуды . Толщина опухоли обычно превышает 1 мм (0,04 дюйма ), и опухоль поражает более глубокие части дермы.
Хозяин вызывает иммунологическую реакцию против опухоли во время ВГП [43] , о которой судят по наличию и активности инфильтрирующих опухоль лимфоцитов (TIL). Эти клетки иногда полностью разрушают первичную опухоль; это называется регрессией, которая является последней стадией развития. В некоторых случаях первичная опухоль полностью разрушается и обнаруживается только метастатическая опухоль. Около 40% меланом человека содержат активирующие мутации, влияющие на структуру белка B-Raf , что приводит к конститутивной передаче сигналов через путь киназы Raf-MAP . [44]
Причиной, общей для большинства видов рака, является повреждение ДНК. [45] UVA-излучение в основном вызывает димеры тимина . [46] UVA также производит активные формы кислорода , которые вызывают другие повреждения ДНК, в первую очередь однонитевые разрывы, окисленные пиримидины и окисленный пуриновый 8-оксогуанин (мутагенное изменение ДНК) на 1/10, 1/10 и 1/3. частоты димеров тимина, индуцированных UVA, соответственно.
Если их не восстановить, фотопродукты циклобутанпиримидинового димера (ЦПД) могут привести к мутациям из-за неточного синтеза транслейкоза во время репликации или репарации ДНК. Наиболее частыми мутациями, вызванными неточным синтезом прошлых CPD, являются мутации перехода цитозина в тимин (C>T) или CC>TT . Их обычно называют мутациями УФ-отпечатков пальцев, поскольку они являются наиболее специфичной мутацией, вызываемой УФ-излучением, и часто обнаруживаются на коже, подвергающейся воздействию солнечных лучей, но редко обнаруживаются во внутренних органах. [47] Ошибки в репарации ДНК УФ-фотопродуктов или неправильный синтез этих фотопродуктов также могут привести к делециям, инсерциям и хромосомным транслокациям .
Были секвенированы полные геномы 25 меланом. [48] В среднем в геноме меланомы обнаружено около 80 000 мутированных оснований (в основном переходы C>T) и около 100 структурных перестроек. Это намного больше, чем примерно 70 мутаций в разных поколениях (от родителей к детям). [49] [50] Среди 25 меланом около 6000 генов, кодирующих белки, имели миссенс- , нонсенс-мутации или мутации сайта сплайсинга . Транскриптомы более 100 меланом также были секвенированы и проанализированы. Почти 70% всех генов, кодирующих человеческие белки, экспрессируются при меланоме. Большинство этих генов также экспрессируются в других нормальных и раковых тканях, при этом около 200 генов демонстрируют более специфичный характер экспрессии при меланоме по сравнению с другими формами рака. Примерами генов, специфичных для меланомы, являются тирозиназа , MLANA и PMEL . [51] [52]
УФ-излучение вызывает повреждение ДНК клеток, обычно димеризацию тимина, которая, если ее не восстановить, может вызвать мутации в генах клетки. Этот сильный мутагенный фактор делает меланому кожи типом опухоли с наибольшим количеством мутаций. [53] Когда клетка делится , эти мутации передаются новым поколениям клеток. Если мутации возникают в протоонкогенах или генах-супрессорах опухолей , скорость митоза в клетках, несущих мутации, может стать неконтролируемой, что приведет к образованию опухоли . Данные пациентов позволяют предположить, что аберрантные уровни активирующего транскрипционного фактора в ядре клеток меланомы связаны с повышенной метастатической активностью клеток меланомы; [54] [55] [56] исследования рака кожи на мышах, как правило, подтверждают роль активации транскрипционного фактора-2 в прогрессировании рака. [57] [58]
Раковые стволовые клетки также могут быть вовлечены. [59]
Крупномасштабные исследования, такие как «Атлас генома рака» , выявили рецидивирующие соматические изменения, которые, вероятно, способствуют возникновению и развитию меланомы кожи. Исследование Атласа генома рака выявило четыре подтипа: мутант BRAF , мутант RAS , мутант NF1 и тройной дикий тип. [60]
Наиболее часто мутация возникает в 600-м кодоне BRAF (50% случаев). BRAF обычно участвует в росте клеток, и эта специфическая мутация делает белок конститутивно активным и независимым от нормальной физиологической регуляции, тем самым способствуя росту опухоли. [61] Гены RAS ( NRAS , HRAS и KRAS ) также подвергаются рекуррентным мутациям (30% случаев TCGA), а мутации в 61-м или 12-м кодонах вызывают онкогенную активность. Мутации потери функции часто затрагивают гены-супрессоры опухолей , такие как NF1 , TP53 и CDKN2A . Другие онкогенные изменения включают слияния с участием различных киназ, таких как BRAF, [62] RAF1, [63] ALK, RET, ROS1, NTRK1., [64] NTRK3 [65] и MET [66] BRAF, RAS и мутации NF1 и киназ. слияния являются в высшей степени взаимоисключающими, поскольку встречаются у разных групп пациентов. Таким образом, оценка мутационного статуса может улучшить стратификацию пациентов и предоставить информацию для таргетной терапии с использованием специфических ингибиторов. [ нужна цитата ]
В некоторых случаях (3-7%) мутированные версии BRAF и NRAS подвергаются амплификации числа копий . [60]
Исследование, проведенное командой Сарны, доказало, что сильно пигментированные клетки меланомы имеют модуль Юнга около 4,93, тогда как у непигментированных клеток он составляет всего 0,98. [67] В другом эксперименте они обнаружили, что эластичность клеток меланомы важна для ее метастазирования и роста: непигментированные опухоли были больше, чем пигментированные, и им было гораздо легче распространяться. Они показали, что в опухолях меланомы есть как пигментированные, так и непигментированные клетки , поэтому они могут быть как устойчивыми к лекарствам, так и метастатическими. [67]

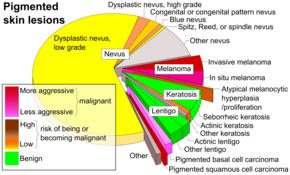
Осмотр или визуальный осмотр рассматриваемой области является наиболее распространенным методом подозрения на меланому. [68] Родинки неправильного цвета и формы обычно рассматриваются как кандидаты. Для выявления меланом (и повышения выживаемости) рекомендуется научиться распознавать их (см. мнемосхему «ABCDE»), регулярно осматривать родинки на предмет изменений (формы, размера, цвета, зуда или кровотечения) и при необходимости обращаться к квалифицированному врачу. появляется кандидат. [69] [70] Осмотр подозрительных поражений кожи при личном осмотре более точен, чем визуальный осмотр изображений подозрительных поражений кожи. [71] При использовании обученными специалистами дерматоскопия более полезна для выявления злокачественных поражений, чем использование только невооруженного глаза. [72] Отражательная конфокальная микроскопия может иметь лучшую чувствительность и специфичность, чем дерматоскопия, при диагностике меланомы кожи, но для подтверждения этого результата необходимы дополнительные исследования. [73]
Однако многие меланомы представляют собой очаги диаметром менее 6 мм, и все меланомы считаются злокачественными, когда они впервые появляются в виде маленькой точки. Врачи обычно исследуют все родинки, в том числе диаметром менее 6 мм. Себорейный кератоз может соответствовать некоторым или всем критериям ABCD и может приводить к ложным тревогам . Врачи обычно могут отличить себорейный кератоз от меланомы при осмотре или с помощью дерматоскопии . [ нужна цитата ]
Некоторые выступают за замену «увеличения» на «эволюцию»: родинки, которые меняются и развиваются, вызывают беспокойство. Альтернативно, некоторые практикующие предпочитают «возвышение». Возвышение может помочь идентифицировать меланому, но отсутствие возвышения не означает, что поражение не является меланомой. Большинство меланом в США выявляются до того, как они достигают повышенного уровня. К тому времени, когда станет видно возвышение, они могут перейти в более опасную инвазивную стадию. [ нужна цитата ]
Одним из методов является « знак гадкого утенка ». [74] Выполнена корреляция общих характеристик поражений. Поражения, отклоняющиеся от общих характеристик, называют «гадким утенком», и требуется дальнейшее профессиональное обследование. Знак « Красной Шапочки » [74] предполагает, что у людей со светлой кожей и светлыми волосами могут быть трудно диагностируемые амеланотические меланомы . При обследовании таких лиц требуется особая осторожность, поскольку у них могут быть множественные меланомы и тяжелые диспластические невусы. Для обнаружения «гадких утят» необходимо использовать дерматоскоп, так как многие меланомы у этих особей напоминают немеланомы или считаются « волками в овечьей шкуре ». [75] У этих людей со светлой кожей часто наблюдаются слегка пигментированные или бесцветные меланомы, которые не демонстрируют легко наблюдаемых изменений цвета и вариаций. Их границы часто нечеткие, что затрудняет визуальную идентификацию без дерматоскопа.
Амеланотические меланомы и меланомы, возникающие у светлокожих людей, очень трудно обнаружить, поскольку они не проявляют многих характеристик правила ABCD, не нарушают признак «гадкого утенка» и их трудно отличить от рубцов после прыщей, укусов насекомых, дерматофибромы , или лентиго .
После визуального осмотра и дерматоскопического исследования [75] или использования диагностических инструментов in vivo , таких как конфокальный микроскоп, врач может провести биопсию подозрительной родинки. Биопсия кожи , выполняемая под местной анестезией, часто требуется для постановки или подтверждения диагноза, а также определения степени тяжести. Эллиптическая эксцизионная биопсия может удалить опухоль с последующим гистологическим анализом и оценкой Бреслоу. Инцизионная биопсия, такая как пункционная биопсия , обычно противопоказана при подозрении на меланому из-за возможности ошибки отбора проб [76] или локальной имплантации, приводящей к неправильной оценке толщины опухоли. [77] [78] Однако опасения, что такие биопсии могут увеличить риск метастатического заболевания, кажутся необоснованными. [79] [80]
Общая фотография тела, которая предполагает фотографическое документирование как можно большей поверхности тела, часто используется во время наблюдения за пациентами из группы высокого риска. Сообщается, что этот метод обеспечивает раннее обнаружение и обеспечивает экономически эффективный подход (с любой цифровой камерой), но его эффективность подвергается сомнению из-за его неспособности обнаруживать макроскопические изменения. [68] Этот метод диагностики следует использовать в сочетании с дерматоскопической визуализацией (а не вместо нее), при этом комбинация обоих методов дает чрезвычайно высокие показатели обнаружения.
Меланома — разновидность нейроэктодермального новообразования . [81] Существует четыре основных типа меланомы: [82]
Другими гистопатологическими типами являются:

Меланома in situ не прорастает за пределы базальной мембраны , тогда как инвазивная меланома распространилась за ее пределы.
Некоторые гистопатологические типы меланомы по своей природе инвазивны, в том числе узловая меланома и меланома злокачественного лентиго , где аналогом меланомы злокачественного лентиго in situ является злокачественное лентиго . [85] Злокачественное лентиго иногда классифицируют как очень раннюю меланому, [86] а иногда и как предшественник меланомы. [87]
Поверхностно распространяющиеся меланомы и акральные лентигинозные меланомы могут быть как in situ , так и инвазивными [88] , но акральные лентигинозные меланомы почти всегда инвазивны. [89]
Дополнительную информацию о стадиях рака можно получить на сайте TNM .

Метастатические меланомы можно обнаружить с помощью рентгенографии, компьютерной томографии, МРТ, ПЭТ и ПЭТ/КТ, ультразвука, тестирования ЛДГ и фотоакустического обнаружения. [90] Однако недостаточно доказательств точности определения стадии у людей с меланомой с помощью различных методов визуализации. [91]
Стадии меланомы по данным AJCC , 8-е издание: [92]
Для стадий 1 и 2 требуется класс N (лимфатический узел):
Для стадий 1, 2 и 3 требуется М (статус метастазов):
Более старые системы включают « уровень Кларка » и « глубину Бреслоу », количественно определяющие микроскопическую глубину инвазии опухоли.

Тесты на лактатдегидрогеназу (ЛДГ) часто используются для выявления метастазов , хотя многие пациенты с метастазами (даже на терминальной стадии) имеют нормальный уровень ЛДГ; чрезвычайно высокий уровень ЛДГ часто указывает на метастатическое распространение заболевания в печень.
Пациентам с диагнозом меланома обычно проводят рентгенографию грудной клетки и тест на ЛДГ, а в некоторых случаях КТ , МРТ и/или ПЭТ . Хотя это и противоречиво, но биопсию сторожевых лимфатических узлов и исследование лимфатических узлов также проводят пациентам для оценки распространения инфекции в лимфатические узлы. Диагноз меланомы подтверждается наличием белка-маркера S-100 .
HMB-45 представляет собой моноклональное антитело, которое реагирует на антиген, присутствующий в меланоцитарных опухолях, таких как меланома. Его используют в анатомической патологии как маркер таких опухолей. Антитело было получено к экстракту меланомы. Он положительно реагирует на меланоцитарные опухоли, но не на другие опухоли, демонстрируя тем самым специфичность и чувствительность. Антитело также положительно реагирует на клетки соединительного невуса, но не на внутридермальные невусы, и на фетальные меланоциты, но не на нормальные взрослые меланоциты.
HMB-45 не реагирует практически на все немеланомные злокачественные новообразования человека, за исключением редких опухолей с признаками меланогенеза (например, пигментная шваннома, светлоклеточная саркома) или опухолей, связанных с комплексом туберозного склероза (ангиомиолипома и лимфангиомиома).
Нет никаких доказательств, подтверждающих или опровергающих скрининг взрослого населения на злокачественную меланому. [93]
Защиту могут обеспечить сведение к минимуму воздействия источников ультрафиолетового излучения (солнце и солярии), [94] соблюдение мер по защите от солнца и ношение солнцезащитной одежды (рубашек с длинными рукавами, длинных брюк и широкополых шляп).
Когда-то считалось, что использование искусственного света для загара помогает предотвратить рак кожи, но на самом деле оно может привести к увеличению заболеваемости меланомой. [95]
УФ-лампы для ногтей, которые используются в маникюрных салонах для сушки лака для ногтей, являются еще одним распространенным и широко распространенным источником УФ-излучения, которого можно избежать. [96] [97] Хотя риск развития рака кожи при использовании УФ-лампы для ногтей невелик, перед использованием УФ-лампы для ногтей все же рекомендуется носить перчатки без пальцев и/или наносить на руки солнцезащитный крем с SPF 30 или выше. [96] [97]
Организм использует ультрафиолетовый свет для выработки витамина D , поэтому необходимо сбалансировать получение достаточного количества солнечного света для поддержания здорового уровня витамина D и снижения риска развития меланомы; организму требуется около получаса солнечного света, чтобы выработать витамин D в течение дня, и это примерно столько же времени, сколько людям со светлой кожей требуется, чтобы получить солнечный ожог. Воздействие солнечного света может быть прерывистым, а не все сразу. [98]
Солнцезащитный крем , по-видимому, эффективен в предотвращении меланомы. [2] [10] В прошлом рекомендовалось использовать солнцезащитные кремы с фактором защиты от солнца (SPF) 50 или выше на открытых участках; поскольку старые солнцезащитные кремы более эффективно блокировали UVA с более высоким SPF. [99] В настоящее время новые солнцезащитные ингредиенты ( авобензон , оксид цинка и диоксид титана ) эффективно блокируют как UVA, так и UVB даже при более низких SPF. Солнцезащитный крем также защищает от плоскоклеточного рака , другого рака кожи. [100]
Высказывались опасения, что солнцезащитный крем может создать ложное чувство безопасности от вредного воздействия солнечных лучей. [101]
Обзор 2005 года обнаружил предварительные доказательства того, что статины и фибраты могут снизить риск развития меланомы. [102] Однако обзор 2006 года не подтвердил никаких преимуществ. [103]

Подтверждение клинического диагноза осуществляется с помощью биопсии кожи . Обычно за этим следует более широкое иссечение рубца или опухоли. В зависимости от стадии может быть выполнена биопсия сторожевого лимфатического узла . Разногласия существуют вокруг доказательств биопсии сторожевых лимфатических узлов; [104] с неясными доказательствами пользы по состоянию на 2015 год. [105] Лечение запущенной злокачественной меланомы проводится на основе мультидисциплинарного подхода.
Эксцизионная биопсия может удалить опухоль, но для снижения риска рецидива часто необходимо дальнейшее хирургическое вмешательство. Стандартным является полное хирургическое иссечение с адекватными хирургическими краями и оценкой наличия обнаруживаемых метастазов, а также краткосрочное и долгосрочное наблюдение. Часто это делается путем широкого местного иссечения (WLE) с краями 1–2 см (0,4–0,8 дюйма). Меланома in-situ и злокачественное лентиго лечатся с использованием более узких хирургических границ, обычно 0,2–0,5 см (0,1–0,2 дюйма). Многие хирурги считают 0,5 см (0,2 дюйма) стандартом при стандартном иссечении меланомы in-situ [106] , но запас в 0,2 см (0,1 дюйма) может быть приемлемым для операций с контролируемым краем ( операция Мооса или двухлезвийная операция). техника с контролем маржи). Широкое иссечение направлено на снижение частоты рецидивов опухоли на месте исходного поражения. Это распространенная картина неудачи лечения меланомы. Значительные исследования были направлены на выяснение допустимых пределов иссечения с учетом общей тенденции к менее агрессивному лечению в течение последних десятилетий. [107] Метаанализ рандомизированных контролируемых исследований 2009 года обнаружил небольшую разницу в показателях выживаемости в пользу широкого удаления первичных меланом кожи, но эти результаты не были статистически значимыми. [108]
Сообщалось, что при хирургическом вмешательстве по методу Мооса показатель излечения составляет всего 77% [109] и достигает 98,0% для меланомы in-situ. [110] CCPDMA и операция с контролируемым периферическим краем «двойного скальпеля» эквивалентна операции Мооса по эффективности при этом «интраэпителиальном» типе меланомы.
Меланомы, которые распространяются, обычно распространяются на лимфатические узлы в области опухоли, прежде чем распространиться на другие места. Попытки улучшить выживаемость путем хирургического удаления лимфатических узлов ( лимфаденэктомия ) были связаны со многими осложнениями, но не принесли общей пользы для выживаемости. Недавно была разработана методика биопсии сторожевых лимфатических узлов , позволяющая уменьшить осложнения операции на лимфатических узлах и одновременно позволяющая оценить поражение узлов опухолью. [111]
Биопсия сторожевых лимфатических узлов является широко используемой процедурой при лечении меланомы кожи. [112] [113]
Ни биопсию сторожевого лимфатического узла, ни другие диагностические тесты не следует проводить для оценки ранней тонкой меланомы, включая меланому in situ, меланому T1a или меланому T1b ≤ 0,5 мм. [114] У людей с такими заболеваниями рак вряд ли распространится на лимфатические узлы или где-либо еще, а 5-летняя выживаемость составляет 97%. [114] По этим соображениям биопсия сторожевых лимфатических узлов считается для них ненужной медицинской помощью . [114] Кроме того, базовые анализы крови и рентгенологические исследования не должны проводиться только на основе выявления этого вида меланомы, поскольку существуют более точные тесты для выявления рака, и эти тесты имеют высокий уровень ложноположительных результатов. [114] Чтобы потенциально исправить ложноположительные результаты, можно использовать профилирование экспрессии генов в качестве вспомогательного теста для неоднозначных и небольших поражений. [115] [116]
Биопсия сторожевого лимфатического узла проводится часто, особенно при опухолях T1b/T2+, опухолях слизистой оболочки, меланоме глаза и опухолях конечностей. [ нужна цитация ] Выполняется процесс, называемый лимфосцинтиграфией , при котором радиоактивный индикатор вводится в место опухоли, чтобы локализовать сторожевой узел(и). Дополнительная точность обеспечивается использованием синего индикаторного красителя и хирургическим вмешательством по биопсии узла(ов). Рутинное окрашивание гематоксилином и эозином (H&E) и иммунопероксидазой будет достаточным для исключения поражения узла. Тесты полимеразной цепной реакции (ПЦР) на узлах, обычно проводимые для проверки допуска к клиническим испытаниям, теперь показывают, что многие пациенты с отрицательным сигнальным лимфатическим узлом на самом деле имеют небольшое количество положительных клеток в своих узлах. Альтернативно может быть выполнена тонкоигольная аспирационная биопсия, которая часто используется для проверки образований.
Если лимфатический узел положительный, в зависимости от степени распространения лимфатического узла часто выполняется радикальная диссекция лимфатического узла. Если заболевание полностью удалено, пациенту будет предложена адъювантная терапия. Эксцизионная биопсия кожи является методом выбора. В этом случае подозрительное поражение полностью удаляется с адекватным (но минимальным, обычно 1 или 2 мм) эллипсом окружающей кожи и тканей. [117] Чтобы избежать нарушения местного лимфатического дренажа, предпочтительный хирургический край для первоначальной биопсии должен быть узким (1 мм). Биопсия должна включать эпидермальный, дермальный и подкожный слои кожи. Это позволяет гистопатологу определить толщину меланомы путем микроскопического исследования. Это описывается толщиной Бреслоу (измеряется в миллиметрах). Однако при больших поражениях, таких как подозрение на злокачественное лентиго, или при поражениях в хирургически сложных областях (лицо, пальцы ног, пальцы рук, веки), небольшая пункционная биопсия в репрезентативных областях даст адекватную информацию и не помешает окончательному определению стадии или глубины. . Ни при каких обстоятельствах первоначальная биопсия не должна включать окончательный хирургический край (0,5 см, 1,0 см или 2 см), поскольку ошибочный диагноз может привести к чрезмерному рубцеванию и осложнениям после процедуры. Большое первоначальное иссечение нарушит местный лимфатический дренаж и может повлиять на дальнейшую диссекцию лимфатических узлов под контролем лимфангиографии. Небольшую пункционную биопсию можно использовать в любое время, когда по логистическим и личным причинам пациент отказывается от более инвазивной эксцизионной биопсии. Небольшая пункционная биопсия минимально инвазивна и быстро заживает, обычно без заметных рубцов.
Адъювантное лечение после операции может снизить риск рецидива после операции, особенно при меланомах высокого риска. В разных странах процедуры различаются, но сегодня (2024 г.) наиболее распространенным адъювантным лечением является лечение ингибиторами иммунных контрольных точек в течение года после операции [118] .
В начале 2000-х годов относительно распространенной стратегией было лечение пациентов с высоким риском рецидива с помощью лечения высокими дозами интерферона в течение года , которое имеет серьезные побочные эффекты, но может немного улучшить прогноз пациента. [119] Метаанализ 2013 года показал, что добавление интерферона альфа увеличивает безрецидивную и среднюю выживаемость у людей с меланомой кожи II-III стадии AJCC TNM. [120] Метаанализ 2011 года показал, что интерферон может продлить время до возвращения меланомы, но увеличивает выживаемость всего на 3% за 5 лет. Неприятные побочные эффекты также значительно снижают качество жизни. [121] В Европейском Союзе интерферон обычно не используется вне рамок клинических исследований. [122] [123]
Химиотерапевтические препараты, такие как дакарбазин, были основой лечения метастатической меланомы с момента одобрения FDA в 1975 году; однако его эффективность с точки зрения выживаемости никогда не была доказана в РКИ . [124] С момента одобрения ингибиторов иммунных контрольных точек дакарбазин и его пероральный аналог темозоломид представляют собой потенциальные варианты лечения на более поздних линиях терапии [125] .
Было обнаружено, что у людей с местно-распространенными злокачественными новообразованиями кожи и саркомой изолированная инфузия конечностей (ГПЗ) является минимально инвазивной и хорошо переносимой процедурой проведения регионарной химиотерапии. [126] [127]
Клетки меланомы имеют мутации, которые позволяют им выживать и неограниченно расти в организме. [124] Таргетная терапия с использованием малых молекул действует путем блокирования генов, участвующих в путях пролиферации и выживания опухолей. [124] Основными методами лечения являются ингибиторы BRAF, C-Kit и NRAS . [128] Эти ингибиторы ингибируют последующие пути, участвующие в пролиферации клеток и развитии опухолей из-за специфических генных мутаций. [129] Людей можно лечить низкомолекулярными таргетными ингибиторами, если у них положительный результат на конкретную мутацию. [124] Ингибиторы BRAF , такие как вемурафениб и дабрафениб , а также ингибитор MEK траметиниб , являются наиболее эффективными и одобренными методами лечения BRAF-положительной меланомы. [130] [124] Опухоли меланомы могут развивать резистентность во время терапии, что может сделать терапию более неэффективной, но сочетание использования ингибиторов BRAF и MEK может создать быстрый и стойкий ответ на терапию меланомы. [131]
Ряд методов лечения улучшают выживаемость по сравнению с традиционной химиотерапией. [124] Биохимиотерапия (химиотерапия цитокинами IL-2 и IFN-α) в сочетании с ингибиторами BRAF улучшила выживаемость людей с BRAF-положительной меланомой. [124] Биохимиотерапия сама по себе не улучшала общую выживаемость и имела более высокую токсичность, чем химиотерапия. [124] Комбинирование нескольких химиотерапевтических агентов (полихиотерапия) не улучшало выживаемость по сравнению с монохимиотерапией. [124] Таргетная терапия приводит к относительно короткому времени выживаемости без прогрессирования (ВБП). Комбинированная терапия дабрафенибом и траметинибом имеет 3-летнюю ВБП 23% и 5-летнюю ВБП 13%. [132]
Лифилеуцел (Амтагви) — это препарат аутологичной Т-клеточной иммунотерапии опухолевого происхождения, который был одобрен для медицинского применения в США в феврале 2024 года. [133] [134]
Иммунотерапия направлена на стимуляцию иммунной системы человека против опухоли путем повышения способности организма распознавать и уничтожать раковые клетки. [135] Современный подход к лечению меланомы с помощью иммунотерапии включает три широкие категории лечения, включая цитокины , ингибиторы иммунных контрольных точек и адоптивный перенос клеток . [135] Эти варианты лечения чаще всего используются у людей с метастатической меланомой и значительно улучшают общую выживаемость. [124] Однако такое лечение зачастую является дорогостоящим. Например, один курс лечения ингибитором иммунных контрольных точек, пембролизумабом , стоит от 10 000 до 12 000 долларов США за однократное введение каждые 3 недели. [136]
Цитокиновая терапия, используемая при меланоме, включает IFN-a и IL-2 . [137] IL-2 ( пролейкин ) был первым новым препаратом, одобренным (ЕС в 1990 г., США в 1992 г.) для лечения метастатической меланомы за 20 лет. [138] IL-2 может обеспечить возможность полной и длительной ремиссии этого заболевания у небольшого процента людей с меланомой. [139] Внутриочаговый IL-2 при транзитных метастазах имеет высокий уровень полного ответа – от 40 до 100%. [130] Аналогичным образом, IFN-a продемонстрировал лишь скромные преимущества по выживаемости и высокую токсичность, что ограничивает его использование в качестве самостоятельной терапии. [124] [137]
Ингибиторы иммунных контрольных точек включают моноклональные антитела против CTLA-4 ( ипилимумаб и тремелимумаб ), агонисты toll-подобных рецепторов (TLR), агонисты CD40 , антитела против PD-1 ( пембролизумаб , пидилизумаб и ниволумаб ) и PD-L1 . [135] [137] Имеющиеся данные свидетельствуют о том, что антитела против PD-1 более эффективны, чем антитела против CTLA4 , с меньшей системной токсичностью. [124] Пятилетняя выживаемость без прогрессирования при иммунотерапии пембролизумабом составляет 21%. [132] Терапевтический подход, включающий комбинацию различных методов лечения, улучшает общую выживаемость и выживаемость без прогрессирования по сравнению с лечением отдельными иммунотерапевтическими препаратами. [124]
Продолжающиеся исследования направлены на лечение методом адоптивного переноса клеток . [140] Перенос адоптивных клеток подразумевает применение предварительно стимулированных модифицированных Т-клеток или дендритных клеток и в настоящее время используется для минимизации осложнений реакции «трансплантат против хозяина» . [137] [141]
Комбинация ниволумаб/релатлимаб (Опдуалаг) была одобрена для медицинского применения в США в марте 2022 г. [142]
Большинство хирургов до сих пор выполняют стандартное иссечение. К сожалению, частота рецидивов чрезвычайно высока (до 50%). Это связано с нечетким видимым хирургическим краем и расположением поражений на лице (часто вынуждающим хирурга использовать узкий хирургический край). Узкий хирургический край в сочетании с ограничениями стандартной техники гистологии фиксированных тканей «хлебного хлеба» приводит к высокому уровню «ложноотрицательных» ошибок и частым рецидивам. Контроль маржи (периферийных полей) необходим для исключения ложноотрицательных ошибок. Если используется выпечка хлеба , расстояния от срезов должны приближаться к 0,1 мм, чтобы гарантировать, что метод приближается к полному контролю полей. Метаанализ литературы, проведенный в 2014 году, не выявил рандомизированных контролируемых исследований хирургических вмешательств для лечения злокачественного лентиго или меланомы in situ, хотя хирургическое вмешательство является наиболее широко используемым методом лечения. [143]
Операция Мооса была проведена, и показатель излечения, по данным другого автора, составляет всего 77% [109] и достигает 95%. [110] Метод иссечения с контролируемым периферическим краем «двойного скальпеля» приближается к методу Мооса в контроле границ, но требует участия патологоанатома, хорошо знакомого со сложностью управления вертикальным краем на тонких периферических срезах и методами окрашивания. [144]
Некоторые меланоцитарные невусы и меланома in-situ ( злокачественное лентиго ) разрешились с помощью экспериментального лечения кремом для местного применения имиквимодом (Алдара), агентом, повышающим иммунитет. Некоторые дерма-хирурги комбинируют два метода: хирургическое иссечение рака и последующую послеоперационную обработку этой области кремом Алдара в течение трех месяцев. Хотя некоторые исследования предполагают адъювантное использование тазаротена местно, имеющихся данных недостаточно, чтобы рекомендовать его, и предполагается, что он усиливает местное воспаление, что приводит к снижению комплаентности пациентов. [143]
Лучевая терапия часто используется после хирургической резекции у пациентов с местно- или регионарно-распространенной меланомой или у пациентов с неоперабельными отдаленными метастазами. Для этих процедур часто используются рентгеновские лучи киловольтного напряжения, которые обладают свойством максимальной дозы облучения, возникающей вблизи поверхности кожи. [145] Это может снизить частоту местных рецидивов, но не продлевает выживаемость. [146] Радиоиммунотерапия метастатической меланомы в настоящее время находится в стадии изучения. Лучевая терапия играет роль в паллиативном лечении метастатической меланомы. [147]

Факторы, влияющие на прогноз, включают:
Определенные типы меланомы имеют худший прогноз, но это объясняется их толщиной . Менее инвазивные меланомы даже с метастазами в лимфатических узлах имеют лучший прогноз, чем глубокие меланомы без региональных метастазов на момент определения стадии. Локальные рецидивы, как правило, ведут себя так же, как и первичные, за исключением случаев, когда они находятся в месте широкого местного иссечения (в отличие от поэтапного иссечения или иссечения с вырубкой/бритьем), поскольку эти рецидивы, как правило, указывают на лимфатическую инвазию.
Когда меланома распространилась на лимфатические узлы , одним из наиболее важных факторов является количество злокачественных узлов. Также важна степень злокачественности внутри узла; микрометастазы , при которых злокачественность носит лишь микроскопический характер, имеют более благоприятный прогноз, чем макрометастазы. В некоторых случаях микрометастазы можно обнаружить только с помощью специального окрашивания, а если злокачественное новообразование можно обнаружить только с помощью редко используемого теста, известного как полимеразная цепная реакция (ПЦР), прогноз лучше. Макрометастазы, при которых злокачественность клинически очевидна (в некоторых случаях рак полностью замещает узел), имеют гораздо худший прогноз, а если узлы спутаны или имеют экстракапсулярное распространение, прогноз еще хуже. В дополнение к этим переменным для оценки прогноза злокачественной меланомы можно использовать уровни экспрессии и вариации числа копий ряда соответствующих генов. [115] [116]
Меланома IV стадии, при которой она метастазирует, является наиболее опасным злокачественным новообразованием кожи: пятилетняя выживаемость составляет 22,5%. [132] При наличии отдаленных метастазов рак обычно считается неизлечимым. Пятилетняя выживаемость составляет менее 10%. [149] Медиана выживаемости составляет 6–12 месяцев. Лечение является паллиативным и направлено на продление и качество жизни . В некоторых случаях пациенты с метастатической меланомой могут жить многие месяцы или даже годы (в зависимости от агрессивности лечения). Метастазы в кожу и легкие имеют лучший прогноз. Метастазы в головной мозг, кости и печень связаны с худшим прогнозом. Выживаемость лучше при метастазах, при которых местоположение первичной опухоли неизвестно. [150]
Недостаточно точных данных, позволяющих адекватно определить стадию и, таким образом, дать прогноз для меланомы глаза и меланомы мягких частей или меланомы слизистых оболочек (например, меланомы прямой кишки), хотя они имеют тенденцию к более легкому метастазированию. Несмотря на то, что регрессия может увеличить выживаемость, когда меланома регрессировала, невозможно узнать ее первоначальный размер, и поэтому исходная опухоль часто хуже, чем может показаться в отчете о патологии .
Около 200 генов имеют прогностическое значение при меланоме: как неблагоприятные гены, высокая экспрессия которых коррелирует с плохой выживаемостью, так и благоприятные гены, где высокая экспрессия связана с более длительным временем выживания. Примерами неблагоприятных генов являются MCM6 и TIMELESS ; примером благоприятного гена является WIPI1 . [51] [52]
Повышенное соотношение нейтрофилов и лимфоцитов связано с худшими исходами. [151] [152] [153]
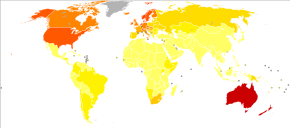
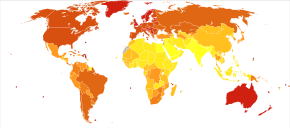
Во всем мире в 2012 году меланома возникла у 232 000 человек и привела к 55 000 смертей. [2] Австралия и Новая Зеландия имеют самый высокий уровень заболеваемости меланомой в мире. [2] За последние 20 лет он стал более распространенным в регионах, преимущественно кавказских . [2]
В последние годы заболеваемость меланомой возросла, но неясно, в какой степени это связано с изменениями в поведении, окружающей среде или раннем выявлении. [155]
В Австралии очень высокий и постоянно растущий уровень заболеваемости меланомой. В 2012 году смертность от меланомы составила 7,3–9,8 на 100 000 населения. В Австралии меланома является третьим по распространенности раком у представителей обоих полов; действительно, заболеваемость им выше, чем раком легких , хотя на долю последнего приходится больше смертей. По оценкам, в 2012 году меланома была диагностирована у более чем 12 000 австралийцев: учитывая скромное население Австралии, это лучше выразить как 59,6 новых случаев на 100 000 населения в год; >1 из 10 всех новых случаев рака были меланомами. [156] Заболеваемость меланомой в Австралии имеет большое значение по следующим причинам:
В США от меланомы умирают около 9000 человек в год. [158] В 2011 году от него пострадало 19,7 случаев на 100 000, а к летальному исходу - 2,7 на 100 000. [158]
В 2013:
По оценкам Американского онкологического общества заболеваемости меланомой в США на 2017 год:
Меланома более чем в 20 раз чаще встречается у белых, чем у афроамериканцев. В целом риск развития меланомы в течение жизни составляет около 2,5% (1 из 40) для белых, 0,1% (1 из 1000) для афроамериканцев и 0,5% (1 из 200) для латиноамериканцев.
Риск меланомы увеличивается с возрастом. Средний возраст людей, когда диагностируется заболевание, составляет 63 года. [160]
Хотя меланома не является новым заболеванием, свидетельств ее возникновения в древности довольно мало. Однако одним из примеров является исследование девяти перуанских мумий, проведенное в 1960-х годах, радиоуглеродный возраст которых составил около 2400 лет, и которое выявило явные признаки меланомы: меланотические массы на коже и диффузные метастазы в костях. [161]
Сообщается, что Джон Хантер первым прооперировал метастатическую меланому в 1787 году. Хотя он и не знал точно, что это такое, он описал ее как «раковое грибковое разрастание». Вырезанная опухоль сохранилась в Хантерианском музее Королевского колледжа хирургов Англии . Лишь в 1968 году микроскопическое исследование образца показало, что это пример метастатической меланомы. [162]
Французский врач Рене Лаэннек был первым, кто описал меланому как заболевание. Его отчет первоначально был представлен во время лекции на Парижском медицинском факультете в 1804 году, а затем опубликован в виде бюллетеня в 1806 году. [163]
Первое сообщение о меланоме на английском языке было представлено английским врачом общей практики из Стоурбриджа Уильямом Норрисом в 1820 году . Патологические и терапевтические замечания по поводу этой болезни ). Норрис также был пионером в предположении связи между невусами и меланомой и возможности связи между меланомой и воздействием окружающей среды, наблюдая, что у большинства его пациентов был бледный цвет лица. [165] Он также описал, что меланомы могут быть бесцветными, а позже показал метастатическую природу меланомы, наблюдая, что они могут распространяться на другие внутренние органы.
Первое официальное признание распространенной меланомы как неизлечимой было сделано Сэмюэлем Купером в 1840 году. Он заявил, что единственный шанс на излечение зависит от раннего устранения заболевания (т.е. раннего удаления злокачественной родинки)...» [166]
Спустя более полутора веков эта ситуация практически не изменилась.
Слово «меланома» пришло в английский язык из неолатинского языка XIX века [167] и использует сочетание форм, происходящих от древнегреческих корней: мелано- (обозначает меланин ) + -ома (обозначает тканевую массу и особенно новообразование ), в свою очередь от греческого μέλας melas , «темный», [168] и -ωμα oma , «процесс». Слово меланома имеет долгую историю использования в более широком смысле для обозначения любой меланоцитарной опухоли , как правило, но не всегда злокачественной [169] [170] , но сегодня более узкий смысл, относящийся только к злокачественным типам, стал настолько доминирующим, что доброкачественные опухоли опухоли обычно больше не называют меланомами, и слово « меланома» теперь обычно означает злокачественную меланому, если не указано иное. Такие термины, как «доброкачественная меланоцитарная опухоль », однозначно обозначают доброкачественные типы, а современные гистопатологические классификации опухолей, используемые в медицине, не используют это слово для обозначения доброкачественных опухолей.
Исследования фармакотерапии неоперабельной или метастатической злокачественной меланомы продолжаются. [171]
В клинических исследованиях проходят испытания адоптивная клеточная терапия и генная терапия . [172]
Два вида экспериментального лечения, разработанные в Национальном институте рака (NCI), использовались при метастатической меланоме с предварительным успехом. [42]
Первый метод лечения включает адоптивную клеточную терапию (ACT) с использованием иммунных клеток TIL (проникающих в опухоль лимфоцитов), выделенных из собственной опухоли меланомы человека. [130] Эти клетки выращивают в больших количествах в лаборатории и возвращают пациенту после лечения, которое временно снижает количество нормальных Т-клеток в организме пациента. TIL-терапия после лимфодеплеции может привести к длительному полному ответу в различных условиях. [173] [174]
Второй метод лечения — адоптивный перенос генетически измененных аутологичных лимфоцитов — зависит от доставки генов, кодирующих так называемые Т-клеточные рецепторы (TCR), в лимфоциты пациента. [130] После этой манипуляции лимфоциты распознают и связываются с определенными молекулами, обнаруженными на поверхности клеток меланомы, и убивают их. [175]
На поздней стадии испытаний в 2009 году противораковая вакцина против меланомы показала умеренную пользу. [176] [177]
Около 60% меланом содержат мутацию гена B-Raf . Ранние клинические испытания показали, что ингибиторы B-Raf, включая вемурафениб компании Plexxicon , могут привести к существенной регрессии опухоли у большинства пациентов, если их опухоль содержит мутацию B-Raf. [178] В июне 2011 года крупное клиническое исследование подтвердило положительные результаты предыдущих исследований. [179] [180]
В августе 2011 года вемурафениб получил одобрение FDA для лечения меланомы поздней стадии. В мае 2013 года FDA США одобрило дабрафениб в качестве монотерапии для пациентов с распространенной меланомой с положительной мутацией BRAF V600E. [181]
Некоторые исследователи полагают, что комбинированная терапия, которая одновременно блокирует несколько путей, может повысить эффективность, затрудняя мутацию опухолевых клеток перед их уничтожением. В октябре 2012 года исследование показало, что сочетание дабрафениба с ингибитором MEK траметинибом привело к еще лучшим результатам. По сравнению с монотерапией дабрафенибом выживаемость без прогрессирования заболевания увеличилась до 41% с 9%, а медиана выживаемости без прогрессирования увеличилась до 9,4 месяцев против 5,8 месяцев. Однако в объединенном исследовании некоторые побочные эффекты были усилены. [182] [183]
В январе 2014 года FDA одобрило комбинацию дабрафениба и траметиниба для лечения людей с метастатической меланомой с мутацией BRAF V600E/K. [184] В июне 2018 года FDA одобрило комбинацию ингибитора BRAF энкорафениба и ингибитора MEK биниметиниба для лечения неоперабельной или метастатической меланомы с мутацией BRAF V600E или V600K. [185]
Возможная устойчивость к ингибиторам BRAF и MEK может быть связана с белком клеточной поверхности, известным как EphA2 , который сейчас исследуется. [186]
На конференции Американского общества клинической онкологии в июне 2010 года фармацевтическая компания Bristol-Myers Squibb сообщила о клинических результатах своего препарата ипилимумаба . Исследование выявило увеличение медианы выживаемости с 6,4 до 10 месяцев у пациентов с поздними стадиями меланомы, получавших моноклональный ипилимумаб, по сравнению с экспериментальной вакциной. Также было обнаружено, что годовая выживаемость составила 25% в контрольной группе, использующей вакцину, 44% в группе вакцины и ипилимумаба и 46% в группе, получавшей только ипилимумаб. [187] Однако некоторые выразили обеспокоенность по поводу этого исследования из-за использования нетрадиционной контрольной группы вместо сравнения препарата с плацебо или стандартным лечением. [188] [189] Критика заключалась в том, что, хотя ипилимумаб действовал лучше, чем вакцина, вакцина ранее не тестировалась и может вызывать токсичность, поэтому по сравнению с ней препарат выглядит лучше.
Ипилимумаб был одобрен FDA в марте 2011 года для лечения пациентов с меланомой поздней стадии, которая распространилась или не может быть удалена хирургическим путем. [190] [191] [192]
В июне 2011 года в ходе клинического испытания ипилимумаба плюс дакарбазина этот усилитель иммунной системы сочетался со стандартным химиотерапевтическим препаратом, воздействующим на деление клеток. Это показало увеличение медианы выживаемости для этих пациентов на поздней стадии до 11 месяцев вместо обычно наблюдаемых 9 месяцев. Исследователи также надеялись на улучшение пятилетней выживаемости, хотя у некоторых пациентов наблюдались серьезные побочные эффекты. Курс лечения стоит 120 тысяч долларов. Торговое название препарата – Ервой. [179] [193]
Достижения в области ультразвукового сканирования с высоким разрешением позволили наблюдать за метастатической нагрузкой в сторожевых лимфатических узлах. [194] Исследование «Скрининг и наблюдение за ультразвуком при меланоме» (SUNMEL) оценивает ультразвук как альтернативу инвазивным хирургическим методам. [195]
В некоторых странах изучаются и применяются методы онколитической виротерапии для лечения меланомы. Онколитическая виротерапия — перспективное направление виротерапии , где для лечения заболеваний используются онколитические вирусы ; вирусы могут усиливать обмен веществ, снижать противоопухолевый иммунитет и дезорганизовать сосудистую систему. [196] В 2015 году было показано, что талимоген лагерпарепвек (T-VEC) (который представляет собой онколитическую иммунотерапию, полученную на основе вируса простого герпеса 1 типа), эффективен против метастатической меланомы с увеличением выживаемости на 4,4 месяца. [197] [12]
Антиретровирусные препараты были протестированы in vitro против меланомы. Обоснование этого заключается в их способности ингибировать эндогенные ретровирусы человека, активность которых связана с развитием меланомы. [198] [199] Результаты на злокачественных клетках показали умеренную эффективность, и ожидаются дальнейшие разработки в ходе испытаний на животных моделях.
Термин «меланома» в медицине человека обозначает злокачественный рост; приставка «злокачественный» является избыточной.
Термин «злокачественная меланома» устаревает, поскольку слово «злокачественный» является излишним, поскольку доброкачественных меланом не существует.
Избегайте избыточной фразы «злокачественная меланома».
Нужно выбрать «меланома»
операции Мооса
частота излечения достигает 98% для небольшой меланомы in situ и достигает 95% для злокачественного лентиго варианта меланоны in situ
.