Нервный гребень — это гребневидная структура, которая формируется временно между эпидермальной эктодермой и нервной пластинкой во время развития позвоночных . Клетки нервного гребня происходят из этой структуры через эпителиально-мезенхимальный переход и, в свою очередь, дают начало разнообразной клеточной линии, включая меланоциты , черепно-лицевые хрящи и кости, гладкие мышцы , дентин , периферические и энтеральные нейроны , мозговое вещество надпочечников и глию . [1] [2]
После гаструляции нервный гребень определяется на границе нервной пластинки и не-нейральной эктодермы . Во время нейруляции границы нервной пластинки, также известные как нервные складки , сходятся на дорсальной средней линии, образуя нервную трубку . [3] Впоследствии клетки нервного гребня из верхней пластинки нервной трубки претерпевают эпителиально-мезенхимальный переход , отслаиваясь от нейроэпителия и мигрируя через периферию, где они дифференцируются в различные типы клеток. [1] Возникновение нервного гребня имело важное значение в эволюции позвоночных , поскольку многие из его структурных производных являются определяющими чертами клады позвоночных . [4]
В основе развития нервного гребня лежит генная регуляторная сеть , описываемая как набор взаимодействующих сигналов, факторов транскрипции и нижестоящих эффекторных генов, которые придают клеткам такие характеристики, как мультипотентность и миграционные способности. [5] Понимание молекулярных механизмов формирования нервного гребня важно для наших знаний о болезнях человека из-за его вклада в множественные клеточные линии . Аномалии в развитии нервного гребня вызывают нейрокристопатии , которые включают такие состояния, как фронтоназальная дисплазия , синдром Ваарденбурга-Шаха и синдром ДиДжорджи . [1]
Определение механизмов развития нервного гребня может пролить свет на ключевые аспекты эволюции позвоночных и нейрокристопатий .
Нервный гребень был впервые описан у куриного эмбриона Вильгельмом Гисом-старшим в 1868 году как «промежуточный шнур» (Zwischenstrang) из-за его происхождения между нервной пластинкой и не-нервной эктодермой. [1] Он назвал ткань ганглиозным гребнем, поскольку ее конечным пунктом назначения была каждая боковая сторона нервной трубки, где он дифференцировался в спинномозговые ганглии. [6] В первой половине 20-го века большинство исследований нервного гребня было проведено с использованием эмбрионов амфибий, что было рассмотрено Хёрстадиусом (1950) в известной монографии. [7]
Методы маркировки клеток продвинули область нервного гребня, поскольку они позволили исследователям визуализировать миграцию ткани по всем развивающимся эмбрионам. В 1960-х годах Уэстон и Чибон использовали радиоизотопную маркировку ядра тритиевым тимидином в эмбрионах цыпленка и амфибии соответственно. Однако этот метод страдает от недостатков стабильности, поскольку каждый раз, когда маркированная клетка делится, сигнал ослабевает. Современные методы маркировки клеток, такие как родамин-лизинированный декстран и витальный краситель diI, также были разработаны для временной маркировки линий нервного гребня. [6]
Система маркировки перепелов и цыплят, разработанная Николь Ле Дуарен в 1969 году, была еще одним инструментальным методом, используемым для отслеживания клеток нервного гребня. [8] [9] Химеры , полученные путем трансплантации, позволили исследователям отличать клетки нервного гребня одного вида от окружающей ткани другого вида. С помощью этого метода поколения ученых смогли надежно маркировать и изучать онтогенез клеток нервного гребня.
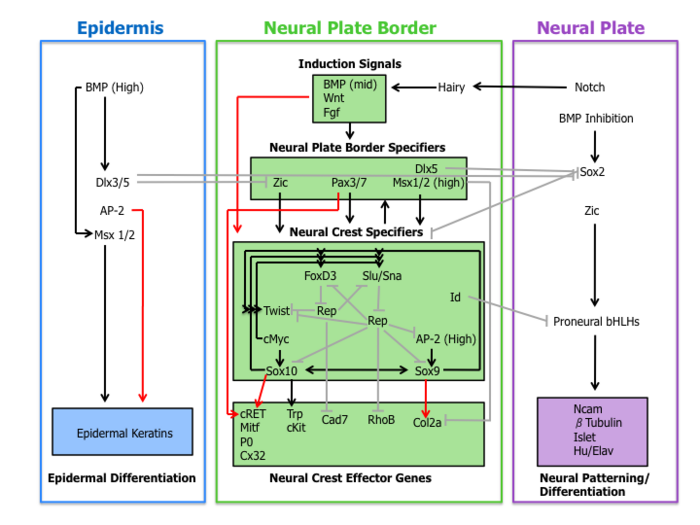
Молекулярный каскад событий участвует в установлении миграционных и мультипотентных характеристик клеток нервного гребня. Эта сеть регуляции генов может быть подразделена на следующие четыре подсети, описанные ниже.
Во-первых, внеклеточные сигнальные молекулы, секретируемые из прилегающего эпидермиса и подлежащей мезодермы, такие как Wnt , BMP и Fgf, отделяют ненейральную эктодерму (эпидермис) от нервной пластинки во время нервной индукции . [1] [4]
Сигнализация Wnt была продемонстрирована в индукции нервного гребня у нескольких видов посредством экспериментов по приобретению и потере функции. В соответствии с этим наблюдением, промоторная область slug (ген, специфичный для нервного гребня) содержит сайт связывания для факторов транскрипции, участвующих в активации целевых генов, зависящих от Wnt, что указывает на прямую роль сигнализации Wnt в спецификации нервного гребня. [10]
Текущая роль BMP в формировании нервного гребня связана с индукцией нервной пластинки. Антагонисты BMP, диффундирующие из эктодермы, создают градиент активности BMP. Таким образом, линия нервного гребня формируется из промежуточных уровней сигнализации BMP, необходимых для развития нервной пластинки (низкий BMP) и эпидермиса (высокий BMP). [1]
Fgf из параксиальной мезодермы был предложен в качестве источника индуктивного сигнала нервного гребня. Исследователи продемонстрировали, что экспрессия доминантно-негативного рецептора Fgf в эксплантатах эктодермы блокирует индукцию нервного гребня при рекомбинации с параксиальной мезодермой. [11] Понимание роли путей BMP, Wnt и Fgf в экспрессии спецификатора нервного гребня остается неполным.
Сигнальные события, которые устанавливают границу нервной пластинки, приводят к экспрессии набора факторов транскрипции, обозначенных здесь как спецификаторы границы нервной пластинки. Эти молекулы включают факторы Zic, Pax3/7, Dlx5, Msx1/2, которые могут опосредовать влияние Wnt, BMP и Fgfs. Эти гены широко экспрессируются в области границы нервной пластинки и предшествуют экспрессии настоящих маркеров нервного гребня. [4]
Экспериментальные данные помещают эти факторы транскрипции выше спецификаторов нервного гребня. Например, у Xenopus Msx1 необходим и достаточен для экспрессии Slug, Snail и FoxD3. [12] Кроме того, Pax3 необходим для экспрессии FoxD3 у эмбрионов мышей. [13]
После экспрессии спецификаторов границы нервной пластинки следует набор генов, включая Slug/Snail, FoxD3, Sox10, Sox9, AP-2 и c-Myc. Этот набор генов, обозначенных здесь как спецификаторы нервного гребня, активируется в возникающих клетках нервного гребня. По крайней мере, у Xenopus каждый спецификатор нервного гребня необходим и/или достаточен для экспрессии всех других спецификаторов, что демонстрирует существование обширной перекрестной регуляции. [4] Более того, этот модельный организм сыграл важную роль в выяснении роли сигнального пути Hedgehog в спецификации нервного гребня, при этом ключевую роль играет фактор транскрипции Gli2. [14]
За пределами строго регулируемой сети спецификаторов нервного гребня находятся два других фактора транскрипции Twist и Id. Twist, фактор транскрипции bHLH , необходим для мезенхимной дифференциации структур глоточной дуги . [15] Id является прямой целью c-Myc и, как известно, важен для поддержания стволовых клеток нервного гребня. [16]
Наконец, спецификаторы нервного гребня включают экспрессию эффекторных генов, которые придают определенные свойства, такие как миграция и мультипотентность. Два эффектора нервного гребня, Rho ГТФазы и кадгерины , функционируют при расслаивании, регулируя морфологию клеток и адгезивные свойства. Sox9 и Sox10 регулируют дифференциацию нервного гребня, активируя множество эффекторов, специфичных для типа клеток, включая Mitf, P0, Cx32, Trp и cKit. [4]

Миграция клеток нервного гребня включает в себя высокоскоординированный каскад событий, который начинается с закрытия дорсальной нервной трубки .
После слияния нервных складок для создания нервной трубки клетки, изначально расположенные на границе нервной пластинки , становятся клетками нервного гребня . [17] Для начала миграции клетки нервного гребня должны пройти процесс, называемый деламинацией, который включает полный или частичный эпителиально-мезенхимальный переход (ЭМП). [18] Деламинация определяется как разделение ткани на разные популяции, в данном случае клетки нервного гребня отделяются от окружающей ткани. [19] И наоборот, ЭМП представляет собой серию событий, координирующих изменение эпителиального фенотипа на мезенхимальный . [ 18] Например, деламинация у куриных эмбрионов запускается каскадом BMP / Wnt , который индуцирует экспрессию факторов транскрипции , способствующих ЭМП, таких как SNAI2 и FOXD3 . [19] Хотя все клетки нервного гребня подвергаются ЭПТ, время расслаивания происходит на разных стадиях у разных организмов: у эмбрионов Xenopus laevis наблюдается массивное расслаивание, которое происходит, когда нервная пластинка не полностью сращена, тогда как расслаивание у куриного эмбриона происходит во время слияния нервной складки . [19]
До расслаивания предполагаемые клетки нервного гребня изначально прикреплены к соседним клеткам с помощью белков плотного соединения, таких как окклюдин , и молекул клеточной адгезии, таких как NCAM и N - кадгерин . [20] Дорсально экспрессируемые BMP инициируют расслаивание, индуцируя экспрессию факторов транскрипции белка цинкового пальца snail , slug и twist . [17] Эти факторы играют прямую роль в индукции эпителиально-мезенхимального перехода , снижая экспрессию окклюдина и N-кадгерина, а также способствуя модификации NCAM остатками полисиаловой кислоты для снижения адгезии. [17] [21] Клетки нервного гребня также начинают экспрессировать протеазы, способные разрушать кадгерины, такие как ADAM10 [22] , и секретировать матриксные металлопротеиназы (MMP) , которые разрушают вышележащую базальную пластинку нервной трубки, позволяя клеткам нервного гребня вырваться. [20] Кроме того, клетки нервного гребня начинают экспрессировать интегрины , которые связываются с белками внеклеточного матрикса , включая коллаген , фибронектин и ламинин , во время миграции. [23] Как только базальная мембрана становится проницаемой, клетки нервного гребня могут начать мигрировать по всему эмбриону.
.jpg/440px-Migration_of_Neural_Crest_Cells_(v2).jpg)
Миграция клеток нервного гребня происходит в рострально - каудальном направлении без необходимости нейронного каркаса, такого как вдоль радиальной глиальной клетки . По этой причине процесс миграции клеток нервного гребня называется «свободной миграцией». Вместо каркаса на клетках-предшественниках миграция нервного гребня является результатом отталкивающего руководства через сигнализацию EphB / EphrinB и семафорин / нейропилин , взаимодействия с внеклеточным матриксом и контактного торможения друг с другом. [17] В то время как белки Ephrin и Eph обладают способностью подвергаться двунаправленной сигнализации, отталкивание клеток нервного гребня использует преимущественно прямую сигнализацию для инициирования ответа внутри клетки нервного гребня, несущей рецептор . [23] Разрастающиеся клетки нервного гребня экспрессируют EphB, рецепторную тирозинкиназу , которая связывает трансмембранный лиганд EphrinB, экспрессируемый в каудальной половине каждого сомита . Когда эти два домена взаимодействуют, это вызывает фосфорилирование тирозина рецептора, активацию rhoGTPases и возможные перестройки цитоскелета в клетках гребня, заставляя их отталкиваться. Это явление позволяет клеткам нервного гребня проходить через ростральную часть каждого сомита. [17]
Отталкивающая сигнализация семафорин-нейропилин работает синергически с сигнализацией EphB, направляя клетки нервного гребня вниз по ростральной половине сомитов у мышей. У куриных эмбрионов семафорин действует в цефалической области, направляя клетки нервного гребня через глоточные дуги . В дополнение к отталкивающей отталкивающей сигнализации клетки нервного гребня экспрессируют β1 и α4 интегрины , которые позволяют связываться и направлять взаимодействие с коллагеном , ламинином и фибронектином внеклеточного матрикса по мере их перемещения. Кроме того, клетки нервного гребня обладают внутренним контактным торможением друг с другом, свободно проникая в ткани разного происхождения, такие как мезодерма . [17] Клетки нервного гребня, которые мигрируют через ростральную половину сомитов, дифференцируются в сенсорные и симпатические нейроны периферической нервной системы . Другой основной путь, по которому идут клетки нервного гребня, — дорсолатеральный между эпидермисом и дермамиотомом . Клетки, мигрирующие по этому пути, дифференцируются в пигментные клетки дермы . Дальнейшая дифференциация клеток нервного гребня и спецификация в их окончательный тип клеток обусловлена их пространственно-временным подчинением морфогенетическим сигналам, таким как BMP, Wnt, FGF, Hox и Notch . [ 20]
Нейрокристопатии возникают в результате аномальной спецификации, миграции, дифференциации или смерти клеток нервного гребня в ходе эмбрионального развития. [24] [25] Эта группа заболеваний охватывает широкий спектр врожденных пороков развития, поражающих многих новорожденных. Кроме того, они возникают из-за генетических дефектов, влияющих на формирование нервного гребня, и из-за действия тератогенов [26]
Синдром Ваарденбурга — это нейрокристопатия , которая возникает в результате дефектной миграции клеток нервного гребня. Основными характеристиками этого состояния являются пегий гребень и врожденная глухота . В случае пегий гребень бесцветные участки кожи вызваны полным отсутствием пигмент -продуцирующих меланоцитов, полученных из нервного гребня . [27] Существует четыре различных типа синдрома Ваарденбурга, каждый из которых имеет различные генетические и физиологические особенности. Типы I и II различаются на основе того, есть ли у членов семьи пораженного человека дистопия канторум . [28] Тип III приводит к аномалиям верхних конечностей. Наконец, тип IV также известен как синдром Ваарденбурга-Шаха, и у пораженных людей проявляются как синдром Ваарденбурга, так и болезнь Гиршпрунга . [29] Типы I и III наследуются по аутосомно-доминантному типу, [27] в то время как II и IV демонстрируют аутосомно-рецессивный тип наследования. В целом, синдром Ваарденбурга встречается редко, с частотой ~ 2/100 000 человек в Соединенных Штатах. Все расы и полы подвержены ему в равной степени. [27] В настоящее время не существует лекарства или лечения синдрома Ваарденбурга.
Также в дефектах, связанных с развитием и миграцией клеток нервного гребня, участвует болезнь Гиршпрунга , характеризующаяся отсутствием иннервации в областях кишечника . Это отсутствие иннервации может привести к дальнейшим физиологическим аномалиям, таким как увеличенная толстая кишка ( мегаколон ), непроходимость кишечника или даже замедленный рост. При здоровом развитии клетки нервного гребня мигрируют в кишечник и образуют энтеральные ганглии . Гены, играющие роль в здоровой миграции этих клеток нервного гребня в кишечник, включают RET , GDNF , GFRα , EDN3 и EDNRB . RET , рецепторная тирозинкиназа (RTK), образует комплекс с GDNF и GFRα . Затем EDN3 и EDNRB вовлекаются в одну и ту же сигнальную сеть. Когда эта сигнализация нарушается у мышей, возникает аганглионоз или отсутствие этих энтеральных ганглиев. [30]
Расстройство фетального алкогольного спектра является одной из наиболее распространенных причин дефектов развития . [31] В зависимости от степени воздействия и тяжести возникающих аномалий, пациенты диагностируются в рамках континуума расстройств, широко обозначенных как расстройство фетального алкогольного спектра]] (FASD). Тяжелое FASD может нарушить миграцию нервного гребня , о чем свидетельствуют характерные краниофациальные аномалии , включая короткие глазные щели , удлиненную верхнюю губу и сглаженный желобок . Однако из-за беспорядочной природы связывания этанола механизмы, посредством которых возникают эти аномалии, до сих пор неясны. Эксплантаты клеточной культуры клеток нервного гребня, а также развивающиеся in vivo эмбрионы данио рерио , подвергшиеся воздействию этанола, показывают снижение количества мигрирующих клеток и сокращение расстояний, пройденных мигрирующими клетками нервного гребня. Механизмы, лежащие в основе этих изменений, не до конца изучены, но данные свидетельствуют о том, что PAE может усиливать апоптоз из-за повышенных уровней цитозольного кальция, вызванных IP3 -опосредованным высвобождением кальция из внутриклеточных запасов. Также было высказано предположение, что снижение жизнеспособности клеток нервного гребня, подвергшихся воздействию этанола, вызвано повышенным окислительным стрессом . Несмотря на эти и другие достижения, многое еще предстоит выяснить о том, как этанол влияет на развитие нервного гребня. Например, похоже, что этанол по-разному влияет на определенные клетки нервного гребня по сравнению с другими; то есть, в то время как краниофациальные аномалии распространены при PAE, пигментные клетки, полученные из нервного гребня, по-видимому, затронуты минимально. [32]
Синдром ДиДжорджи связан с делециями или транслокациями небольшого сегмента в человеческой хромосоме 22. Эта делеция может нарушить миграцию или развитие ростральных клеток нервного гребня . Некоторые наблюдаемые дефекты связаны с системой глоточного кармана , которая получает вклад от ростральных миграционных клеток гребня. Симптомы синдрома ДиДжорджи включают врожденные пороки сердца , дефекты лица и некоторые неврологические и обучаемые нарушения . У пациентов с делециями 22q11 также наблюдается более высокая заболеваемость шизофренией и биполярным расстройством . [33]
Синдром Тричера-Коллинза (TCS) является результатом нарушения развития первой и второй глоточных дуг на ранней эмбриональной стадии, что в конечном итоге приводит к аномалиям средней и нижней части лица. TCS вызывается миссенс-мутацией гена TCOF1 , которая заставляет клетки нервного гребня подвергаться апоптозу во время эмбриогенеза . Хотя мутации гена TCOF1 являются одними из наиболее хорошо охарактеризованных по своей роли в TCS, мутации в генах POLR1C и POLR1D также связаны с патогенезом TCS. [34]
Клетки нервного гребня, происходящие из разных положений вдоль передне -задней оси, развиваются в различные ткани. Эти области нервного гребня можно разделить на четыре основных функциональных домена, которые включают краниальный нервный гребень, туловищный нервный гребень, вагальный и крестцовый нервный гребень и сердечный нервный гребень.
Черепной нервный гребень мигрирует дорсолатерально, образуя краниофациальную мезенхиму, которая дифференцируется в различные краниальные ганглии, а также краниофациальные хрящи и кости. [21] Эти клетки проникают в глоточные карманы и дуги, где они вносят вклад в тимус , кости среднего уха и челюсти, а также одонтобласты зачатков зубов. [35]
Нервный гребень ствола дает начало двум популяциям клеток. [36] Одна группа клеток, предназначенных стать меланоцитами, мигрирует дорсолатерально в эктодерму по направлению к вентральной средней линии. Вторая группа клеток мигрирует вентролатерально через переднюю часть каждого склеротома . Клетки, которые остаются в склеротоме, образуют ганглии дорсальных корешков , тогда как те, которые продолжают движение более вентрально, образуют симпатические ганглии, мозговое вещество надпочечников и нервы, окружающие аорту. [35]
Клетки блуждающего нерва и крестцового нервного гребня развиваются в ганглии энтеральной нервной системы и парасимпатические ганглии. [35]
Сердечный нервный гребень развивается в меланоциты, хрящ, соединительную ткань и нейроны некоторых глоточных дуг. Кроме того, этот домен дает начало таким областям сердца, как мышечно-соединительная ткань крупных артерий и часть перегородки , которая разделяет легочный кровоток от аорты. [35] Согласно новому исследованию, полулунные клапаны сердца связаны с клетками нервного гребня. [37]
Несколько структур, отличающих позвоночных от других хордовых, образованы из производных клеток нервного гребня. В своей теории «Новой головы» Ганс и Норткат утверждают, что наличие нервного гребня стало основой для специфических особенностей позвоночных, таких как сенсорные ганглии и черепной скелет. Более того, появление этих особенностей имело решающее значение в эволюции позвоночных, поскольку оно способствовало хищному образу жизни. [38] [39]
Однако, считая нервный гребень инновацией позвоночных, это не означает, что он возник de novo . Вместо этого новые структуры часто возникают посредством модификации существующих регуляторных программ развития. Например, регуляторные программы могут быть изменены путем кооптации новых регуляторов верхнего уровня или путем использования новых целевых генов нижнего уровня, тем самым помещая существующие сети в новый контекст. [40] [41] Эта идея подтверждается данными гибридизации in situ , которые показывают сохранение спецификаторов границ нервной пластинки у протохордовых , что предполагает, что часть сети предшественников нервного гребня присутствовала у общего предка хордовых. [5] У некоторых беспозвоночных хордовых, таких как оболочники, была идентифицирована линия клеток (меланоцитов), которые похожи на клетки нервного гребня у позвоночных. Это подразумевает, что рудиментарный нервный гребень существовал у общего предка позвоночных и оболочников. [42]
Эктомезенхима (также известная как мезектодерма ): [43] одонтобласты , зубные сосочки , хондрокраниум (носовая капсула, меккелев хрящ , склеральные косточки, квадратная кость, суставная кость, подъязычная кость и колумелла), трахеальный и гортанный хрящи, дерматокраниум (перепончатые кости), спинные плавники и пластрон черепахи (низшие позвоночные), перициты и гладкие мышцы жаберных артерий и вен, сухожилия глазных и жевательных мышц, соединительная ткань желез головы и шеи (гипофиз, слюнные, слезные, вилочковая железа, щитовидная железа), дерма и жировая ткань свода черепа, вентральной части шеи и лица
Эндокринные клетки : хромаффинные клетки мозгового вещества надпочечников, гломусные клетки I/II типа.
Периферическая нервная система : сенсорные нейроны и глия ганглиев задних корешков , головные ганглии (VII и частично V, IX и X), клетки Рохона-Берда , некоторые клетки Меркеля в вибриссах, [44] [45] сателлитные глиальные клетки всех автономных и сенсорных ганглиев, шванновские клетки всех периферических нервов.
Энтеральные клетки : энтерохромаффинные клетки . [46]
Меланоциты , мышечные клетки радужной оболочки глаза и пигментные клетки , и даже связаны с некоторыми опухолями (например, меланотическая нейроэктодермальная опухоль младенцев ).