
В органической химии алкен или олефин — это углеводород , содержащий двойную связь углерод - углерод . [1] Двойная связь может быть внутренней или в терминальном положении. Терминальные алкены также известны как α-олефины .
Международный союз теоретической и прикладной химии (ИЮПАК) рекомендует использовать название «алкен» только для ациклических углеводородов с одной двойной связью; алкадиен , алкатриен и т. д. или полиен для ациклических углеводородов с двумя или более двойными связями; циклоалкен , циклоалкадиен и т. д. для циклических ; и «олефин» для общего класса — циклических или ациклических, с одной или более двойными связями. [2] [3] [4]
Ациклические алкены, имеющие только одну двойную связь и не имеющие других функциональных групп (также известные как моноены ), образуют гомологический ряд углеводородов с общей формулой C n H 2 n , где n является натуральным числом > 1 (что на два атома водорода меньше, чем у соответствующего алкана ). Когда n равно четырем или более, возможны изомеры , различающиеся положением и конформацией двойной связи.
Алкены, как правило , бесцветные неполярные соединения, несколько похожие на алканы, но более реакционноспособные . Первые несколько членов ряда являются газами или жидкостями при комнатной температуре. Простейший алкен, этилен ( C2H4 ) (или «этен» в номенклатуре ИЮПАК ) — это органическое соединение, производимое в промышленных масштабах в наибольшем количестве. [5]
Ароматические соединения часто изображаются как циклические алкены, однако их структура и свойства достаточно различны, чтобы их можно было классифицировать как алкены или олефины. [3] Углеводороды с двумя перекрывающимися двойными связями ( C=C=C ) называются алленами — простейшее такое соединение само по себе называется алленом — а те, у которых есть три или более перекрывающихся связей ( C=C=C=C , C=C=C=C=C и т. д.), называются кумуленами .
Алкены, имеющие четыре или более атомов углерода , могут образовывать разнообразные структурные изомеры . Большинство алкенов также являются изомерами циклоалканов . Ациклические структурные изомеры алкенов с одной двойной связью следующие: [6]
Многие из этих молекул демонстрируют цис - транс -изомерию . Также могут быть хиральные атомы углерода, особенно внутри более крупных молекул (от C5 ). Число потенциальных изомеров быстро увеличивается с дополнительными атомами углерода.

Двойная связь углерод-углерод состоит из сигма-связи и пи-связи . Эта двойная связь прочнее одинарной ковалентной связи (611 кДж / моль для C=C против 347 кДж/моль для C–C), [1] , но не в два раза прочнее. Двойные связи короче одинарных, средняя длина связи составляет 1,33 Å (133 пм ) против 1,53 Å для типичной одинарной связи CC. [7]
Каждый атом углерода двойной связи использует свои три гибридные sp 2 орбитали для образования сигма-связей с тремя атомами (другим атомом углерода и двумя атомами водорода). Негибридизованные атомные орбитали 2p, которые лежат перпендикулярно плоскости, созданной осями трех гибридных sp 2 орбиталей, объединяются, образуя пи-связь. Эта связь лежит вне главной оси C–C, причем половина связи находится на одной стороне молекулы, а половина — на другой. При прочности 65 ккал/моль пи-связь значительно слабее сигма-связи.
Вращение вокруг двойной связи углерод-углерод ограничено, поскольку для нарушения выравнивания p-орбиталей на двух атомах углерода требуются энергетические затраты. Следовательно, цис- или транс- изомеры взаимопревращаются настолько медленно, что с ними можно свободно обращаться в условиях окружающей среды без изомеризации. Более сложные алкены могут быть названы с помощью обозначения E – Z для молекул с тремя или четырьмя различными заместителями (боковыми группами). Например, из изомеров бутена две метильные группы ( Z )-бут-2 -ена (он же цис -2-бутен) появляются на одной стороне двойной связи, а в ( E )-бут-2-ене (он же транс -2-бутен) метильные группы появляются на противоположных сторонах. Эти два изомера бутена обладают различными свойствами.
Как предсказывает модель отталкивания электронных пар VSEPR , молекулярная геометрия алкенов включает углы связи вокруг каждого атома углерода в двойной связи около 120°. Угол может меняться из-за стерического напряжения , вызванного не связанными взаимодействиями между функциональными группами, присоединенными к атомам углерода двойной связи. Например, угол связи C–C–C в пропилене составляет 123,9°.
Для мостиковых алкенов правило Бредта гласит, что двойная связь не может возникнуть в мостиковом центре мостиковой кольцевой системы, если кольца не достаточно велики. [8] Следуя Фосетту и определяя S как общее число атомов, не являющихся мостиками, в кольцах, [9] бициклические системы требуют S ≥ 7 для стабильности [8] , а трициклические системы требуют S ≥ 11. [10]
В органической химии префиксы цис- и транс- используются для описания положений функциональных групп, присоединенных к атомам углерода, соединенным двойной связью. На латыни цис и транс означают «по эту сторону» и «по другую сторону» соответственно. Поэтому, если функциональные группы находятся по одну сторону углеродной цепи, говорят, что связь имеет цис- конфигурацию, в противном случае (т. е. функциональные группы находятся по другую сторону углеродной цепи), говорят, что связь имеет транс- конфигурацию.
Для того чтобы были цис- и транс-конфигурации, должна быть углеродная цепь, или по крайней мере одна функциональная группа, присоединенная к каждому углероду, одинакова для обоих. E- и Z-конфигурации могут использоваться вместо этого в более общем случае, когда все четыре функциональные группы, присоединенные к атомам углерода в двойной связи, различны. E- и Z- являются сокращениями немецких слов zusammen (вместе) и entgegen (напротив). В E- и Z-изомерии каждой функциональной группе назначается приоритет на основе правил приоритета Кана-Ингольда-Прелога . Если две группы с более высоким приоритетом находятся по одну сторону двойной связи, связи назначается Z- конфигурация, в противном случае (т. е. две группы с более высоким приоритетом находятся по противоположную сторону двойной связи), связи назначается E- конфигурация. Цис- и транс-конфигурации не имеют фиксированной связи с E- и Z -конфигурациями.
Многие физические свойства алкенов и алканов схожи: они бесцветны, неполярны и горючи. Физическое состояние зависит от молекулярной массы : подобно соответствующим насыщенным углеводородам, простейшие алкены ( этилен , пропилен и бутен ) являются газами при комнатной температуре. Линейные алкены, содержащие приблизительно от пяти до шестнадцати атомов углерода, являются жидкостями, а высшие алкены — восковыми твердыми веществами. Температура плавления твердых веществ также увеличивается с увеличением молекулярной массы.
Алкены обычно имеют более сильный запах, чем соответствующие им алканы. У этилена сладкий и затхлый запах. Известно, что напряженные алкены, в частности, такие как норборнен и транс -циклооктен, имеют сильный, неприятный запах, что согласуется с более сильными π-комплексами, которые они образуют с ионами металлов, включая медь. [11]
Ниже приведен список температур кипения и плавления различных алкенов с соответствующими аналогами алканов и алкинов. [12] [13]
Растяжение связи C=C даст пик поглощения ИК-излучения при 1670–1600 см −1 , тогда как изгиб связи C=C поглощает длину волны от 1000 до 650 см −1 .
В спектроскопии ЯМР 1 H водород, связанный с углеродом, соседствующим с двойными связями, даст δ H 4,5–6,5 ppm . Двойная связь также деэкранирует водород, присоединенный к углеродам, соседствующим с sp 2 углеродами, и это генерирует пики δ H =1,6–2. ppm. [14] Цис/транс изомеры различимы из-за различного эффекта J-связывания . Цис- вицинальные водороды будут иметь константы связи в диапазоне 6–14 Гц , тогда как транс будет иметь константы связи 11–18 Гц. [15]
В спектрах ЯМР 13 C алкенов двойные связи также деэкранируют углероды, что приводит к низкому сдвигу поля. Двойные связи C=C обычно имеют химический сдвиг около 100–170 ppm. [15]
Как и большинство других углеводородов , алкены сгорают с образованием углекислого газа и воды.
Сгорание алкенов выделяет меньше энергии, чем сгорание той же молярности насыщенных с тем же числом атомов углерода. Эта тенденция хорошо прослеживается в списке стандартных энтальпий сгорания углеводородов. [16]
Алкены являются относительно стабильными соединениями, но более реакционноспособны, чем алканы . Большинство реакций алкенов включают присоединения к этой пи-связи, образуя новые одинарные связи . Алкены служат сырьем для нефтехимической промышленности , поскольку они могут участвовать в самых разных реакциях, в частности, в полимеризации и алкилировании. За исключением этилена, алкены имеют два центра реакционной способности: углерод-углеродную пи-связь и наличие аллильных CH-центров. Первый доминирует, но аллильные центры также важны.
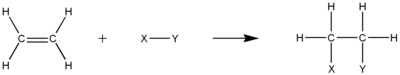
Гидрирование включает добавление H 2 , что приводит к образованию алкана. Уравнение гидрирования этилена с образованием этана :
Реакции гидрирования обычно требуют катализаторов для увеличения скорости реакции . Общее количество водородов, которые могут быть добавлены к ненасыщенному углеводороду, зависит от степени его ненасыщенности .
Подобно водороду, галогены присоединяются к двойным связям.
Ионы галония являются промежуточными продуктами. Эти реакции не требуют катализаторов.

Бромный тест используется для проверки насыщенности углеводородов. [17] Бромный тест также может использоваться в качестве показателя степени ненасыщенности ненасыщенных углеводородов. Бромное число определяется как грамм брома, способный реагировать со 100 г продукта. [18] Подобно гидрированию, галогенирование брома также зависит от числа π-связей. Более высокое бромное число указывает на более высокую степень ненасыщенности.
π-связи алкеновых углеводородов также подвержены гидратации . Реакция обычно включает сильную кислоту в качестве катализатора . [19] Первый шаг гидратации часто включает образование карбокатиона . Конечным результатом реакции будет спирт . Уравнение реакции гидратации этилена:

Гидрогалогенирование включает присоединение H−X к ненасыщенным углеводородам. В результате этой реакции образуются новые σ-связи C−H и C−X. Образование промежуточного карбокатиона селективно и подчиняется правилу Марковникова . Гидрогалогенирование алкена приведет к образованию галогеналкана . Уравнение реакции присоединения HBr к этилену:
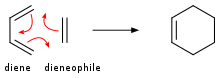
![Генерация синглетного кислорода и его [4+2]-циклоприсоединение с циклопентадиеном](http://upload.wikimedia.org/wikipedia/commons/thumb/1/12/4%2B2_cycloaddition_cyclopentadiene_O2.svg/350px-4%2B2_cycloaddition_cyclopentadiene_O2.svg.png)
Алкены присоединяются к диенам, образуя циклогексены . Это превращение является примером реакции Дильса-Альдера . Такая реакция протекает с сохранением стереохимии. Скорости чувствительны к электроноакцепторным или электронодонорным заместителям. При облучении УФ-светом алкены димеризуются, образуя циклобутаны . [20] Другим примером является реакция Шенкена , в которой синглетный кислород реагирует с аллильной структурой, образуя транспонированный аллилпероксид :
Алкены реагируют с перкарбоновыми кислотами и даже перекисью водорода с образованием эпоксидов :
Эпоксидирование этилена осуществляется в очень больших промышленных масштабах с использованием кислорода в присутствии катализаторов на основе серебра:
Алкены реагируют с озоном, что приводит к разрыву двойной связи. Этот процесс называется озонолизом . Часто процедура реакции включает мягкий восстановитель, такой как диметилсульфид ( SMe 2 ):
При обработке горячим концентрированным подкисленным раствором KMnO 4 алкены расщепляются с образованием кетонов и/или карбоновых кислот . Стехиометрия реакции чувствительна к условиям. Эту реакцию и озонолиз можно использовать для определения положения двойной связи в неизвестном алкене.
Окисление можно остановить на уровне вицинального диола, а не путем полного расщепления алкена, используя тетроксид осмия или другие окислители:
Эта реакция называется дигидроксилированием .
В присутствии соответствующего фотосенсибилизатора , такого как метиленовый синий , и света, алкены могут вступать в реакцию с активными формами кислорода, генерируемыми фотосенсибилизатором, такими как гидроксильные радикалы , синглетный кислород или супероксидный ион. Реакции возбужденного сенсибилизатора могут включать перенос электронов или водорода, обычно с восстанавливающим субстратом (реакция типа I) или взаимодействие с кислородом (реакция типа II). [21] Эти различные альтернативные процессы и реакции можно контролировать выбором определенных условий реакции, что приводит к широкому спектру продуктов. Распространенным примером является [4+2]-циклоприсоединение синглетного кислорода с диеном, таким как циклопентадиен, с получением эндопероксида :
Терминальные алкены являются предшественниками полимеров через процессы, называемые полимеризацией . Некоторые полимеризации имеют большое экономическое значение, так как они производят пластмассы полиэтилен и полипропилен . Полимеры из алкена обычно называют полиолефинами, хотя они не содержат олефинов. Полимеризация может протекать по различным механизмам. Сопряженные диены , такие как бута-1,3-диен и изопрен (2-метилбута-1,3-диен), также производят полимеры, одним из примеров которых является натуральный каучук.
Наличие связи C=C π в ненасыщенных углеводородах ослабляет энергию диссоциации аллильных связей C−H. Таким образом, эти группировки восприимчивы к свободнорадикальному замещению на этих участках CH, а также к реакциям присоединения на участке C=C. В присутствии радикальных инициаторов аллильные связи CH могут быть галогенированы. [22] Наличие двух связей C=C, фланкирующих одну метиленовую, т. е. дважды аллильных, приводит к особенно слабым связям HC-H. Высокая реакционная способность этих ситуаций является основой для определенных свободнорадикальных реакций, проявляющихся в химии высыхающих масел .
Алкены подвергаются метатезису олефинов , который расщепляет и меняет местами заместители алкена. Связанная реакция — этенолиз : [23]


В комплексах переходных металлов и алкенов алкены служат лигандами для металлов. [24] В этом случае π-электронная плотность отдается [ требуется разъяснение ] на d-орбитали металла. Чем сильнее отдача, тем сильнее обратная связь от d-орбитали металла к π*-антисвязывающей орбитали алкена. Этот эффект снижает порядок связи алкена и увеличивает длину связи CC . Одним из примеров является комплекс PtCl 3 (C 2 H 4 )] − . Эти комплексы связаны с механизмами катализируемых металлами реакций ненасыщенных углеводородов. [23]
Алкены производятся путем крекинга углеводородов. В США и на Ближнем Востоке сырьем в основном являются компоненты конденсата природного газа (главным образом этан и пропан), а в Европе и Азии — нафта . Алканы расщепляются при высоких температурах, часто в присутствии цеолитного катализатора, для получения смеси в основном алифатических алкенов и алканов с более низкой молекулярной массой. Смесь зависит от сырья и температуры и разделяется фракционной перегонкой. Это в основном используется для производства малых алкенов (до шести атомов углерода). [25]

С этим связана каталитическая дегидрогенизация , при которой алкан теряет водород при высоких температурах, образуя соответствующий алкен. [1] Это процесс, обратный каталитическому гидрированию алкенов.

Этот процесс также известен как риформинг . Оба процесса эндотермичны и при высоких температурах энтропия приводит к образованию алкена .
Каталитический синтез высших α-алкенов (типа RCH=CH 2 ) может быть также достигнут путем реакции этилена с металлоорганическим соединением триэтилалюминием в присутствии никеля , кобальта или платины .
Одним из основных методов синтеза алкенов в лабораторных условиях является реакция элиминирования алкилгалогенидов, спиртов и подобных соединений. Наиболее распространенным является β-элиминирование по механизму E2 или E1. [26] Коммерчески значимым примером является производство винилхлорида .
Механизм E2 обеспечивает более надежный метод β-элиминирования, чем E1, для большинства синтезов алкенов. Большинство элиминирований E2 начинаются с алкилгалогенида или алкилсульфонатного эфира (например, тозилата или трифлата ). Когда используется алкилгалогенид, реакция называется дегидрогалогенированием . Для несимметричных продуктов более замещенные алкены (те, у которых меньше водородов, присоединенных к C=C), как правило, преобладают (см. правило Зайцева ). Два распространенных метода реакций элиминирования — это дегидрогалогенирование алкилгалогенидов и дегидратация спиртов. Типичный пример показан ниже; обратите внимание, что, если возможно, H находится в анти-положении к уходящей группе, даже если это приводит к менее стабильному Z -изомеру. [27]
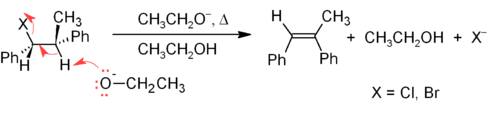
Алкены могут быть синтезированы из спиртов путем дегидратации , в этом случае вода теряется по механизму E1. Например, дегидратация этанола дает этилен:
Спирт также может быть преобразован в лучшую уходящую группу (например, ксантогенат ), чтобы обеспечить более мягкое син -элиминирование, такое как элиминирование Чугаева и элиминирование Грико . Связанные реакции включают элиминирование β-галогенэфирами ( синтез олефинов по Бурду ) и эфирами ( пиролиз эфиров ). Тиокетон и фосфитный эфир в сочетании ( олефинирование по Кори-Уинтеру ) или тетраиодид дифосфора дезоксигенируют гликоли до алкенов.
Алкены могут быть получены косвенно из алкиламинов . Амин или аммиак не являются подходящей уходящей группой, поэтому амин сначала либо алкилируется (как в элиминировании Хофмана ), либо окисляется до оксида амина ( реакция Копа ), чтобы сделать возможным плавное элиминирование. Реакция Копа представляет собой син -элиминирование, которое происходит при температуре 150 °C или ниже, например: [28]

Элиминирование Хофмана необычно тем, что основным продуктом обычно является менее замещенный (не зайцевский ) алкен.
Алкены образуются из α-галогенсульфонов в реакции Рамберга-Бэклунда через промежуточный сульфон с трехчленным кольцом.
Другой важный класс методов синтеза алкенов включает построение новой двойной связи углерод-углерод путем связывания или конденсации карбонильного соединения (такого как альдегид или кетон ) с карбанионом или его эквивалентом. Преобладающей является альдольная конденсация . Конденсации Кнёвенагеля представляют собой родственный класс реакций, которые превращают карбонилы в алкены. Хорошо известные методы называются олефинированиями . Реакция Виттига является иллюстративной, но известны и другие родственные методы, включая реакцию Хорнера-Уодсворта-Эммонса .
Реакция Виттига включает реакцию альдегида или кетона с реагентом Виттига (или фосфораном) типа Ph 3 P=CHR с образованием алкена и Ph 3 P=O . Сам реагент Виттига легко приготовить из трифенилфосфина и алкилгалогенида. [29]

С реакцией Виттига связана олефинация Петерсона , которая использует реагенты на основе кремния вместо фосфорана. Эта реакция позволяет выбирать E- или Z -продукты. Если требуется E -продукт, другой альтернативой является олефинация Жюлиа , которая использует карбанион, полученный из фенилсульфона . Олефинация Такаи , основанная на промежуточном хроморганическом соединении, также дает E-продукты. Соединение титана, реагент Теббе , полезно для синтеза метиленовых соединений; в этом случае реагируют даже эфиры и амиды .
Пара кетонов или альдегидов может быть дезоксигенирована для получения алкена. Симметричные алкены могут быть получены из одного альдегида или кетона, соединяющегося с самим собой, с использованием восстановления металлическим титаном ( реакция Мак-Мерри ). Если необходимо соединить разные кетоны, требуется более сложный метод, такой как реакция Бартона-Келлогга .
Отдельный кетон также можно преобразовать в соответствующий алкен через его тозилгидразон, используя метилат натрия ( реакция Бэмфорда-Стивенса ) или алкиллитий ( реакция Шапиро ).
Образование более длинных алкенов посредством поэтапной полимеризации более мелких является привлекательным, поскольку этилен (самый маленький алкен) является недорогим и легкодоступным, с сотнями миллионов тонн, производимых ежегодно. Процесс Циглера-Натта позволяет образовывать очень длинные цепи, например, те, которые используются для полиэтилена . Когда требуются более короткие цепи, как для производства поверхностно-активных веществ , то важны процессы, включающие этап метатезиса олефинов , такие как процесс Shell для получения высших олефинов .
Метатезис олефинов также используется в коммерческих целях для взаимопревращения этилена и 2-бутена в пропилен. В этом процессе используется гетерогенный катализ, содержащий рений и молибден: [30]
Гидровинилирование, катализируемое переходными металлами, является еще одним важным процессом синтеза алкенов, начинающимся с самого алкена. [31] Он включает в себя добавление водорода и винильной группы (или алкенильной группы) через двойную связь.
Восстановление алкинов является полезным методом стереоселективного синтеза дизамещенных алкенов. Если требуется цис -алкен, обычно используется гидрирование в присутствии катализатора Линдлара (гетерогенный катализатор, состоящий из палладия, нанесенного на карбонат кальция и обработанного различными формами свинца), хотя гидроборирование с последующим гидролизом обеспечивает альтернативный подход. Восстановление алкина металлическим натрием в жидком аммиаке дает транс -алкен. [32]
При получении многозамещенных алкенов карбометаллирование алкинов может приводить к образованию большого разнообразия производных алкенов.
Алкены могут быть синтезированы из других алкенов посредством реакций перегруппировки . Помимо метатезиса олефинов (описанного выше), могут быть использованы многие перициклические реакции , такие как реакция ена и перегруппировка Копа .
В реакции Дильса-Альдера производное циклогексена получается из диена и реакционноспособного или электронодефицитного алкена.
Непредельные углеводороды широко используются для производства пластмасс, лекарств и других полезных материалов.
Алкены широко распространены в природе. Растения являются основным природным источником алкенов в форме терпенов . [33] Многие из самых ярких природных пигментов являются терпенами; например , ликопин (красный в томатах), каротин (оранжевый в моркови) и ксантофиллы (желтый в яичном желтке). Самый простой из всех алкенов, этилен — это сигнальная молекула , которая влияет на созревание растений.
Хотя эта номенклатура не получила широкого распространения, согласно ИЮПАК, алкен — это ациклический углеводород, содержащий всего одну двойную связь между атомами углерода. [2] Олефины включают в себя более обширную группу циклических и ациклических алкенов, а также диенов и полиенов. [3]
Чтобы сформировать корень названий ИЮПАК для алкенов с прямой цепью, измените инфикс -an- в родительском слове на -en- . Например, CH 3 -CH 3 — это алкан ethANe . Поэтому название CH 2 =CH 2 — ethENe .
Для алкенов с прямой цепью, содержащих 4 или более атомов углерода, это название не полностью определяет соединение. Для этих случаев, а также для разветвленных ациклических алкенов, применяются следующие правила:
Положение двойной связи часто указывается перед названием цепи (например, «2-пентен»), а не перед суффиксом («пент-2-ен»).
Позиции не обязательно указывать, если они уникальны. Обратите внимание, что двойная связь может подразумевать иную нумерацию цепи, чем та, которая используется для соответствующего алкана: (H
3С)
3С– СН
2– Ч.
3представляет собой «2,2-диметилпентан», тогда как (H
3С)
3С– СН = СН
2«3,3-диметил-1-пентен».
Более сложные правила применяются для полиенов и циклоалкенов . [4]

Если двойная связь ациклического моноена не является первой связью цепи, то название, как построено выше, все еще не полностью идентифицирует соединение из-за цис - транс -изомерии . Тогда необходимо указать, находятся ли две одинарные связи C–C, соседние с двойной связью, на одной стороне ее плоскости или на противоположных сторонах. Для моноалкенов конфигурация часто указывается префиксами цис- (от латинского «по эту сторону») или транс- («через», «по другую сторону») перед названием соответственно; как в цис -2-пентене или транс -2-бутене.

В более общем смысле, цис - транс -изомерия будет существовать, если к каждому из двух атомов углерода в двойной связи присоединены два разных атома или группы. Учитывая эти случаи, ИЮПАК рекомендует более общую нотацию E–Z вместо префиксов цис и транс . Эта нотация рассматривает группу с наивысшим приоритетом CIP в каждом из двух атомов углерода. Если эти две группы находятся на противоположных сторонах плоскости двойной связи, конфигурация обозначается E (от немецкого entgegen, что означает «противоположный»); если они находятся на одной стороне, она обозначается Z (от немецкого zusammen , «вместе»). Эту маркировку можно изучить с помощью мнемонического правила « Z означает 'on ze zame zide'». [34]

ИЮПАК признает два названия для углеводородных групп, содержащих двойные связи углерод-углерод: винильная группа и аллильная группа. [4]
