
В химии спирт (от арабского слова al-kuḥl , الكحل ) — это тип органического соединения , которое несет по крайней мере одну гидроксильную ( −OH ) функциональную группу , связанную с насыщенным атомом углерода. [2] [3] Спирты варьируются от простых, таких как метанол и этанол , до сложных, таких как сахара и холестерин . Наличие группы ОН сильно изменяет свойства углеводородов, придавая им гидрофильные (водолюбивые) свойства. Группа ОН обеспечивает место, на котором могут происходить многие реакции.
Воспламеняющаяся природа испарений вина была известна уже древним натурфилософам, таким как Аристотель (384–322 гг. до н. э.), Теофраст ( ок. 371–287 гг. до н. э.) и Плиний Старший (23/24–79 гг. н. э.). [4] Однако это не привело к немедленному выделению алкоголя, даже несмотря на развитие более совершенных методов дистилляции в Римском Египте во втором и третьем веках н . э . [5] Важное признание, впервые найденное в одном из сочинений, приписываемых Джабиру ибн Хайяну (девятый век н. э.), заключалось в том, что при добавлении соли в кипящее вино, что увеличивает относительную летучесть вина , воспламеняемость образующихся паров может быть усилена. [6] Перегонка вина засвидетельствована в арабских трудах, приписываемых аль-Кинди ( ок. 801–873 гг. н. э.) и аль-Фараби ( ок. 872–950 гг.), а также в 28-й книге Kitāb al-Taṣrīf аз -Захрави (лат. Abulcasis, 936–1013 гг.) (позже переведенной на латынь как Liber servatoris ). [7] В двенадцатом веке рецепты производства aqua ardens («горящей воды», т. е. спирта) путем перегонки вина с солью начали появляться в ряде латинских трудов, и к концу тринадцатого века он стал широко известным веществом среди западноевропейских химиков. [8]
В работах Таддео Альдеротти (1223–1296) описывается метод концентрирования спирта, включающий повторную фракционную перегонку через охлаждаемый водой дистиллятор, с помощью которого можно было получить чистоту спирта 90%. [9] Лечебные свойства этанола изучались Арнальдом из Виллановы (1240–1311 гг. н. э.) и Иоанном из Рупесциссы ( ок. 1310–1366 гг.), последний из которых считал его сохраняющим жизнь веществом, способным предотвратить все болезни ( aqua vitae или «вода жизни», также называемая Иоанном квинтэссенцией вина). [10]
Слово «алкоголь» происходит от арабского kohl ( араб . الكحل , романизировано : al-kuḥl ), пудры, используемой в качестве подводки для глаз. [11] Первая часть слова ( al- ) — это арабский определенный артикль , эквивалентный the в английском языке. Вторая часть слова ( kuḥl ) имеет несколько предшественников в семитских языках , в конечном итоге происходящих от аккадского 𒎎𒋆𒁉𒍣𒁕 ( guḫlum ), что означает стибнит или сурьма . [12]
Как и его предшественники в арабском и более древних языках, термин « алкоголь» изначально использовался для очень тонкого порошка, полученного путем возгонки природного минерала стибнита для образования трисульфида сурьмы Sb 2 S 3 . Он считался сущностью или «духом» этого минерала. Он использовался как антисептик , подводка для глаз и косметическое средство . Позже значение слова «алкоголь» было распространено на дистиллированные вещества в целом, а затем снова сузилось до этанола, когда «спирты» стали синонимом крепкого напитка . [13]
Парацельс и Либавий оба использовали термин «алкоголь» для обозначения тонкого порошка, последний говорил об алкоголе, полученном из сурьмы. В то же время Парацельс использует это слово для обозначения летучей жидкости; alcool или alcool vini часто встречаются в его трудах. [14]
Бартоломей Трахерон в своем переводе Иоанна Вигского 1543 года вводит это слово как термин, используемый «варварскими» авторами для обозначения «тонкого порошка». Виго писал: «варварские авторы используют алкоголь или (как я иногда пишу) alcofoll для обозначения самого тонкого порошка». [15]
В «Lexicon Chymicum» Уильяма Джонсона 1657 года это слово толкуется как «сурьма с сурьмой». [16] В более широком смысле, это слово стало обозначать любую жидкость, полученную путем дистилляции, включая «винный спирт», дистиллированную сущность вина. Либавиус в «Алхимии» (1594 г.) называет « vini Alcohol vel vinum alcalisatum ». Джонсон (1657) определяет алкоголь как « quando omnis superfluitas vini a vino separatur, ita ut accensum ardeat donec totum consumatur, nihilque fæcum aut phlegmatis infundo remaneat ». Значение слова стало ограничиваться «винным спиртом» (химическое вещество, известное сегодня как этанол ) в 18 веке и было распространено на класс веществ, так называемых «спиртами» в современной химии после 1850 года. [15]
Термин « этанол» был изобретен в 1892 году путем смешивания « этана » с окончанием «-ол» в слове «алкоголь», которое было обобщено как либфикс . [17]
Термин «алкоголь» первоначально относился к первичному спирту этанолу (этиловому спирту), который используется в качестве лекарственного средства и является основным алкоголем, присутствующим в алкогольных напитках .

Суффикс -ol появляется в химическом названии Международного союза теоретической и прикладной химии (IUPAC) всех веществ, где гидроксильная группа является функциональной группой с наивысшим приоритетом. Когда в соединении присутствует группа с более высоким приоритетом, в его названии IUPAC используется префикс hydroxy- . Суффикс -ol в названиях, не относящихся к IUPAC (таких как парацетамол или холестерин ), также обычно указывает на то, что вещество является спиртом. Однако некоторые соединения, содержащие гидроксильные функциональные группы, имеют тривиальные названия , которые не включают суффикс -ol или префикс hydroxy- , например, сахара глюкоза и сахароза .
Номенклатура ИЮПАК используется в научных публикациях и в работах, где важна точная идентификация вещества. При наименовании простых спиртов название алкановой цепи теряет конечную e и добавляет суффикс -ol , например , как в "ethanol" из названия алкановой цепи " ethane ". [18] При необходимости положение гидроксильной группы указывается числом между названием алкана и -ol : пропан-1-ол для CH 3 CH 2 CH 2 OH , пропан-2-ол для CH 3 CH(OH)CH 3 . Если присутствует группа с более высоким приоритетом (например, альдегид , кетон или карбоновая кислота ), то используется префикс hydroxy- , [18] например, как в 1-гидрокси-2-пропаноне ( CH 3 C(O)CH 2 OH ). [19] Соединения, имеющие более одной гидроксильной группы, называются полиолами . Они называются с использованием суффиксов -диол, -триол и т. д., следующих за списком номеров положений гидроксильных групп, как в пропан-1,2-диоле для CH 3 CH(OH)CH 2 OH (пропиленгликоль).
В случаях, когда гидроксильная группа связана с sp2 - углеродом ароматического кольца , молекула классифицируется отдельно как фенол и именуется в соответствии с правилами ИЮПАК для наименования фенолов. [20] Фенолы обладают особыми свойствами и не классифицируются как спирты.
В других менее формальных контекстах спирт часто называют по названию соответствующей алкильной группы, за которым следует слово «спирт», например, метиловый спирт, этиловый спирт. Пропиловый спирт может быть н- пропиловым спиртом или изопропиловым спиртом , в зависимости от того, связана ли гидроксильная группа с конечным или средним углеродом на прямой пропановой цепи. Как описано в систематическом наименовании, если другая группа в молекуле имеет приоритет, спиртовая часть часто обозначается с помощью префикса «гидрокси-». [21]
В архаичной номенклатуре спирты могут быть названы как производные метанола, используя окончание «-карбинол». Например, (CH 3 ) 3 COH может быть назван триметилкарбинолом .
Спирты затем классифицируются на первичные, вторичные ( сек- , s- ) и третичные ( трет- , t- ) на основе числа атомов углерода, связанных с атомом углерода, который несет гидроксильную функциональную группу . Соответствующие числовые сокращения 1°, 2° и 3° иногда используются в неформальной обстановке. [22] Первичные спирты имеют общие формулы RCH 2 OH . Простейшим первичным спиртом является метанол ( CH 3 OH ), для которого R = H, а следующим является этанол, для которого R = CH 3 , метильная группа . Вторичные спирты - это те, которые имеют форму RR'CHOH, простейшим из которых является 2-пропанол ( R = R' = CH 3 ). Для третичных спиртов общая форма — RR'R"COH. Простейшим примером является трет -бутанол (2-метилпропан-2-ол), в котором каждый из R, R' и R" представляет собой CH 3 . В этих сокращениях R, R' и R" представляют заместители , алкильные или другие присоединенные, как правило, органические группы.
Спирты имеют долгую историю бесчисленных применений. Для простых моноспиртов, которые являются предметом этой статьи, наиболее важными промышленными спиртами являются следующие: [24]
Метанол является наиболее распространенным промышленным спиртом, в 1980 году его было произведено около 12 миллионов тонн в год. Совокупная мощность других спиртов примерно такая же и распределена примерно поровну. [24]
Что касается острой токсичности, простые спирты имеют низкую острую токсичность . Дозы в несколько миллилитров переносятся. Для пентанолов , гексанолов , октанолов и более длинных спиртов LD50 варьируется от 2 до 5 г/кг (крысы, перорально). Этанол менее остро токсичен. [25] Все спирты являются слабыми раздражителями кожи. [24]
Метанол и этиленгликоль более токсичны, чем другие простые спирты. На их метаболизм влияет присутствие этанола, который имеет более высокое сродство к алкогольдегидрогеназе печени . Таким образом, метанол будет выводиться нетронутым с мочой. [26] [27] [28]
В общем, гидроксильная группа делает спирты полярными . Эти группы могут образовывать водородные связи друг с другом и с большинством других соединений. Благодаря наличию полярной ОН спирты более растворимы в воде, чем простые углеводороды. Метанол, этанол и пропанол смешиваются с водой. 1-бутанол с четырехуглеродной цепью умеренно растворим.
Из-за водородных связей спирты, как правило, имеют более высокие температуры кипения, чем сопоставимые углеводороды и эфиры . Температура кипения спирта этанола составляет 78,29 °C, по сравнению с 69 °C для углеводорода гексана и 34,6 °C для диэтилового эфира .
Спирты широко распространены в природе, как производные глюкозы, такие как целлюлоза и гемицеллюлоза , а также в фенолах и их производных, таких как лигнин . [29] Начиная с биомассы , 180 миллиардов тонн/год сложных углеводов (полимеров сахара) производятся в коммерческих целях (по состоянию на 2014 год). [30] Многие другие спирты широко распространены в организмах, что проявляется в других сахарах, таких как фруктоза и сахароза , в полиолах, таких как глицерин , и в некоторых аминокислотах , таких как серин . Простые спирты, такие как метанол, этанол и пропанол, встречаются в природе в скромных количествах и синтезируются в больших количествах в промышленности для использования в качестве химических прекурсоров, топлива и растворителей.
Многие спирты производятся путем гидроксилирования , т. е. установки гидроксильной группы с использованием кислорода или родственного окислителя. Гидроксилирование — это способ, с помощью которого организм перерабатывает многие яды , превращая липофильные соединения в гидрофильные производные, которые легче выводятся. Ферменты, называемые гидроксилазами и оксидазами, облегчают эти преобразования.
Многие промышленные спирты, такие как циклогексанол для производства нейлона , производятся путем гидроксилирования.
В процессе Циглера линейные спирты производятся из этилена и триэтилалюминия с последующим окислением и гидролизом. [24] Показан идеализированный синтез 1-октанола :
В результате этого процесса образуется ряд спиртов, которые разделяются путем перегонки .
Многие высшие спирты получаются путем гидроформилирования алкенов с последующим гидрированием. При применении к терминальному алкену , как это обычно бывает, обычно получается линейный спирт: [24]
В результате таких процессов получаются жирные спирты , которые используются в моющих средствах.
Некоторые низкомолекулярные спирты промышленного значения производятся путем добавления воды к алкенам. Этанол, изопропанол, 2-бутанол и трет -бутанол производятся этим общим методом. Используются два варианта реализации: прямой и косвенный. Прямой метод позволяет избежать образования стабильных промежуточных продуктов, обычно используя кислотные катализаторы. В косвенном методе алкен преобразуется в сульфатный эфир , который впоследствии гидролизуется. Прямая гидратация использует этилен ( гидратация этилена ) [31] или другие алкены, полученные в результате крекинга фракций перегнанной сырой нефти .
Гидратация также используется в промышленности для получения диола этиленгликоля из окиси этилена .
Этанол получают путем ферментации глюкозы (которая часто получается из крахмала ) в присутствии дрожжей. Углекислый газ образуется одновременно. Как и этанол, бутанол может быть получен путем ферментации. Известно, что дрожжи Saccharomyces производят эти высшие спирты при температуре выше 75 °F (24 °C). Бактерия Clostridium acetobutylicum может питаться целлюлозой (также спиртом) для производства бутанола в промышленных масштабах. [32]
Первичные алкилгалогениды реагируют с водным NaOH или KOH , давая спирты в нуклеофильном алифатическом замещении . Вторичные и особенно третичные алкилгалогениды дадут вместо этого продукт элиминирования (алкен). Реактивы Гриньяра реагируют с карбонильными группами, давая вторичные и третичные спирты. Родственные реакции — реакция Барбье и реакция Нозаки-Хиямы .
Альдегиды или кетоны восстанавливаются с помощью борогидрида натрия или алюмогидрида лития (после кислотной обработки). Другое восстановление с использованием изопропоксида алюминия — это восстановление Меервейна-Понндорфа-Верлея . Асимметричное гидрирование Нойори — это асимметричное восстановление β-кетоэфиров.
Алкены участвуют в реакции гидратации, катализируемой кислотой , с использованием концентрированной серной кислоты в качестве катализатора, что обычно дает вторичные или третичные спирты. Образование вторичного спирта через восстановление и гидратацию алкена показано:
Гидроборирование -окисление и оксимеркурирование-восстановление алкенов более надежны в органическом синтезе. Алкены реагируют с N -бромсукцинимидом и водой в реакции образования галогенгидрина . Амины могут быть преобразованы в соли диазония , которые затем гидролизуются.
С водными значениями p K a около 16–19 спирты, как правило, являются немного более слабыми кислотами, чем вода . С сильными основаниями, такими как гидрид натрия или натрий, они образуют соли [a] , называемые алкоксидами , с общей формулой RO − M + (где R — алкил , а M — металл ).
Кислотность спиртов сильно зависит от сольватации . В газовой фазе спирты более кислые, чем в воде. [33] В ДМСО спирты (и вода) имеют ap K a около 29–32. Как следствие, алкоксиды (и гидроксид) являются мощными основаниями и нуклеофилами (например, для синтеза эфира Уильямсона ) в этом растворителе. В частности, RO − или HO − в ДМСО можно использовать для получения значительных равновесных концентраций ацетилид-ионов посредством депротонирования алкинов (см. реакцию Фаворского ). [34] [35]
Третичные спирты реагируют с соляной кислотой , образуя третичный алкилхлорид . Первичные и вторичные спирты преобразуются в соответствующие хлориды с использованием тионилхлорида и различных реагентов хлорида фосфора. [36]
Первичные и вторичные спирты также превращаются в алкилбромиды с использованием трибромида фосфора , например:
В процессе дезоксигенации Бартона-МакКомби спирт дезоксигенируется до алкана с помощью гидрида трибутилолова или комплекса триметилборан -вода в реакции радикального замещения .
Между тем, атом кислорода имеет неподеленные пары несвязанных электронов, которые делают его слабоосновным в присутствии сильных кислот, таких как серная кислота . Например, с метанолом:
При обработке сильными кислотами спирты подвергаются реакции элиминирования E1 с образованием алкенов . Реакция, в общем, подчиняется правилу Зайцева , которое гласит, что образуется наиболее стабильный (обычно наиболее замещенный) алкен. Третичные спирты легко элиминируются при температуре чуть выше комнатной, но первичные спирты требуют более высокой температуры.
Это схема кислотно-катализируемой дегидратации этанола с получением этилена :
Более контролируемая реакция элиминирования требует образования эфира ксантогената.
Третичные спирты реагируют с сильными кислотами, образуя карбокатионы. Реакция связана с их дегидратацией, например, изобутилен из трет -бутилового спирта. Особый вид реакции дегидратации включает трифенилметанол и особенно его аминозамещенные производные. При обработке кислотой эти спирты теряют воду, давая стабильные карбокатионы, которые являются коммерческими красителями. [37]

Спирт и карбоновые кислоты реагируют в так называемой этерификации Фишера . Реакция обычно требует катализатора , например, концентрированной серной кислоты:
Аналогичным образом получают и другие типы эфиров, например, тозиловые (тозилатные) эфиры получают реакцией спирта с 4-толуолсульфонилхлоридом в пиридине .
Первичные спирты ( R−CH 2 OH ) могут окисляться либо до альдегидов ( R−CHO ), либо до карбоновых кислот ( R−CO 2 H ). Окисление вторичных спиртов ( R 1 R 2 CH−OH ) обычно заканчивается на стадии кетонов ( R 1 R 2 C=O ). Третичные спирты ( R 1 R 2 R 3 C−OH ) устойчивы к окислению.
Прямое окисление первичных спиртов до карбоновых кислот обычно протекает через соответствующий альдегид, который преобразуется через альдегидгидрат ( R −CH(OH) 2 ) в результате реакции с водой, прежде чем он может быть дополнительно окислен до карбоновой кислоты.
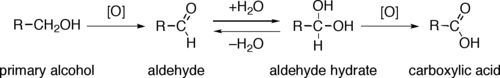
Реагенты, полезные для превращения первичных спиртов в альдегиды, обычно подходят и для окисления вторичных спиртов в кетоны. К ним относятся реагент Коллинза и периодинан Десса-Мартина . Прямое окисление первичных спиртов в карбоновые кислоты можно осуществить с помощью перманганата калия или реагента Джонса .
Поскольку ol указывает на производное OH, то, по-видимому, нет причин, по которым простое слово acid не должно означать карбоксил, а al не должно означать COH; названия ethanol ethanal и ethanoic acid или просто ethane acid тогда будут обозначать производные OH, COH и COOH этана.