Респираторно-синцитиальный вирус ( RSV ), [a] также называемый респираторно-синцитиальным вирусом человека ( hRSV ) и ортопневмовирусом человека , является заразным вирусом , вызывающим инфекции дыхательных путей . Это одноцепочечный РНК-вирус с отрицательным знаком . [2] Его название происходит от крупных клеток, известных как синцитии , которые образуются при слиянии инфицированных клеток. [2] [3]
RSV является частой причиной респираторной госпитализации у младенцев, и повторное инфицирование остается распространенным в более позднем возрасте, хотя часто с меньшей степенью тяжести. Это заметный патоген во всех возрастных группах. Уровень инфицирования обычно выше в холодные зимние месяцы, вызывая бронхиолит у младенцев, простуду у взрослых и более серьезные респираторные заболевания, такие как пневмония , у пожилых и с ослабленным иммунитетом . [4]
RSV может вызывать вспышки как в обществе, так и в больничных условиях. После первичного заражения через глаза или нос вирус поражает эпителиальные клетки верхних и нижних дыхательных путей, вызывая воспаление, повреждение клеток и обструкцию дыхательных путей. [2] Для обнаружения и диагностики RSV доступны различные методы, включая тестирование на антиген , молекулярное тестирование и вирусную культуру . [3]
Исторически рекомендуемые меры профилактики включают мытье рук и избегание тесного контакта с инфицированными людьми. [5] Обнаружение RSV в респираторных аэрозолях, [6] наряду с образованием мелких и сверхмелких аэрозолей во время обычного дыхания, разговора, [7] и кашля, [8] и формирующийся научный консенсус относительно передачи всех респираторных инфекций, [9] меры предосторожности при воздушном переносе также могут потребоваться для надежной защиты. В мае 2023 года Управление по контролю за продуктами и лекарствами США (FDA) одобрило первые вакцины против RSV , Arexvy (разработанную GSK plc ) и Abrysvo ( Pfizer ). [10] [11]
Лечение тяжелой формы заболевания в первую очередь поддерживающее, включая кислородную терапию и более продвинутую респираторную поддержку с постоянным положительным давлением в дыхательных путях (CPAP) или носовым высоким потоком кислорода , по мере необходимости. В случаях тяжелой дыхательной недостаточности может потребоваться интубация и искусственная вентиляция легких. Рибавирин — это противовирусный препарат , лицензированный для лечения РСВ у детей. [12]
Респираторно-синцитиальный вирус (РСВ) был обнаружен в 1956 году у лабораторного шимпанзе с заболеванием верхних дыхательных путей. Когда 14 шимпанзе наблюдались с симптомами, похожими на простуду, Моррис и его коллеги обнаружили новый вирус, который они первоначально назвали «возбудителем насморка шимпанзе» (CCA). Позже Чанок и его коллеги показали, что этот вирус также вызывает респираторное заболевание у людей, выделив его у двух детей, у одного из которых была инфекция горла и голосовых связок, а у другого — инфекция легких. Они обнаружили, что этот вирус был похож на CCA. Когда у большинства детей школьного возраста было обнаружено специфическое антитело против CCA, вирус переименовали в «респираторно-синцитиальный вирус», чтобы лучше отразить его влияние на здоровье и лабораторные результаты. [13] Открытие этого заболевания чрезвычайно важно, поскольку оно идентифицирует новый вирус, поражающий животных и людей.
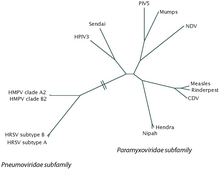
Благодаря открытию нейтрализующих антител у детей и подтверждению того, что вирус вызывает респираторное заболевание, это заболевание было названо респираторно-синцитиальным вирусом. Это название также подчеркивает характерную черту, наблюдаемую во время инфекции, а именно слияние клеток. RSV принадлежит к группе Mononegavirales, которая представляет собой вирусы с несегментированными отрицательно-полярными геномами РНК. RSV также относится к семейству Paramyxoviridae, которое представляет собой семейство одноцепочечных РНК-вирусов, вызывающих различные типы инфекций у позвоночных. [14] Кроме того, RSV является частью подсемейства Pneumovirinae, которое представляет собой вирусы, в первую очередь поражающие дыхательные пути.
Условия окружающей среды, такие как температура и pH, могут привести к снижению инфекционности, поскольку RSV чувствителен к ним. Исследования изучали возможности выживания RSV на поверхностях окружающей среды и обнаружили, что RSV может выживать в течение многих часов на непористых поверхностях и может передаваться через дыхательные капли и прямой контакт. [13]
Бремя респираторно-синцитиального вируса высоко у детей младшего возраста в странах с низким и средним уровнем дохода. «Целевая группа PROUD (Профилактика респираторно-синцитиального вируса в слаборазвитых странах) из 24 экспертов по RSV во всем мире оценила основные потребности в профилактике RSV в странах с низким и средним уровнем дохода (LMIC), включая вакцину и новые профилактические меры». [15] RSV и инфекции нижних дыхательных путей (LRTI) вызывают более «3 миллионов госпитализаций и более 100 000 смертей у детей в возрасте до 5 лет каждый год». [15] Около «90%» этих показателей смертности приходится на LMIC, «где RSV, как сообщается, является наиболее частой причиной смертности среди младенцев после неонатального периода». [15] За последние два десятилетия Всемирная организация здравоохранения сделала меры профилактики RSV и LRTI своим приоритетом. Однако даже после «60 лет исследований» «меры профилактики РС-вирусной инфекции по-прежнему ограничиваются соблюдением правил гигиены и применением паливизумаба — моноклонального антитела, используемого только для детей из группы высокого риска, включая недоношенных детей (гестационный возраст ≤35 недель) и детей с врожденным пороком сердца и бронхолегочной дисплазией». [15]
Одной из основных проблем является обеспечение доступа к различным типам вмешательства по устойчивой и доступной цене для «улучшения управления RSV в странах с низким и средним уровнем дохода». [15] Даже при применении вакцин и «моноклональных антител» страны с низким и средним уровнем дохода имеют ограниченный доступ к медицинской помощи и испытывают «отсутствие осведомленности/понимания воздействия RSV на общественное здравоохранение среди медицинских работников (HCPs)». [15] Также наблюдается «отсутствие надежных местных/региональных эпидемиологических и данных о бремени болезней для информирования об оценке экономической эффективности и руководства профилактическими мерами, а также отсутствие доступа к тестам по месту оказания медицинской помощи». [15] Целевая группа PROUD из 24 глобальных RSV была создана для оказания помощи в «понимании и предложении решений этих проблем». [15] Цель целевой группы — оказать давление на политиков, влиятельных поставщиков медицинских услуг, организации общественного здравоохранения и ассоциации, чтобы они работали вместе для борьбы с RSV в странах с низким и средним уровнем дохода. [15] Одним из первых шагов, предпринятых рабочей группой PROUD для достижения своей цели, было создание «подробной оценки ключевых соображений и приоритетов для профилактики и лечения инфекции RSV в странах с низким и средним уровнем дохода». [15] Они сделали это посредством «глобального онлайн-опроса HCPS». [15]
Различия в лечении и профилактике различаются во всем мире, а симптомы и распространенность RSV также различаются в культурном отношении. В статье под названием «Сравнение этнических групп в госпитализациях с респираторно-синцитиальным вирусным бронхиолитом в Израиле» «Этнические различия в RSV-бронхиолите были задокументированы. Исследование, проведенное в Соединенных Штатах, показало более высокие показатели госпитализаций RSV у чернокожих детей, чем у белых детей в возрасте 12–23 месяцев; однако не было обнаружено различий ни в показателях заболеваемости на первом году жизни, ни в тяжести заболевания». [16] Способы, которыми некоторые регионы мира справляются с RSV и другими вирусами, различаются в зависимости от культурных причин, а также медицинских предпочтений. Например, профилактические меры могут быть жизнеспособными источниками в одном регионе мира, такими как вакцины и поддержание актуальности визитов к врачу, но в других местах профилактическая помощь может быть не таким уж большим вариантом или возможностью для всех. Социально-экономический статус также может играть роль в этом неравенстве в уходе, поскольку в некоторых местах больше медицинской помощи и ресурсов, чем в других.
Инфекция RSV может проявляться широким спектром признаков и симптомов, которые варьируются от легких инфекций верхних дыхательных путей (ИВДП) до тяжелых и потенциально опасных для жизни инфекций нижних дыхательных путей (ИНДП), требующих госпитализации и искусственной вентиляции легких . [17] Хотя RSV может вызывать инфекции дыхательных путей у людей всех возрастов и относится к распространенным детским инфекциям, его проявления часто различаются в зависимости от возрастных групп и иммунного статуса. [4] Повторное инфицирование распространено на протяжении всей жизни, но младенцы и пожилые люди остаются в группе риска по симптоматическому инфицированию. [17]
Почти все дети в Соединенных Штатах переносят по крайней мере одну инфекцию RSV до достижения двухлетнего возраста. [18] Детские инфекции RSV довольно быстро проходят сами по себе с типичными признаками и симптомами верхних дыхательных путей, такими как заложенность носа, насморк , кашель и субфебрильная температура. [4] [18] При осмотре можно увидеть воспаление слизистой оболочки носа ( ринит ) и горла ( фарингит ), а также покраснение глаз ( конъюнктивальная инфекция ). [3] Примерно у 15–50% детей впоследствии развиваются более серьезные инфекции нижних дыхательных путей, такие как бронхиолит, вирусная пневмония или круп . [17] [19]
Бронхиолит — это распространенная инфекция нижних дыхательных путей, характеризующаяся воспалением и обструкцией мелких дыхательных путей в легких. [20] Хотя бронхиолит могут вызывать несколько вирусов, RSV является причиной примерно 70% случаев. [4] Обычно он проявляется насморком и заложенностью носа в течение 2–4 дней, за которыми следует усиливающийся кашель, шумное дыхание, тахипноэ (учащенное дыхание) и хрипы . [18] Может наблюдаться лихорадка, но высокая температура встречается редко. [17] При аускультации часто можно услышать хрипы и хрипы , а уровень насыщения кислородом может быть снижен. [20]
Повторное заражение RSV остается распространенным явлением на протяжении всей жизни. Повторное заражение во взрослом возрасте часто вызывает только легкие или умеренные симптомы, неотличимые от обычной простуды или синусита . [4] Инфекция также может протекать бессимптомно . Если симптомы присутствуют, они, как правило, изолированы от верхних дыхательных путей: насморк, боль в горле, лихорадка и недомогание . В подавляющем большинстве случаев заложенность носа предшествует развитию кашля. [3] В отличие от других инфекций верхних дыхательных путей, RSV также с большей вероятностью вызывает новое начало хрипов у взрослых. [3] Около 25% инфицированных взрослых будут прогрессировать до серьезной инфекции нижних дыхательных путей, такой как бронхит или трахеобронхит . [17]
Хотя RSV очень редко вызывает тяжелое заболевание у здоровых взрослых, он может вызывать заболеваемость и смертность у пожилых людей и у людей с сопутствующим иммунодефицитом или сердечно-легочными заболеваниями. У пожилых людей проявления заболевания схожи с проявлениями у молодых людей, но, как правило, у них более выраженные симптомы с повышенным риском поражения нижних дыхательных путей. В частности, у пожилых людей чаще возникают пневмония , респираторный дистресс и смерть. [3]
Как у взрослых, так и у детей, у тех, у кого ослаблен иммунитет, повышен риск тяжелой инфекции RSV. Инфицированные лица в этой группе с большей вероятностью прогрессируют от поражения верхних дыхательных путей до нижних и имеют длительное выделение вируса . [21] Тяжесть симптомов, по-видимому, тесно связана со степенью подавления иммунитета. Те, кто перенес трансплантацию гемопоэтических стволовых клеток (HSCT), интенсивную химиотерапию и трансплантацию легких, особенно восприимчивы. [3] [22] Пациенты с трансплантацией костного мозга, по-видимому, подвергаются наибольшему риску, особенно до приживления костного мозга. В этой группе инфекция RSV несет почти 80% риск как пневмонии, так и смерти. [3] [23]
RSV или респираторно-синцитиальный вирус (sin-SISH-uhl) по-разному влияет на многие группы населения. Наиболее подверженной риску осложнений RSV являются пожилые люди и люди с сопутствующими заболеваниями или лица с ослабленным иммунитетом. [24] Ежегодно в Соединенных Штатах госпитализируют от 60 000 до 160 000 пожилых людей с RSV. Ежегодно от инфекции RSV умирают от 6 000 до 10 000 пожилых людей. [25] Кроме того, RSV может «... приводить к ухудшению серьезных состояний, таких как астма, хроническая обструктивная болезнь легких (ХОБЛ) — хроническое заболевание легких, при котором трудно дышать, и даже застойная сердечная недостаточность — когда сердце не может перекачивать достаточно крови и кислорода через организм». [25] Своевременная и правильная медицинская помощь важна для пожилых людей, поскольку ожидание или получение неправильного диагноза могут быть связаны с повышенным риском осложнений. С августа 2023 года в Канаде и США вакцинация против РСВ будет доступна для взрослых в возрасте 60 лет и старше. [25]
Две вакцины, одна под торговой маркой Arexvy, разработанная GSK, и другая под торговой маркой Abrysvo, от Pfizer, были одобрены FDA и показали свою чрезвычайную эффективность против RSV в августе 2023 года. [26] Вакцина, разработанная GSK, сообщила об «общей эффективности 82,6% против заболеваний нижних дыхательных путей в течение первого сезона, 77,3% в середине сезона и 67,2% в течение двух сезонов». [27] Вторая вакцина, созданная после Pfizer, доказала «эффективность почти 89% против LRTD, включающих по крайней мере три симптома в первый год после вакцинации, и 78,6% в середине второго сезона в данных, представленных в FDA». [27] Эти цифры являются новаторскими для пожилых пациентов, которые также могут страдать от последствий основных заболеваний. В целом, «врачи говорят, что преимущества новых вакцин для пожилых людей перевешивают потенциальный вред в случаях, когда RSV может быть опасным для жизни». [27] Они рекомендуют вакцины всем пожилым людям, имеющим на это право, и специально нацеливают их на людей с сопутствующими заболеваниями. Центры по контролю и профилактике заболеваний США рекомендуют использовать совместное клиническое принятие решений при принятии решения о вакцинации, с коммуникацией между поставщиком медицинских услуг и пациентом о пользе вакцинации, факторах риска пациента для тяжелого заболевания RSV и любых потенциальных побочных эффектах вакцины. [28]
Факторы риска развития тяжелой инфекции нижних дыхательных путей, вызванной РСВ, различаются в зависимости от популяции.
RSV — это одноцепочечный РНК- вирус с отрицательным знаком . [2] Научное название этого вирусного вида — человеческий ортопневмовирус . Это синоним респираторно-синцитиального вируса человека (hRSV), который часто сокращается до просто RSV. [34] Он принадлежит к роду Orthopneumovirus , семейству Pneumoviridae , отряду Mononegavirales . [2] Его название происходит от того факта, что белки F на поверхности вируса заставляют соседние клеточные мембраны сливаться, создавая большие многоядерные синцитии . [3]
RSV делится на два антигенных подтипа, A и B, на основе реактивности поверхностных белков F и G к моноклональным антителам. [2] [3] Подтипы имеют тенденцию циркулировать одновременно в пределах локальных эпидемий, хотя подтип A имеет тенденцию быть более распространенным. [23] Как правило, подтип RSV A (RSVA) считается более вирулентным, чем подтип RSV B (RSVB), с более высокой вирусной нагрузкой и более быстрым временем передачи. [2] [3] На сегодняшний день идентифицировано 16 кладов RSVA и 22 RSVB . [2] Среди RSVA преобладают клады GA1, GA2, GA5 и GA7; GA7 встречается только в Соединенных Штатах. [2] Среди RSVB во всем мире преобладает клад BA. [2]

RSV имеет отрицательно-полярный одноцепочечный РНК-геном. [2] Геном линейный и имеет длину около 15 000 нуклеотидов . [3] Он имеет 10 генов, кодирующих 11 белков. [2] [4] Порядок генов - NS1- NS2 -NPM-SH-GF-M2-L, причем гены NS1 и NS2 служат неструктурными промоторными генами. [35]

_EM_PHIL_2175_lores.jpg/440px-Respiratory_Syncytial_Virus_(RSV)_EM_PHIL_2175_lores.jpg)
RSV — это оболочечный вирус среднего размера (~150 нм ) . Хотя многие частицы имеют сферическую форму, были также идентифицированы нитевидные виды. [2] [3] Геном находится внутри спирального нуклеокапсида и окружен матричным белком и оболочкой, содержащей вирусные гликопротеины. [36] Существует 11 белков, описанных далее в таблице ниже.
_(52456711008).jpg/440px-Human_Respiratory_Syncytial_Virus_(RSV)_(52456711008).jpg)
_(52501736052).jpg/440px-Human_Respiratory_Syncytial_Virus_(RSV)_(52501736052).jpg)
Поверхностный белок G (гликопротеин) в первую очередь отвечает за прикрепление вируса к клеткам-хозяевам. [37] Этот белок сильно варьируется между штаммами. [23] Белок G существует как в мембраносвязанной, так и в секретируемой формах. [3] [37] Мембраносвязанная форма отвечает за прикрепление путем связывания с гликозаминогликанами (ГАГ), такими как гепарансульфат , на поверхности клеток-хозяев. [2] [4] [3] Секретируемая форма действует как приманка, взаимодействуя с антигенпрезентирующими клетками, чтобы ингибировать нейтрализацию , опосредованную антителами . [3] [37] Белок G также содержит мотив, подобный фракталкину CX3C , который связывается с хемокиновым рецептором 1 CX3C ( CX3CR1 ) на поверхности реснитчатых бронхиальных клеток-хозяев. [2] [4] Это связывание может изменять клеточный хемотаксис и уменьшать миграцию иммунных клеток в легкие инфицированных людей. [37] G-белок также изменяет иммунный ответ хозяина, ингибируя передачу сигналов от нескольких толл-подобных рецепторов , включая TLR4 . [4] [37]
Поверхностный белок F (белок слияния) отвечает за слияние вирусных и клеточных мембран хозяина, а также за образование синцития между вирусными частицами. [37] Его последовательность в высокой степени консервативна между штаммами. [23] Хотя присоединение вируса, по-видимому, включает как белки F, так и G, слияние F происходит независимо от G. [37] Белок F существует в нескольких конформационных формах. [2] [4] В состоянии предслияния (PreF) белок существует в тримерной форме и содержит основной антигенный сайт Ø. [2] Ø служит основной целью нейтрализующих антител в организме. [4] После связывания со своей целью на поверхности клетки-хозяина (его точный лиганд остается неясным), PreF претерпевает конформационное изменение , в ходе которого Ø теряется. [2] [4] Это изменение позволяет белку встраиваться в мембрану клетки- хозяина и приводит к слиянию вирусной и клеточной мембран. [2] Окончательный конформационный сдвиг приводит к более стабильной и удлиненной форме белка (постслияние, PostF). [4] В отличие от белка G вируса RSV, белок F вируса RSV также связывается с толл-подобным рецептором 4 (TLR4) и активирует его, инициируя врожденный иммунный ответ и передачу сигнала. [2] [37]

После слияния вирусной и клеточной мембран хозяина вирусный нуклеокапсид (содержащий вирусный геном) и связанная с ним вирусная полимераза доставляются в цитоплазму клетки хозяина . Транскрипция и трансляция происходят в цитоплазме. РНК-зависимая РНК-полимераза транскрибирует геном в 10 сегментов информационной РНК ( мРНК ), которая транслируется в структурные белки механизмами клетки хозяина. Во время репликации вирусного генома с отрицательным смыслом РНК-зависимая РНК-полимераза синтезирует комплемент с положительным смыслом, называемый антигеномом. Эта комплементарная цепь используется в качестве шаблона для построения геномной отрицательной РНК, которая упаковывается в нуклеокапсиды и транспортируется к плазматической мембране для сборки и почкования частиц. [36]
RSV очень заразен и может вызывать вспышки как в обществе, так и в больнице. [3] По оценкам, на каждого человека, инфицированного RSV, в среднем заражаются от 5 до 25 неинфицированных людей. [38] RSV может распространяться, когда инфицированный человек кашляет или чихает, выделяя зараженные капли в воздух. Передача обычно происходит, когда эти капли попадают в глаза, нос или рот другого человека. [39] Как и все респираторные патогены, которые когда-то считались передающимися воздушно-капельным путем, он с большой вероятностью переносится аэрозолями, образующимися при обычном дыхании, разговоре и даже пении. [9] RSV также может жить до 25 минут на загрязненной коже (например, руках) и несколько часов на других поверхностях, таких как столешницы и дверные ручки. [3] [38] Инкубационный период составляет от 2 до 8 дней. [3] После заражения люди обычно заразны в течение 3–8 дней. Однако у младенцев и людей с ослабленной иммунной системой вирус может продолжать распространяться до 4 недель (даже после того, как у них больше не проявляются симптомы). [39]
_infection_x400.jpg/440px-Respiratory_syncytial_virus_(RSV)_infection_x400.jpg)
После передачи через нос или глаза RSV заражает реснитчатые столбчатые эпителиальные клетки верхних и нижних дыхательных путей. [3] RSV продолжает размножаться в этих бронхиальных клетках в течение примерно 8 дней. [2] После первых нескольких дней инфицированные RSV клетки станут более округлыми и в конечном итоге отторгнутся в более мелкие бронхиолы нижних дыхательных путей. [2] Этот механизм отторгания также считается ответственным за распространение вируса из верхних в нижние дыхательные пути. [2] Инфекция вызывает генерализованное воспаление в легких, включая миграцию и инфильтрацию воспалительных клеток (таких как моноциты и Т-клетки), некроз стенки эпителиальных клеток, отек и повышенную выработку слизи. [3] Воспаление и повреждение клеток, как правило, носят очаговый, а не диффузный характер. [3] Вместе отторгшиеся эпителиальные клетки, слизистые пробки и накопленные иммунные клетки вызывают обструкцию нижних дыхательных путей. [2] [3]
Реинфекция РСВ
После выздоровления от «респираторных заболеваний, связанных с инфекцией RSV, вирус препятствует формированию иммунологической памяти, что приводит к повторным повторным инфекциям». [40] По оценкам, «36% людей» могут быть повторно инфицированы RSV «по крайней мере один раз в течение зимнего сезона». [40] Подобные повторные инфекции могут быть результатом «первоначального столкновения с RSV», которое «не инициирует адекватные гуморальные и клеточные иммунные реакции для генерации защитных лимфоцитов памяти». [40]
Повторное заражение RSV может происходить на протяжении всей жизни. В результате это может вызвать «зимние/ранние весенние эпидемии в умеренных регионах, но синхронизация активности RSV может сильно различаться» в зависимости от региона, в котором живет человек. [40] Обычно, «если только у взрослых нет иммунодефицита», у взрослых наблюдаются легкие симптомы при повторном заражении. [41] Легкие симптомы, как правило, ограничивают верхние дыхательные пути. Однако люди младшего возраста чрезвычайно уязвимы к развитию «тяжелых симптомов», которые обычно затрагивают нижние дыхательные пути. [41] Поскольку у младенцев дыхательные пути меньше, чем у детей, «они могут быть закупорены воспалением, отеком и слизью». [41] Это может способствовать развитию «более тяжелого заболевания нижних дыхательных путей». [41] Как уже упоминалось, повторное заражение RSV часто встречается среди людей всех возрастов, и тип реакции хозяина на повторное заражение может определить, «у каких детей разовьется постоянное хриплое дыхание и, возможно, астма». [41] Возможно, что возраст, в котором вы инфицированы РСВ, может быть решающим фактором в «определении фенотипа реакции дыхательных путей на последующую инфекцию РСВ». [41]
Иммунный побег при РСВ
Генетические вариации в вирусных эпитопах и смежных областях влияют на сворачивание белка, посттранскрипционные модификации и антигенную обработку, влияя на иммунитет В- и Т-клеток во время вирусных инфекций. [42] Это изменение конформации может привести к уклонению от иммунного ответа, потенциально влияя на тяжесть заболевания, вспышки и повторные инфекции. В частности, изменчивость, наблюдаемая в гене G, за которым следуют гены SH и F, предполагает корреляцию между структурными различиями в белках и их иммуногенностью. [42] В частности, нерегулярная скручиваемость и низкая энергия связи белка G делают его склонным к конформационным изменениям, влияя на его иммуногенность и потенциально модулируя иммунный ответ. [42]
Различные генотипы RSV демонстрируют вариации в структурной конформации ключевых белков, таких как G, SH и F, влияющих на иммунные ответы. Появление новых генотипов, таких как ON1 и BA9, связано с отчетливыми структурными различиями, особенно в белке G, что может способствовать иммунному уклонению. Данные свидетельствуют о том, что гликопротеин G RSV играет решающую роль в иммунной модуляции во время инфекции, влияя на экспрессию цитокинов и противовирусный ответ. [42] Кроме того, положительное давление отбора приводит к доминированию определенных генотипов над другими, что потенциально обусловлено мутациями в определенных областях гена G.
Белок F является основной мишенью для нейтрализующих антител, но его изменчивость позволяет вирусу уклоняться от нейтрализации, влияя на эффективность антител, таких как Palivizumab. [42] Наблюдаются перекрестные реакции между подтипами и генотипами RSV, но иммунные ответы являются специфичными для подтипа или генотипа, что указывает на влияние мутаций генов, особенно в белке G, на иммунное уклонение. Кроме того, различия в экспрессии цитокинов и реакциях иммунных клеток подчеркивают сложность иммунных взаимодействий во время инфекции RSV. Геномные вариации RSV, особенно в белках, таких как G и F, влияют на иммунные ответы и способствуют иммунному уклонению. Этот многогранный иммуномодулирующий арсенал, вероятно, способствует способности RSV вызывать легкие респираторные симптомы в большинстве случаев, однако он представляет серьезную угрозу для уязвимых групп населения, таких как младенцы и пожилые люди, потенциально приводя к опасному для жизни заболеванию легких, характеризующемуся нарушением иммунной регуляции. Вирус RSV выработал множество стратегий, позволяющих избежать противовирусного ответа хозяина, при этом более половины его белков оказывают иммуномодулирующее действие.
Для диагностики инфекции RSV доступны различные лабораторные тесты. Хотя Американская академия педиатрии (AAP) обычно не рекомендует использовать лабораторные тесты для диагностики бронхиолита RSV (для которого лечение в основном поддерживающее), [5] подтверждение инфекции RSV может быть оправдано в группах высокого риска, если результат будет определять клинические решения. Распространенные методы идентификации включают тестирование на антиген, молекулярное тестирование и вирусную культуру. [3]
Тестирование на антиген включает обнаружение фрагментов антигена RSV (или частей молекулярных вирусных структур), обычно из мазка из носоглотки или аспирата. Это можно сделать либо путем просмотра флуоресцентно меченых антигенов под микроскопом (прямой флуоресцентный анализ, или DFA), либо с помощью коммерчески доступного быстрого теста на обнаружение антигена (RADT). [3] В целом, тестирование на антиген высокочувствительно у маленьких детей (80–90%), но существенно менее надежно у детей старшего возраста и взрослых, у которых меньше вирусовыделение. [3] Тесты на антиген также подвержены более высоким ложноположительным показателям вне пикового сезона RSV, например, в летние месяцы. В этих сценариях использование либо вирусной культуры, либо тестирования амплификации нуклеиновых кислот (NAAT) может помочь в точной диагностике RSV. [ необходима цитата ]
Молекулярные анализы, такие как тесты амплификации нуклеиновых кислот (NAAT), позволяют чувствительно обнаруживать очень малые количества вируса в мазках из носоглотки и аспиратах. Анализы NAAT, такие как полимеразная цепная реакция (ПЦР), обнаруживают генетический материал, специфичный для вируса, а не вирусные антигены. Их чувствительность и специфичность приближаются к 100%. [43] Однако они, как правило, более дороги и требуют более сложного оборудования, чем другие методы тестирования, что делает их менее практичными в районах с ограниченными ресурсами. Молекулярное тестирование на RSV обычно не рекомендуется всем людям с респираторными симптомами. Однако его можно рекомендовать тем, у кого высокий риск осложнений RSV, таким как младенцы, пожилые люди и люди с хроническими заболеваниями. [ медицинская цитата необходима ] ОТ-ПЦР имеет чувствительность 90-95% и специфичность 98-99%, в то время как LAMP имеет чувствительность 95-100% и специфичность 99-100%. [ необходима цитирование ]
В традиционной вирусной культуре образец вируса вводится в различные клеточные линии и размножается, чтобы его можно было изучить. Преимущества этого метода включают возможность проводить генетическую характеристику, типирование штаммов и тестирование восприимчивости к противовирусным препаратам. Однако он ограничен длительным временем выполнения, составляющим 3–7 дней, что делает его менее распространенным в уходе за пациентами и более распространенным в исследовательских учреждениях. [3]
Серология (измерение вирусспецифических антител в сыворотке ) нечасто используется в диагностике RSV. Время, необходимое организму для формирования значительного серологического ответа (и демонстрации значительного повышения антител, которые можно обнаружить в сыворотке), обычно не полезно для руководства лечением пациентов. [2] До 30% пациентов с задокументированной инфекцией RSV будут иметь отрицательные результаты серологии. [43] Таким образом, этот метод обычно зарезервирован для исследовательских и наблюдательных исследований. [2]
Результаты рентгенографии грудной клетки у детей с бронхиолитом, вызванным RSV, обычно неспецифичны и включают перихилярные отметины, пятнистую гиперинфляцию и ателектаз . [18] Однако Американская академия педиатрии (AAP) не рекомендует рутинную визуализацию для детей с предполагаемым бронхиолитом, вызванным RSV, поскольку она не изменяет клинические результаты и связана с более частым использованием антибиотиков. [18] [5] Рентгенография грудной клетки иногда рассматривается, когда диагноз бронхиолита неясен или когда наблюдается неожиданное ухудшение. [5] У взрослых с инфекцией RSV рентгенограммы грудной клетки часто нормальные или демонстрируют неспецифические изменения, соответствующие вирусной пневмонии, такие как пятнистые двусторонние инфильтраты. [44]
Дифференциальная диагностика для лиц с признаками и симптомами инфекции верхних и нижних дыхательных путей включает другие вирусные инфекции (такие как риновирус , метапневмовирус и грипп) и первичную бактериальную пневмонию. У детей обычно рассматриваются вдыхаемые инородные тела и врожденные состояния, такие как муковисцидоз или астма. [3]
Основной мерой профилактики является избежание тесного контакта с инфицированными людьми. [5] Меры предосторожности при воздушно-капельном переносе, такие как респираторы , вентиляция и фильтры HEPA / с высоким MERV , вероятно, защищают от аэрозолей, содержащих RSV. [9]
Существует интерес и исследования в области открытия вакцины против RSV, учитывая бремя болезни вируса и отсутствие специфических методов лечения. [ необходима цитата ] Разработка вакцины столкнулась с препятствиями, которые заблокировали ее прогресс. Среди них есть факторы, характерные для младенцев, такие как незрелая иммунная система младенца и наличие материнских антител , которые затрудняют иммунизацию младенцев . [3]
Инфекция RSV широко распространена в раннем детстве, внося значительный вклад в глобальное бремя болезней. Связь между тяжелыми детскими инфекциями и последующими респираторными проблемами не полностью изучена, особенно предполагаемая связь между бронхиолитом, рецидивирующим хрипом у младенцев и детской астмой. В отличие от других респираторных патогенов, которые можно предотвратить с помощью вакцин, RSV оказался сложным для разработки вакцин. Текущие усилия сосредоточены на создании вакцин, которые обеспечивают длительную защиту, и полевые испытания с нетерпением ожидаются. В настоящее время поддерживающая терапия является основой лечения заболевания RSV, поскольку ожидаются эффективные вакцины и противовирусные препараты. Внедрение противовирусных препаратов и вакцин в сочетании с передовыми методами диагностики обещает снизить глобальное воздействие RSV в ближайшие годы. Эти вмешательства могут изменить динамику инфекции и ослабить влияние RSV на сообщества по всему миру. [3]
Потенциальные исследуемые вакцины делятся на пять широких категорий: живые ослабленные , белковые субъединицы , векторные , вирусные субъединицы и РНК-мессенджеры . Каждая из них нацелена на разные иммунные реакции и, таким образом, может лучше подходить для профилактики заболеваний в разных группах риска. Живые ослабленные вакцины показали определенный успех у младенцев, не инфицированных RSV. Другие кандидаты на вакцины надеются нацелиться на уязвимые группы населения на протяжении всей жизни, включая беременных женщин и пожилых людей. [45] [3]
Основные фармацевтические разработчики, GSK и Pfizer, получили одобрение Управления по контролю за продуктами и лекарствами (FDA) на вакцины против RSV, предназначенные для взрослых в возрасте 60 лет и старше. Arexvy от GSK может похвастаться эффективностью 94% против тяжелого и 83% против симптоматического RSV в этой возрастной группе, в то время как Abrysvo от Pfizer эффективен 86% против тяжелого и 67% против симптоматического заболевания у взрослых в возрасте 60 лет и старше. [48]
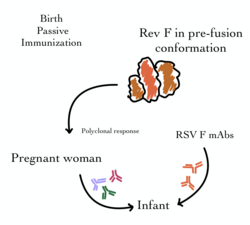
Обращаясь к более сложному аспекту, необходимости вакцины для новорожденных, исследователи использовали подход, вводимый во время беременности, чтобы защитить младенцев в течение первых шести месяцев, критический период для восприимчивости к RSV. [48] Консультативный комитет FDA одобрил родительскую вакцину Pfizer против RSV, признав ее 82% эффективность против тяжелой RSV у новорожденных до трех месяцев и 69% эффективность в течение шести месяцев. Хотя комитет был единодушен в пользу эффективности, 10 против 4 проголосовали за безопасность, с опасениями по поводу немного более высокого уровня преждевременных родов в вакцинированной группе. GSK остановила собственное исследование из-за 38% более высокой вероятности преждевременных родов в вакцинированной группе. [48]
В мае 2023 года Управление по контролю за продуктами и лекарствами США (FDA) одобрило первые вакцины против RSV : Arexvy (разработанную GSK plc ) и Abrysvo ( Pfizer ). [10] [11] Mresvia — это вакцина на основе мРНК , которая была одобрена для медицинского применения в США в мае 2024 года. [49] [50] [51]
Исторически для обеспечения пассивного иммунитета использовался внутривенный иммуноглобулин , специфичный к РСВ (IVIG). Это включало ежемесячное введение нейтрализующих РСВ антител (или иммуноглобулинов) от доноров-людей, выздоравливающих от болезни. Хотя этот перенос антител был достаточно эффективным для обеспечения краткосрочной иммунизации младенцев из группы риска, он был ограничен как внутривенным введением, так и стоимостью. [52]
RSV-IVIG с тех пор был заменен использованием моноклонального антитела (МАб), которое может быть введено посредством мышечной инъекции . Паливизумаб (Синагис) — это моноклональное антитело, направленное против поверхностного белка слияния (F) вируса RSV. Он был лицензирован в 1998 году и эффективен для обеспечения временной профилактики как против RSV A, так и против B. Он вводится путем ежемесячных инъекций, которые начинаются непосредственно перед сезоном RSV и обычно продолжаются в течение пяти месяцев. Было показано, что паливизумаб снижает как показатели госпитализации, так и смертность от всех причин в определенных группах детей с высоким риском (например, с хроническими заболеваниями легких, врожденными пороками сердца и недоношенными). [38] [53] Однако его стоимость ограничивает его использование во многих частях мира. С тех пор были разработаны более мощные производные этого антитела (включая мотавизумаб ), но они были связаны со значительными побочными эффектами. [54]
Американская академия педиатрии (AAP 2014) рекомендует профилактику респираторно-синцитиальной вирусной инфекции с помощью паливизумаба во время сезона респираторно-синцитиальной вирусной инфекции для: [5]
Согласно рекомендациям AAP, профилактическое применение паливизумаба может также рассматриваться у младенцев с: [5]
Нирсевимаб (Бейфортус) — еще одно противовирусное моноклональное антитело, одобренное для профилактики респираторно-синцитиального вирусного заболевания нижних дыхательных путей у новорожденных и младенцев во время их первого сезона респираторно-синцитиального вируса. [55] Для нирсевимаба требуется только одна доза, которая действует в течение всего сезона респираторно-синцитиального вируса, в отличие от паливизумаба, который необходимо вводить примерно один раз в месяц до четырех раз, чтобы он оставался эффективным. [56] Нирсевимаб был одобрен для медицинского применения в Европейском союзе [57] [58] и Соединенном Королевстве [59] в ноябре 2022 года, а в Канаде — в апреле 2023 года. [56]
Лечение инфекции RSV в первую очередь сосредоточено на поддерживающей терапии. Это может включать мониторинг дыхания пациента или использование отсасывания для удаления выделений из верхних дыхательных путей. Дополнительный кислород также может подаваться через носовую канюлю или маску для лица, чтобы улучшить поток воздуха. В тяжелых случаях дыхательной недостаточности может потребоваться интубация и искусственная вентиляция легких для поддержки дыхания. Если присутствуют признаки обезвоживания, жидкости также могут вводиться перорально или через внутривенный катетер. [52]
Бронходилататоры , лекарства, обычно используемые для лечения астмы, иногда используются для лечения хрипов, связанных с инфекцией RSV. Эти лекарства (например, альбутерол или сальбутамол ) являются бета-агонистами , которые расслабляют мышцы дыхательных путей, обеспечивая улучшение потока воздуха. Однако не было обнаружено, что бронходилататоры улучшают клиническую тяжесть инфекции или частоту госпитализаций среди лиц с инфекцией RSV. Учитывая их ограниченную пользу, а также их профиль побочных эффектов , они не рекомендуются для использования при бронхиолите RSV. [52] [63]
Антибиотикотерапия не подходит для лечения бронхиолита, связанного с RSV, или вирусной пневмонии. [65] Антибиотики нацелены на бактериальные патогены, а не на вирусные патогены, такие как RSV. Однако антибиотики могут быть рассмотрены, если есть явные доказательства того, что развилась вторичная бактериальная инфекция. Ушные инфекции также могут развиться у небольшого числа младенцев с бронхиолитом, вызванным RSV, в этом случае иногда можно использовать пероральные антибиотики. [52]
Помимо вакцин, AstraZeneca и Sanofi представили нирсевимаб , профилактическое моноклональное антитело с 75% эффективностью против случаев RSV у младенцев в возрасте до одного года. Европа одобрила нирсевимаб в ноябре 2022 года, а FDA последовало ее примеру в июле 2023 года. Клесровимаб компании Merck, аналогичное моноклональное антитело, находится на поздней стадии испытаний. [48]
Во всем мире RSV является основной причиной бронхиолита и пневмонии у младенцев и детей в возрасте до 5 лет. Риск серьезной инфекции наиболее высок в течение первых 6 месяцев жизни. Из тех, кто инфицирован RSV, у 2–3% разовьется бронхиолит , требующий госпитализации. [66] Ежегодно RSV вызывает около 30 миллионов острых респираторных заболеваний и более 60 000 детских смертей во всем мире. По оценкам, 87% младенцев переносят инфекцию RSV к возрасту 18 месяцев, и почти все дети будут инфицированы к 3 годам. В Соединенных Штатах RSV является причиной до 20% госпитализаций с острыми респираторными инфекциями у детей в возрасте до 5 лет. Однако подавляющее большинство смертей, связанных с RSV, происходит в странах с низким уровнем дохода, где отсутствует доступ к базовой поддерживающей терапии. [3]
Профилактическое использование паливизумаба или нирсевимаба (оба препарата являются моноклональными антителами ) может предотвратить инфекцию RSV у младенцев с высоким риском. Пассивная иммунизация доступна для предотвращения инфекции RSV и госпитализации младенцев с высоким риском.
Дополнительные поддерживающие методы лечения были исследованы у младенцев, госпитализированных с бронхиолитом, вызванным РСВ. Они включают:
Ингаляционная рекомбинантная человеческая дезоксирибонуклеаза (рчДНКаза), фермент, расщепляющий ДНК, способствующую образованию слизи и обструкции дыхательных путей, не показала улучшения клинических результатов в этой группе.
В статье JAMA Open за 2024 год было высказано предположение, что рост числа случаев внезапной неожиданной детской смертности (SUID) может быть связан с необычным всплеском RSV в 2021 году. [67] Исследователи проанализировали более 14 000 случаев SUID, используя записи CDC , и обнаружили, что показатель на 100 000 живорождений увеличился на 10% в период с 2019 по 2021 год. [68] Исследование показало, что риск SUID был самым высоким с июня по декабрь 2021 года, что совпало с внесезонным всплеском госпитализаций из-за RSV после того, как вирус отклонился от своего типичного зимнего характера в 2020 году. [69]
У здоровых молодых людей редко развивается тяжелое заболевание, требующее госпитализации из-за RSV. Однако в настоящее время он признан значимой причиной заболеваемости и смертности среди определенных групп взрослого населения, включая пожилых людей и людей с сопутствующими заболеваниями сердца или легких. Его клиническое воздействие среди пожилых людей оценивается как аналогичное воздействию гриппа . [23] Ежегодно примерно 5–10% жителей домов престарелых заболевают RSV-инфекцией со значительными показателями пневмонии и смерти. RSV также является причиной 2–5% пневмоний, приобретенных у взрослых в обществе . [23]
Как у взрослых, так и у детей иммуносупрессия повышает восприимчивость к инфекции RSV. Дети, живущие с ВИЧ , с большей вероятностью заболеют острым заболеванием и в 3,5 раза чаще нуждаются в госпитализации, чем дети без ВИЧ. [3] Пациенты с трансплантацией костного мозга до приживления костного мозга подвергаются особенно высокому риску, при этом RSV составляет почти половину вирусных инфекций в этой группе населения. Эта группа также продемонстрировала показатели смертности до 80% среди людей с пневмонией RSV. [23] Хотя заражение может произойти в обществе, считается, что внутрибольничное заражение составляет 30–50% случаев среди лиц с ослабленным иммунитетом. [23]
Сезонность RSV различается по всему миру. В умеренном климате уровень инфицирования, как правило, самый высокий в холодные зимние месяцы. Это часто объясняется увеличением скученности людей в помещениях и повышением вирусной стабильности при более низких температурах. Однако в тропическом и арктическом климате годовые колебания менее выражены и, по-видимому, более распространены в сезон дождей. [2] [3] Ежегодные эпидемии, как правило, вызваны присутствием нескольких различных вирусных штаммов. Вирусы подтипов A и B часто циркулируют одновременно в определенном географическом регионе, хотя вирусы группы A более распространены. [23]
Исследование изучало реакции Т-клеток, специфичных к RSV, у «55 младенцев, госпитализированных с бронхиолитом, вызванным RSV, и обнаружило, что эти реакции были схожи как во время острой болезни, так и во время выздоровления и не усиливались после последующих инфекций RSV. [41] Это говорит о том, что реакции Т-клеток, специфичных к RSV, могут не предотвращать повторное инфицирование и могут не распространяться эффективно в организме после повторного инфицирования. Однако возможно, что эти клетки могут быть расположены в определенных областях легких и сильнее реагировать на вторичную инфекцию, как это было показано в исследованиях на животных. Например, исследование с использованием мышей показало, что «степень воспалительной реакции БАЛ на реакцию на повторное инфицирование во взрослом возрасте определяется возрастом при первом инфицировании». [41] Исследование также обнаружило, что паттерны различаются для «неонатальной инфекции, которая подготавливает хозяина к развитию Th2-смещенного ответа». [41] Точные механизмы, лежащие в основе этого явления, остаются неясными. Одна из возможностей заключается в том, что отсутствие продукции IFN-γ у новорожденных во время их первого столкновения с RSV, возможно, из-за незрелой иммунной системы, позволяет для возникновения Th2-смещенного ответа, который сохраняется и может быть вызван снова во время последующих инфекций RSV. [41] Однако маловероятно, что изменения только в уровнях IFN-γ объясняют это окно восприимчивости. IL-13, по-видимому, играет важную роль в качестве регулятора в этом процессе. IL-13 — это белок, расположенный в легких. Он является «медиатором аллергической астмы» и отвечает за «регуляцию эозинофильного воспаления, секреции слизи и гиперреактивности дыхательных путей». [70]
Инфекции SARS-CoV-2 , вируса, вызывающего COVID-19 , могут привести к более высокому риску заражения RSV. [71] В ноябре 2022 года уровень госпитализации новорожденных с RSV был в семь раз выше, чем в 2018 году. [ необходима цитата ] Это, в сочетании с ростом циркуляции гриппа, привело к тому, что американский штат Орегон объявил чрезвычайное положение. [ необходима цитата ] Ассоциация детских больниц и Американская академия педиатрии обратились к президенту США Джо Байдену с просьбой объявить чрезвычайное положение. [72]
Результаты поперечного исследования 2024 года с участием 6248 госпитализированных взрослых с инфекцией RSV свидетельствуют о том, что острые сердечные события распространены среди госпитализированных пожилых людей с инфекцией RSV и связаны с тяжелыми клиническими исходами. Почти четверть госпитализированных людей старше 50 лет с RSV перенесли острое сердечное событие (чаще всего острую сердечную недостаточность), включая 1 из 12 взрослых (8,5%) без документированного основного сердечно-сосудистого заболевания. У пациентов, у которых были острые сердечные события, риск тяжелого исхода был почти в два раза выше, чем у пациентов, у которых их не было. [73] [74]
{{cite journal}}: CS1 maint: переопределенная настройка ( ссылка )