
Редактирование генома , или генная инженерия , или редактирование генов , является типом генной инженерии , при котором ДНК вставляется, удаляется, модифицируется или заменяется в геноме живого организма. В отличие от ранних методов генной инженерии , которые случайным образом вставляют генетический материал в геном хозяина, редактирование генома нацеливает вставки на сайт-специфичные места. Основной механизм, задействованный в генетических манипуляциях с помощью программируемых нуклеаз, — это распознавание целевых геномных локусов и связывание эффекторного ДНК-связывающего домена (DBD), двухцепочечных разрывов (DSB) в целевой ДНК эндонуклеазами рестрикции ( FokI и Cas ), а также восстановление DSB посредством гомологически направленной рекомбинации (HDR) или негомологичного соединения концов (NHEJ). [1] [2]
Редактирование генома было впервые применено в 1990-х годах [3] до появления распространенных современных платформ редактирования генов на основе нуклеаз, но его использование было ограничено низкой эффективностью редактирования. Редактирование генома с помощью сконструированных нуклеаз, т. е. всех трех основных классов этих ферментов — цинковых пальцеобразных нуклеаз (ZFN), эффекторных нуклеаз, подобных активаторам транскрипции (TALEN) и сконструированных мегануклеаз — было выбрано Nature Methods в качестве метода года 2011 года. [4] Система CRISPR-Cas была выбрана Science в качестве прорыва года 2015 года. [5]
По состоянию на 2015 год [обновлять]использовались четыре семейства сконструированных нуклеаз: мегануклеазы , нуклеазы с цинковыми пальцами (ZFN), нуклеазы на основе эффекторов, подобных активаторам транскрипции (TALEN), и система коротких палиндромных повторов, регулярно расположенных кластерами ( CRISPR / Cas9 ). [6] [7] [8] [9] По состоянию на 2017 год было доступно девять редакторов генома [обновлять]. [10]
В 2018 году общепринятыми методами такого редактирования были инженерные нуклеазы , или «молекулярные ножницы». Эти нуклеазы создают сайт-специфичные двухцепочечные разрывы (DSB) в желаемых местах генома. Индуцированные двухцепочечные разрывы восстанавливаются посредством негомологичного соединения концов (NHEJ) или гомологичной рекомбинации (HR), что приводит к целевым мутациям («редактированиям»).
В мае 2019 года китайские юристы сообщили, что в свете предполагаемого создания китайским ученым Хэ Цзянькуем первых людей с отредактированным геномом (см. споры о Лулу и Нане ) разрабатываются правила, согласно которым любой, кто манипулирует человеческим геномом с помощью методов редактирования генов, таких как CRISPR , будет нести ответственность за любые связанные с этим неблагоприятные последствия. [11] Недавно обсуждалась предостерегающая точка зрения на возможные слепые пятна и риски CRISPR и связанных с ним биотехнологий, [12] с упором на стохастическую природу процессов клеточного контроля.
Институт Рослина при Эдинбургском университете вывел свиней, устойчивых к вирусу, вызывающему репродуктивно-респираторный синдром свиней , который обходится американским и европейским свиноводам в 2,6 млрд долларов ежегодно. [13]
В феврале 2020 года исследование в США безопасно продемонстрировало редактирование гена CRISPR у 3 больных раком. [14] В 2020 году Sicilian Rouge High GABA, томат, который вырабатывает больше аминокислоты, способствующей расслаблению, был одобрен для продажи в Японии. [13]
В 2021 году Англия (не остальная часть Великобритании) планировала снять ограничения на генно-редактированные растения и животных, перейдя от регулирования, соответствующего требованиям Европейского союза, к правилам, более близким к правилам США и некоторых других стран. В отчете Европейской комиссии за апрель 2021 года были обнаружены «веские признаки» того, что текущий режим регулирования не подходит для редактирования генов. [13] Позднее в 2021 году исследователи объявили об альтернативе CRISPR, обозначенной как белки обязательной активности мобильных элементов (OMEGA), включая IscB, IsrB и TnpB как эндонуклеазы, обнаруженные в транспозонах , и управляемые малыми ωРНК. [15] [16]
Генная инженерия как метод введения новых генетических элементов в организмы существует с 1970-х годов. Одним из недостатков этой технологии является случайный характер вставки ДНК в геном хозяина , что может повредить или изменить другие гены в организме. Хотя было обнаружено несколько методов, которые направляют вставленные гены на определенные участки в геноме организма. [3] Это также позволило редактировать определенные последовательности в геноме, а также уменьшить нецелевые эффекты. Это можно использовать в исследовательских целях, направляя мутации на определенные гены, и в генной терапии . Вставляя функциональный ген в организм и направляя его на замену дефектного, можно было бы вылечить определенные генетические заболевания .
Ранние методы нацеливания генов на определенные участки в геноме организма (называемые нацеливанием генов ) основывались на гомологичной рекомбинации (HR). [17] Создавая конструкции ДНК, которые содержат шаблон, соответствующий целевой последовательности генома, возможно, что процессы HR внутри клетки вставят конструкцию в желаемое место. Использование этого метода на эмбриональных стволовых клетках привело к созданию трансгенных мышей с нокаутированными целевыми генами . Также стало возможным нокаутировать гены или изменять паттерны экспрессии генов . [18] В знак признания их открытия того, как гомологичная рекомбинация может быть использована для введения генетических модификаций у мышей через эмбриональные стволовые клетки, Марио Капеччи , Мартин Эванс и Оливер Смитис были награждены Нобелевской премией по физиологии и медицине 2007 года . [19]
Если выключить жизненно важный ген, это может оказаться смертельным для организма. Для изучения функции этих генов использовались сайт-специфические рекомбиназы (SSR). Двумя наиболее распространенными типами являются системы Cre-LoxP и Flp-FRT . Рекомбиназа Cre — это фермент, который удаляет ДНК путем гомологичной рекомбинации между связывающими последовательностями, известными как сайты Lox-P. Система Flip-FRT работает аналогичным образом, при этом рекомбиназа Flip распознает последовательности FRT. Скрещивая организм, содержащий сайты рекомбиназы, фланкирующие интересующий ген, с организмом, который экспрессирует SSR под контролем тканеспецифических промоторов , можно выключать или включать гены только в определенных клетках. Эти методы также использовались для удаления маркерных генов из трансгенных животных. Дальнейшие модификации этих систем позволили исследователям индуцировать рекомбинацию только при определенных условиях, позволяя выключать или экспрессировать гены в желаемые моменты времени или на желаемых стадиях развития . [18]

Распространенная форма редактирования генома основана на концепции механики репарации двухцепочечных разрывов ДНК (DSB). Существует два основных пути, которые восстанавливают DSB: негомологичное соединение концов (NHEJ) и гомологичное направленное восстановление (HDR). NHEJ использует различные ферменты для непосредственного соединения концов ДНК, в то время как более точный HDR использует гомологичную последовательность в качестве шаблона для восстановления отсутствующих последовательностей ДНК в точке разрыва. Это можно использовать, создав вектор с желаемыми генетическими элементами в последовательности, которая гомологична фланкирующим последовательностям DSB. Это приведет к тому, что желаемое изменение будет вставлено в место DSB. Хотя редактирование генов на основе HDR похоже на нацеливание генов на основе гомологичной рекомбинации, скорость рекомбинации увеличивается как минимум на три порядка. [20]

Ключ к редактированию генома — создание DSB в определенной точке генома. Обычно используемые рестриктазы эффективны при разрезании ДНК, но обычно распознают и разрезают на нескольких участках. Чтобы преодолеть эту проблему и создать сайт-специфические DSB, на сегодняшний день были обнаружены и биоинженерно разработаны три различных класса нуклеаз. Это нуклеазы с цинковыми пальцами ( ZFN ), эффекторные нуклеазы, подобные активаторам транскрипции ( TALEN ), мегануклеазы и система кластеризованных регулярно расположенных коротких палиндромных повторов ( CRISPR /Cas9).
Мегануклеазы , открытые в конце 1980-х годов, представляют собой ферменты семейства эндонуклеаз , характеризующиеся способностью распознавать и разрезать большие последовательности ДНК (от 14 до 40 пар оснований). [21] Наиболее распространенными и известными мегануклеазами являются белки семейства LAGLIDADG, которые получили свое название благодаря консервативной последовательности аминокислот .
Мегануклеазы, обычно встречающиеся в микробных видах, обладают уникальным свойством иметь очень длинные последовательности распознавания (>14 п.н.), что делает их естественно очень специфичными. [22] [23] Однако практически нет шансов найти точную мегануклеазу, необходимую для действия на выбранную конкретную последовательность ДНК. Чтобы преодолеть эту проблему, были использованы методы мутагенеза и высокопроизводительного скрининга для создания вариантов мегануклеазы, которые распознают уникальные последовательности. [23] [24] Другие смогли объединить различные мегануклеазы и создать гибридные ферменты, которые распознают новую последовательность. [25] [26] Другие же попытались изменить взаимодействующие с ДНК аминокислоты мегануклеазы для разработки специфичных для последовательности мегануклеаз в методе, называемом рационально спроектированной мегануклеазой. [27] Другой подход заключается в использовании компьютерных моделей для попытки максимально точно предсказать активность модифицированных мегануклеаз и специфичность распознанной нуклеиновой последовательности. [28]
Был создан большой банк, содержащий несколько десятков тысяч белковых единиц. Эти единицы можно объединять для получения химерных мегануклеаз, которые распознают целевой сайт, тем самым предоставляя инструменты для исследований и разработок, которые отвечают широкому спектру потребностей (фундаментальные исследования, здравоохранение, сельское хозяйство, промышленность, энергетика и т. д.). К ним относится промышленное производство двух мегануклеаз, способных расщеплять ген XPC человека; мутации в этом гене приводят к пигментной ксеродерме , тяжелому моногенному заболеванию, которое предрасполагает пациентов к раку кожи и ожогам всякий раз, когда их кожа подвергается воздействию ультрафиолетовых лучей. [29]
Мегануклеазы обладают тем преимуществом, что вызывают меньшую токсичность в клетках, чем такие методы, как нуклеаза с цинковыми пальцами (ZFN), вероятно, из-за более строгого распознавания последовательности ДНК; [23] однако, создание ферментов, специфичных для последовательности, для всех возможных последовательностей является дорогостоящим и трудоемким, поскольку не используются преимущества комбинаторных возможностей, которые используют такие методы, как слияния на основе ZFN и TALEN.
В отличие от мегануклеаз, концепция, лежащая в основе технологий ZFN и TALEN, основана на неспецифическом каталитическом домене разрезания ДНК, который затем может быть связан со специфическими пептидами, распознающими последовательность ДНК, такими как цинковые пальцы и эффекторы, подобные активаторам транскрипции (TALE). [30] Первым шагом к этому было найти эндонуклеазу, сайт распознавания ДНК которой и сайт расщепления были бы отделены друг от друга, ситуация, которая не является самой распространенной среди рестриктаз. [30] Как только этот фермент был найден, его расщепляющая часть могла быть отделена, что было бы очень неспецифично, поскольку она не имела бы способности к распознаванию. Затем эту часть можно было бы связать с пептидами, распознающими последовательность, что могло бы привести к очень высокой специфичности.
Мотивы цинкового пальца встречаются в нескольких факторах транскрипции . Ион цинка, обнаруженный в 8% всех белков человека, играет важную роль в организации их трехмерной структуры. В факторах транскрипции он чаще всего располагается в местах взаимодействия белок-ДНК, где стабилизирует мотив. С-концевая часть каждого пальца отвечает за специфическое распознавание последовательности ДНК.
Распознаваемые последовательности короткие, состоят примерно из 3 пар оснований, но путем объединения 6-8 цинковых пальцев, сайты распознавания которых были охарактеризованы, можно получить специфические белки для последовательностей примерно из 20 пар оснований. Таким образом, можно контролировать экспрессию определенного гена. Было показано, что эта стратегия может быть использована для содействия процессу ангиогенеза у животных. [31] Также возможно слить белок, сконструированный таким образом, с каталитическим доменом эндонуклеазы, чтобы вызвать целевой разрыв ДНК, и, следовательно, использовать эти белки в качестве инструментов генной инженерии. [32]
Метод, обычно применяемый для этого, включает в себя ассоциацию двух ДНК-связывающих белков, каждый из которых содержит от 3 до 6 специально выбранных цинковых пальцев, с каталитическим доменом эндонуклеазы FokI , которым необходимо димеризоваться для расщепления двухцепочечной ДНК. Два белка распознают две последовательности ДНК, которые находятся на расстоянии нескольких нуклеотидов друг от друга. Связывание двух белков цинковых пальцев с их соответствующими последовательностями сближает два домена FokI. FokI требует димеризации для проявления нуклеазной активности, и это означает, что специфичность резко возрастает, поскольку каждый партнер нуклеазы будет распознавать уникальную последовательность ДНК. Для усиления этого эффекта были разработаны нуклеазы FokI , которые могут функционировать только как гетеродимеры. [33]
Для разработки специфических нуклеаз цинковых пальцев для выбранных последовательностей используется несколько подходов. Наиболее распространенный из них заключается в объединении единиц цинковых пальцев с известной специфичностью (модульная сборка). Были разработаны различные методы отбора с использованием бактерий, дрожжей или клеток млекопитающих для идентификации комбинаций, которые обеспечивают наилучшую специфичность и наилучшую переносимость клетками. Хотя прямая характеристика активности нуклеазы цинковых пальцев по всему геному не была опубликована, анализ, измеряющий общее количество разрывов двухцепочечной ДНК в клетках, показал, что только один-два таких разрыва происходят выше фона в клетках, обработанных нуклеазами цинковых пальцев с составным участком распознавания 24 п.н. и облигатными гетеродимерными доменами нуклеазы FokI . [33]
Гетеродимерные функционирующие нуклеазы избегают возможности нежелательной гомодимерной активности и, таким образом, повышают специфичность DSB. Хотя нуклеазные части конструкций ZFN и TALEN обладают схожими свойствами, разница между этими сконструированными нуклеазами заключается в их пептиде распознавания ДНК. ZFN полагаются на цинковые пальцы Cys2-His2, а конструкции TALEN — на TALE. Оба этих домена пептидов, распознающих ДНК, имеют ту характеристику, что они естественным образом встречаются в комбинациях в их белках. Цинковые пальцы Cys2-His2 обычно встречаются в повторах, которые находятся на расстоянии 3 п.н. друг от друга, и встречаются в различных комбинациях в различных белках, взаимодействующих с нуклеиновыми кислотами, таких как факторы транскрипции . Каждый палец домена цинкового пальца полностью независим, и на связывающую способность одного пальца влияет его сосед. TALE, с другой стороны, встречаются в повторах с соотношением распознавания один к одному между аминокислотами и распознанными парами нуклеотидов. Поскольку и цинковые пальцы, и TALE встречаются в повторяющихся шаблонах, можно пробовать различные комбинации для создания широкого спектра специфичностей последовательностей. [22] Цинковые пальцы более известны в этих терминах, и такие подходы, как модульная сборка (где цинковые пальцы, коррелирующие с триплетной последовательностью, присоединяются в ряд, чтобы покрыть требуемую последовательность), OPEN (низкострогий отбор пептидных доменов против триплетных нуклеотидов с последующим высокострогим отбором пептидной комбинации против конечной цели в бактериальных системах) и бактериальный одногибридный скрининг библиотек цинковых пальцев среди других методов, использовались для создания сайт-специфичных нуклеаз.
Нуклеазы цинковых пальцев — это инструменты для исследований и разработок, которые уже использовались для модификации ряда геномов, в частности, лабораториями Консорциума цинковых пальцев. Американская компания Sangamo BioSciences использует нуклеазы цинковых пальцев для проведения исследований в области генной инженерии стволовых клеток и модификации иммунных клеток в терапевтических целях. [34] [35] Модифицированные Т-лимфоциты в настоящее время проходят фазу I клинических испытаний для лечения типа опухоли мозга ( глиобластомы ) и в борьбе со СПИДом. [33]

Эффекторные нуклеазы, подобные активаторам транскрипции (TALEN), представляют собой специфические ДНК-связывающие белки, которые содержат массив из 33 или 34 повторов аминокислот. TALEN — это искусственные рестриктазы, созданные путем слияния домена резки ДНК нуклеазы с доменами TALE, которые можно адаптировать для специфического распознавания уникальной последовательности ДНК. Эти слитые белки служат легко нацеливаемыми «ножницами ДНК» для приложений редактирования генов, которые позволяют выполнять целевые модификации генома, такие как вставка, удаление, восстановление и замена последовательности в живых клетках. [36] Домены связывания ДНК, которые можно спроектировать для связывания любой желаемой последовательности ДНК, происходят из эффекторов TAL , ДНК-связывающих белков, выделяемых фитопатогенным приложением Xanthomanos. Эффекторы TAL состоят из повторяющихся доменов, каждый из которых содержит высококонсервативную последовательность из 34 аминокислот и распознает один нуклеотид ДНК в целевом сайте. Нуклеаза может создавать двухцепочечные разрывы в целевом сайте, которые могут быть исправлены с помощью негомологичного соединения концов (NHEJ), подверженного ошибкам, что приводит к нарушениям генов за счет введения небольших вставок или делеций. Каждый повтор сохраняется, за исключением так называемых повторяющихся вариабельных остатков (RVD) в положениях аминокислот 12 и 13. RVD определяют последовательность ДНК, с которой будет связываться TALE. Это простое соответствие один к одному между повторами TALE и соответствующей последовательностью ДНК делает процесс сборки массивов повторов для распознавания новых последовательностей ДНК простым. Эти TALE могут быть слиты с каталитическим доменом из ДНК-нуклеазы, FokI, для создания эффекторной нуклеазы, подобной активатору транскрипции (TALEN). Полученные конструкции TALEN сочетают специфичность и активность, эффективно генерируя сконструированные специфичные для последовательности нуклеазы, которые связывают и расщепляют последовательности ДНК только в предварительно выбранных сайтах. Система распознавания цели TALEN основана на легко предсказуемом коде. Нуклеазы TAL специфичны к своей цели отчасти из-за длины их участка связывания из 30+ пар оснований. TALEN может быть выполнена в диапазоне 6 пар оснований любого отдельного нуклеотида во всем геноме. [37]
Конструкции TALEN используются аналогично разработанным нуклеазам с цинковыми пальцами и имеют три преимущества в целевом мутагенезе: (1) специфичность связывания ДНК выше, (2) побочные эффекты ниже и (3) проще конструирование доменов связывания ДНК.
CRISPR (Clustered Regularly Interspaced Short Palindromic Repeats) — это генетические элементы, которые бактерии используют в качестве своего рода приобретенного иммунитета для защиты от вирусов. Они состоят из коротких последовательностей, которые происходят из вирусных геномов и были включены в бактериальный геном. Cas (ассоциированные с CRISPR белки) обрабатывают эти последовательности и разрезают соответствующие вирусные последовательности ДНК. Вводя плазмиды, содержащие гены Cas и специально сконструированные CRISPR, в эукариотические клетки, эукариотический геном можно разрезать в любом желаемом месте. [38]
Один из самых ранних методов эффективного редактирования нуклеиновых кислот использует ферменты модификации азотистых оснований, направляемые направляющими последовательностями нуклеиновых кислот, и был впервые описан в 1990-х годах и недавно снова стал популярным. [3] [39] [40] [41] Этот метод имеет то преимущество, что он не требует разрыва геномных цепей ДНК и, таким образом, позволяет избежать случайных вставок и делеций, связанных с разрывом цепей ДНК. Он подходит только для точного редактирования, требующего замены отдельных нуклеотидов, и оказался весьма эффективным для этого типа редактирования. [41] [42]
ARCUT означает искусственный рестрикционный ДНК-резак, это метод, разработанный Комиямой. Этот метод использует псевдокомплементарную пептидную нуклеиновую кислоту (pcPNA) для идентификации сайта расщепления в хромосоме. После того, как pcPNA определяет сайт, выполняется вырезание церием (CE) и ЭДТА (химическая смесь), которая выполняет функцию сплайсинга. [43]
Мегануклеазный метод редактирования генов является наименее эффективным из методов, упомянутых выше. Из-за природы его ДНК-связывающего элемента и расщепляющего элемента он ограничен распознаванием одной потенциальной цели на каждые 1000 нуклеотидов. [9] ZFN был разработан для преодоления ограничений мегануклеазы. Количество возможных целей, которые может распознать ZFN, было увеличено до одной на каждые 140 нуклеотидов. [9] Однако оба метода непредсказуемы из-за их ДНК-связывающих элементов, влияющих друг на друга. В результате требуются высокая степень экспертизы и длительные и дорогостоящие процессы валидации.
Нуклеазы TALE, являясь наиболее точным и специфичным методом, дают более высокую эффективность, чем предыдущие два метода. Такая эффективность достигается за счет того, что элемент связывания ДНК состоит из массива субъединиц TALE, каждая из которых обладает способностью распознавать определенную нуклеотидную цепь ДНК независимо от других, что приводит к большему количеству целевых участков с высокой точностью. Создание новых нуклеаз TALE занимает около недели и несколько сотен долларов, с учетом специальных знаний в области молекулярной биологии и белковой инженерии. [9]
Нуклеазы CRISPR имеют немного меньшую точность по сравнению с нуклеазами TALE. Это вызвано необходимостью иметь определенный нуклеотид на одном конце для того, чтобы произвести направляющую РНК, которую CRISPR использует для исправления двухцепочечного разрыва, который она вызывает. Было показано, что это самый быстрый и дешевый метод, стоимостью менее двухсот долларов и нескольких дней времени. [9] CRISPR также требует наименьшего количества знаний в молекулярной биологии, поскольку дизайн заключается в направляющей РНК вместо белков. Одним из основных преимуществ CRISPR по сравнению с методами ZFN и TALEN является то, что его можно нацеливать на различные последовательности ДНК, используя его ~80nt CRISPR sgRNA, в то время как методы ZFN и TALEN требовали конструирования и тестирования белков, созданных для нацеливания на каждую последовательность ДНК. [44]
Поскольку нецелевая активность активной нуклеазы может иметь потенциально опасные последствия на генетическом и организменном уровнях, точность мегануклеаз, ZFN, CRISPR и слияний на основе TALEN стала активной областью исследований. Хотя сообщалось о различных цифрах, ZFN, как правило, имеют большую цитотоксичность, чем методы TALEN или нуклеазы, управляемые РНК, в то время как подходы TALEN и РНК, как правило, имеют наибольшую эффективность и меньше нецелевых эффектов. [45] Основываясь на максимальном теоретическом расстоянии между связыванием ДНК и активностью нуклеазы, подходы TALEN приводят к наибольшей точности. [9]
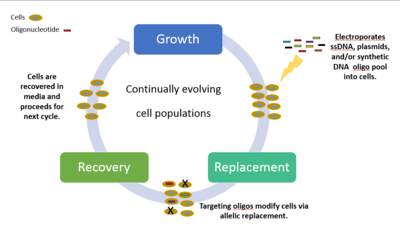
Методы для ученых и исследователей, желающих изучить геномное разнообразие и все возможные связанные с ним фенотипы, были очень медленными, дорогими и неэффективными. До этой новой революции исследователям приходилось проводить манипуляции с одним геном и настраивать геном по одному маленькому участку за раз, наблюдать фенотип и начинать процесс заново с другой манипуляцией с одним геном. [46] Поэтому исследователи из Института Висса при Гарвардском университете разработали MAGE, мощную технологию, которая улучшает процесс редактирования генома in vivo. Она позволяет проводить быстрые и эффективные манипуляции с геномом, и все это происходит в машине, достаточно маленькой, чтобы поставить ее на небольшой кухонный стол. Эти мутации объединяются с вариациями, которые естественным образом возникают во время митоза клеток, создавая миллиарды клеточных мутаций.
Химически объединенные, синтетические одноцепочечные ДНК (ssDNA) и пул олигонуклеотидов вводятся в целевые области клетки, тем самым создавая генетические модификации. Циклический процесс включает трансформацию ssDNA (электропорацией ) с последующим ростом, во время которого гомологичные рекомбинационные белки бактериофага опосредуют отжиг ssDNA с их геномными мишенями. Эксперименты, нацеленные на селективные фенотипические маркеры, проверяются и идентифицируются путем высевания клеток на дифференциальные среды. Каждый цикл в конечном итоге занимает 2,5 часа для обработки, с дополнительным временем, необходимым для выращивания изогенных культур и характеристики мутаций. Путем итеративного введения библиотек мутагенных ssDNA, нацеленных на несколько сайтов, MAGE может генерировать комбинаторное генетическое разнообразие в популяции клеток. Может быть до 50 геномных правок, от отдельных пар нуклеотидных оснований до целых геномных или генных сетей одновременно с результатами в течение нескольких дней. [46]
Эксперименты MAGE можно разделить на три класса, характеризующиеся различной степенью масштаба и сложности: (i) множество целевых участков, отдельные генетические мутации; (ii) единичный целевой участок, множество генетических мутаций; и (iii) множество целевых участков, множество генетических мутаций. [46] Пример класса три был отражен в 2009 году, когда Чёрч и его коллеги смогли запрограммировать Escherichia coli на выработку в пять раз большего количества ликопина, антиоксиданта, обычно встречающегося в семенах томатов и связанного с противораковыми свойствами. Они применили MAGE для оптимизации метаболического пути 1-дезокси- D -ксилулоза 5-фосфата (DXP) в Escherichia coli для перепроизводства изопреноидного ликопина. Им потребовалось около 3 дней и чуть более 1000 долларов на материалы. Простота, скорость и экономическая эффективность, с которыми MAGE может изменять геномы, могут изменить подход отраслей к производству и выпуску важных соединений в биоинженерии, биоэнергетике, биомедицинской инженерии, синтетической биологии, фармацевтической, сельскохозяйственной и химической промышленности.

По состоянию на 2012 год эффективное редактирование генома было разработано для широкого спектра экспериментальных систем, от растений до животных, часто за пределами клинического интереса, и стало стандартной экспериментальной стратегией в исследовательских лабораториях. [47] Недавнее поколение крыс, зебровых рыб , кукурузы и табака, опосредованных ZFN, и усовершенствования в подходах на основе TALEN свидетельствуют о значимости методов, и список быстро расширяется. Редактирование генома с помощью сконструированных нуклеаз, вероятно, внесет вклад во многие области наук о жизни, от изучения функций генов у растений и животных до генной терапии у людей. Например, область синтетической биологии , которая направлена на конструирование клеток и организмов для выполнения новых функций, вероятно, выиграет от способности сконструированной нуклеазы добавлять или удалять геномные элементы и, следовательно, создавать сложные системы. [47] Кроме того, функции генов можно изучать с помощью стволовых клеток с помощью сконструированных нуклеаз.
Ниже перечислены некоторые конкретные задачи, которые может выполнять этот метод:
Сочетание последних открытий в генной инженерии, в частности редактирования генов, и последних усовершенствований в технологиях воспроизводства крупного рогатого скота (например, in vitro эмбриональной культуры) позволяет редактировать геном непосредственно в оплодотворенных ооцитах с использованием синтетических высокоспецифичных эндонуклеаз. РНК-управляемые эндонуклеазы: кластеризованные регулярно расположенные короткие палиндромные повторы, ассоциированные с Cas9 (CRISPR/Cas9), являются новым инструментом, еще больше расширяющим диапазон доступных методов . В частности, CRISPR/Cas9-инженерные эндонуклеазы позволяют использовать несколько направляющих РНК для одновременных нокаутов (KO) за один шаг путем прямой цитоплазматической инъекции (CDI) в зиготы млекопитающих. [48]
Кроме того, редактирование генов может быть применено к определенным типам рыб в аквакультуре, таким как атлантический лосось. Редактирование генов у рыб в настоящее время является экспериментальным, но возможности включают рост, устойчивость к болезням, стерильность, контролируемое воспроизводство и цвет. Отбор по этим признакам может обеспечить более устойчивую среду и лучшее благополучие для рыб. [49]
Лосось AquAdvantage — это генетически модифицированный атлантический лосось, разработанный AquaBounty Technologies. Ген, регулирующий гормон роста в атлантическом лососе, заменен геном, регулирующим гормон роста, из тихоокеанского чавычи и последовательностью промотора из океанского тунца [50]
Благодаря параллельному развитию транскриптомики отдельных клеток, редактированию генома и новым моделям стволовых клеток мы сейчас вступаем в научно захватывающий период, когда функциональная генетика больше не ограничивается животными моделями, а может выполняться непосредственно на образцах человека. Анализ экспрессии генов отдельных клеток разрешил транскрипционную дорожную карту развития человека, из которой определяются ключевые гены-кандидаты для функциональных исследований. Используя глобальные данные транскриптомики для руководства экспериментами, инструмент редактирования генома на основе CRISPR сделал возможным разрушение или удаление ключевых генов для выяснения функции в условиях человека. [51]

Редактирование генома с использованием мегануклеазы , [52] ZFN и TALEN обеспечивает новую стратегию генетической манипуляции в растениях и, вероятно, поможет в разработке желаемых признаков растений путем модификации эндогенных генов. Например, сайт-специфическое добавление генов в основных видах сельскохозяйственных культур может быть использовано для «укладки признаков», при которой несколько желаемых признаков физически связаны, чтобы обеспечить их косегрегацию в процессе селекции. [33] Прогресс в таких случаях недавно был зарегистрирован в Arabidopsis thaliana [53] [54] [55] и Zea mays . В Arabidopsis thaliana с использованием нацеливания генов с помощью ZFN два гена устойчивости к гербицидам (табачная ацетолактатсинтаза SuRA и SuRB) были введены в локусы SuR с трансформированными клетками с мутациями до 2%. [53] В Zea mays нарушение целевого локуса было достигнуто с помощью DSB, индуцированных ZFN, и полученного NHEJ. ZFN также использовался для перемещения кассеты экспрессии гена устойчивости к гербицидам (PAT) в целевой эндогенный локус IPK1 в этом случае. [56] Было показано, что такая модификация генома, наблюдаемая в регенерированных растениях, наследуется и передается следующему поколению. [56] Потенциально успешный пример применения методов редактирования генома для улучшения урожая можно найти в банане, где ученые использовали редактирование CRISPR/Cas9 для инактивации эндогенного вируса банановой полосатости в геноме B банана ( Musa spp. ), чтобы преодолеть серьезную проблему в селекции бананов. [57]
Кроме того, генная инженерия на основе TALEN была тщательно протестирована и оптимизирована для использования в растениях. [58] Слияния TALEN также использовались американской компанией по производству пищевых ингредиентов Calyxt [59] для улучшения качества продуктов из соевого масла [60] и для увеличения потенциала хранения картофеля [61].
Необходимо провести несколько оптимизаций для улучшения редактирования геномов растений с использованием опосредованного ZFN нацеливания. [62] Существует необходимость в надежном дизайне и последующем тестировании нуклеаз, отсутствии токсичности нуклеаз, соответствующем выборе растительной ткани для нацеливания, путях индукции активности фермента, отсутствии нецелевого мутагенеза и надежном обнаружении случаев мутаций. [62]
Распространенным методом доставки CRISPR/Cas9 в растения является трансформация на основе Agrobacterium . [63] T-ДНК вводится непосредственно в геном растения с помощью механизма T4SS. Кассеты экспрессии на основе Cas9 и gRNA превращаются в плазмиды Ti , которые трансформируются в Agrobacterium для применения в растениях. [63] Для улучшения доставки Cas9 в живые растения используются вирусы для более эффективной доставки трансгенов. [63]
Идеальная практика генной терапии заключается в замене дефектного гена нормальным аллелем в его естественном местоположении. Это выгодно по сравнению с геном, доставленным вирусом, поскольку нет необходимости включать полные кодирующие последовательности и регуляторные последовательности, когда требуется изменить лишь небольшие пропорции гена, как это часто бывает. [64] [65] Экспрессия частично замененных генов также больше соответствует нормальной клеточной биологии, чем полные гены, переносимые вирусными векторами.
Первое клиническое применение редактирования генома на основе TALEN было при лечении острого лимфобластного лейкоза CD19+ у 11-месячного ребенка в 2015 году. Модифицированные донорские Т-клетки были сконструированы так, чтобы атаковать клетки лейкемии, быть устойчивыми к алемтузумабу и избегать обнаружения иммунной системой хозяина после введения. [66] [67]
Были проведены обширные исследования на клетках и животных с использованием CRISPR-Cas9 в попытке исправить генетические мутации, которые вызывают генетические заболевания, такие как синдром Дауна, расщепление позвоночника, анэнцефалия и синдромы Тернера и Клайнфельтера. [68]
В феврале 2019 года ученые-медики, работающие с компанией Sangamo Therapeutics , головной офис которой находится в Ричмонде, Калифорния , объявили о первой в истории терапии редактирования генов человека «внутри тела» с целью постоянного изменения ДНК — у пациента с синдромом Хантера . [69] Клинические испытания, проводимые компанией Sangamo, включающие редактирование генов с использованием цинк-пальчиковой нуклеазы (ZFN), продолжаются. [70]
Исследователи использовали генные драйверы CRISPR-Cas9 для модификации генов, связанных со стерильностью A. gambiae , переносчика малярии. [71] Этот метод имеет дополнительные последствия для искоренения других трансмиссивных заболеваний, таких как желтая лихорадка, лихорадка денге и вирус Зика. [72]
Система CRISPR-Cas9 может быть запрограммирована на модуляцию популяции любого вида бактерий путем нацеливания на клинические генотипы или эпидемиологические изоляты. Она может избирательно включать полезные виды бактерий вместо вредных, устраняя патоген, что дает ей преимущество перед антибиотиками широкого спектра действия. [46]
В настоящее время изучаются противовирусные приложения для терапии, направленной на человеческие вирусы, такие как ВИЧ, герпес и вирус гепатита В. CRISPR может использоваться для воздействия на вирус или хозяина, чтобы нарушить гены, кодирующие белки рецепторов клеточной поверхности вируса. [44] В ноябре 2018 года Хэ Цзянькуй объявил, что он отредактировал два человеческих эмбриона, чтобы попытаться отключить ген CCR5 , который кодирует рецептор, используемый ВИЧ для проникновения в клетки. Он сказал, что девочки-близнецы, Лулу и Нана , родились несколькими неделями ранее. Он сказал, что девочки все еще несли функциональные копии CCR5 вместе с отключенным CCR5 ( мозаицизм ) и все еще были уязвимы для ВИЧ. Работа была широко осуждена как неэтичная, опасная и преждевременная. [73]
В январе 2019 года ученые в Китае сообщили о создании пяти идентичных клонированных обезьян с отредактированным геном, используя ту же технику клонирования, которая использовалась с Чжун Чжуном и Хуа Хуа — первыми клонированными обезьянами — и овцой Долли , и ту же технику редактирования генов Crispr - Cas9, предположительно использованную Хэ Цзянькуем при создании первых в истории генетически модифицированных человеческих младенцев Лулу и Нана . Клоны обезьян были созданы для изучения нескольких медицинских заболеваний. [74] [75]
В будущем важной целью исследований в области редактирования генома с помощью сконструированных нуклеаз должно стать повышение безопасности и специфичности действия нуклеаз. [76] Например, улучшение способности обнаруживать нецелевые события может улучшить нашу способность узнавать о способах их предотвращения. Кроме того, цинковые пальцы, используемые в ZFN, редко бывают полностью специфичными, а некоторые могут вызывать токсическую реакцию. Однако сообщалось, что токсичность снижается за счет модификаций, выполненных в домене расщепления ZFN. [65]
Кроме того, исследования Даны Кэрролл по модификации генома с помощью сконструированных нуклеаз показали необходимость лучшего понимания основных механизмов рекомбинации и восстановления ДНК. В будущем возможным методом идентификации вторичных целей будет захват сломанных концов из клеток, экспрессирующих ZFN, и секвенирование фланкирующей ДНК с использованием высокопроизводительного секвенирования. [65]
Из-за простоты использования и экономической эффективности CRISPR в настоящее время проводятся его обширные исследования. Сейчас публикаций по CRISPR больше, чем по ZFN и TALEN, несмотря на то, насколько недавним было открытие CRISPR. [44] Как CRISPR, так и TALEN являются предпочтительными вариантами для внедрения в крупномасштабное производство из-за их точности и эффективности.
Редактирование генома происходит также как естественный процесс без искусственной генной инженерии. Агенты, которые способны редактировать генетические коды, — это вирусы или субвирусные РНК-агенты.
Хотя GEEN имеет более высокую эффективность, чем многие другие методы обратной генетики, он все еще не очень эффективен; во многих случаях менее половины обработанных популяций получают желаемые изменения. [53] Например, когда кто-то планирует использовать NHEJ клетки для создания мутации, системы HDR клетки также будут работать над исправлением DSB с более низкими скоростями мутаций.
Традиционно мыши были наиболее распространенным выбором для исследователей в качестве хозяина модели заболевания. CRISPR может помочь преодолеть разрыв между этой моделью и клиническими испытаниями на людях, создавая трансгенные модели заболеваний на более крупных животных, таких как свиньи, собаки и нечеловеческие приматы. [77] [78] Используя систему CRISPR-Cas9, запрограммированный белок Cas9 и sgRNA могут быть напрямую введены в оплодотворенные зиготы для достижения желаемых модификаций генов при создании трансгенных моделей на грызунах. Это позволяет обойти обычную стадию нацеливания клеток при создании трансгенных линий, и в результате это сокращает время генерации на 90%. [78]
Одним из потенциальных возможностей, которые CRISPR приносит с собой благодаря своей эффективности, является применение ксенотрансплантации. В предыдущих исследовательских испытаниях CRISPR продемонстрировал способность выявлять и устранять эндогенные ретровирусы, что снижает риск передачи заболеваний и снижает иммунные барьеры. [44] Устранение этих проблем улучшает функцию донорского органа, что приближает это применение к реальности.
В растениях редактирование генома рассматривается как жизнеспособное решение для сохранения биоразнообразия. Генный драйв является потенциальным инструментом для изменения скорости воспроизводства инвазивных видов , хотя существуют значительные сопутствующие риски. [79]
Многие трансгуманисты рассматривают редактирование генома как потенциальный инструмент для улучшения человека . [80] [81] [82] Австралийский биолог и профессор генетики Дэвид Эндрю Синклер отмечает, что «новые технологии с редактированием генома позволят использовать его на людях (...) для того, чтобы иметь (...) более здоровых детей» — дизайнерских младенцев . [83] Согласно отчету Совета по биоэтике Наффилда за сентябрь 2016 года, в будущем может появиться возможность улучшать людей с помощью генов из других организмов или полностью синтетических генов, например, для улучшения ночного зрения и обоняния . [84] [85] Джордж Чёрч составил список потенциальных генетических модификаций для возможно полезных черт, таких как меньшая потребность во сне , изменения, связанные с познанием, которые защищают от болезни Альцгеймера, устойчивость к болезням и улучшенные способности к обучению, а также некоторые связанные с этим исследования и потенциальные негативные эффекты. [86] [87]
Американская национальная академия наук и Национальная академия медицины опубликовали в феврале 2017 года отчет, в котором квалифицированно поддержали редактирование генома человека. [88] Они рекомендовали, чтобы клинические испытания по редактированию генома могли быть однажды разрешены, как только будут найдены ответы на проблемы безопасности и эффективности, «но только для серьезных состояний под строгим надзором». [89]
В заявлении 2016 года «Оценка всемирной угрозы» разведывательного сообщества США директор Национальной разведки США Джеймс Р. Клэппер назвал редактирование генома потенциальным оружием массового поражения , заявив, что редактирование генома, проводимое странами с нормативными или этическими стандартами, «отличающимися от западных стран», вероятно, увеличивает риск создания вредных биологических агентов или продуктов. Согласно заявлению, широкое распространение, низкая стоимость и ускоренные темпы развития этой технологии, ее преднамеренное или непреднамеренное неправильное использование могут привести к далеко идущим экономическим и национальным последствиям для безопасности. [90] [91] [92] Например, такие технологии, как CRISPR, могут быть использованы для создания «комаров-убийц», которые вызывают эпидемии, уничтожающие основные сельскохозяйственные культуры. [92]
Согласно отчету Совета по биоэтике Наффилда за сентябрь 2016 года , простота и низкая стоимость инструментов для редактирования генетического кода позволят любителям — или « биохакерам » — проводить собственные эксперименты, что создает потенциальный риск от выпуска генетически модифицированных микробов. Обзор также показал, что риски и преимущества изменения генома человека — и передачи этих изменений будущим поколениям — настолько сложны, что требуют срочного этического анализа. Такие изменения могут иметь непреднамеренные последствия, которые могут нанести вред не только ребенку, но и его будущим детям, поскольку измененный ген будет находиться в их сперме или яйцеклетках. [84] [85] В 2001 году австралийские исследователи Рональд Джексон и Ян Рэмшоу подверглись критике за публикацию статьи в журнале вирусологии, в которой изучался потенциальный контроль мышей, основных вредителей в Австралии, путем заражения их измененным вирусом мышиной оспы , который мог бы вызвать бесплодие, поскольку предоставленная конфиденциальная информация могла бы привести к изготовлению биологического оружия потенциальными биотеррористами , которые могли бы использовать эти знания для создания вакциноустойчивых штаммов других вирусов оспы, таких как оспа , которые могли бы поражать людей. [85] [93] Кроме того, существуют дополнительные опасения относительно экологических рисков высвобождения генных драйвов в дикие популяции. [85] [94] [95]
В 2007 году Нобелевская премия по физиологии и медицине была присуждена Марио Капеччи, Мартину Эвансу и Оливеру Смитису «за открытие принципов введения специфических генных модификаций у мышей с использованием эмбриональных стволовых клеток». [19]
В 2020 году Нобелевская премия по химии была присуждена Эммануэль Шарпантье и Дженнифер Дудна за «разработку метода редактирования генома». [96]
«ВОЗ запускает глобальный реестр по редактированию генома человека». PharmaBiz, 31 августа 2019 г. Gale General OneFile, дата обращения 27 апреля 2020 г.