

В химии радикал , также известный как свободный радикал , представляет собой атом , молекулу или ион , имеющий по крайней мере один неспаренный валентный электрон . [1] [2] За некоторыми исключениями, эти неспаренные электроны делают радикалы химически высокореактивными . Многие радикалы спонтанно димеризуются . Большинство органических радикалов имеют короткое время жизни.
Ярким примером радикала является гидроксильный радикал (HO · ), молекула, которая имеет один неспаренный электрон на атоме кислорода. Два других примера — триплетный кислород и триплетный карбен ( ꞉ CH
2), которые имеют два неспаренных электрона.
Радикалы могут быть получены несколькими способами, но типичные методы включают окислительно-восстановительные реакции , ионизирующее излучение , тепло, электрические разряды и электролиз , как известно, производят радикалы. Радикалы являются промежуточными продуктами во многих химических реакциях, в большей степени, чем это очевидно из сбалансированных уравнений.
Радикалы играют важную роль в горении , атмосферной химии , полимеризации , плазменной химии, биохимии и многих других химических процессах. Большинство природных продуктов генерируются ферментами, генерирующими радикалы. В живых организмах радикалы супероксида и оксида азота и продукты их реакций регулируют многие процессы, такие как контроль сосудистого тонуса и, следовательно, артериального давления. Они также играют ключевую роль в промежуточном метаболизме различных биологических соединений. Такие радикалы могут даже быть посланниками в процессе, называемом окислительно-восстановительной сигнализацией . Радикал может быть захвачен в клетке растворителя или быть иным образом связан.
Радикалы образуются либо (1) из спин-спаренных молекул, либо (2) из других радикалов. Радикалы образуются из спин-спаренных молекул посредством гомолиза слабых связей или переноса электронов, также известного как восстановление. Радикалы образуются из других радикалов посредством реакций замещения, присоединения и элиминирования.
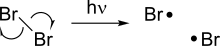
Гомолиз создает два новых радикала из спин-спаренной молекулы путем разрыва ковалентной связи, оставляя каждый из фрагментов с одним из электронов в связи. [3] Поскольку разрыв химической связи требует энергии, гомолиз происходит при добавлении тепла или света. Энергия диссоциации связи, связанная с гомолизом, зависит от стабильности данного соединения, и некоторые слабые связи способны гомолизоваться при относительно более низких температурах.
Некоторые реакции гомолиза особенно важны, поскольку они служат инициатором других радикальных реакций. Одним из таких примеров является гомолиз галогенов, который происходит под действием света и служит движущей силой для реакций радикального галогенирования.
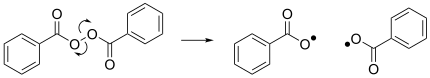
Другой заметной реакцией является гомолиз дибензоилпероксида, который приводит к образованию двух бензоилоксирадикалов и действует как инициатор многих радикальных реакций. [4]

Классически радикалы образуются путем одноэлектронного восстановления . Обычно одноэлектронно восстановленные органические соединения нестабильны. Устойчивость придается радикальному аниону, когда заряд может быть делокализован . Примерами служат нафтениды щелочных металлов , антрацениды и кетилы .

Отщепление водорода генерирует радикалы. Для достижения этой реакции связь CH донора атома H должна быть слабой, что редко бывает в органических соединениях. Аллильные и особенно дважды аллильные связи CH склонны к отщеплению O 2 . Эта реакция является основой высыхающих масел , таких как производные линолевой кислоты .
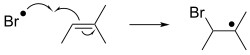
В свободно-радикальных присоединениях радикал присоединяется к спин-спаренному субстрату. При применении к органическим соединениям реакция обычно влечет за собой присоединение к алкену. Это присоединение генерирует новый радикал, который может присоединиться к еще одному алкену и т. д. Такое поведение лежит в основе радикальной полимеризации , технологии, которая производит множество пластиков . [5] [6]
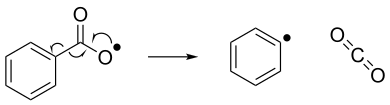
Радикальное устранение можно рассматривать как обратную реакцию радикального присоединения. При радикальном устранении нестабильное радикальное соединение распадается на спин-спаренную молекулу и новое радикальное соединение. Ниже показан пример реакции радикального устранения, где бензоилоксирадикал распадается на фенильный радикал и молекулу диоксида углерода. [7]
Генерация и реакционная способность органических радикалов зависят как от их термодинамической стабильности, так и от кинетической стабильности, также известной как устойчивость. Это различие необходимо, поскольку эти два типа стабильности не всегда коррелируют друг с другом. Например, бензильные радикалы, которые известны своей слабой прочностью бензильной связи C−H, термодинамически стабилизированы из-за резонансной делокализации. Однако эти радикалы кинетически являются транзитивными, поскольку они могут подвергаться быстрой, ограниченной диффузией димеризации, что приводит к времени жизни менее нескольких наносекунд. Чтобы избежать путаницы, особенно для радикалов с углеродным центром, Гриллер и Ингольд ввели следующие определения: [8] «Стабилизированный следует использовать для описания радикала с углеродным центром, R · , когда прочность связи R−H слабее, чем соответствующая связь C−H алкана». «Стойкий следует использовать для описания радикала, который имеет время жизни, значительно большее, чем метил [радикал] при тех же условиях». В то время как отношения между термодинамической стабильностью и кинетической устойчивостью в значительной степени зависят от случая, органические радикалы, как правило, могут быть стабилизированы любым или всеми из этих факторов: наличием электроотрицательности, делокализации и стерических препятствий. [8] Соединение 2,2,6,6-тетраметилпиперидинилоксила иллюстрирует комбинацию всех трех факторов. Это коммерчески доступное твердое вещество, которое, помимо того, что является магнитным, ведет себя как обычное органическое соединение.
Органические радикалы по своей природе являются электронодефицитными, поэтому чем больше электроотрицательность атома, на котором находится неспаренный электрон, тем менее стабилен радикал. [9] Например, среди углерода, азота и кислорода углерод является наиболее стабильным, а кислород — наименее стабильным.
Электроотрицательность также влияет на стабильность атомов углерода в различных гибридизациях. Больший s-характер коррелирует с большей электроотрицательностью атома углерода (из-за близкого расположения s-орбиталей к ядру), и чем больше электроотрицательность, тем менее стабилен радикал. [9] sp-гибридизованные углероды (50% s-характера) образуют наименее стабильные радикалы по сравнению с sp 3 -гибридизованными углеродами (25% s-характера), которые образуют наиболее стабильные радикалы.
Делокализация электронов по структуре радикала, также известная как его способность образовывать одну или несколько резонансных структур, позволяет распределить дефицит электронов по нескольким атомам, минимизируя нестабильность. Делокализация обычно происходит в присутствии электронодонорных групп, таких как гидроксильные группы (−OH), эфиры (−OR), смежные алкены и амины (−NH 2 или −NR), или электроноакцепторных групп, таких как C=O или C≡N. [3]

Эффекты делокализации также можно понять, используя теорию молекулярных орбиталей в качестве линзы, а именно, исследуя внутримолекулярное взаимодействие неспаренного электрона с парой электронов донорной группы или пустой π*-орбиталью электроноакцепторной группы в форме молекулярной орбитальной диаграммы. HOMO радикала однократно занята, поэтому орбиталь уместно называть SOMO или однократно занятой молекулярной орбиталью. Для электронодонорной группы SOMO взаимодействует с неподеленной парой с более низкой энергией, образуя новую заполненную связывающую орбиталь с более низкой энергией и однократно заполненную новую SOMO, более высокую по энергии, чем исходная. В то время как энергия неспаренного электрона увеличилась, уменьшение энергии неподеленной пары, образующей новую связывающую орбиталь, перевешивает увеличение энергии новой SOMO, что приводит к чистому уменьшению энергии молекулы. Таким образом, электронодонорные группы помогают стабилизировать радикалы.

С группой, которая вместо этого является электроноакцепторной, SOMO затем взаимодействует с пустой π*-орбиталью. Электроны не занимают образованную более высокую энергетическую орбиталь, в то время как образуется новая SOMO с более низкой энергией. Это приводит к более низкой энергии и более высокой стабильности радикальных видов. Как донорные, так и акцепторные группы стабилизируют радикалы.
Другой хорошо известной, хотя и более слабой формой делокализации является гиперконъюгация . В радикальной химии радикалы стабилизируются гиперконъюгацией с соседними алкильными группами. Передача сигма (σ) связей C−H в частично пустые радикальные орбитали помогает различать устойчивость радикалов на третичном, вторичном и первичном углероде. Третичные углеродные радикалы имеют три связи σ CH, которые являются донорами, вторичные радикалы — только две, а первичные радикалы — только одну. Поэтому третичные радикалы являются наиболее стабильными, а первичные радикалы — наименее стабильными.
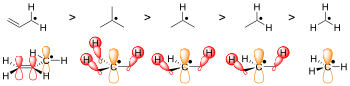

Проще говоря, чем больше стерическое препятствие, тем сложнее реакциям происходить, и радикальная форма предпочтительна по умолчанию. Например, сравните водород-абстрагированную форму N -гидроксипиперидина с молекулой TEMPO . [3] TEMPO, или (2,2,6,6-тетраметилпиперидин-1-ил)оксил, слишком стерически затруднен дополнительными метильными группами, чтобы реагировать, что делает его достаточно стабильным для коммерческой продажи в его радикальной форме. N -гидроксипиперидин, однако, не имеет четырех метильных групп, чтобы препятствовать пути реагирующей молекулы, поэтому структура нестабильна. [3]
Стабильность многих (или большинства) органических радикалов не указывается их изолируемостью, а проявляется в их способности функционировать как доноры H • . Это свойство отражает ослабленную связь с водородом, обычно O−H, но иногда N−H или C−H. Такое поведение важно, поскольку эти доноры H • служат антиоксидантами в биологии и в торговле. Иллюстрацией является α-токоферол ( витамин E ). Сам по себе радикал токоферола недостаточно стабилен для выделения, но исходная молекула является высокоэффективным донором атома водорода. Связь C−H ослаблена в производных трифенилметила (тритила).

Большое разнообразие неорганических радикалов стабильно и фактически изолировано. Примерами являются большинство комплексов переходных металлов первого ряда.
Что касается радикалов основной группы, наиболее распространенный радикал во Вселенной является также наиболее распространенным химическим веществом во Вселенной, H • . Большинство радикалов основной группы, однако, не могут быть изолированы , несмотря на их внутреннюю стабильность. Например, водородные радикалы охотно объединяются, образуя H 2 . Оксид азота (NO) является хорошо известным примером изолируемого неорганического радикала. Соль Фреми (нитрозодисульфонат калия, (KSO 3 ) 2 NO) является родственным примером. Известно много тиазильных радикалов, несмотря на ограниченную степень стабилизации π-резонанса . [10] [11]
Многие радикалы можно представить как продукты разрыва ковалентных связей путем гомолиза . Энергии диссоциации гомолитической связи , обычно сокращенно обозначаемые как «Δ H °», являются мерой прочности связи. Например, для расщепления H 2 на 2 H • требуется Δ H ° +435 кДж/моль , тогда как для расщепления Cl 2 на два Cl • требуется Δ H ° +243 кДж/моль. Для слабых связей гомолиз может быть вызван термически. Для сильных связей требуются фотоны высокой энергии или даже пламя, чтобы вызвать гомолиз.
Дирадикалы — это молекулы, содержащие два радикальных центра. Дикислород (O 2 ) является важным примером стабильного дирадикала. Синглетный кислород , нерадикальное состояние дикислорода с самой низкой энергией, менее стабилен, чем дирадикал из-за правила максимальной множественности Хунда . Относительная стабильность дирадикала кислорода в первую очередь обусловлена запрещенной по спину природой триплет-синглетного перехода, необходимого для того, чтобы он захватил электроны, т. е. « окислился ». Дирадикальное состояние кислорода также приводит к его парамагнитному характеру, что демонстрируется его притяжением к внешнему магниту. [12] Дирадикалы также могут встречаться в металл-оксокомплексах , что подходит для изучения запрещенных по спину реакций в химии переходных металлов . [13] Карбены в их триплетном состоянии можно рассматривать как дирадикалы, центрированные на одном и том же атоме, в то время как они обычно являются высокореакционноспособными, известны устойчивые карбены , причем наиболее распространенным примером являются N-гетероциклические карбены.
Триплетные карбены и нитрены являются бирадикалами. Их химические свойства отличаются от свойств их синглетных аналогов.

Знакомая радикальная реакция — горение . Молекула кислорода — стабильный дирадикал , лучше всего представленный как • O–O • . Поскольку спины электронов параллельны, эта молекула стабильна. В то время как основное состояние кислорода — это этот нереакционноспособный спин-неспаренный ( триплетный ) дирадикал, доступно чрезвычайно реактивное спин-спаренное ( синглетное ) состояние. Для того чтобы произошло горение, необходимо преодолеть энергетический барьер между ними. Этот барьер можно преодолеть с помощью тепла, что требует высоких температур. Переход триплет-синглет также « запрещен ». Это представляет собой дополнительный барьер для реакции. Это также означает, что молекулярный кислород относительно нереакционноспособен при комнатной температуре, за исключением присутствия каталитического тяжелого атома, такого как железо или медь.
Горение состоит из различных радикальных цепных реакций, которые может инициировать синглетный радикал. Воспламеняемость данного материала в значительной степени зависит от концентрации радикалов, которая должна быть получена до того, как преобладают реакции инициирования и распространения, приводящие к возгоранию материала. После того, как горючий материал израсходован, снова преобладают реакции прекращения, и пламя гаснет. Как указано, содействие реакциям распространения или прекращения изменяет воспламеняемость. Например, поскольку сам свинец дезактивирует радикалы в смеси бензина и воздуха, тетраэтилсвинец когда-то обычно добавляли в бензин. Это предотвращает неконтролируемое начало горения или в несгоревших остатках ( стук двигателя ) или преждевременное воспламенение ( предзажигание ).
При сгорании углеводорода в процесс вовлекается большое количество различных кислородных радикалов. Сначала образуются гидропероксильные радикалы (HOO • ). Затем они вступают в дальнейшую реакцию, образуя органические гидропероксиды , которые распадаются на гидроксильные радикалы (HO • ).
Многие реакции полимеризации инициируются радикалами. Полимеризация включает начальное радикальное присоединение к нерадикалу (обычно алкену) для получения новых радикалов. Этот процесс является основой радикальной цепной реакции. Искусство полимеризации подразумевает метод, с помощью которого вводится инициирующий радикал. Например, метилметакрилат (ММА) может быть полимеризован для получения поли(метилметакрилата) (ПММА – плексиглас или перспекс) посредством повторяющейся серии шагов радикального присоединения :
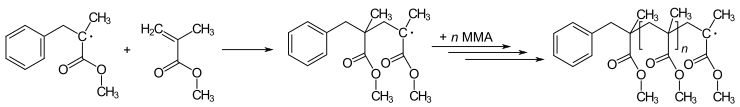
Более новые методы радикальной полимеризации известны как живая радикальная полимеризация . Варианты включают обратимую передачу цепи присоединения-фрагментации ( RAFT ) и радикальную полимеризацию с переносом атома ( ATRP ).
Будучи распространенным радикалом, O 2 реагирует со многими органическими соединениями, образуя радикалы вместе с радикалом гидропероксида . Олифы и алкидные краски затвердевают из-за радикальной сшивки, инициированной кислородом из атмосферы.
Наиболее распространенным радикалом в нижних слоях атмосферы является молекулярный дикислород. Фотодиссоциация исходных молекул производит другие радикалы. В нижних слоях атмосферы важные радикалы производятся фотодиссоциацией диоксида азота на атом кислорода и оксид азота (см . ур. 1.1 ниже), который играет ключевую роль в образовании смога , и фотодиссоциацией озона с образованием возбужденного атома кислорода O(1D) (см. ур. 1.2 ниже). Также показаны чистые и обратные реакции ( ур. 1.3 и ур. 1.4 соответственно).
В верхних слоях атмосферы фотодиссоциация обычно нереакционноспособных хлорфторуглеродов (ХФУ) под действием солнечного ультрафиолетового излучения является важным источником радикалов (см. уравнение 1 ниже). Эти реакции дают радикал хлора , Cl • , который катализирует превращение озона в O 2 , тем самым способствуя истощению озонового слоя ( уравнения 2.2 – 2.4 ниже).
Такие реакции вызывают истощение озонового слоя , особенно потому, что радикал хлора может свободно вступать в другую цепочку реакций; следовательно, использование хлорфторуглеродов в качестве хладагентов было ограничено.

Радикалы играют важную роль в биологии. Многие из них необходимы для жизни, например, внутриклеточное уничтожение бактерий фагоцитарными клетками, такими как гранулоциты и макрофаги . Радикалы участвуют в процессах клеточной сигнализации , [15] известных как окислительно-восстановительная сигнализация . Например, радикальная атака линолевой кислоты производит ряд 13-гидроксиоктадекадиеновых кислот и 9-гидроксиоктадекадиеновых кислот , которые могут регулировать локализованные воспалительные и/или заживляющие реакции тканей, восприятие боли и пролиферацию злокачественных клеток. Радикальные атаки на арахидоновую кислоту и докозагексаеновую кислоту производят аналогичный, но более широкий набор сигнальных продуктов. [16]
Радикалы также могут быть вовлечены в болезнь Паркинсона , старческую и лекарственную глухоту , шизофрению и болезнь Альцгеймера . [17] Классический синдром свободных радикалов, болезнь накопления железа гемохроматоз , обычно связан с совокупностью симптомов, связанных со свободными радикалами, включая двигательные расстройства, психозы, нарушения пигментации меланина кожи , глухоту, артрит и сахарный диабет. Теория старения, основанная на свободных радикалах, предполагает, что радикалы лежат в основе самого процесса старения . Аналогичным образом, процесс митогормезиса предполагает , что повторное воздействие радикалов может продлить продолжительность жизни.
Поскольку радикалы необходимы для жизни, организм имеет ряд механизмов для минимизации повреждений, вызванных радикалами, и для восстановления повреждений, которые возникают, например, ферменты супероксиддисмутаза , каталаза , глутатионпероксидаза и глутатионредуктаза . Кроме того, антиоксиданты играют ключевую роль в этих защитных механизмах. Часто это три витамина: витамин А , витамин С и витамин Е , а также полифенольные антиоксиданты . Кроме того, есть веские доказательства того, что билирубин и мочевая кислота могут действовать как антиоксиданты, помогая нейтрализовать определенные радикалы. Билирубин образуется в результате распада содержимого эритроцитов , в то время как мочевая кислота является продуктом распада пуринов . Однако слишком много билирубина может привести к желтухе , которая в конечном итоге может повредить центральную нервную систему, в то время как слишком много мочевой кислоты вызывает подагру . [18]
Активные формы кислорода или ROS — это такие виды, как супероксид , перекись водорода и гидроксильный радикал , которые обычно связаны с повреждением клеток. ROS образуются как естественный побочный продукт нормального метаболизма кислорода и играют важную роль в передаче сигналов клетками. Два важных радикала, центрированных на кислороде, — это супероксид и гидроксильный радикал . Они образуются из молекулярного кислорода в восстановительных условиях. Однако из-за своей реакционной способности эти же радикалы могут участвовать в нежелательных побочных реакциях, приводящих к повреждению клеток. Избыточное количество этих радикалов может привести к повреждению и смерти клеток , что может способствовать возникновению многих заболеваний, таких как рак , инсульт , инфаркт миокарда , диабет и серьезные расстройства. [19] Считается, что многие формы рака являются результатом реакций между радикалами и ДНК , потенциально приводящих к мутациям , которые могут неблагоприятно влиять на клеточный цикл и потенциально приводить к злокачественным новообразованиям. [20] Некоторые симптомы старения , такие как атеросклероз, также приписываются окислению холестерина до 7-кетохолестерина, вызванному радикалами. [21] Кроме того, радикалы способствуют алкогольному повреждению печени , возможно, даже больше, чем сам алкоголь. Радикалы, образующиеся в сигаретном дыме , участвуют в инактивации альфа-1-антитрипсина в легких . Этот процесс способствует развитию эмфиземы .
Было обнаружено, что оксибензон образует радикалы на солнце, и, следовательно, может быть связан с повреждением клеток. Это происходило только тогда, когда он сочетался с другими ингредиентами, обычно встречающимися в солнцезащитных кремах, такими как оксид титана и октилметоксициннамат . [22]
ROS атакуют полиненасыщенную жирную кислоту , линолевую кислоту , образуя ряд продуктов 13-гидроксиоктадекадиеновой кислоты и 9-гидроксиоктадекадиеновой кислоты , которые служат сигнальными молекулами, которые могут запускать реакции, противодействующие повреждению тканей, вызвавшему их образование. ROS атакуют другие полиненасыщенные жирные кислоты, например, арахидоновую кислоту и докозагексаеновую кислоту , образуя аналогичный ряд сигнальных продуктов. [23]
Активные формы кислорода также используются в контролируемых реакциях с участием синглетного дикислорода, известных как реакции фотооксигенации типа II после передачи энергии Декстера ( триплет-триплетная аннигиляция ) от естественного триплетного дикислорода и триплетного возбужденного состояния фотосенсибилизатора. Типичные химические превращения с этим синглетным дикислородом включают, среди прочего, преобразование целлюлозных биоотходов в новые полиметиновые красители. [24]
В химических уравнениях радикалы часто обозначаются точкой, расположенной непосредственно справа от атомного символа или молекулярной формулы, как показано ниже:
Механизмы радикальных реакций используют односторонние стрелки для изображения движения отдельных электронов:

Гомолитический разрыв разрывающейся связи изображен стрелкой в виде «рыболовного крючка», чтобы отличить его от обычного движения двух электронов , изображенного стандартной фигурной стрелкой. Второй электрон разрывающейся связи также движется, чтобы образовать пару с атакующим радикальным электроном.
Радикалы также принимают участие в радикальном присоединении и радикальном замещении в качестве реакционноспособных промежуточных продуктов . Цепные реакции с участием радикалов обычно можно разделить на три отдельных процесса. Это инициирование , распространение и завершение .

До конца 20 века слово «радикал» использовалось в химии для обозначения любой связанной группы атомов, такой как метильная группа или карбоксильная группа , независимо от того, была ли она частью более крупной молекулы или молекулой сама по себе. Радикал часто называют группой R. Затем для указания несвязанного случая потребовался квалификатор «свободный». После недавних изменений в номенклатуре часть более крупной молекулы теперь называется функциональной группой или заместителем , а «радикал» теперь подразумевает «свободный». Однако старая номенклатура все еще может встречаться в некоторых книгах.
Термин радикал уже использовался, когда была разработана ныне устаревшая радикальная теория . Луи-Бернар Гитон де Морво ввел фразу «радикал» в 1785 году, а Антуан Лавуазье использовал ее в 1789 году в своем «Traité Élémentaire de Chimie» . Затем радикал был идентифицирован как корневая основа некоторых кислот (латинское слово «radix» означает «корень»). Исторически термин радикал в радикальной теории также использовался для связанных частей молекулы, особенно когда они остаются неизменными в реакциях. Теперь они называются функциональными группами . Например, метиловый спирт был описан как состоящий из метильного «радикала» и гидроксильного «радикала». Ни один из них не является радикалом в современном химическом смысле, поскольку они постоянно связаны друг с другом и не имеют неспаренных, реакционноспособных электронов; однако их можно наблюдать как радикалы в масс-спектрометрии при расщеплении облучением энергичными электронами.
В современном контексте первым идентифицированным органическим (углеродсодержащим) радикалом был трифенилметильный радикал , (C 6 H 5 ) 3 C • . Этот вид был открыт Моисеем Гомбергом в 1900 году. В 1933 году Моррис С. Хараш и Фрэнк Майо предположили, что свободные радикалы ответственны за антимарковниковское присоединение бромистого водорода к аллилбромиду . [25] [26]
В большинстве областей химии историческое определение радикалов утверждает, что молекулы имеют ненулевой электронный спин. Однако в таких областях, как спектроскопия и астрохимия , определение немного отличается. Герхард Герцберг , получивший Нобелевскую премию за исследования электронной структуры и геометрии радикалов, предложил более свободное определение свободных радикалов: «любые переходные (химически нестабильные) виды (атом, молекула или ион)». [27] Основной смысл его предложения заключается в том, что существует много химически нестабильных молекул, которые имеют нулевой спин, таких как C 2 , C 3 , CH 2 и так далее. Это определение более удобно для обсуждения переходных химических процессов и астрохимии; поэтому исследователи в этих областях предпочитают использовать это свободное определение. [28]