Спектроскопия ядерного магнитного резонанса , наиболее известная как спектроскопия ЯМР или спектроскопия магнитного резонанса ( МРС ), представляет собой спектроскопический метод, основанный на переориентации атомных ядер с ненулевыми ядерными спинами во внешнем магнитном поле. Эта переориентация происходит при поглощении электромагнитного излучения в радиочастотной области примерно от 4 до 900 МГц, которая зависит от изотопной природы ядра и увеличивается пропорционально напряженности внешнего магнитного поля. [1] Примечательно, что резонансная частота каждого ЯМР-активного ядра зависит от его химического окружения. В результате спектры ЯМР предоставляют информацию об отдельных функциональных группах, присутствующих в образце, а также о связях между соседними ядрами в одной и той же молекуле. Поскольку спектры ЯМР уникальны или в высокой степени характерны для отдельных соединений и функциональных групп , спектроскопия ЯМР является одним из важнейших методов идентификации молекулярных структур, особенно органических соединений .
Принцип ЯМР обычно включает три последовательных этапа:
Аналогично биохимики используют ЯМР для идентификации белков и других сложных молекул. Помимо идентификации, спектроскопия ЯМР предоставляет подробную информацию о структуре, динамике, состоянии реакции и химическом окружении молекул. Наиболее распространенными типами ЯМР являются спектроскопия ЯМР протонов и углерода-13 , но она применима к любому виду образца, который содержит ядра, обладающие спином .
Спектры ЯМР уникальны, хорошо разрешены, аналитически трактуемы и часто весьма предсказуемы для малых молекул . Различные функциональные группы , очевидно, различимы, и идентичные функциональные группы с различными соседними заместителями все еще дают различимые сигналы. ЯМР в значительной степени заменил традиционные тесты мокрой химии , такие как цветные реагенты или типичная хроматография для идентификации.
Самым существенным недостатком ЯМР-спектроскопии является ее низкая чувствительность (по сравнению с другими аналитическими методами, такими как масс-спектрометрия ). Обычно для записи ЯМР-спектра приличного качества требуется 2–50 мг вещества. Метод ЯМР является неразрушающим, поэтому вещество может быть восстановлено. Для получения ЯМР-спектров высокого разрешения твердые вещества обычно растворяют, чтобы получить жидкие растворы, хотя твердотельная ЯМР- спектроскопия также возможна.
Временная шкала ЯМР относительно длинная, и поэтому она не подходит для наблюдения быстрых явлений, производя только усредненный спектр. Хотя большие количества примесей действительно видны в спектре ЯМР, существуют лучшие методы обнаружения примесей, поскольку ЯМР по своей природе не очень чувствителен – хотя на более высоких частотах чувствительность выше.
Корреляционная спектроскопия является развитием обычного ЯМР. В двумерном ЯМР излучение сосредоточено вокруг одной частоты, и наблюдаются коррелированные резонансы. Это позволяет идентифицировать соседние заместители наблюдаемой функциональной группы, позволяя однозначно идентифицировать резонансы. Существуют также более сложные 3D и 4D методы и различные методы, предназначенные для подавления или усиления определенных типов резонансов. В спектроскопии ядерного эффекта Оверхаузера (NOE) наблюдается релаксация резонансов. Поскольку NOE зависит от близости ядер, количественная оценка NOE для каждого ядра позволяет построить трехмерную модель молекулы.

Спектрометры ЯМР относительно дороги; они обычно есть в университетах, но они менее распространены в частных компаниях. В период с 2000 по 2015 год спектрометр ЯМР стоил около 0,5–5 миллионов долларов США . [3] [4] Современные спектрометры ЯМР имеют очень сильный, большой и дорогой сверхпроводящий магнит, охлаждаемый жидким гелием , поскольку разрешение напрямую зависит от напряженности магнитного поля. Более сильное магнитное поле также улучшает чувствительность спектроскопии ЯМР, которая зависит от разницы заселенностей между двумя ядерными уровнями, которая экспоненциально увеличивается с напряженностью магнитного поля.
Также доступны менее дорогие машины, использующие постоянные магниты и более низкое разрешение, которые все еще обеспечивают достаточную производительность для определенных приложений, таких как мониторинг реакций и быстрая проверка образцов. Существуют даже настольные спектрометры ядерного магнитного резонанса . Спектры ЯМР протонов ( ядра 1 H) можно наблюдать даже в магнитном поле Земли . ЯМР низкого разрешения дает более широкие пики, которые могут легко перекрывать друг друга, вызывая проблемы при разрешении сложных структур. Использование более сильных магнитных полей приводит к лучшей чувствительности и более высокому разрешению пиков, и это предпочтительно для исследовательских целей. [5]
Заслуга в открытии ЯМР принадлежит Исидору Исааку Раби , который получил Нобелевскую премию по физике в 1944 году. [6] Группа Перселла в Гарвардском университете и группа Блоха в Стэнфордском университете независимо друг от друга разработали ЯМР-спектроскопию в конце 1940-х и начале 1950-х годов. Эдвард Миллс Перселл и Феликс Блох разделили Нобелевскую премию по физике 1952 года за свои изобретения. [7]
Ключевым фактором, определяющим активность ЯМР в атомных ядрах, является квантовое число ядерного спина ( I ). Это внутреннее квантовое свойство, аналогичное « спину » атома , характеризует угловой момент ядра. Чтобы быть ЯМР-активным, ядро должно иметь ненулевой ядерный спин ( I ≠ 0). [8] Именно этот ненулевой спин позволяет ядрам взаимодействовать с внешними магнитными полями и показывать сигналы в ЯМР. Атомы с нечетной суммой протонов и нейтронов демонстрируют полуцелые значения для квантового числа ядерного спина ( I = 1/2, 3/2, 5/2 и т. д.). Эти атомы являются ЯМР-активными, потому что обладают ненулевым ядерным спином. Атомы с четной суммой, но как нечетным числом протонов, так и нечетным числом нейтронов демонстрируют целые ядерные спины ( I = 1, 2, 3 и т. д.). Наоборот, атомы с четным числом как протонов, так и нейтронов имеют ядерное квантовое число спина, равное нулю ( I = 0), и поэтому не являются ЯМР-активными. [9] Ядра, активные в ЯМР, особенно те, у которых спиновое квантовое число равно 1/2, имеют большое значение в ЯМР-спектроскопии. Примерами являются 1 H, 13 C, 15 N и 31 P. [10]
При помещении в магнитное поле активные ядра ЯМР (например, 1 H или 13 C) поглощают электромагнитное излучение на частоте, характерной для изотопа . [11] Резонансная частота, энергия поглощенного излучения и интенсивность сигнала пропорциональны напряженности магнитного поля. Например, в магнитном поле 21 Тесла ядра водорода ( протоны ) резонируют на частоте 900 МГц. Обычно магнит 21 Т называют магнитом 900 МГц , поскольку водород является наиболее распространенным обнаруженным ядром. Однако разные ядра будут резонировать на разных частотах при этой напряженности поля пропорционально их ядерным магнитным моментам . [ необходима цитата ]

Спектрометр ЯМР обычно состоит из вращающегося держателя образца внутри очень сильного магнита, радиочастотного излучателя и приемника с зондом (антенной сборкой), который входит внутрь магнита, чтобы окружить образец, опционально градиентные катушки для измерений диффузии и электроники для управления системой. Вращение образца обычно необходимо для усреднения диффузионного движения, однако некоторые эксперименты требуют неподвижного образца, когда движение раствора является важной переменной. Например, измерения констант диффузии ( диффузионно-упорядоченная спектроскопия или DOSY) [12] [13] выполняются с использованием неподвижного образца с выключенным вращением, а проточные ячейки могут использоваться для онлайн-анализа технологических потоков.
Подавляющее большинство молекул в растворе являются молекулами растворителя, и большинство обычных растворителей являются углеводородами и поэтому содержат ЯМР-активные ядра водорода-1. Чтобы избежать того, чтобы сигналы от атомов водорода растворителя подавляли эксперимент и мешали анализу растворенного аналита, используются дейтерированные растворители , в которых >99% протонов заменены дейтерием (водородом-2). [14] Наиболее широко используемым дейтерированным растворителем является дейтерохлороформ (CDCl3 ) , хотя другие растворители могут использоваться по разным причинам, таким как растворимость образца, желание контролировать водородные связи или температуры плавления или кипения. Химические сдвиги молекулы немного меняются между растворителями, и поэтому используемый растворитель почти всегда сообщается с химическими сдвигами. [ необходима цитата ] Спектры протонного ЯМР часто калибруются по известному пику остаточного протона растворителя [15] в качестве внутреннего стандарта вместо добавления тетраметилсилана (TMS), который традиционно определяется как имеющий химический сдвиг, равный нулю. [16]
Для обнаружения очень малых сдвигов частоты из-за ядерного магнитного резонанса приложенное магнитное поле должно быть чрезвычайно однородным по всему объему образца. ЯМР-спектрометры высокого разрешения используют шиммы для регулировки однородности магнитного поля до частей на миллиард ( ppb ) в объеме нескольких кубических сантиметров. Для того чтобы обнаружить и компенсировать неоднородность и дрейф в магнитном поле, спектрометр поддерживает «захват» на частоте растворителя дейтерия с помощью отдельного блока захвата, который по сути является дополнительным передатчиком и РЧ-процессором, настроенным на блокирующее ядро (дейтерий), а не на ядра интересующего образца. [17] В современных ЯМР-спектрометрах шиммирование регулируется автоматически, хотя в некоторых случаях оператору приходится вручную оптимизировать параметры шимма для получения наилучшего возможного разрешения. [17] [18]
При возбуждении образца радиочастотным (60–1000 МГц) импульсом получается ответ ядерного магнитного резонанса – спад свободной индукции (ССИ). Это очень слабый сигнал, для улавливания которого требуются чувствительные радиоприемники. Преобразование Фурье выполняется для извлечения спектра частотной области из необработанного ССИ временной области. Спектр от одного ССИ имеет низкое отношение сигнал/шум , но он легко улучшается при усреднении повторных сборов. Хорошие спектры ЯМР 1 H можно получить с 16 повторами, что занимает всего несколько минут. Однако для элементов тяжелее водорода время релаксации довольно велико, например, около 8 секунд для 13 C. Таким образом, получение количественных спектров тяжелых элементов может занять много времени, от десятков минут до часов. [ необходима цитата ]
После импульса ядра, в среднем, возбуждаются под определенным углом относительно магнитного поля спектрометра. Степень возбуждения можно контролировать с помощью ширины импульса, обычно около 3–8 мкс для оптимального импульса 90°. Ширина импульса может быть определена путем построения графика (знаковой) интенсивности как функции ширины импульса. Она следует синусоидальной кривой и, соответственно, меняет знак при ширине импульса, соответствующей импульсам 180° и 360°. [ необходима цитата ]
Время затухания возбуждения, обычно измеряемое в секундах, зависит от эффективности релаксации, которая быстрее для более легких ядер и в твердых телах, медленнее для более тяжелых ядер и в растворах и может быть очень долгой в газах. Если второй импульс возбуждения посылается преждевременно до завершения релаксации, средний вектор намагниченности не распадается до основного состояния, что непредсказуемым образом влияет на силу сигнала. На практике площади пиков тогда не пропорциональны стехиометрии; можно различить только наличие, но не количество функциональных групп. Эксперимент по восстановлению инверсии может быть проведен для определения времени релаксации и, следовательно, требуемой задержки между импульсами. Передаются импульс 180°, регулируемая задержка и импульс 90°. Когда импульс 90° точно отменяет сигнал, задержка соответствует времени, необходимому для релаксации на 90°. [19] Восстановление инверсии целесообразно для количественных 13 C, 2 D и других трудоемких экспериментов.
Сигналы ЯМР обычно характеризуются тремя переменными: химическим сдвигом, спин-спиновой связью и временем релаксации.

Разница энергий Δ E между состояниями ядерного спина пропорциональна магнитному полю ( эффект Зеемана ). Δ E также чувствительна к электронному окружению ядра, что приводит к тому, что известно как химический сдвиг, δ. Простейшие типы графиков ЯМР представляют собой графики различных химических сдвигов ядер, изучаемых в молекуле. Значение δ часто выражается в терминах «экранирования»: экранированные ядра имеют более высокий Δ E. Диапазон значений δ называется дисперсией. Он довольно мал для сигналов 1 H, но намного больше для других ядер. Сигналы ЯМР сообщаются относительно опорного сигнала, обычно сигнала ТМС ( тетраметилсилана ). Кроме того, поскольку распределение сигналов ЯМР зависит от поля, эти частоты делятся на частоту спектрометра. Однако, поскольку мы делим Гц на МГц, полученное число будет слишком малым, и поэтому оно умножается на миллион. Таким образом, эта операция дает локаторное число, называемое «химическим сдвигом» с единицами измерения в частях на миллион. [20] Химический сдвиг предоставляет структурную информацию.
Преобразование химических сдвигов (и J, см. ниже) называется присвоением спектра. Для диамагнитных органических соединений присвоения спектров ЯМР 1 H и 13 C чрезвычайно сложны из-за больших баз данных и простых вычислительных инструментов. В целом, химические сдвиги для протонов весьма предсказуемы, поскольку сдвиги в первую очередь определяются эффектами экранирования (электронной плотностью). Химические сдвиги для многих более тяжелых ядер сильнее зависят от других факторов, включая возбужденные состояния («парамагнитный» вклад в тензор экранирования). Этот парамагнитный вклад, который не связан с парамагнетизмом ) не только нарушает тенденции в химических сдвигах, что усложняет присвоения, но и приводит к очень большим диапазонам химических сдвигов. Например, большинство сигналов ЯМР 1 H для большинства органических соединений находятся в пределах 15 ppm. Для ЯМР 31 P диапазон составляет сотни ppm. [21]
В парамагнитной ЯМР-спектроскопии образцы являются парамагнитными, т.е. содержат неспаренные электроны. Парамагнетизм приводит к очень разнообразным химическим сдвигам. В 1 H ЯМР-спектроскопии диапазон химических сдвигов может достигать тысяч ppm. [22]
Часть наиболее полезной информации для определения структуры в одномерном спектре ЯМР исходит из J-связи, или скалярной связи (частный случай спин-спиновой связи ), между активными ядрами ЯМР. Эта связь возникает из-за взаимодействия различных спиновых состояний через химические связи молекулы и приводит к расщеплению сигналов ЯМР. Для протона локальное магнитное поле немного отличается в зависимости от того, указывает ли соседнее ядро на магнитное поле спектрометра или против него, что приводит к появлению двух сигналов на протон вместо одного. Эти паттерны расщепления могут быть сложными или простыми и, аналогично, могут быть прямо интерпретируемыми или обманчивыми. Эта связь обеспечивает детальное понимание связности атомов в молекуле. [ необходима цитата ]
Множественность расщепления является эффектом спинов ядер, которые связаны, и числа таких ядер, участвующих в связи. Связь с n эквивалентными ядрами со спином 1/2 расщепляет сигнал на n + 1 мультиплет с отношениями интенсивностей, следующими треугольнику Паскаля, как описано в таблице. Связь с дополнительными спинами приводит к дальнейшему расщеплению каждого компонента мультиплета, например, связь с двумя различными ядрами со спином 1/2 с существенно разными константами связи приводит к дублету дублетов (сокращенно: dd). Обратите внимание, что связь между ядрами, которые химически эквивалентны (то есть имеют одинаковый химический сдвиг), не влияет на спектры ЯМР, а связи между ядрами, которые находятся на большом расстоянии (обычно более чем на 3 связи для протонов в гибких молекулах), обычно слишком малы, чтобы вызвать наблюдаемые расщепления. В циклических и ароматических соединениях часто можно наблюдать дальние связи, включающие более трех связей , что приводит к более сложным моделям расщепления. [ необходима ссылка ]
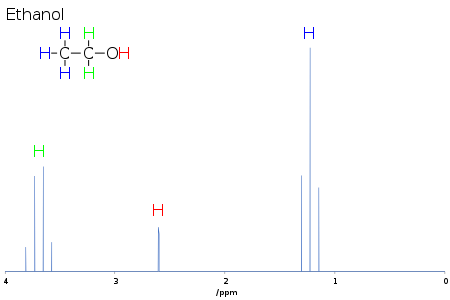
Например, в протонном спектре этанола группа CH 3 расщепляется на триплет с соотношением интенсивностей 1:2:1 двумя соседними протонами CH 2. Аналогично, группа CH 2 расщепляется на квартет с соотношением интенсивностей 1:3:3:1 тремя соседними протонами CH 3. В принципе, два протона CH 2 также будут снова расщепляться на дублет, образуя дублет квартетов гидроксильным протоном, но межмолекулярный обмен кислотным гидроксильным протоном часто приводит к потере информации о сопряжении.
Связывание с любыми ядрами со спином 1/2, такими как фосфор-31 или фтор-19, работает таким образом (хотя величины констант связи могут сильно различаться). Но паттерны расщепления отличаются от описанных выше для ядер со спином больше 1/2, поскольку квантовое число спина имеет более двух возможных значений. Например, связывание с дейтерием (ядром со спином 1) расщепляет сигнал на триплет 1:1:1, поскольку спин 1 имеет три состояния спина. Аналогично, ядро со спином 3/2, такое как 35 Cl, расщепляет сигнал на квартет 1:1:1:1 и так далее.
Связывание в сочетании с химическим сдвигом (и интегрированием для протонов) говорит нам не только о химическом окружении ядер, но и о числе соседних активных ядер ЯМР внутри молекулы. В более сложных спектрах с несколькими пиками при схожих химических сдвигах или в спектрах ядер, отличных от водорода, связывание часто является единственным способом различить разные ядра.
Величина связи (константа связи J ) является следствием того, насколько сильно ядра связаны друг с другом. Для простых случаев это следствие расстояния связи между ядрами, магнитного момента ядер и двугранного угла между ними.
Приведенное выше описание предполагает, что константа связи мала по сравнению с разницей в частотах ЯМР между неэквивалентными спинами. Если сдвиговое разделение уменьшается (или сила связи увеличивается), картины интенсивности мультиплета сначала искажаются, а затем становятся более сложными и менее легко анализируемыми (особенно если задействовано более двух спинов). Усиление некоторых пиков в мультиплете достигается за счет остатка, который иногда почти исчезает в фоновом шуме, хотя интегрированная площадь под пиками остается постоянной. Однако в большинстве ЯМР с высоким полем искажения обычно незначительны, и характерные искажения ( крыша ) могут фактически помочь идентифицировать связанные пики.
Некоторые из этих моделей можно проанализировать с помощью метода , опубликованного Джоном Поплом [23], хотя он имеет ограниченную область применения.
Эффекты второго порядка уменьшаются по мере увеличения разницы частот между мультиплетами, так что спектры ЯМР с высоким полем (т.е. высокой частотой) демонстрируют меньше искажений, чем спектры с более низкой частотой. Ранние спектры на частоте 60 МГц были более склонны к искажениям, чем спектры более поздних машин, обычно работающих на частотах 200 МГц или выше.
Кроме того, как показано на рисунке справа, J-связь может быть использована для идентификации орто-мета-пара-замещения кольца. Орто-связь является самой сильной при 15 Гц, мета-связь следует за ней со средней частотой 2 Гц, и, наконец, пара-связь обычно незначительна для исследований.
Более тонкие эффекты могут возникать, если химически эквивалентные спины (т. е. ядра, связанные симметрией и, таким образом, имеющие одинаковую частоту ЯМР) имеют различные связи с внешними спинами. Спины, которые химически эквивалентны, но не являются неразличимыми (на основе их связей), называются магнитно неэквивалентными. Например, сайты 4 H 1,2-дихлорбензола делятся на две химически эквивалентные пары по симметрии, но отдельный член одной из пар имеет различные связи со спинами, составляющими другую пару.
Магнитная неэквивалентность может привести к очень сложным спектрам, которые можно проанализировать только с помощью вычислительного моделирования. Такие эффекты чаще встречаются в спектрах ЯМР ароматических и других негибких систем, в то время как конформационное усреднение по связям C−C в гибких молекулах имеет тенденцию выравнивать связи между протонами на соседних атомах углерода, уменьшая проблемы с магнитной неэквивалентностью.
Корреляционная спектроскопия является одним из нескольких типов двумерной ядерной магнитно-резонансной (ЯМР) спектроскопии или 2D-ЯМР . Этот тип эксперимента ЯМР наиболее известен по его аббревиатуре COSY . Другие типы двумерного ЯМР включают J-спектроскопию, обменную спектроскопию (EXSY), спектроскопию ядерного эффекта Оверхаузера (NOESY), полную корреляционную спектроскопию (TOCSY) и эксперименты по гетероядерной корреляции, такие как HSQC , HMQC и HMBC . В корреляционной спектроскопии эмиссия центрирована на пике отдельного ядра; если его магнитное поле коррелирует с другим ядром посредством сквозной связи (COSY, HSQC и т. д.) или сквозной пространственной связи (NOE), отклик также может быть обнаружен на частоте коррелированного ядра. Двумерные спектры ЯМР предоставляют больше информации о молекуле, чем одномерные спектры ЯМР, и особенно полезны для определения структуры молекулы , особенно для молекул, которые слишком сложны для работы с использованием одномерного ЯМР. Первый двумерный эксперимент, COSY, был предложен Жаном Дженером, профессором Свободного университета Брюсселя, в 1971 году. [24] [25] Этот эксперимент был позже реализован Уолтером П. Ауэ, Энрико Бартольди и Ричардом Р. Эрнстом , которые опубликовали свою работу в 1976 году. [26]

Различные физические обстоятельства не позволяют изучать молекулы в растворе, и в то же время не позволяют использовать другие спектроскопические методы на атомном уровне. В твердофазных средах, таких как кристаллы, микрокристаллические порошки, гели, анизотропные растворы и т. д., именно дипольная связь и анизотропия химического сдвига становятся доминирующими в поведении ядерных спиновых систем. В обычной спектроскопии ЯМР в растворе эти дополнительные взаимодействия привели бы к значительному уширению спектральных линий. Различные методы позволяют устанавливать условия высокого разрешения, которые могут, по крайней мере для спектров 13 C, быть сопоставимыми со спектрами ЯМР в растворе.
Две важные концепции для твердотельной ЯМР-спектроскопии высокого разрешения — это ограничение возможной ориентации молекул ориентацией образца и уменьшение анизотропных ядерных магнитных взаимодействий вращением образца. Из последнего подхода быстрое вращение вокруг магического угла является очень заметным методом, когда система включает ядра со спином 1/2. Используются скорости вращения около 20 кГц, что требует специального оборудования. В настоящее время [ когда? ] в ЯМР-спектроскопии используется ряд промежуточных методов с образцами частичного выравнивания или пониженной подвижности. [ необходима цитата ]
Приложения, в которых происходят эффекты твердотельного ЯМР, часто связаны со структурными исследованиями мембранных белков, белковых фибрилл или всех видов полимеров, а также химическим анализом в неорганической химии, но также включают «экзотические» приложения, такие как листья растений и топливные элементы. Например, Рахмани и др. изучали влияние давления и температуры на самосборку бицеллярных структур с использованием спектроскопии ЯМР дейтерия. [28]
Большая часть инноваций в ЯМР-спектроскопии была в области ЯМР -спектроскопии белков, важного метода в структурной биологии . Общей целью этих исследований является получение 3-мерных структур белка с высоким разрешением, подобных тем, что можно получить с помощью рентгеновской кристаллографии . В отличие от рентгеновской кристаллографии, ЯМР-спектроскопия обычно ограничивается белками с массой менее 35 кДа , хотя были решены и более крупные структуры. ЯМР-спектроскопия часто является единственным способом получения информации с высоким разрешением о частично или полностью неструктурированных белках . В настоящее время это распространенный инструмент для определения соотношений конформации и активности , когда структура до и после взаимодействия, например, с кандидатом на лекарственное средство сравнивается с его известной биохимической активностью. Белки на порядки больше, чем небольшие органические молекулы, обсуждавшиеся ранее в этой статье, но основные методы ЯМР и некоторая теория ЯМР также применимы. Из-за гораздо большего количества атомов, присутствующих в молекуле белка по сравнению с небольшим органическим соединением, основные одномерные спектры становятся переполненными перекрывающимися сигналами до такой степени, что прямой спектральный анализ становится невозможным. Поэтому были разработаны многомерные (2, 3 или 4D) эксперименты для решения этой проблемы. Для облегчения этих экспериментов желательно изотопно пометить белок 13 C и 15 N , поскольку преобладающий природный изотоп 12 C не является ЯМР-активным, а ядерный квадрупольный момент преобладающего природного изотопа 14 N не позволяет получить информацию с высоким разрешением из этого изотопа азота. Самый важный метод, используемый для определения структуры белков, использует эксперименты NOE для измерения расстояний между атомами внутри молекулы. Впоследствии полученные расстояния используются для создания трехмерной структуры молекулы путем решения задачи геометрии расстояний . ЯМР также можно использовать для получения информации о динамике и конформационной гибкости различных областей белка.
ЯМР нуклеиновых кислот — это использование ЯМР-спектроскопии для получения информации о структуре и динамике полинуклеиновых кислот , таких как ДНК или РНК . По состоянию на 2003 год [обновлять], почти половина всех известных структур РНК была определена с помощью ЯМР-спектроскопии. [29]
Спектроскопия ЯМР нуклеиновых кислот и белков похожа, но существуют различия. Нуклеиновые кислоты имеют меньший процент атомов водорода, которые являются атомами, обычно наблюдаемыми в спектроскопии ЯМР, и поскольку двойные спирали нуклеиновых кислот жесткие и приблизительно линейные, они не складываются сами на себя, чтобы дать «дальнобойные» корреляции. [30] Типы ЯМР, обычно проводимые с нуклеиновыми кислотами, это 1 H или протонный ЯМР , 13 C ЯМР , 15 N ЯМР и 31 P ЯМР . Почти всегда используются двумерные методы ЯМР , такие как корреляционная спектроскопия (COSY) и спектроскопия переноса полной когерентности (TOCSY) для обнаружения ядерных связей через связь, и ядерная спектроскопия эффекта Оверхаузера (NOESY) для обнаружения связей между ядрами, которые находятся близко друг к другу в пространстве. [31]
Параметры, взятые из спектра, в основном перекрестные пики NOESY и константы связи , могут быть использованы для определения локальных структурных особенностей, таких как углы гликозидных связей , двугранные углы (с использованием уравнения Карплуса ) и конформации сахарной складки. Для крупномасштабной структуры эти локальные параметры должны быть дополнены другими структурными предположениями или моделями, поскольку ошибки накапливаются по мере прохождения двойной спирали, и в отличие от белков, двойная спираль не имеет компактной внутренней части и не сворачивается сама на себя. ЯМР также полезен для исследования нестандартных геометрий, таких как изогнутые спирали , не-Уотсон-Криковское спаривание оснований и коаксиальное укладывание . Он был особенно полезен при исследовании структуры природных олигонуклеотидов РНК, которые имеют тенденцию принимать сложные конформации, такие как стебель-петля и псевдоузлы . ЯМР также полезен для исследования связывания молекул нуклеиновых кислот с другими молекулами, такими как белки или лекарственные препараты, путем наблюдения за тем, какие резонансы смещаются при связывании другой молекулы. [31]
Спектроскопия ЯМР углеводов рассматривает вопросы структуры и конформации углеводов . Анализ углеводов методом ЯМР 1H является сложным из-за ограниченного разнообразия функциональных групп, что приводит к резонансам 1H, сконцентрированным в узких полосах спектра ЯМР. Другими словами, наблюдается плохая спектральная дисперсия. Аномерные протонные резонансы отделены от других из-за того, что аномерные атомы углерода несут два атома кислорода. Для более мелких углеводов дисперсия аномерных протонных резонансов облегчает использование экспериментов 1D TOCSY для исследования целых спиновых систем отдельных углеводных остатков.
Знание энергетических минимумов и вращательных энергетических барьеров малых молекул в растворе можно получить с помощью ЯМР, например, рассматривая конформационные предпочтения свободных лигандов и конформационную динамику соответственно. Это может быть использовано для руководства гипотезами дизайна лекарств, поскольку экспериментальные и расчетные значения сопоставимы. Например, AstraZeneca использует ЯМР для своих исследований и разработок в области онкологии. [32]
Одной из первых научных работ, посвященных использованию давления как переменного параметра в экспериментах ЯМР, стала работа Дж. Джонаса, опубликованная в журнале Annual Review of Biophysics в 1994 году. [33] Использование высоких давлений в спектроскопии ЯМР было обусловлено прежде всего стремлением изучать биохимические системы, где использование высокого давления позволяет осуществлять контролируемые изменения межмолекулярных взаимодействий без существенных возмущений.
Конечно, были предприняты попытки решения научных задач с использованием ЯМР-спектроскопии высокого давления. Однако большинство из них было трудно воспроизводимо из-за проблемы оборудования для создания и поддержания высокого давления. В [34] [35] [36] приведены наиболее распространенные типы ЯМР-ячеек для реализации экспериментов ЯМР высокого давления. [ необходимо разъяснение ]
Спектроскопия ЯМР высокого давления широко используется для различных приложений, в основном связанных с характеристикой структуры молекул белков. [37] [38] Однако в последние годы были предложены программные и конструкторские решения для характеристики химических и пространственных структур малых молекул в сверхкритической флюидной среде, [39] используя параметры состояния в качестве движущей силы таких изменений. [40]
Связанные методы ядерной спектроскопии :