Streptococcus — род грамположительныхили сферических бактерий, принадлежащих к семейству Streptococcaceae , в порядке Lactobacillales (молочнокислые бактерии), в типе Bacillota . [2] Деление клеток у стрептококков происходит вдоль одной оси , поэтому при росте они имеют тенденцию образовывать пары или цепочки, которые могут казаться изогнутыми или скрученными. Это отличается от стафилококков , которые делятся вдоль нескольких осей, тем самым образуя нерегулярные, похожие на виноград скопления клеток . Большинство стрептококков являются оксидазоотрицательными и каталазоотрицательными , и многие являются факультативными анаэробами (способными расти как аэробно, так и анаэробно).
Термин был придуман в 1877 году венским хирургом Альбертом Теодором Бильротом (1829–1894) [3] путем объединения префикса «strepto-» (от др.-греч . στρεπτός , латинизированного : streptós , букв. «легко скручиваемый, гибкий» [4] ) вместе с суффиксом «-coccus» (от современного латинского : coccus , от др.-греч. κόκκος , латинизированного: kókkos , букв. «зерно, семя, ягода» [5] ). В 1984 году многие бактерии, ранее сгруппированные в род Streptococcus, были разделены на роды Enterococcus и Lactococcus . [6] В настоящее время в этом роде признано более 50 видов. Было обнаружено, что этот род является частью микробиома слюны . [7]
Помимо стрептококкового фарингита (ангины), некоторые виды стрептококков ответственны за многие случаи конъюнктивита , [ 8] менингита , бактериальной пневмонии , эндокардита , рожистого воспаления и некротизирующего фасциита (бактериальных инфекций, поедающих плоть). Однако многие виды стрептококков не являются патогенными и входят в состав комменсальной человеческой микробиоты рта , кожи, кишечника и верхних дыхательных путей. Стрептококки также являются необходимым ингредиентом при производстве сыра Эмменталь («швейцарский») . [9]
Виды стрептококков классифицируются на основе их гемолитических свойств. [10] Альфа-гемолитические виды вызывают окисление железа в молекулах гемоглобина в эритроцитах, придавая им зеленоватый цвет на кровяном агаре. Бета-гемолитические виды вызывают полный разрыв эритроцитов. На кровяном агаре это выглядит как широкие области, свободные от кровяных клеток, окружающие бактериальные колонии. Гамма-гемолитические виды не вызывают гемолиза. [11]
Бета-гемолитические стрептококки далее классифицируются по группировке Лэнсфилда , классификации серотипов (то есть, описывающей определенные углеводы, присутствующие на клеточной стенке бактерий). [6] 21 описанный серотип названы группами Лэнсфилда от A до W (исключая E, I и J). Эта система классификации была разработана Ребеккой Лэнсфилд , ученым из Рокфеллеровского университета . [12]
В медицинской практике наиболее важными группами являются альфа-гемолитические стрептококки групп S. pneumoniae и Streptococcus viridans , а также бета-гемолитические стрептококки групп Лэнсфилда A и B (также известные как «стрептококки группы A» и «стрептококки группы B»).
Таблица: Медицински значимые стрептококки [10]
При наличии альфа-гемолиза (α-гемолиз) агар под колонией будет выглядеть темным и зеленоватым из-за преобразования гемоглобина в зеленый биливердин . Streptococcus pneumoniae и группа оральных стрептококков ( Streptococcus viridans или viridans streptococci) демонстрируют альфа-гемолиз. Альфа-гемолиз также называется неполным гемолизом или частичным гемолизом, поскольку клеточные мембраны эритроцитов остаются нетронутыми. Иногда это также называют зеленым гемолизом из-за изменения цвета агара. [ необходима цитата ]
Бета-гемолиз (β-гемолиз), иногда называемый полным гемолизом , представляет собой полный лизис эритроцитов в среде вокруг и под колониями: область выглядит светлой (желтой) и прозрачной. Стрептолизин, экзотоксин, представляет собой фермент, вырабатываемый бактериями, который вызывает полный лизис эритроцитов. Существует два типа стрептолизина: стрептолизин O (SLO) и стрептолизин S (SLS). Стрептолизин O представляет собой чувствительный к кислороду цитотоксин, секретируемый большинством стрептококков группы A (GAS), и взаимодействует с холестерином в мембране эукариотических клеток (в основном эритроцитов и лейкоцитов, макрофагов и тромбоцитов) и обычно приводит к бета-гемолизу под поверхностью кровяного агара. Стрептолизин S представляет собой стабильный к кислороду цитотоксин, также вырабатываемый большинством штаммов GAS, что приводит к просветлению поверхности кровяного агара. SLS влияет на иммунные клетки, включая полиморфноядерные лейкоциты и лимфоциты, и, как полагают, не дает иммунной системе хозяина очиститься от инфекции. Streptococcus pyogenes , или GAS, демонстрирует бета-гемолиз.
Некоторые слабо бета-гемолитические виды вызывают интенсивный гемолиз при совместном выращивании со штаммом Staphylococcus . Это называется тестом CAMP . Streptococcus agalactiae демонстрирует это свойство. Clostridium perfringens можно предположительно идентифицировать с помощью этого теста. Listeria monocytogenes также положительна на агаре из овечьей крови.

Группа A S. pyogenes является возбудителем широкого спектра стрептококковых инфекций группы A (GAS). Эти инфекции могут быть неинвазивными или инвазивными. Неинвазивные инфекции, как правило, более распространены и менее серьезны. Наиболее распространенными из этих инфекций являются стрептококковый фарингит (ангина) и импетиго . [13] Скарлатина является еще одним примером неинвазивной инфекции группы A.
Инвазивные инфекции, вызванные бета-гемолитическими стрептококками группы А, как правило, более тяжелые и менее распространенные. Это происходит, когда бактерия способна инфицировать области, где она обычно не встречается, такие как кровь и органы . [14] Заболевания, которые могут быть вызваны, включают синдром стрептококкового токсического шока , некротизирующий фасциит , пневмонию и бактериемию . [13] По оценкам, во всем мире GAS ежегодно становится причиной более 500 000 смертей, что делает его одним из ведущих патогенов в мире . [13]
Дополнительные осложнения могут быть вызваны GAS, а именно острой ревматической лихорадкой и острым гломерулонефритом . Ревматическая лихорадка , заболевание, которое поражает суставы , почки и сердечные клапаны , является следствием нелеченной инфекции стрептококка А, вызванной не самой бактерией, а антителами, вырабатываемыми иммунной системой для борьбы с инфекцией, перекрестно реагирующими с другими белками в организме. Эта «перекрестная реакция» заставляет организм по сути атаковать себя и приводит к указанному выше повреждению. Предполагается, что аналогичный аутоиммунный механизм, инициируемый инфекцией бета-гемолитического стрептококка группы А (GABHS), вызывает детские аутоиммунные нейропсихиатрические расстройства, связанные со стрептококковыми инфекциями (PANDAS) , при которых аутоиммунные антитела поражают базальные ганглии, вызывая быстрое возникновение психиатрических, двигательных, сонливых и других симптомов у детей.
Инфекция GAS обычно диагностируется с помощью быстрого теста на стрептококк или посева.
S. agalactiae , или стрептококк группы B, GBS , вызывает пневмонию и менингит у новорожденных и пожилых людей , а также иногда системную бактериемию . Важно отметить, что Streptococcus agalactiae является наиболее распространенной причиной менингита у младенцев в возрасте от одного до трех месяцев. Они также могут колонизировать кишечник и женский репродуктивный тракт, увеличивая риск преждевременного разрыва плодных оболочек во время беременности и передачи микроорганизма младенцу. Американский колледж акушеров и гинекологов , Американская академия педиатрии и Центры по контролю и профилактике заболеваний рекомендуют всем беременным женщинам в возрасте от 35 до 37 недель беременности проходить тестирование на GBS. Женщинам, у которых результаты теста положительные, следует назначать профилактические антибиотики во время родов, что обычно предотвращает передачу инфекции младенцу. [15] Полисахаридные вакцины группы III доказали свою эффективность в предотвращении передачи GBS от матери к младенцу. [16]
Соединенное Королевство решило принять протокол, основанный на факторах риска, а не протокол, основанный на культуре, который используется в США. [17] Текущие рекомендации гласят, что если присутствует один или несколько из следующих факторов риска, то женщину следует лечить антибиотиками во время родов :
Этот протокол приводит к введению антибиотиков во время родов 15–20% беременных женщин и предотвращению 65–70% случаев раннего сепсиса, вызванного синдромом Гийена–Барре. [18]
Эта группа включает S. equi , который вызывает удушье у лошадей, [19] и S. zooepidemicus — S. equi является клональным потомком или биоваром предкового S. zooepidemicus — который вызывает инфекции у нескольких видов млекопитающих, включая крупный рогатый скот и лошадей. S. dysgalactiae подвид. dysgalactiae [20] также является членом группы C, бета-гемолитических стрептококков , которые могут вызывать фарингит и другие гнойные инфекции, подобные стрептококкам группы A. Бактерии стрептококка группы C считаются зоонозными патогенами, то есть инфекция может передаваться от животного к человеку. [21]
Многие бывшие стрептококки группы D были переклассифицированы и помещены в род Enterococcus (включая E. faecalis , E. faecium , E. durans и E. avium ). [22] Например, Streptococcus faecalis теперь называется Enterococcus faecalis . E. faecalis иногда является альфа-гемолитическим, а E. faecium иногда является бета-гемолитическим. [23]
Остальные штаммы неэнтерококковой группы D включают Streptococcus gallolyticus , Streptococcus bovis , Streptococcus equinus и Streptococcus suis .
Негемолитические стрептококки редко вызывают заболевания. Однако слабогемолитические бета-гемолитические стрептококки группы D и Listeria monocytogenes (которая на самом деле является грамположительной палочкой) не следует путать с негемолитическими стрептококками.
Стрептококки группы F были впервые описаны в 1934 году Лонгом и Блиссом среди «мельчайших гемолитических стрептококков». [24] Они также известны как Streptococcus anginosus (согласно системе классификации Лэнсфилда) или как члены группы S. milleri (согласно европейской системе).
Эти стрептококки обычно, но не исключительно, являются бета-гемолитическими. Streptococcus dysgalactiae subsp. canis [20] является преобладающим встречающимся подвидом. Это особенно распространенный GGS у людей, хотя обычно он встречается у животных. S. phocae является подвидом GGS, который был обнаружен у морских млекопитающих и морских рыб. У морских млекопитающих он в основном связан с менингоэнцефалитом , сепсисом и эндокардитом , но также связан со многими другими патологиями. Его экологический резервуар и пути передачи у морских млекопитающих недостаточно изучены. Стрептококки группы G также считаются зоонозными патогенами.
Стрептококки группы H вызывают инфекции у собак среднего размера. Стрептококки группы H редко вызывают заболевания у людей, если только человек не контактирует напрямую с пастью собаки. Один из наиболее распространенных способов передачи — это контакт от человека к собаке, рот в рот. Однако собака может лизнуть руку человека, и инфекция также может распространиться. [25]
В клинической практике наиболее распространенные группы стрептококков можно различить с помощью простых лабораторных тестов, таких как тест PYR для стрептококков группы А. Существуют также наборы для латексной агглютинации, которые позволяют различить каждую из основных групп, встречающихся в клинической практике.
Стрептококковые инфекции можно лечить антибиотиками из группы пенициллинов . Чаще всего для лечения стрептококковой инфекции используют пенициллин или амоксициллин. Эти антибиотики действуют, нарушая выработку пептидогликана в клеточной стенке. [26] Лечение чаще всего проводится в виде 10-дневного цикла приема пероральных антибиотиков. Для пациентов с аллергией на пенициллин и страдающих кожными инфекциями можно использовать клиндамицин. Клиндамицин действует, нарушая синтез белка внутри клетки.

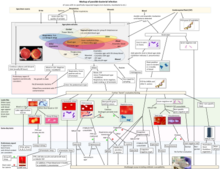
Стрептококки были разделены на шесть групп на основе их последовательностей 16S рДНК: S. anginosus, S. gallolyticus, S. mitis, S. mutans, S. pyogenes и S. salivarius . [28] Группы 16S были подтверждены с помощью секвенирования всего генома (см. рисунок). Важные патогены S. pneumoniae и S. pyogenes относятся к группам S. mitis и S. pyogenes соответственно, [29] в то время как возбудитель кариеса зубов , Streptococcus mutans , является базальным по отношению к группе Streptococcus .

Недавние технологические достижения привели к увеличению количества доступных последовательностей генома для видов Streptococcus , что позволяет проводить более надежные и достоверные филогенетические и сравнительные геномные анализы. [30] В 2018 году эволюционные связи внутри Streptococcus были повторно изучены Пателем и Гуптой посредством анализа комплексных филогенетических деревьев , построенных на основе четырех различных наборов данных белков, и идентификации 134 высокоспецифичных молекулярных сигнатур (в форме консервативных сигнатурных инделей ), которые являются общими исключительно для всего рода или его отдельных подкладов. [30]
Результаты выявили наличие двух основных кладов на самом высоком уровне в Streptococcus , названных кладами "Mitis-Suis" и "Pyogenes-Equinus-Mutans". [30] Основная клада "Mitis-Suis" включает в себя субклад Suis и кладу Mitis, которая охватывает субклады Angiosus, Pneumoniae, Gordonii и Parasanguinis. Вторая основная клада, "Pyogenes-Equinus-Mutans", включает в себя субклады Pyogenes, Mutans, Salivarius, Equinus, Sobrinus, Halotolerans, Porci, Entericus и Orisratti. Всего в роде Streptococcus было идентифицировано 14 отдельных подкладов , каждый из которых подтверждается надежными схемами ветвления в филогенетических деревьях и наличием множественных консервативных сигнатурных инделей в различных белках, которые являются отличительными характеристиками членов этих 14 подкладов. [30] Сводная диаграмма, показывающая общие взаимоотношения между Streptococcus , основанная на этих исследованиях, изображена на рисунке на этой странице.

Геномы сотен видов были секвенированы. [32] Большинство геномов Streptococcus имеют размер от 1,8 до 2,3 Мб и кодируют от 1700 до 2300 белков. Некоторые важные геномы перечислены в таблице. [33] Четыре вида, показанные в таблице ( S. pyogenes, S. agalactiae, S. pneumoniae и S. mutans ), имеют среднюю попарную идентичность белковых последовательностей около 70%. [33]
Бактериофаги были описаны для многих видов Streptococcus . 18 профагов были описаны в S. pneumoniae , размер которых варьируется от 38 до 41 кб, кодируя от 42 до 66 генов каждый. [34] Некоторые из первых обнаруженных фагов Streptococcus были Dp-1 [35] [36] и ω1 (псевдоним ω-1). [37] [38] [39] В 1981 году было открыто семейство Cp (Complutense phage 1, официально Streptococcus virus Cp1 , Picovirinae ), первым членом которого был Cp-1. [40] Dp-1 и Cp-1 инфицируют как S. pneumoniae , так и S. mitis . [41] Однако диапазоны хозяев большинства фагов Streptococcus не были исследованы систематически.
Естественная генетическая трансформация включает перенос ДНК от одной бактерии к другой через окружающую среду. Трансформация — сложный процесс, зависящий от экспрессии многочисленных генов. Чтобы быть способной к трансформации, бактерия должна войти в особое физиологическое состояние, называемое компетентностью . S. pneumoniae , S. mitis и S. oralis могут стать компетентными и в результате активно приобретать гомологичную ДНК для трансформации с помощью хищного братоубийственного механизма [42]. Этот братоубийственный механизм в основном использует некомпетентных братьев и сестер, присутствующих в той же нише [43]. Среди высококомпетентных изолятов S. pneumoniae Ли и др. [44] показали, что приспособленность к назальной колонизации и вирулентность (легочная инфекционность) зависят от неповрежденной системы компетентности. Компетентность может позволить стрептококковому патогену использовать внешнюю гомологичную ДНК для рекомбинационного восстановления повреждений ДНК, вызванных окислительной атакой хозяина. [45]