Термодинамика — раздел физики , изучающий тепло , работу и температуру , а также их связь с энергией , энтропией и физическими свойствами материи и излучения . Поведение этих величин регулируется четырьмя законами термодинамики , которые дают количественное описание с использованием измеримых макроскопических физических величин , но могут быть объяснены в терминах микроскопических составляющих статистической механикой . Термодинамика применима к широкому кругу тем в науке и технике , особенно к физической химии , биохимии , химической технологии и машиностроению , а также к другим сложным областям, таким как метеорология .
Исторически термодинамика развивалась из желания повысить эффективность ранних паровых двигателей , в частности, благодаря работам французского физика Сади Карно (1824), который считал, что эффективность двигателя является ключом, который может помочь Франции выиграть Наполеоновские войны . [1] Шотландско-ирландский физик лорд Кельвин был первым, кто сформулировал краткое определение термодинамики в 1854 году [2], которое гласило: «Термодинамика является предметом отношения тепла к силам, действующим между смежными частями тел, и отношения тепла к электрическому агенту». Немецкий физик и математик Рудольф Клаузиус переформулировал принцип Карно, известный как цикл Карно , и дал теории тепла более верную и надежную основу. Его самая важная работа «О движущей силе тепла» [3] , опубликованная в 1850 году, впервые сформулировала второй закон термодинамики . В 1865 году он ввел понятие энтропии. В 1870 году он ввел теорему вириала , которая применялась к теплу. [4]
Первоначальное применение термодинамики к механическим тепловым двигателям было быстро распространено на изучение химических соединений и химических реакций. Химическая термодинамика изучает природу роли энтропии в процессе химических реакций и обеспечила большую часть расширения и знаний в этой области. Появились другие формулировки термодинамики. Статистическая термодинамика , или статистическая механика, занимается статистическими предсказаниями коллективного движения частиц из их микроскопического поведения. В 1909 году Константин Каратеодори представил чисто математический подход в аксиоматической формулировке, описание, часто называемое геометрической термодинамикой .
Описание любой термодинамической системы использует четыре закона термодинамики , которые формируют аксиоматическую основу. Первый закон определяет, что энергия может передаваться между физическими системами как тепло , как работа и с переносом материи. [5] Второй закон определяет существование величины, называемой энтропией , которая описывает направление, термодинамически, в котором система может развиваться, и количественно определяет состояние порядка системы, и которая может быть использована для количественной оценки полезной работы, которая может быть извлечена из системы. [6]
В термодинамике изучаются и классифицируются взаимодействия между большими ансамблями объектов. Центральными здесь являются концепции термодинамической системы и ее окружения . Система состоит из частиц, чьи средние движения определяют ее свойства, и эти свойства, в свою очередь, связаны друг с другом через уравнения состояния . Свойства можно комбинировать для выражения внутренней энергии и термодинамических потенциалов , которые полезны для определения условий равновесия и спонтанных процессов .
С помощью этих инструментов термодинамика может быть использована для описания того, как системы реагируют на изменения в окружающей среде. Это может быть применено к широкому кругу тем в науке и технике , таких как двигатели , фазовые переходы , химические реакции , явления переноса и даже черные дыры . Результаты термодинамики имеют важное значение для других областей физики и для химии , химической инженерии , коррозионной инженерии , аэрокосмической техники , машиностроения , клеточной биологии , биомедицинской инженерии , материаловедения и экономики , и это лишь некоторые из них. [7] [8]
В этой статье основное внимание уделяется классической термодинамике, которая в первую очередь изучает системы в термодинамическом равновесии . Неравновесная термодинамика часто рассматривается как расширение классической трактовки, но статистическая механика принесла много достижений в эту область.

История термодинамики как научной дисциплины обычно начинается с Отто фон Герике , который в 1650 году построил и спроектировал первый в мире вакуумный насос и продемонстрировал вакуум, используя свои магдебургские полушария . Герике был вынужден создать вакуум, чтобы опровергнуть давнее предположение Аристотеля о том, что «природа не терпит пустоты». Вскоре после Герике англо-ирландский физик и химик Роберт Бойль узнал о разработках Герике и в 1656 году совместно с английским ученым Робертом Гуком построил воздушный насос. [10] Используя этот насос, Бойль и Гук заметили корреляцию между давлением , температурой и объемом . Со временем был сформулирован закон Бойля , который гласит, что давление и объем обратно пропорциональны . Затем, в 1679 году, на основе этих концепций коллега Бойля по имени Дени Папен построил паровой котел , представлявший собой закрытый сосуд с плотно прилегающей крышкой, которая удерживала пар до тех пор, пока не создавалось высокое давление.
В более поздних конструкциях был реализован паровой выпускной клапан, который не давал машине взорваться. Наблюдая за тем, как клапан ритмично двигался вверх и вниз, Папен задумал идею поршневого и цилиндрового двигателя. Однако он не довел свой проект до конца. Тем не менее, в 1697 году на основе проектов Папена инженер Томас Савери построил первый двигатель, а в 1712 году за ним последовал Томас Ньюкомен . Хотя эти ранние двигатели были грубыми и неэффективными, они привлекли внимание ведущих ученых того времени.
Фундаментальные концепции теплоемкости и скрытой теплоты , которые были необходимы для развития термодинамики, были разработаны профессором Джозефом Блэком в Университете Глазго, где Джеймс Уатт работал изготовителем инструментов. Блэк и Уатт проводили эксперименты вместе, но именно Уатт придумал идею внешнего конденсатора , которая привела к значительному увеличению эффективности паровой машины . [11] Опираясь на все предыдущие работы, Сади Карно , «отец термодинамики», опубликовал «Размышления о движущей силе огня » (1824), рассуждение о тепле, мощности, энергии и эффективности двигателя. В книге были изложены основные энергетические соотношения между двигателем Карно , циклом Карно и движущей силой. Она ознаменовала начало термодинамики как современной науки. [12]
Первый учебник по термодинамике был написан в 1859 году Уильямом Рэнкином , изначально получившим образование физика и профессором гражданского и машиностроительного машиностроения в Университете Глазго . [13] Первый и второй законы термодинамики появились одновременно в 1850-х годах, в основном из работ Уильяма Рэнкина, Рудольфа Клаузиуса и Уильяма Томсона (лорда Кельвина). Основы статистической термодинамики были изложены такими физиками, как Джеймс Клерк Максвелл , Людвиг Больцман , Макс Планк , Рудольф Клаузиус и Дж. Уиллард Гиббс .
Клаузиус, впервые изложивший основные идеи второго закона в своей работе «О движущей силе тепла» [3] , опубликованной в 1850 году, и которого называют «одним из отцов-основателей термодинамики» [14] , ввел понятие энтропии в 1865 году.
В 1873–1876 годах американский физик-математик Джозайя Уиллард Гиббс опубликовал серию из трех статей, наиболее известной из которых была « О равновесии гетерогенных веществ » [15], в которой он показал, как термодинамические процессы , включая химические реакции , можно графически проанализировать, изучая энергию , энтропию , объем , температуру и давление термодинамической системы таким образом, что можно определить, будет ли процесс происходить самопроизвольно. [16] Также Пьер Дюгем в 19 веке писал о химической термодинамике. [17] В начале 20 века такие химики, как Гилберт Н. Льюис , Мерл Рэндалл [ 18] и Э. А. Гуггенхайм [19] [20] применили математические методы Гиббса к анализу химических процессов.
Термодинамика имеет сложную этимологию. [21]
Поверхностный анализ показывает, что слово состоит из двух частей, которые можно проследить до древнегреческого. Во-первых, thermo- («тепла»; используется в таких словах, как термометр ) можно проследить до корня θέρμη therme , что означает «тепло». Во-вторых, слово dynamics («наука о силе [или мощи]») [22] можно проследить до корня δύναμις dynamis , что означает «мощь». [23]
В 1849 году Уильям Томсон использовал прилагательное термодинамический . [24] [25]
В 1854 году Томсон и Уильям Ренкин использовали существительное «термодинамика» для обозначения науки об обобщенных тепловых двигателях. [25] [21]
Пьер Перро утверждает, что термин «термодинамика» был придуман Джеймсом Джоулем в 1858 году для обозначения науки об отношениях между теплом и мощностью, [12] однако Джоуль никогда не использовал этот термин, а вместо этого использовал термин « совершенный термодинамический двигатель» в отношении фразеологии Томсона 1849 года [24] . [21]
Изучение термодинамических систем развилось в несколько взаимосвязанных направлений, каждое из которых использует отдельную фундаментальную модель в качестве теоретической или экспериментальной основы или применяет принципы к различным типам систем.
Классическая термодинамика — это описание состояний термодинамических систем, близких к равновесию, которое использует макроскопические, измеримые свойства. Она используется для моделирования обмена энергией, работой и теплом на основе законов термодинамики . Квалификатор «классический» отражает тот факт, что он представляет собой первый уровень понимания предмета, который развивался в 19 веке, и описывает изменения системы в терминах макроскопических эмпирических (крупномасштабных и измеримых) параметров. Микроскопическая интерпретация этих концепций была позже предоставлена развитием статистической механики .
Статистическая механика , также известная как статистическая термодинамика, возникла с развитием атомных и молекулярных теорий в конце 19-го и начале 20-го века и дополнила классическую термодинамику интерпретацией микроскопических взаимодействий между отдельными частицами или квантово-механическими состояниями. Эта область связывает микроскопические свойства отдельных атомов и молекул с макроскопическими, объемными свойствами материалов, которые можно наблюдать в масштабах человека, тем самым объясняя классическую термодинамику как естественный результат статистики, классической механики и квантовой теории на микроскопическом уровне.
Химическая термодинамика — это изучение взаимосвязи энергии с химическими реакциями или с физическим изменением состояния в рамках законов термодинамики . Основной целью химической термодинамики является определение спонтанности данного превращения. [26]
Равновесная термодинамика — это изучение переносов материи и энергии в системах или телах, которые под воздействием факторов в их окружении могут быть переведены из одного состояния термодинамического равновесия в другое. Термин «термодинамическое равновесие» указывает на состояние равновесия, в котором все макроскопические потоки равны нулю; в случае простейших систем или тел их интенсивные свойства однородны, а их давления перпендикулярны их границам. В состоянии равновесия нет неуравновешенных потенциалов или движущих сил между макроскопически различными частями системы. Центральной целью равновесной термодинамики является: при наличии системы в четко определенном начальном равновесном состоянии, а также при наличии ее окружения и при наличии ее конститутивных стенок вычислить, каким будет конечное равновесное состояние системы после того, как указанная термодинамическая операция изменит ее стенки или окружение.
Неравновесная термодинамика — это раздел термодинамики, который занимается системами, которые не находятся в термодинамическом равновесии . Большинство систем, встречающихся в природе, не находятся в термодинамическом равновесии, поскольку они не находятся в стационарных состояниях и непрерывно и прерывисто подвергаются потоку материи и энергии в другие системы и из них. Термодинамическое исследование неравновесных систем требует более общих концепций, чем те, с которыми имеет дело равновесная термодинамика. [27] Многие природные системы до сих пор остаются за пределами сферы действия известных в настоящее время макроскопических термодинамических методов.
.jpg/440px-Carnot_engine_(hot_body_-_working_body_-_cold_body).jpg)
Термодинамика в основном основана на наборе из четырех законов, которые являются универсально действительными, когда применяются к системам, которые попадают в ограничения, подразумеваемые каждым из них. В различных теоретических описаниях термодинамики эти законы могут быть выражены в, казалось бы, различных формах, но наиболее известными формулировками являются следующие.
Нулевой закон термодинамики гласит: если две системы находятся в тепловом равновесии с третьей, то они также находятся в тепловом равновесии друг с другом.
Это утверждение подразумевает, что тепловое равновесие является отношением эквивалентности на множестве рассматриваемых термодинамических систем . Системы считаются находящимися в равновесии, если небольшие случайные обмены между ними (например, броуновское движение ) не приводят к чистому изменению энергии. Этот закон молчаливо предполагается при каждом измерении температуры. Таким образом, если кто-то пытается решить, находятся ли два тела при одинаковой температуре , нет необходимости приводить их в соприкосновение и измерять какие-либо изменения их наблюдаемых свойств во времени. [28] Закон дает эмпирическое определение температуры и обоснование для построения практических термометров.
Нулевой закон изначально не был признан отдельным законом термодинамики, поскольку его основа в термодинамическом равновесии подразумевалась в других законах. Первый, второй и третий законы были уже явно сформулированы и нашли общее признание в физическом сообществе до того, как была осознана важность нулевого закона для определения температуры. Поскольку было непрактично перенумеровывать другие законы, он был назван нулевым законом .

Первый закон термодинамики гласит: В процессе без переноса вещества изменение внутренней энергии термодинамической системы равно энергии, полученной в виде тепла, за вычетом термодинамической работы, произведенной системой над окружающей средой. [32] [nb 1]
где обозначает изменение внутренней энергии замкнутой системы (для которой возможны тепло или работа через границу системы, но невозможен перенос вещества), обозначает количество энергии, поставляемой системе в виде тепла, и обозначает количество термодинамической работы, выполняемой системой над своим окружением. Эквивалентное утверждение заключается в том, что вечные двигатели первого рода невозможны; работа, выполняемая системой над своим окружением, требует, чтобы внутренняя энергия системы уменьшалась или потреблялась, так что количество внутренней энергии, потерянное этой работой, должно быть восполнено в виде тепла внешним источником энергии или в виде работы внешней машины, действующей на систему (чтобы она восстанавливалась), чтобы заставить систему работать непрерывно.
Для процессов, включающих перенос вещества, необходимо дополнительное утверждение: с учетом соответствующих исходных состояний систем, когда две системы, которые могут иметь разный химический состав, изначально разделенные только непроницаемой стенкой и в остальном изолированные, объединяются в новую систему посредством термодинамической операции удаления стенки, то
где U 0 обозначает внутреннюю энергию объединенной системы, а U 1 и U 2 обозначают внутренние энергии соответствующих разделенных систем.
Адаптированный для термодинамики, этот закон является выражением принципа сохранения энергии , который гласит, что энергия может быть преобразована (изменена из одной формы в другую), но не может быть создана или уничтожена. [33]
Внутренняя энергия является основным свойством термодинамического состояния , в то время как тепло и работа являются способами передачи энергии, посредством которых процесс может изменить это состояние. Изменение внутренней энергии системы может быть достигнуто любой комбинацией добавленного или удаленного тепла и работы, выполненной системой или системой. Как функция состояния , внутренняя энергия не зависит от способа или пути через промежуточные этапы, посредством которых система пришла в свое состояние.
Традиционная версия второго закона термодинамики гласит: Тепло не может самопроизвольно переходить от более холодного тела к более горячему.
Второй закон относится к системе материи и излучения, изначально с неоднородностями температуры, давления, химического потенциала и других интенсивных свойств , которые обусловлены внутренними «ограничениями» или непроницаемыми жесткими стенками внутри нее или внешними силами. Закон отмечает, что когда система изолирована от внешнего мира и от этих сил, существует определенная термодинамическая величина, ее энтропия , которая увеличивается по мере устранения ограничений, в конечном итоге достигая максимального значения в термодинамическом равновесии, когда неоднородности практически исчезают. Для систем, которые изначально далеки от термодинамического равновесия, хотя и было предложено несколько, не известно общего физического принципа, который определяет скорости приближения к термодинамическому равновесию, и термодинамика не имеет дела с такими скоростями. Все многочисленные версии второго закона выражают общую необратимость переходов, вовлеченных в системы, приближающиеся к термодинамическому равновесию.
В макроскопической термодинамике второй закон представляет собой базовое наблюдение, применимое к любому реальному термодинамическому процессу; в статистической термодинамике второй закон постулируется как следствие молекулярного хаоса.
Третий закон термодинамики гласит: Когда температура системы приближается к абсолютному нулю, все процессы прекращаются и энтропия системы приближается к минимальному значению.
Этот закон термодинамики является статистическим законом природы относительно энтропии и невозможности достижения абсолютного нуля температуры. Этот закон дает абсолютную точку отсчета для определения энтропии. Энтропия, определенная относительно этой точки, является абсолютной энтропией. Альтернативные определения включают «энтропия всех систем и всех состояний системы наименьшая при абсолютном нуле», или, что эквивалентно, «невозможно достичь абсолютного нуля температуры никаким конечным числом процессов».
Абсолютный ноль, при котором прекратилась бы всякая деятельность, если бы его можно было достичь, составляет -273,15 °C (градусов Цельсия), или -459,67 °F (градусов Фаренгейта), или 0 K (кельвинов), или 0° R (градусов Ранкина ).
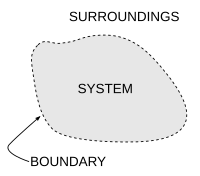
Важной концепцией в термодинамике является термодинамическая система , которая представляет собой точно определенную область изучаемой вселенной. Все во вселенной, за исключением системы, называется окружением . Система отделена от остальной части вселенной границей , которая может быть физической или воображаемой, но служит для ограничения системы конечным объемом. Сегменты границы часто описываются как стены ; они имеют соответствующие определенные «проницаемости». Передача энергии в виде работы , или тепла , или материи между системой и окружением происходит через стены в соответствии с их соответствующими проницаемостями.
Материя или энергия, которые проходят через границу, чтобы вызвать изменение внутренней энергии системы, должны быть учтены в уравнении баланса энергии. Объем, заключенный в стенках, может быть областью, окружающей один атом, резонирующий с энергией, например, как это определил Макс Планк в 1900 году; это может быть тело пара или воздуха в паровой машине , например, как это определил Сади Карно в 1824 году. Система также может состоять всего из одного нуклида (т. е. системы кварков ), как это предполагается в квантовой термодинамике . Если принять более свободную точку зрения и отказаться от требования термодинамического равновесия, система может быть телом тропического циклона , например, как это предположил Керри Эмануэль в 1986 году в области термодинамики атмосферы , или горизонтом событий черной дыры .
Границы бывают четырех типов: фиксированные, подвижные, реальные и мнимые. Например, в двигателе фиксированная граница означает, что поршень заблокирован в своем положении, в пределах которого может происходить процесс постоянного объема. Если поршню разрешено двигаться, эта граница подвижна, в то время как границы цилиндра и головки цилиндра фиксированы. Для закрытых систем границы являются реальными, тогда как для открытых систем границы часто являются мнимыми. В случае реактивного двигателя фиксированная мнимая граница может быть принята на впуске двигателя, фиксированные границы вдоль поверхности корпуса и вторая фиксированная мнимая граница поперек выхлопного сопла.
В целом термодинамика различает три класса систем, определяемых с точки зрения того, чему разрешено пересекать их границы:
С течением времени в изолированной системе внутренние различия давлений, плотностей и температур имеют тенденцию выравниваться. Система, в которой все выравнивающие процессы дошли до завершения, называется находящейся в состоянии термодинамического равновесия .
Находясь в термодинамическом равновесии, свойства системы по определению не меняются со временем. Системы в равновесии намного проще и понятнее, чем системы, которые не находятся в равновесии. Часто при анализе динамического термодинамического процесса делается упрощающее предположение, что каждое промежуточное состояние в процессе находится в равновесии, производя термодинамические процессы, которые развиваются настолько медленно, что позволяют каждому промежуточному шагу быть равновесным состоянием, и называются обратимыми процессами .
Когда система находится в равновесии при заданном наборе условий, говорят, что она находится в определенном термодинамическом состоянии . Состояние системы можно описать рядом величин состояния , которые не зависят от процесса, посредством которого система пришла в свое состояние. Они называются интенсивными переменными или экстенсивными переменными в зависимости от того, как они изменяются при изменении размера системы. Свойства системы можно описать уравнением состояния , которое определяет взаимосвязь между этими переменными. Состояние можно рассматривать как мгновенное количественное описание системы с заданным числом переменных, сохраняющихся постоянными.
Термодинамический процесс можно определить как энергетическую эволюцию термодинамической системы, переходящую от начального состояния к конечному. Его можно описать с помощью величин процесса . Обычно каждый термодинамический процесс отличается от других процессов по энергетическому характеру в соответствии с тем, какие параметры, такие как температура, давление или объем и т. д., удерживаются фиксированными; Кроме того, полезно сгруппировать эти процессы в пары, в которых каждая переменная, удерживаемая постоянной, является одним из членов сопряженной пары.
Вот несколько наиболее часто изучаемых термодинамических процессов:
Существует два типа термодинамических приборов : счетчик и резервуар. Термодинамический счетчик — это любое устройство, которое измеряет любой параметр термодинамической системы . В некоторых случаях термодинамический параметр фактически определяется в терминах идеализированного измерительного прибора. Например, нулевой закон гласит, что если два тела находятся в тепловом равновесии с третьим телом, они также находятся в тепловом равновесии друг с другом. Этот принцип, как отметил Джеймс Максвелл в 1872 году, утверждает, что можно измерить температуру. Идеализированный термометр — это образец идеального газа при постоянном давлении. Из закона идеального газа pV=nRT объем такого образца можно использовать в качестве индикатора температуры; таким образом он определяет температуру. Хотя давление определяется механически, устройство для измерения давления, называемое барометром, также может быть построено из образца идеального газа, поддерживаемого при постоянной температуре. Калориметр — это устройство, которое используется для измерения и определения внутренней энергии системы.
Термодинамический резервуар — это система, которая настолько велика, что ее параметры состояния не изменяются заметно, когда она вступает в контакт с интересующей системой. Когда резервуар вступает в контакт с системой, система приходит в равновесие с резервуаром. Например, резервуар давления — это система с определенным давлением, которая накладывает это давление на систему, с которой она механически связана. Атмосфера Земли часто используется в качестве резервуара давления. Океан может действовать как температурный резервуар при использовании для охлаждения электростанций.
Центральным понятием термодинамики является понятие энергии , способности совершать работу . Согласно Первому закону , полная энергия системы и ее окружения сохраняется. Энергия может быть передана в систему путем нагревания, сжатия или добавления вещества, а также извлечена из системы путем охлаждения, расширения или извлечения вещества. В механике , например, передача энергии равна произведению силы, приложенной к телу, и полученного смещения.
Сопряженные переменные — это пары термодинамических понятий, где первое сродни «силе», приложенной к некоторой термодинамической системе , второе сродни результирующему «смещению», а произведение двух равно количеству переданной энергии. Распространенные сопряженные переменные:
Термодинамические потенциалы — это различные количественные меры запасенной энергии в системе. Потенциалы используются для измерения изменений энергии в системах по мере их перехода от начального состояния к конечному. Используемый потенциал зависит от ограничений системы, таких как постоянная температура или давление. Например, энергии Гельмгольца и Гиббса — это энергии, доступные в системе для выполнения полезной работы, когда температура и объем или давление и температура фиксированы соответственно. Термодинамические потенциалы нельзя измерить в лабораториях, но их можно вычислить с помощью молекулярной термодинамики [34] [35] .
Пять наиболее известных потенциалов:
где — температура , энтропия , давление , объем , химический потенциал , число частиц в системе, а — количество типов частиц в системе .
Термодинамические потенциалы могут быть получены из уравнения баланса энергии, примененного к термодинамической системе. Другие термодинамические потенциалы могут быть также получены с помощью преобразования Лежандра .
Аксиоматическая термодинамика — это математическая дисциплина , целью которой является описание термодинамики в терминах строгих аксиом , например, путем нахождения математически строгого способа выражения известных законов термодинамики .
Первой попыткой аксиоматической теории термодинамики была работа Константина Каратеодори 1909 года «Исследования по основам термодинамики» , в которой использовались системы Пфаффа и концепция адиабатической доступности , понятие, введенное самим Каратеодори. [36] [37] В этой формулировке термодинамические концепции, такие как теплота , энтропия и температура, выводятся из величин, которые можно измерить более непосредственно. [38] Теории, которые появились после, отличались в том смысле, что они делали предположения относительно термодинамических процессов с произвольными начальными и конечными состояниями, в отличие от рассмотрения только соседних состояний.
{{cite book}}: CS1 maint: multiple names: authors list (link): PwR_Sbkwa8IC.Содержит английские переводы многих других его работ.
{{cite book}}: |journal=проигнорировано ( помощь ){{cite book}}: CS1 maint: multiple names: authors list (link)Основной предмет натуральной философии — Динамика, или
наука о силе
... Каждое явление в природе есть проявление силы.
{{cite book}}: CS1 maint: multiple names: authors list (link){{cite book}}: |journal=проигнорировано ( помощь )Следующие названия более технические:
{{cite book}}: CS1 maint: multiple names: authors list (link)