Тиамин , также известный как тиамин и витамин B1 , представляет собой витамин , необходимый микроэлемент для человека и животных. [3] [4] Он содержится в продуктах питания и коммерчески синтезируется в качестве пищевой добавки или лекарства . [1] [5] Фосфорилированные формы тиамина необходимы для некоторых метаболических реакций , включая расщепление глюкозы и аминокислот . [1]
Пищевые источники тиамина включают цельнозерновые продукты , бобовые , а также некоторые виды мяса и рыбы. [1] [6] При обработке зерна удаляется большая часть витаминов, поэтому во многих странах крупы и мука обогащаются тиамином. [1] Доступны добавки и лекарства для лечения и профилактики дефицита тиамина и связанных с ним расстройств, таких как бери-бери и энцефалопатия Вернике . Они также используются для лечения болезни мочи кленового сиропа и синдрома Ли . Добавки и лекарства обычно принимаются перорально , но их также можно вводить внутривенно или внутримышечно . [7]
Добавки тиамина обычно хорошо переносятся. Аллергические реакции , включая анафилаксию , могут возникать при повторном введении инъекций. [7] [8] Тиамин включен в Список основных лекарственных средств Всемирной организации здравоохранения . [9] Он доступен в виде непатентованного лекарства , а в некоторых странах – в виде пищевой добавки, отпускаемой без рецепта. [7]
Тиамин является одним из витаминов группы B и также известен как витамин B 1 . [3] [4] Это катион , который обычно поставляется в виде хлоридной соли . Он растворим в воде, метаноле и глицерине , но практически нерастворим в менее полярных органических растворителях . [10] [11] В организме тиамин может образовывать производные ; наиболее хорошо изученным из них является тиаминпирофосфат (ТПП), кофермент, участвующий в катаболизме сахаров и аминокислот. [3]
Химическая структура состоит из аминопиримидинового и тиазолиевого кольца, соединенных метиленовым мостиком . Тиазол замещен метильной и гидроксиэтильной боковыми цепями . Тиамин стабилен при кислом pH , но нестабилен в щелочных растворах и при воздействии тепла . [10] [11] Он сильно реагирует в реакциях типа Майяра . [10] В результате окисления образуется флуоресцентное производное тиохрома , которое можно использовать для определения количества витамина, присутствующего в биологических образцах. [12]
Хорошо известные расстройства, вызванные дефицитом тиамина, включают бери-бери , синдром Вернике-Корсакова , невропатию зрительного нерва , болезнь Ли , африканскую сезонную атаксию (или нигерийскую сезонную атаксию) и центральный понтинный миелинолиз . [13] Симптомы включают недомогание , потерю веса, раздражительность и спутанность сознания. [10] [14] [15]
В западных странах хронический алкоголизм является фактором риска дефицита. Также в группе риска находятся пожилые люди, люди с ВИЧ/СПИДом или диабетом , а также те, кто перенес бариатрическую операцию . [1] Различные степени недостаточности тиамина были связаны с длительным применением диуретиков . [16] [17]

Известны пять природных производных тиаминфосфата: тиаминмонофосфат (ТМР), тиаминпирофосфат (ТПП), тиаминтрифосфат (ТТФ), аденозинтиаминдифосфат (АТДФ) и аденозинтиаминтрифосфат (АТТФ). Они участвуют во многих клеточных процессах. [18] Наиболее охарактеризованной формой является TPP, кофермент, участвующий в катаболизме сахаров и аминокислот. Хотя его роль хорошо известна, некоферментное действие тиамина и его производных может реализовываться через связывание с белками, которые не используют этот механизм. [19] Никакая физиологическая роль монофосфата не известна, кроме как промежуточного продукта в клеточном превращении тиамина в ди- и трифосфаты. [20]
Тиаминпирофосфат (ТПП), также называемый тиаминдифосфатом (ТДФ), участвует в качестве кофермента в метаболических реакциях, в том числе в тех, в которых имеет место инверсия полярности . [21] Его синтез катализируется ферментом тиаминдифосфокиназой по реакции тиамин + АТФ → ТПП + АМФ (КФ 2.7.6.2). ТПП является коферментом нескольких ферментов, катализирующих перенос двухуглеродных единиц и, в частности, дегидрирование ( декарбоксилирование и последующее конъюгирование с коферментом А ) 2-оксокислот (альфа-кетокислот). Механизм действия ТПП как кофермента основан на его способности образовывать илид . [22] Примеры включают:
Ферменты транскетолаза, пируватдегидрогеназа (ПДГ) и 2-оксоглутаратдегидрогеназа (ОГДГ) играют важную роль в углеводном обмене . ПДГ связывает гликолиз с циклом лимонной кислоты . OGDH катализирует общее превращение 2-оксоглутарата (альфа-кетоглутарата) в сукцинил-КоА и CO 2 в ходе цикла лимонной кислоты . Реакция, катализируемая OGDH, является лимитирующей стадией цикла лимонной кислоты. Цитозольный фермент транскетолаза занимает центральное место в пентозофосфатном пути , основном пути биосинтеза пентозосахаров , дезоксирибозы и рибозы . Митохондриальные PDH и OGDH являются частью биохимических путей, которые приводят к выработке аденозинтрифосфата (АТФ), который является основной молекулой-переносчиком энергии в клетке. В нервной системе ПДГ также участвует в синтезе миелина и нейромедиатора ацетилхолина . [11]
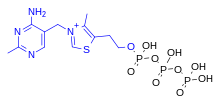
ThTP участвует в активации хлоридных каналов в нейронах млекопитающих и других животных, хотя его роль недостаточно изучена. [20] ThTP был обнаружен в бактериях, грибах и растениях, что позволяет предположить, что он выполняет и другие клеточные функции. [23] У Escherichia coli он участвует в реакции на аминокислотное голодание. [24]
AThDP существует в небольших количествах в печени позвоночных, но его роль остается неизвестной. [24]
АТТФ присутствует в E. coli , где он накапливается в результате углеродного голодания. У этой бактерии АТТФ может составлять до 20% общего количества тиамина. Он также присутствует в меньших количествах в дрожжах , корнях высших растений и тканях животных. [24]
Во время беременности тиамин передается плоду через плаценту . Беременные женщины нуждаются в этом витамине больше, чем другие взрослые, особенно в третьем триместре . Беременные женщины с гиперемезисом беременных подвергаются повышенному риску дефицита тиамина из-за его потерь при рвоте. [25] У кормящих женщин тиамин попадает в грудное молоко, даже если это приводит к дефициту тиамина у матери. [4] [26]
Тиамин важен не только для развития митохондриальных мембран , но и для функции синаптических мембран . [27] Также было высказано предположение, что его дефицит препятствует развитию мозга у младенцев и может быть причиной синдрома внезапной детской смерти . [20]
Национальная медицинская академия США обновила расчетные средние потребности (EAR) и рекомендуемые диетические нормы (RDA) для тиамина в 1998 году. EAR для тиамина для женщин и мужчин в возрасте 14 лет и старше составляют 0,9 мг/день и 1,1 мг/день соответственно. ; рекомендуемые дозы составляют 1,1 и 1,2 мг/день соответственно. RDA выше, чем EAR, чтобы обеспечить адекватный уровень потребления для людей с потребностями выше среднего. Рекомендуемая суточная доза во время беременности и для кормящих женщин составляет 1,4 мг/день. Для младенцев в возрасте до 12 месяцев адекватная доза (AI) составляет 0,2–0,3 мг/день, а для детей в возрасте 1–13 лет рекомендуемая суточная норма увеличивается с возрастом от 0,5 до 0,9 мг/день. [4]
Европейское управление по безопасности пищевых продуктов (EFSA) называет совокупный набор информации эталонными диетическими значениями , с эталонными нормами потребления для населения (PRI) вместо RDA и средними потребностями вместо EAR. Для женщин (в том числе беременных и кормящих), мужчин и детей PRI составляет 0,1 мг тиамина на мегаджоуль (МДж) энергии в их рационе. Поскольку преобразование составляет 1 МДж = 239 ккал, взрослый человек, потребляющий 2390 килокалорий, должен потреблять 1,0 мг тиамина. Это немного ниже, чем RDA в США. [29]
Ни Национальная академия медицины, ни EFSA не установили верхний уровень потребления тиамина, поскольку нет данных о побочных эффектах высоких доз на людях. [4] [28]
Тиамин обычно хорошо переносится и нетоксичен при пероральном применении . [7] Имеются редкие сообщения о неблагоприятных побочных эффектах при внутривенном введении тиамина , включая аллергические реакции, тошноту , летаргию и нарушение координации . [28] [3]
Для целей маркировки пищевых продуктов и пищевых добавок в США количество в порции выражается в процентах от дневной нормы. С 27 мая 2016 г. дневная норма составляет 1,2 мг, что соответствует рекомендуемой суточной дозе. [30] [31]
Тиамин содержится в самых разных обработанных и цельных продуктах, [18] включая чечевицу , горох , цельнозерновые продукты , свинину и орехи . [6] [32] Типичный ежедневный витаминный продукт для беременных содержит около 1,5 мг тиамина. [33]
Некоторые страны требуют или рекомендуют обогащение зерновых продуктов, таких как пшеница , рис или кукуруза (кукуруза), поскольку обработка снижает содержание витаминов. [34] По состоянию на февраль 2022 года 59 стран, в основном в Северной Африке и странах Африки к югу от Сахары, требуют обогащения пищевых продуктов пшеницы, риса или кукурузы тиамином или мононитратом тиамина. Предусмотренные количества варьируются от 2,0 до 10,0 мг/кг. [35] Еще 18 стран имеют добровольную программу обогащения пищевых продуктов. Например, правительство Индии рекомендует 3,5 мг/кг для муки «майда» (белая) и «атта» (цельнозерновая) . [36]
Биосинтез тиамина происходит у бактерий, некоторых простейших, растений и грибов. [37] [38] Тиазольные и пиримидиновые фрагменты биосинтезируются отдельно, а затем объединяются с образованием ThMP под действием тиамин-фосфатсинтазы .
Пиримидиновая кольцевая система образуется в реакции, катализируемой фосфометилпиримидинсинтазой (ThiC), ферментом радикального суперсемейства SAM железо-серных белков , которые используют S-аденозилметионин в качестве кофактора . [39] [40]
Исходным материалом является риботид 5-аминоимидазола , который подвергается реакции перегруппировки через радикальные промежуточные соединения, которые включают в продукт синий, зеленый и красный фрагменты. [41] [42]
Тиазольное кольцо образуется в реакции, катализируемой тиазолсинтазой (EC 2.8.1.10). [39] Конечными предшественниками являются 1-дезокси-D-ксилулозо-5-фосфат, 2-иминоацетат и белок-переносчик серы, называемый ThiS. Дополнительный белок ThiG также необходим для объединения всех компонентов кольца в активном центре фермента. [43]
Последний этап образования ThMP включает декарбоксилирование промежуточного тиазола, который реагирует с пирофосфатным производным фосфометилпиримидина, который сам является продуктом киназы , фосфометилпиримидинкиназы . [39]
Пути биосинтеза различаются у разных организмов. У E. coli и других энтеробактерий ThMP фосфорилируется до кофактора TPP с помощью тиаминфосфаткиназы (ThMP + АТФ → TPP + ADP). [39] У большинства бактерий и эукариот ТМФ гидролизуется до тиамина, а затем пирофосфорилируется до ТФП с помощью тиаминдифосфокиназы (тиамин + АТФ → ТФП + АМФ). [44]
Пути биосинтеза регулируются рибопереключателями . [3] Если в клетке присутствует достаточное количество тиамина, то он связывается с мРНК ферментов , которые необходимы в этом пути, и предотвращает их трансляцию . Если тиамин отсутствует, ингибирования нет, и вырабатываются ферменты, необходимые для биосинтеза. Специфический рибопереключатель, рибопереключатель TPP , является единственным известным рибопереключателем, обнаруженным как у эукариотических, так и у прокариотических организмов. [45]
При первом полном синтезе в 1936 году этил-3-этоксипропаноат обрабатывали этилформиатом с получением промежуточного дикарбонильного соединения, которое при реакции с ацетамидином образовывало замещенный пиримидин . Превращение его гидроксильной группы в аминогруппу осуществлялось путем нуклеофильного ароматического замещения сначала в хлоридное производное с помощью оксихлорида фосфора с последующей обработкой аммиаком . Затем этоксигруппу превращали в бромпроизводное с использованием бромистоводородной кислоты . На заключительной стадии тиамин (в виде его дибромидной соли) образовывался в реакции алкилирования с использованием 4-метил-5-(2-гидроксиэтил)тиазола. [46] : 7 [47]

Компания Merck & Co. адаптировала лабораторный синтез 1936 года, что позволило им производить тиамин в Рэуэе в 1937 году . [47] Однако был альтернативный путь с использованием промежуточного диамина Греве (5-(аминометил)-2-метил-4-пиримидинамин) , впервые опубликованная в 1937 году, [48] была исследована Хоффманом Ла Рошем , после чего последовали конкурентные производственные процессы. Эффективные пути к диамину по-прежнему вызывают интерес. [47] [49] В Европейской экономической зоне тиамин зарегистрирован в соответствии с регламентом REACH , и там производится или импортируется от 100 до 1000 тонн в год. [50]
Многие аналоги витамина B1 , такие как бенфотиамин , фурсултиамин и сульбутиамин , являются синтетическими производными тиамина. Большинство из них были разработаны в Японии в 1950-х и 1960-х годах как формы, предназначенные для улучшения всасывания по сравнению с тиамином. [51] Некоторые из них одобрены для использования в некоторых странах в качестве лекарственного средства или безрецептурной пищевой добавки для лечения диабетической нейропатии или других заболеваний. [52] [53] [54]
В верхних отделах тонкой кишки эфиры тиаминфосфата, присутствующие в пище, гидролизуются ферментами щелочной фосфатазой . При низких концентрациях процесс абсорбции опосредован носителем. При более высоких концентрациях абсорбция также происходит посредством пассивной диффузии . [3] Активный транспорт может подавляться употреблением алкоголя или дефицитом фолиевой кислоты . [10]
Большая часть тиамина в сыворотке связана с белками, главным образом с альбумином . Примерно 90% общего количества тиамина в крови находится в эритроцитах . Специфический связывающий белок, называемый тиамин-связывающим белком, был идентифицирован в сыворотке крыс и считается регулируемым гормонами белком-носителем, важным для распределения тиамина в тканях. [14] Поглощение тиамина клетками крови и других тканей происходит посредством активного транспорта и пассивной диффузии. [10] Два члена семейства белков-транспортеров, кодируемых генами SLC19A2 и SLC19A3 , способны транспортировать тиамин. [20] В некоторых тканях поглощение и секреция тиамина, по-видимому, опосредованы Na + -зависимым переносчиком и трансклеточным протонным градиентом. [14]
Запасы тиамина в организме человека составляют от 25 до 30 мг, при этом наибольшая концентрация наблюдается в скелетных мышцах, сердце, мозге, печени и почках. ТМФ и свободный (нефосфорилированный) тиамин присутствуют в плазме, молоке, спинномозговой жидкости и, предположительно, во всей внеклеточной жидкости . В отличие от высокофосфорилированных форм тиамина, ТМФ и свободный тиамин способны проникать через клеточные мембраны. Было показано, что кальций и магний влияют на распределение тиамина в организме, а дефицит магния усугубляет дефицит тиамина. [20] Содержание тиамина в тканях человека меньше, чем у других видов. [14] [55]
Тиамин и его метаболиты (2-метил-4-амино-5-пиримидинкарбоновая кислота, 4-метилтиазол-5-уксусная кислота и др.) выводятся преимущественно с мочой. [3]
На биодоступность тиамина в пищевых продуктах можно влиять различными способами. Сульфиты , добавляемые в пищу в качестве консерванта, [56] атакуют тиамин по метиленовому мостику, отщепляя пиримидиновое кольцо от тиазольного кольца. Скорость этой реакции увеличивается в кислых условиях. [14] Тиамин разлагается термолабильными тиаминазами , присутствующими в некоторых видах рыб, моллюсков и других пищевых продуктах. [10] Куколки африканского шелкопряда Anaphe venata — традиционная еда в Нигерии. Потребление приводит к дефициту тиамина. [57] В более старых литературных источниках сообщается, что в Таиланде потребление ферментированной, сырой рыбы вызывало дефицит тиамина, но либо воздержание от употребления рыбы, либо ее нагревание сначала устраняли дефицит. [58] У жвачных животных кишечные бактерии синтезируют тиамин и тиаминазы. Бактериальные тиаминазы представляют собой ферменты клеточной поверхности, которые должны диссоциировать от клеточной мембраны перед активацией; диссоциация может происходить у жвачных животных в ацидотических условиях . У молочных коров перекармливание зерном вызывает подострый рубцовый ацидоз и повышенное выделение тиаминазы рубцовыми бактериями, что приводит к дефициту тиамина. [59]
Согласно отчетам о двух небольших исследованиях, проведенных в Таиланде, жевание кусочков ореха арека, завернутых в листья бетеля , и жевание чайных листьев снижает биодоступность тиамина в пище по механизму, который может включать дубильные вещества . [58] [60]
Известно, что бариатрическая хирургия с целью снижения веса препятствует усвоению витаминов. [61] Метаанализ показал, что 27% людей, перенесших бариатрические операции, испытывают дефицит витамина B1 . [62]
Тиамин был первым из водорастворимых витаминов, который был выделен. [63] Самые ранние наблюдения на людях и курах показали, что рацион, состоящий в основном из полированного белого риса, вызывает бери-бери, но не связывают это с отсутствием ранее неизвестного важного питательного вещества. [64] [65]
В 1884 году Такаки Канехиро , главный хирург Императорского флота Японии , отверг предыдущую микробную теорию бери-бери и вместо этого предположил, что болезнь возникает из-за недостаточного питания. [64] Изменяя диету на военном корабле, он обнаружил, что замена диеты, состоящей только из белого риса, на диету, также содержащую ячмень, мясо, молоко, хлеб и овощи, почти устранила бери-бери во время девятимесячного морского путешествия. Однако Такаки добавил к своей успешной диете много продуктов и ошибочно объяснил пользу увеличением потребления белка, поскольку витамины в то время были неизвестны. Военно-морской флот не был убежден в необходимости такой дорогостоящей программы улучшения питания, и многие мужчины продолжали умирать от бери-бери даже во время русско -японской войны 1904–1905 годов. Лишь в 1905 году, после того как в рисовых отрубях (удаленных при полировке белого риса ) и ячменных отрубях был обнаружен фактор, препятствующий бери-бери , эксперимент Такаки был удостоен награды. Он был удостоен звания барона в японской системе пэров, после чего его ласково называли «Ячменным бароном». [64]
Конкретная связь с зерном была установлена в 1897 году Кристианом Эйкманом , военным врачом из Голландской Ост-Индии , который обнаружил, что у домашних птиц, питавшихся вареным, шлифованным рисом, развивается паралич, который можно обратить вспять, прекратив шлифовку риса. [65] Он объяснил бери-бери высоким содержанием токсичного крахмала в рисе. Он считал, что токсичности можно противостоять с помощью соединения, присутствующего в рисовой шлифовке. [66] Его коллега Геррит Гринс правильно истолковал связь между чрезмерным потреблением полированного риса и авитаминозом в 1901 году: он пришел к выводу, что рис содержит важные питательные вещества во внешних слоях зерна, которые удаляются при полировке. [67] В конечном итоге Эйкман был удостоен Нобелевской премии по физиологии и медицине в 1929 году, поскольку его наблюдения привели к открытию витаминов.
В 1910 году японский агрохимик Императорского университета Токио Уметаро Судзуки выделил из рисовых отрубей водорастворимое соединение тиамина, которое он назвал абериновой кислотой . (Позже он переименовал его в Оризанин .) Он описал это соединение не только как фактор против бери-бери, но и как необходимое для питания человека; однако это открытие не получило огласки за пределами Японии, поскольку утверждение о том, что это соединение было новым открытием, было опущено в переводе его публикации с японского на немецкий. [63] В 1911 году польский биохимик Казимир Функ выделил из рисовых отрубей антиневритическое вещество (современный тиамин), которое он назвал «витамином» (из-за того, что оно содержит аминогруппу). [68] [69] Однако Функ не полностью охарактеризовал его химическую структуру. Голландские химики Баренд Коэнраад Петрус Янсен и его ближайший сотрудник Виллем Фредерик Донат в 1926 году выделили и кристаллизовали активное вещество, [70] структура которого была определена Робертом Раннелсом Уильямсом в 1934 году. Команда Уильямса назвала тиамин смесь слов «тио» (что означает серосодержащий) и «витамин». Термин «витамин» произошел косвенно, по линии Функа, от аминной группы самого тиамина (хотя к этому времени было известно, что витамины не всегда являются аминами, например витамин С ). Тиамин был также синтезирован группой Уильямса в 1936 году. [71]
Сэр Рудольф Питерс из Оксфорда использовал голубей, чтобы понять, как дефицит тиамина приводит к патолого-физиологическим симптомам бери-бери. У голубей, питавшихся исключительно полированным рисом, развился опистотонус — состояние, характеризующееся втягиванием головы. Если не лечить, животные умирали через несколько дней. Введение тиамина после обнаружения опистотонуса привело к полному излечению в течение 30 минут. Поскольку в мозгу голубей до и после лечения тиамином не наблюдалось никаких морфологических изменений, Петерс ввел концепцию биохимического повреждения. [72] В 1937 году Ломанн и Шустер показали, что дифосфорилированное производное тиамина, TPP, является кофактором, необходимым для окислительного декарбоксилирования пирувата. [73]
Случаев неблагоприятного воздействия избытка тиамина не зарегистрировано... Несколько единичных случаев пурита...