Трансформация Рихтера (РТ), также известная как синдром Рихтера , представляет собой превращение хронического лимфоцитарного лейкоза (ХЛЛ) или его варианта, малой лимфоцитарной лимфомы (МЛЛ), в новое, более агрессивное злокачественное заболевание. [1] ХЛЛ представляет собой циркуляцию злокачественных В-лимфоцитов с инфильтрацией этих клеток в лимфатические или другие ткани или без нее, в то время как СЛЛ представляет собой инфильтрацию этих злокачественных В-лимфоцитов в лимфатические и/или другие ткани с незначительной циркуляцией или отсутствием циркуляции этих клеток в лимфатических и/или других тканях. кровь. [2] ХЛЛ вместе с его вариантом SLL сгруппированы в термин CLL/SLL. [1]
РТ диагностируется у лиц с ХЛЛ/СЛЛ, которая трансформируется в злокачественное новообразование с микроскопической гистопатологией диффузной крупноклеточной В-клеточной лимфомы (ДКБКЛ) или, реже, лимфомы Ходжкина (ЛХ). [3] Встречаются редкие случаи: 1) ХЛЛ/SLL, которые преобразуются в лимфобластную лимфому , волосатоклеточный лейкоз или Т-клеточную лимфому высокой степени злокачественности [4], например, анапластическую крупноклеточную лимфому или ангиоиммунобластную Т-клеточную лимфому ; [5] 2) ХЛЛ/SLL, которые трансформируются в острый миелоидный лейкоз ; [6] 3) ХЛЛ/SLL, которые трансформируются или развиваются в негематологические злокачественные новообразования, такие как рак легких, рак головного мозга, меланома глаза или кожи, [5] [7] опухоли слюнных желез и саркомы Капоши ; [8] и 4) трансформация фолликулярной лимфомы , лимфобластной лимфомы или лимфомы маргинальной зоны в другие виды гематологических злокачественных новообразований. [9] Хотя некоторые из этих конверсий были названы RT, Всемирная организация здравоохранения [10] и большинство обзоров определили RT как конверсию ХЛЛ/SLL в заболевание с гистопатологией DLBCL или HL. Здесь RT считаются ХЛЛ/SLL, которые преобразуются в заболевание либо с гистопатологией DLBCL (здесь называемой DLBCL-RT), либо с гистопатологией лимфомы Ходжкина (здесь называемой HL-RT).
ХЛЛ/СЛЛ является наиболее распространенным лейкозом у взрослых в западных странах, на его долю приходится 1,2% новых случаев рака, диагностируемых каждый год в Соединенных Штатах. Обычно оно возникает у пожилых людей ( средний возраст на момент постановки диагноза 70 лет) и протекает вяло в течение многих лет. [11] Около 1-10% ХЛЛ/СЛЛ развивают трансформацию Рихтера со скоростью 0,5-1% в год. В более ранних исследованиях сообщалось, что трансформированное заболевание является гораздо более агрессивным, чем ХЛЛ/СЛЛ, с общим средним временем выживаемости (т.е. временем, когда 50% случаев остаются в живых) от 1,1 до 16,3 месяцев. Новые терапевтические схемы улучшают прогноз DLBCL-RT и HL-RT. [12]
В 1928 году Морис Рихтер сообщил, что у пациента с ХЛЛ развилось агрессивное генерализованное опухание лимфатических узлов , печени и селезенки из-за их инфильтрации быстро растущими «саркомоподобными клетками». Больной умер от этого заболевания через 22 дня после обращения. Доктор Рихтер назвал это заболевание «генерализованной ретикулярно-клеточной саркомой». [13] В 1964 году Лортолари и др. описали возникновение DLBCL у пациентов с ХЛЛ и назвали это состояние трансформацией Рихтера. [14] Последующие исследования объединили SLL с CLL и включили HL-RT с DLBCL-RT в определение RT CLL/SLL. [4]
Исследования показали, что CLL/SLL трансформируется в DLBCL-RT примерно в 90% и в HL-RT в 0,7–15% всех RT. [1] Эти преобразования могут произойти в любой момент в ходе CLL/SLL. В исследовании с участием 77 человек DLBCL-RT и HL-RT были диагностированы одновременно с ХЛЛ/SLL в 6 случаях или через 3–171 месяц после постановки диагноза CLL/SLL в 71 случае. [15] Исследование 10 случаев RT показало, что у одного человека наблюдалась трансформированная ХЛЛ/СЛЛ, а у 9 трансформировались через 12–111 месяцев после постановки диагноза ХЛЛ/СЛЛ. [9] В 5 других исследованиях среднее время между диагнозом ХЛЛ/СЛЛ и ЛТ варьировалось от 1,8 до 5 лет. [16]
У лиц с ХЛЛ/СЛЛ, у которых развивается ЛТ, обычно наблюдается быстрое увеличение размера поверхностных (т.е. шейных , подмышечных , паховых и/или заглоточных ) лимфатических узлов; возможно, это единственный признак трансформации. [2] Другие симптомы могут включать симптомы B (т. е. лихорадку при отсутствии инфекции, обильный ночной пот и/или необъяснимую потерю веса) и/или ухудшение общего состояния здоровья. Эти симптомы часто сопровождаются развитием экстраузловых заболеваний, т. е. отеков или опухолей вследствие инфильтрации злокачественными В-лимфоцитами в желудочно-кишечный тракт , [17] кости, кожу, центральную нервную систему , селезенку , печень, [2] мочевыводящие пути. мочевой пузырь, щитовидная железа и/или легочная плевра . [9] Аномальные лабораторные показатели включают повышение уровня лактатдегидрогеназы в крови в 50–80% случаев, прогрессивное ухудшение анемии (т.е. снижение количества эритроцитов ), тромбоцитопению (т.е. снижение количества тромбоцитов ) [1] и/или гиперкальциемию ( т.е. снижение количества эритроцитов). т.е. повышение уровня кальция в сыворотке крови (часто из-за поражения костей). [6] ФДГ-позитронно-эмиссионная томография-компьютерная томография (т.е. ФДГ-ПЭТ-КТ) может определить места инвазии тканей, лучшие места для биопсии, а в некоторых случаях предложить диагноз DLBCL-RT, показывая, что пораженные ткани имеют отчетливо высокий уровень поглощения ФДГ. [2] [12] [18] У лиц с ЛТ на момент постановки диагноза ХЛЛ/СЛЛ будут проявляться эти симптомы и признаки наряду с микроскопическими гистопатологическими признаками ХЛЛ/СЛЛ одновременно с DLBCL-RT или HL-RT.
Считается, что лица с ХЛЛ/СЛЛ имеют повышенный риск развития РТ, если у них имеется: 1) увеличение лимфатических узлов, печени и/или селезенки; 2) запущенная стадия заболевания; 3) низкое количество тромбоцитов и/или повышенный уровень бета-2-микроглобулина в сыворотке; 4) клетки CLL/SLL, у которых возникают делеции гена CDKN2A , нарушения гена TP53 , активация гена C-MYC , трисомия (т.е. дополнительная) хромосомы 12 или мутации в гене NOTCH1 ; [12] и/или 5) предшествующее лечение ХЛЛ/СЛЛ с использованием режимов химиотерапии , сочетающих аналоги пурина и алкилирующие агенты , несколько различных типов химиотерапии [12] и/или комбинации флударабина , циклофосфамида и ритуксимаба (последний режим был связан с с риском развития ХЛЛ/СЛЛ в 2,38 раза выше, чем у RT). [8]
Микроскопическая гистопатология DLBCL-RT в пораженных лимфатических узлах и других тканях, окрашенных гемотоксилином и эозином, обычно показывает сливающиеся листы крупных злокачественных B-лимфоцитов, которые напоминают центробласты в ~ 80% случаев или иммунобласты в остальных ~ 20% случаев. Эти злокачественные В-лимфоциты экспрессируют поверхностный мембранный белок CD20 почти во всех случаях, поверхностный мембранный белок PD-1 почти в 80% случаев (высокие уровни PD-1 помогают раковым клеткам уклоняться от иммунной системы хозяина), поверхностный мембранный белок CD5 примерно в 30% случаев. случаев и поверхностный мембранный белок CD23 примерно в 15% случаев. В 90–95% случаев эти клетки также экспрессируют IRF4 ( фактор транскрипции , регулирующий развитие лимфоцитов, в том числе В-лимфоцитов) или в остальных 5–10% случаев CD10 ( фермент , обнаруженный в неопластических клетках пре-В- лимфоцитов). клеточные лейкозы и некоторые случаи ХЛЛ/СЛЛ). [12]
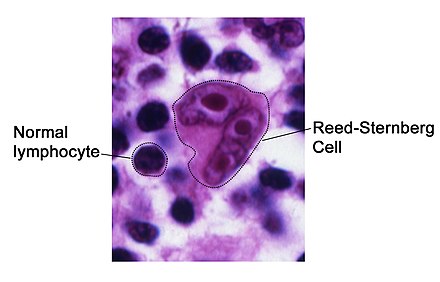
Гистопатологию пораженных тканей при HL-RT диагностируют на основании наличия клеток Рида-Штернберга (здесь называемых RS-клетками). На соседней микрофотографии показаны типичные клетки RS, окруженные нормальными лимфоцитами. Клетки RS имеют большие размеры и имеют несколько ядер , как в его случае, или одно ядро с двумя долями. Клетки RS экспрессируют белок клеточной поверхности CD30 (член семейства рецепторов фактора некроза опухоли ) и CD15 ( углевод антигена группы крови на поверхности клетки). [19] В одном исследовании сообщалось, что клетки RS в HL-RT не экспрессируют CD20 [19] , но в другом сообщается, что ~35% экспрессируют. [20] Эти клетки также экспрессируют белок, расположенный в клеточном ядре , фактор связывания лимфоидного энхансера 1 , примерно в 80% случаев. [19] RS-клетки при HL-RT распространены по 1) ХЛЛ/СЛЛ-подобному фону из мелких лимфоцитов различной формы или 2) воспалительному клеточному фону из эпителиоидных гистиоцитов , эозинофилов и плазматических клеток , который похож на что во многих случаях обнаруживается лимфома Ходжкина, не связанная с лучевой терапией (здесь это называется HL-not RT). Случаи HL-RT с ХЛЛ/SLL-подобным фоном называются HL-RT типа 1 (или типа I), а случаи с воспалительно-клеточным фоном называются HL-RT типа 2 (или типа II). [1] Хотя в некоторых исследованиях поражения с гистопатологией 1-го типа рассматривались как ненастоящие HL-RT, в одном исследовании сообщалось, что из 26 случаев 1-го типа и 51 случая 2-го типа в 3 при серийных исследованиях наблюдалась эволюция гистопатологии 1-го типа в гистопатологию 2-го типа. биопсии, и оба типа одинаково реагировали на схемы химиотерапии, используемые для лечения лимфомы Ходжкина, а не на лучевую терапию. [20] Второе исследование показало, что гистопатология типа 1 и 2 может возникать не только последовательно, но и в одном и том же очаге поражения. [21] Наконец, исследование 51 случая HL-RT 2 типа показало, что клетки RS экспрессируют PAX5 в 100%, CD30 в 100%, CD15 в 92%, CD20 в 47% и ZAP-70 в 32% случаев. в то время как в 26 случаях типа 1 были клетки RS, которые экспрессировали соответствующие белки в 100%, 100%, 78%, 52% и 57% случаев. [20] Здесь HL-RT рассматривается как состоящий из лейкозных клеток с гистопатологией типа 1, типа 2 или смеси типа 1 и типа 2.
Более 90% населения мира инфицировано вирусом Эпштейна-Барра (ВЭБ). Во время инфекции ВЭБ проникает в В-лимфоциты и может вызвать инфекционный мононуклеоз , незначительные неспецифические симптомы или отсутствие симптомов. Затем вирус переходит в латентную фазу, в которой инфицированные люди становятся пожизненными бессимптомными носителями ВЭБ в своих В-лимфоцитах. Спустя долгое время после первоначального заражения и латентного периода ВЭБ может снова стать активным в В-лимфоцитах и вызывать широкий спектр заболеваний, связанных с ВЭБ, включая различные лимфопролиферативные заболевания, связанные с вирусом Эпштейна-Барр . [22] Реактивация EBV может происходить в В-лимфоцитах ХЛЛ/СЛЛ и приводить к более тяжелой форме ХЛЛ/СЛЛ и/или к трансформации Рихтера. [23] Сообщалось, что трансформация RT редко лежит в основе развития DLBCL-RT, но связана с развитием HL-RT 1 типа в 75% из 51 случая 2 типа и 65% из 26 случаев 1 типа. [20] ВЭБ выявляется в 30–50% случаев ЛХ, а не ЛТ (см. вирус-положительную лимфому Ходжкина Эпштейна-Барра ). [22] Инфекция EBV в злокачественных B-лимфоцитах CLL/SLL часто диагностируется с помощью гибридизации in situ для обнаружения малых РНК, кодируемых вирусом Эпштейна-Барра (т.е. EBER), вырабатываемых вирусом. [19]
Злокачественные В-лимфоциты при DLBCL-RT, но не DLBCL, не связанные с RT (т.е. DLBCL-not RT), несут инактивированный ген-супрессор опухоли TP53 в 50–60% случаев [12] и часто имеют аномалии в генах NOTCH1 , MYC и CDKN2A . . [1] Клетки DLBCL-RT обычно не имеют аномалий в генах, регулирующих передачу сигналов клеток или пути дифференцировки B-лимфоцитов , которые часто обнаруживаются в злокачественных B-лимфоцитах DLBCL, а не RT. В злокачественных B-лимфоцитах DLBCL-RT также отсутствуют генные аномалии, обычно встречающиеся в DLBCL-RT, а не в RT, такие как инактивированная ацетилтрансфераза , CREB-связывающий белок , EP300 , гены бета-2-микроглобулина ; транслокации генов BCL6 и BCL2 ; и потери генов PRDM1 и TNFAIP3 . [1]
Существует важное различие в DLBCL-RT, основанное на сходстве их генов, продуцирующих антитела, с генами в предшествующих им злокачественных B-лимфоцитах CLL/SLL. Нормальные В-лимфоциты вырабатывают антитела , которые распознают чужеродные антигены и связываются с ними . Образование этих антител требует перестройки генов, продуцирующих антитела (см. Производство антител ). Анализы показали, что ~ 80% случаев DLBCL-RT имеют гены, продуцирующие антитела, в злокачественных B-лимфоцитах, которые связаны с генами, продуцирующими антитела, в злокачественных B-лимфоцитах предшествующего CLL/SLL; эти случаи представляют собой истинные трансформации злокачественных B-лимфоцитов CLL/SLL и здесь называются чистыми DLBCL-RT. Остальные ~20% случаев DLBCL не имеют такой связи и, следовательно, не происходят из злокачественных B-лимфоцитов их предшественников CLL/SLL. [1] [3] Эти случаи здесь называются DLBCL-RT de novo . [3] Обзор эпиднадзора, эпидемиологии и конечных результатов 530 случаев с диагнозом RT показал, что чистые случаи DLCBL-RT и случаи DLBCL-RT de novo имели медианное время выживаемости 14,2 и 62,5 месяцев соответственно. [17] В двух небольших исследованиях сообщалось, что чистые случаи DLBCL-RT и случаи DLBCL-RT de novo имели медианное время выживаемости 8–16 месяцев и ~ 60 месяцев соответственно [24] и 14,2 и 62,5 месяцев соответственно. [1] Таким образом, чистая DLBCL-RT является гораздо более агрессивным заболеванием, чем DLBCL-RT de novo .
Клетки RS в HL-RT также могут демонстрировать реаранжировки генов, продуцирующих антитела, которые отличаются от таковых в предшествующих им клетках CLL/SLL. [1] [19] Одно исследование показало, что 53% из 14 случаев HL-RT 2 типа имели, а 47% не имели изменений в генах, продуцирующих антитела, в RS-клетках, которые были связаны с изменениями в их предшественниках, злокачественных CLL/SLL. В-лимфоциты, в то время как 29% из 14 случаев HL-RT типа 1 имели, а 71% не имели гены, продуцирующие антитела, которые были связаны с предшествующими им B-лимфоцитами ХЛЛ/СЛЛ. [20] Таким образом, случаи HL-RT, как и случаи DLBC-RTL, могут быть либо развитием заболевания из злокачественных B-лимфоцитов CLL/SLL, либо не иметь такой взаимосвязи. [12] Примечательно, что DL-RT 1-го типа является более агрессивным заболеванием, чем HL-RT 2-го типа (см. раздел «Лечение и прогноз THL-RT»). [21]
Диагностика РТ зависит от обнаружения у лиц со стабильной ХЛЛ/СЛЛ в анамнезе или у лиц, впервые поступивших с ХЛЛ/СЛЛ, наблюдаются: 1) быстрое ухудшение симптомов и/или признаков, в частности увеличение лимфатических узлов или поражение нелимфатических узлов. ткани узла (см. раздел «Презентация»); [2] 2) ФДГ-ПЭТ-КТ-сканирование, которое может показать вовлеченные ткани, имеют высокий уровень поглощения ФДГ; [18] 3) эксцизионная биопсия (хирургическое удаление пораженной ткани, такой как лимфатический узел) или кор-биопсия (хирургическое удаление части пораженной ткани), которая показывает гистопатологию DLBCL-RT или HL-RT ( тонкоигольная биопсия ). аспирационная биопсия пораженных тканей не оказалась клинически полезной, точной или ценной для диагностики ХЛЛ/SLL-RT [1] ); и 4) анализ экспрессии генов и/или белков, который позволяет отличить чистый DLBLC-RT от DLBCL-RT de novo (см. раздел «Аномалии генов DLBCL-RT»). [1] В подгруппе ХЛЛ/СЛЛ (~23% всех случаев) развивается «ускоренный» ХЛЛ, т.е. злокачественные В-лимфоциты, которые быстро пролиферируют. [11] У людей с ускоренным CCL/SLL наблюдается ухудшение симптомов и признаков, а также микроскопическая гистопатология пораженных тканей, которую трудно отличить от RT. [10] Сканирование с ФДГ-ПЭТ-КТ может помочь отличить ЛТ от ускоренной ХЛЛ/СЛЛ, если они показывают, что пораженная ткань при лучевой терапии поглощает очень высокие уровни ФДГ. [2] [18] Тем не менее, диагноз этих РТ может быть трудно отличить друг от друга, а также от ускоренного ХЛЛ: окончательный диагноз РТ должен ставить гематопатолог, знакомый с этой областью. [12]
По состоянию на 2021 год не было опубликованных рандомизированных контролируемых исследований , определяющих оптимальное лечение лучевой терапии. Случаи DLBCL-RT лечили химиотерапией (терапией, направленной на раковые клетки) в сочетании с иммунотерапией (терапией, нацеленной на иммунную систему). Модифицированная схема химиоиммунотерапии CHOP , названная [R]-CHOEP, которая состоит из ритуксимаба (препарат иммунотерапевтических антител, который связывается с белком клеточной поверхности CD20), циклофосфамида , доксорубицина , винкристина и преднизолона , дала общий уровень ответа 50–60% при медиана общей продолжительности выживаемости 15–21 месяц. Для лечения DLBCL-RT использовались другие схемы химиоиммунотерапии. В ретроспективном когортном исследовании схема R-EPOCH с ритуксимабом, этопозидом , преднизоном, винкристином, циклофосфамидом и доксорубицином дала общий уровень ответа 39% и медиану общей выживаемости 5,9 месяцев . R-DHAP (ритуксимаб, дексаметазон, цитарабин и цисплатин ), R-ESHAP (ритуксимаб, этопозид, метилпреднизолон , цитарабин и цисплатин) и схемы с интенсифицированной дозой, такие как R-гипер-CVAD (ритуксимаб с гиперфракционированным [т.е. интенсивное лечение небольшими дозами более одного раза в день] циклофосфамид, винкристин, доксорубицин и дексаметазон, чередующиеся с высокими дозами метотрексата и цитарабина, как описано в других источниках [25] ), дали более высокие показатели полного ответа , но также и более высокие побочные эффекты, более частое лечение. связанная смертность и более короткое общее время выживания по сравнению с [R]-CHOEP. Следовательно, эти другие схемы обычно не используются для лечения DLBCL-RT. Недавно к схемам химиотерапии и иммунотерапии были добавлены низкомолекулярные противораковые препараты (например , венетоклакс , атезолизумаб , дувелисиб , ублитуксимаб , занубрутиниб , обинутузумаб , олатузумаб и блинатумомаб ), которые используются для лечения ХЛЛ/SLL и/или DLBCL-не RT. лечить РТ. Хотя эти исследования все еще находятся на ранних стадиях, т.е. на стадиях I или II , некоторые из них уже дали обнадеживающие результаты. [1] В настоящее время продолжаются дальнейшие исследования этих низкомолекулярных препаратов, а также исследования с использованием технологии CAR-T для лечения DLBCL-RT. [12]Химиотерапия в сочетании с иммунотерапией есть и останется золотым стандартом лечения DLBCL-RT до тех пор, пока будущие исследования не сообщат о более эффективных схемах. [12]
Пациентам с DLBCL-RT проводилась аутологичная или аллогенная трансплантация гемопоэтических стволовых клеток . При этих процедурах гемопоэтические стволовые клетки выделяют у пациента для аутологичной трансплантации или у донора для аллогенной трансплантации. Затем пациентов лечат «схемой абляционной терапии», то есть высокодозной химиотерапией с иммунотерапией или без нее и лучевой терапией , чтобы искоренить или, по крайней мере, остановить или уменьшить дальнейший рост его или ее злокачественных В-лимфоцитов. После этой терапии пациентам вводят собственные или донорские гемопоэтические стволовые клетки. В одном исследовании сообщалось о 3-летней выживаемости 36%, а в другом сообщалось о медиане времени выживаемости без прогрессирования (т.е. времени, когда болезнь не ухудшается) 11,2 месяца, при этом медиана общего времени выживаемости не была достигнута после 54 месяцев наблюдения. . [26] Метаанализ 4 предыдущих исследований показал , что 72 человека, получившие аллогенную трансплантацию гемопоэтических стволовых клеток (AHSCT) для лучевой терапии (почти все случаи были DLBCL-RT), достигли общего уровня ответа (процент пациентов, демонстрирующих снижение заболеваемости ) 79%, уровень полного ответа (процент пациентов с очевидным исчезновением заболевания) 33% и 2-летняя и 5-летняя выживаемость 46 и 35% соответственно. Поскольку общее среднее время выживания во многих исследованиях составляло менее 10 месяцев для лиц, не получавших AHSCT, исследование пришло к выводу, что AHSCT является разумным вариантом лечения для здоровых людей, чье заболевание ответило на абляционную терапию. [27] Однако в этих исследованиях, [27] , а также в других исследованиях по гомологичной и/или аутологичной трансплантации для DLBCL-RT, индивидуумы для трансплантации отбирались на основе их частичного или полного ответа на абляционную терапию [26] и часто выбираются только пациенты. которые физически и по другим причинам были лучше всего подходят для трансплантации: в одном исследовании только 20 из 148 человек с DLBCL-RT были признаны подходящими для трансплантации. [1] Необходимы дальнейшие исследования, предпочтительно рандомизированные контролируемые исследования, чтобы определить, улучшает ли этот режим лечения исходы у таких тщательно отобранных пациентов с DLBCL-RT.
Исторически случаи HL-RT обычно лечились схемами, направленными против ХЛЛ/SLL или других злокачественных опухолей, но не теми, которые использовались для лечения лимфом Ходжкина, не вызванных лучевой терапией, т.е. HL-not RT. Медианное время общей выживаемости у лиц, получавших эти схемы, варьировало в пределах 0,8–3,9 года. [28] В настоящее время HL-RT лечат такими схемами химиотерапии, как ABVD (т.е. адриамицин , блеомицин , винбластин и дакарбазин ), которые используются для лечения HL-RT, а не RT. В многоцентровом исследовании 62 человека с HL-RT получали лечение ABVD или по схеме на основе AVD. Медиана общей выживаемости у этих пациентов составила 13,2 года, время, аналогичное тому, которое наблюдалось при большинстве подтипов ЛХ, а не ЛТ, при сопоставлении с возрастом пациента на момент лечения. Трансплантация гемопоэтических стволовых клеток у 7 из этих людей не улучшила медианное время общей выживаемости. [28] На основании этого результата одно исследование пришло к выводу, что трансплантация стволовых клеток, проводимая в качестве консолидационной терапии (т.е. терапии, проводимой для улучшения результатов предыдущей терапии), не рекомендуется для лечения HL-RT. [1] В исследовании 8 человек с HL-RT, получавших BEACOPP (2 случая), ABVD (1 случай) или другие схемы (5 случаев), направленные против HL-а не RT, медиана общего времени выживаемости составила 7 лет. [29] Ретроспективное обзорное исследование случаев HL-RT 1-го типа (которые имеют худший прогноз, чем HL-RT 2-го типа) показало, что у лиц, получавших схемы терапии, направленные против HL-RT, не было медианного общего времени выживаемости 57 месяцев, значительно выше, чем у тех, кто лечился схемами, используемыми для лечения ХЛЛ/ССШ (среднее общее время выживаемости 8,4 месяца). [21] В настоящее время схемы лечения, в частности ABVD, используемые для лечения HL-RT, являются стандартом лечения HL-RT. [1] [28]