В химии электрофил — это химическое вещество , которое образует связи с нуклеофилами , принимая электронную пару . [1] Поскольку электрофилы принимают электроны, они являются кислотами Льюиса . [2] Большинство электрофилов заряжены положительно , имеют атом, который несет частичный положительный заряд, или имеют атом, который не имеет октета электронов.
Электрофилы в основном взаимодействуют с нуклеофилами посредством реакций присоединения и замещения . Часто встречающиеся электрофилы в органических синтезах включают катионы, такие как H + и NO + , поляризованные нейтральные молекулы, такие как HCl , алкилгалогениды , ацилгалогениды и карбонильные соединения , поляризуемые нейтральные молекулы, такие как Cl 2 и Br 2 , окислители, такие как органические надкислоты , химические виды, которые не удовлетворяют правилу октета , такие как карбены и радикалы , и некоторые кислоты Льюиса, такие как BH 3 и DIBAL .
Они происходят между алкенами и электрофилами, часто галогенами, как в реакциях присоединения галогенов . Обычные реакции включают использование бромной воды для титрования образца, чтобы вывести количество присутствующих двойных связей. Например, этен + бром → 1,2-дибромэтан :
Это происходит в форме трех основных шагов, показанных ниже; [3]
Этот процесс называется механизмом Ad E 2 («присоединение, электрофильное, второго порядка»). Йод (I 2 ), хлор (Cl 2 ), ион сульфенила (RS + ), катион ртути (Hg 2+ ) и дихлоркарбен (:CCl 2 ) также реагируют по схожим путям. Прямое превращение 1 в 3 произойдет, когда Br − будет в большом избытке в реакционной среде. Промежуточный ион β-бромкарбения может быть преобладающим вместо 3 , если алкен имеет заместитель, стабилизирующий катион, такой как фенильная группа. Есть пример выделения иона бромония 2 . [4]
Галогениды водорода, такие как хлористый водород (HCl), присоединяются к алкенам, давая алкилгалогениды при гидрогалогенировании . Например, реакция HCl с этиленом дает хлорэтан. Реакция протекает с промежуточным катионом, отличаясь от вышеуказанного присоединения галогена. Пример показан ниже:
Таким образом, стереоселективность продукта, то есть, с какой стороны будет атаковать Cl −, зависит от типов применяемых алкенов и условий реакции. По крайней мере, какой из двух атомов углерода будет атакован H +, обычно определяется правилом Марковникова . Таким образом, H + атакует атом углерода, который несет меньше заместителей, так что образуется более стабилизированный карбокатион (с более стабилизирующими заместителями).
Это еще один пример механизма Ad E 2. [5] Фтористый водород (HF) и иодистый водород (HI) реагируют с алкенами аналогичным образом, и будут приведены продукты типа Марковникова. Бромистый водород (HBr) также следует этому пути, но иногда конкурирует радикальный процесс, и может образовываться смесь изомеров. Хотя вводные учебники редко упоминают эту альтернативу, [6] механизм Ad E 2, как правило, конкурирует с механизмом Ad E 3 (более подробно описанным для алкинов ниже), в котором перенос протона и нуклеофильное присоединение происходят согласованным образом. Степень, в которой каждый путь вносит вклад, зависит от нескольких факторов, таких как природа растворителя (например, полярность), нуклеофильность галогенид-иона, стабильность карбокатиона и стерические эффекты. В качестве кратких примеров можно привести образование стерически необремененного, стабилизированного карбокатиона, благоприятствующего пути Ad E 2, в то время как более нуклеофильный ион брома благоприятствует пути Ad E 3 в большей степени по сравнению с реакциями с участием иона хлора. [7]
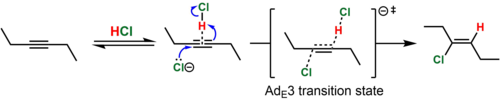
В случае диалкилзамещенных алкинов (например, 3-гексина) промежуточный винильный катион, который мог бы образоваться в результате этого процесса, крайне нестабилен. В таких случаях считается, что происходит одновременное протонирование (HCl) и атака алкина нуклеофилом (Cl−). Этот механистический путь известен под обозначением Ингольда Ad E 3 ( «присоединение, электрофильное, третьего порядка»). Поскольку одновременное столкновение трех химических видов в реакционной ориентации маловероятно, считается, что термомолекулярное переходное состояние достигается, когда нуклеофил атакует обратимо образованную слабую ассоциацию алкина и HCl. Такой механизм согласуется с преимущественно антиприсоединением (>15:1 анти : син для показанного примера) продукта гидрохлорирования и законом термомолекулярной скорости, Скорость = k [алкин][HCl] 2 . [8] [9] В поддержку предложенной ассоциации алкин-HCl, T-образный комплекс алкина и HCl был охарактеризован кристаллографически. [10]
Напротив, фенилпропин реагирует по механизму Ad E 2 ip («присоединение, электрофильное, второго порядка, ионная пара»), давая преимущественно син- продукт (~10:1 син : анти ). В этом случае промежуточный винильный катион образуется путем присоединения HCl, поскольку он резонансно стабилизирован фенильной группой. Тем не менее, время жизни этого высокоэнергетического вида короткое, и полученная ионная пара винильный катион-хлоридный анион немедленно разрушается, прежде чем хлоридный ион успевает покинуть оболочку растворителя, давая винилхлорид. Близость аниона к стороне винильного катиона, куда был добавлен протон, используется для обоснования наблюдаемого преобладания син- присоединения. [7]

Одна из наиболее сложных реакций гидратации использует серную кислоту в качестве катализатора . Эта реакция происходит аналогично реакции присоединения, но имеет дополнительный шаг, в котором группа OSO 3 H заменяется группой OH, образуя спирт:
Как видно, H 2 SO 4 принимает участие в общей реакции, однако остается неизменным, поэтому классифицируется как катализатор.
Вот более подробная реакция:
В целом этот процесс добавляет молекулу воды к молекуле этена.
Это важная реакция в промышленности, поскольку в результате ее получается этанол , который используется в качестве топлива и исходного материала для других химикатов.
Многие электрофилы хиральны и оптически стабильны . Обычно хиральные электрофилы также оптически чисты.
Одним из таких реагентов является органический катализатор, полученный из фруктозы, используемый в эпоксидировании Ши . [11] Катализатор может осуществлять высокоэнантиоселективное эпоксидирование транс -дизамещенных и тризамещенных алкенов . Катализатор Ши, кетон , окисляется стехиометрическим оксоном до активной диоксирановой формы перед продолжением каталитического цикла.

Оксазиридины, такие как хиральные N-сульфонилоксазиридины, вызывают энантиоселективное окисление кетона альфа на пути к сегментам AB-кольца различных природных продуктов , включая γ-родомиционон и α-цитромицинон. [12]
Полимерно-связанные хиральные селеновые электрофилы осуществляют асимметричные реакции селененилирования. [13] Реагенты представляют собой арилселененилбромиды, и они были впервые разработаны для химии в фазе раствора, а затем модифицированы для присоединения гранул твердой фазы через арилоксигруппу. Твердофазные реагенты были применены для селененилирования различных алкенов с хорошей энантиоселективностью. Продукты можно отщепить от твердого носителя с помощью восстанавливающих агентов на основе гидрида олова . Реагенты на твердом носителе имеют преимущества по сравнению с химией в фазе раствора из-за простоты обработки и очистки.
Существует несколько методов ранжирования электрофилов по степени реакционной способности [15] , и один из них был разработан Робертом Парром [14] с индексом электрофильности ω, заданным как:
с электроотрицательностью и химической твердостью . Это уравнение связано с классическим уравнением для электрической мощности :
где - сопротивление ( Ом или Ω), а - напряжение . В этом смысле индекс электрофильности является своего рода электрофильной силой. Обнаружены корреляции между электрофильностью различных химических соединений и скоростями реакций в биохимических системах и такими явлениями, как аллергический контактный дермит.
Индекс электрофильности также существует для свободных радикалов . [16] Сильно электрофильные радикалы, такие как галогены, реагируют с богатыми электронами реакционными центрами, а сильно нуклеофильные радикалы, такие как 2-гидроксипропил-2-ил и трет-бутил радикал, реагируют с предпочтением к бедным электронами реакционным центрам.
Суперэлектрофилы определяются как катионные электрофильные реагенты с существенно повышенной реакционной способностью в присутствии суперкислот . Эти соединения были впервые описаны Джорджем А. Олахом . [17] Суперэлектрофилы образуются как дважды электронодефицитный суперэлектрофил путем протосольватации катионного электрофила. Как наблюдал Олах, смесь уксусной кислоты и трифторида бора способна удалять гидрид-ион из изобутана при сочетании с фтористоводородной кислотой через образование суперкислоты из BF3 и HF . Ответственным реакционноспособным промежуточным продуктом является дикатион [CH3CO2H3 ] 2+ . Аналогично, метан может быть нитрирован до нитрометана с помощью тетрафторбората нитрония NO+
2БФ−
4только в присутствии сильной кислоты, такой как фторсерная кислота, через протонированный дикатион нитрония.
В гитонических ( гитонических ) суперэлектрофилах заряженные центры разделены не более чем одним атомом, например, ион протонитрония O=N + =O + —H (протонированный ион нитрония ). А в дистонических суперэлектрофилах они разделены 2 или более атомами, например, во фторирующем реагенте F-TEDA-BF 4 . [18]
{{cite book}}: CS1 maint: отсутствует местоположение издателя ( ссылка ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка ){{cite book}}: CS1 maint: несколько имен: список авторов ( ссылка )