Железо – химический элемент . Он имеет символ Fe (от латинского Ferrum «железо») и атомный номер 26. Это металл , принадлежащий к первому переходному ряду и 8-й группе периодической таблицы . По массе это самый распространенный элемент на Земле , образующий большую часть внешнего и внутреннего ядра Земли . Это четвертый по распространенности элемент в земной коре , который в основном откладывается метеоритами в металлическом состоянии.
Для извлечения полезного металла из железной руды требуются печи или печи , способные достигать температуры 1500 ° C (2730 ° F), что примерно на 500 ° C (932 ° F) выше, чем температура, необходимая для выплавки меди . Люди начали осваивать этот процесс в Евразии во 2-м тысячелетии до нашей эры, и использование железных инструментов и оружия начало вытеснять медные сплавы – в некоторых регионах только около 1200 года до нашей эры. Это событие считается переходом от бронзового века к железному веку . В современном мире сплавы железа, такие как сталь , нержавеющая сталь , чугун и специальные стали , на сегодняшний день являются наиболее распространенными промышленными металлами благодаря своим механическим свойствам и низкой стоимости. Таким образом, черная и сталелитейная промышленность очень важна с экономической точки зрения, а железо является самым дешевым металлом, цена которого составляет несколько долларов за килограмм или фунт.
Нетронутые и гладкие поверхности из чистого железа имеют зеркальный серебристо-серый цвет. Железо легко реагирует с кислородом и водой с образованием гидратированных оксидов железа от коричневого до черного цвета , широко известных как ржавчина . В отличие от оксидов некоторых других металлов, которые образуют пассивирующие слои, ржавчина занимает больший объем, чем металл, и поэтому отслаивается, открывая больше свежих поверхностей для коррозии. С химической точки зрения наиболее распространенными степенями окисления железа являются железо(II) и железо(III) . Железо разделяет многие свойства других переходных металлов, включая другие элементы 8-й группы , рутений и осмий . Железо образует соединения в широком диапазоне степеней окисления , от –4 до +7. Железо также образует множество координационных соединений ; некоторые из них, такие как ферроцен , ферриоксалат и берлинская лазурь, имеют важное промышленное, медицинское или исследовательское применение.
В организме взрослого человека содержится около 4 граммов (0,005% массы тела) железа, преимущественно в гемоглобине и миоглобине . Эти два белка играют важную роль в транспортировке кислорода кровью и хранении кислорода в мышцах . Для поддержания необходимого уровня метаболизм железа у человека требует минимума железа в рационе. Железо также является металлом в активном центре многих важных окислительно-восстановительных ферментов, участвующих в клеточном дыхании , окислении и восстановлении у растений и животных. [9]

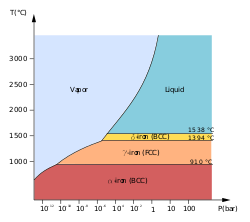
Известны по крайней мере четыре аллотропа железа (различное расположение атомов в твердом теле), условно обозначаемые α , γ , δ и ε .
Первые три формы наблюдаются при обычных давлениях. Когда расплавленное железо остывает после точки замерзания 1538 ° C, оно кристаллизуется в свой δ-аллотроп, который имеет объемноцентрированную кубическую (ОЦК) кристаллическую структуру . По мере дальнейшего охлаждения до 1394 ° C он превращается в аллотроп γ-железа, гранецентрированную кубическую (ГЦК) кристаллическую структуру или аустенит . При температуре 912 °C и ниже кристаллическая структура снова становится аллотропом ОЦК α-железа. [10]
Физические свойства железа при очень высоких давлениях и температурах также широко изучались [11] [12] из-за их значимости для теорий о ядрах Земли и других планет. При давлении выше примерно 10 ГПа и температуре в несколько сотен кельвинов или меньше α-железо превращается в другую гексагональную плотноупакованную (ГПУ) структуру, которая также известна как ε-железо . γ-фаза с более высокой температурой также превращается в ε-железо, но происходит это при более высоком давлении.
Существуют некоторые противоречивые экспериментальные данные о стабильной β- фазе при давлениях выше 50 ГПа и температурах не менее 1500 К. Предполагается, что она имеет ромбическую или двойную ГПУ-структуру. [13] (Что сбивает с толку, термин «β-железо» иногда также используется для обозначения α-железа выше точки Кюри, когда оно меняется с ферромагнитного на парамагнитное, хотя его кристаллическая структура не изменилась. [10] ).
Обычно полагают , что внутреннее ядро Земли состоит из железо - никелевого сплава со структурой ε (или β). [14]
Точки плавления и кипения железа, а также его энтальпия атомизации ниже, чем у более ранних 3d-элементов, от скандия до хрома , что указывает на меньший вклад 3d-электронов в металлическую связь, поскольку они все больше и больше притягиваются к инертной среде. ядро за ядром; Однако в [15] они выше, чем значения для предыдущего элемента марганца, поскольку этот элемент имеет наполовину заполненную 3d подоболочку и, следовательно, его d-электроны нелегко делокализовать. Та же самая тенденция наблюдается для рутения, но не для осмия . [16]
Температура плавления железа экспериментально хорошо определена при давлениях менее 50 ГПа. Для более высоких давлений опубликованные данные (по состоянию на 2007 год) по-прежнему различаются на десятки гигапаскалей и более тысячи кельвинов. [17]

Ниже точки Кюри 770 ° C (1420 ° F; 1040 К) α-железо меняется с парамагнитного на ферромагнитное : спины двух неспаренных электронов в каждом атоме обычно совпадают со спинами его соседей, создавая общее магнитное поле. . [19] Это происходит потому, что орбитали этих двух электронов (d z 2 и d x 2 - y 2 ) не направлены в сторону соседних атомов в решетке и, следовательно, не участвуют в металлической связи. [10]
В отсутствие внешнего источника магнитного поля атомы спонтанно разделяются на магнитные домены диаметром около 10 микрометров [20] , так что атомы в каждом домене имеют параллельные спины, но некоторые домены имеют другую ориентацию. Таким образом, макроскопический кусок железа будет иметь почти нулевое общее магнитное поле.
Приложение внешнего магнитного поля приводит к тому, что домены, намагниченные в одном направлении, растут за счет соседних доменов, направленных в других направлениях, усиливая внешнее поле. Этот эффект используется в устройствах, которым необходимо направлять магнитные поля для выполнения конструктивных функций, таких как электрические трансформаторы , головки магнитной записи и электродвигатели . Примеси, дефекты решетки или границы зерен и частиц могут «закрепить» домены в новых положениях, так что эффект сохраняется даже после удаления внешнего поля, превращая таким образом железный предмет в (постоянный) магнит . [19]
Подобное поведение демонстрируют некоторые соединения железа, такие как ферриты , включая минерал магнетит , кристаллическую форму смешанного оксида железа (II,III) Fe 3 O 4 (хотя механизм атомного масштаба, ферримагнетизм , несколько иной). Кусочки магнетита с естественной постоянной намагниченностью ( магниты ) служили самыми ранними компасами для навигации. Частицы магнетита широко использовались в носителях магнитной записи, таких как сердечники памяти , магнитные ленты , дискеты и диски , пока они не были заменены материалами на основе кобальта .
Железо имеет четыре стабильных изотопа : Fe 54 (5,845% природного железа), Fe 56 (91,754%), Fe 57 (2,119%) и Fe 58 (0,282%). Также были созданы двадцать четыре искусственных изотопа. Из этих стабильных изотопов только 57 Fe имеет ядерный спин (− 1 ⁄ 2 ). Нуклид 54 Fe теоретически может подвергаться двойному захвату электронов на 54 Cr, но этот процесс никогда не наблюдался , и был установлен только нижний предел периода полураспада 3,1×10 22 года. [21]
60 Fe – потухший радионуклид с длительным периодом полураспада (2,6 миллиона лет). [22] Он не встречается на Земле, но его конечным продуктом распада является его внучка, стабильный нуклид 60 Ni . [21] Большая часть прошлых работ по изотопному составу железа была сосредоточена на нуклеосинтезе 60 Fe посредством изучения метеоритов и рудообразования. За последнее десятилетие достижения масс-спектрометрии позволили обнаружить и количественно оценить мельчайшие, естественные изменения в соотношениях стабильных изотопов железа. Большая часть этой работы проводится сообществами ученых о Земле и планетах , хотя появляются приложения для биологических и промышленных систем. [23]
В фазах метеоритов Семаркона и Черный Кут корреляция между концентрацией 60 Ni, внучки 60 Fe, и обилием стабильных изотопов железа свидетельствовала о существовании 60 Fe во время формирования Солнечной системы . . Возможно, энергия, выделяющаяся при распаде 60 Fe, наряду с энергией , выделяемой 26 Al , способствовала переплавлению и дифференциации астероидов после их образования 4,6 миллиарда лет назад. Обилие 60 Ni, присутствующего во внеземном материале, может способствовать дальнейшему пониманию происхождения и ранней истории Солнечной системы . [24]
Самый распространенный изотоп железа 56 Fe представляет особый интерес для ученых-ядерщиков, поскольку он представляет собой наиболее распространенную конечную точку нуклеосинтеза . [25] Поскольку 56 Ni (14 альфа-частиц ) легко образуется из более лёгких ядер в альфа-процессе в ядерных реакциях в сверхновых (см. Процесс горения кремния ), он является конечной точкой термоядерных цепей внутри чрезвычайно массивных звёзд , поскольку добавление ещё одного альфа-частицы частица, в результате которой образуется 60 Zn, требует гораздо больше энергии. Этот 56 Ni, период полураспада которого составляет около 6 дней, создается в больших количествах в этих звездах, но вскоре распадается в результате двух последовательных выбросов позитронов в продуктах распада сверхновой в остаточном газовом облаке сверхновой, сначала до радиоактивного 56 Co, а затем до стабильного 56 Fe. Таким образом, железо является наиболее распространенным элементом в ядре красных гигантов , а также наиболее распространенным металлом в железных метеоритах и в плотных металлических ядрах планет, таких как Земля . [26] Он также очень распространен во Вселенной по сравнению с другими стабильными металлами примерно того же атомного веса . [26] [27] Железо является шестым по распространенности элементом во Вселенной и наиболее распространенным тугоплавким элементом. [28]
Хотя еще один небольшой выигрыш в энергии можно было бы получить за счет синтеза 62 Ni , энергия связи которого немного выше, чем у 56 Fe, условия в звездах для этого процесса непригодны. Производство элементов в сверхновых в значительной степени благоприятствует железу, а не никелю, и в любом случае 56 Fe по-прежнему имеет меньшую массу на нуклон, чем 62 Ni, из-за более высокой доли более легких протонов. [29] Следовательно, для образования элементов тяжелее железа требуется сверхновая , включающая быстрый захват нейтронов с помощью запуска ядер 56 Fe. [26]
В далеком будущем Вселенной, если предположить, что распада протона не произойдет, холодный синтез , происходящий посредством квантового туннелирования , приведет к слиянию легких ядер обычной материи в ядра 56 Fe. Деление и испускание альфа-частиц затем приведет к распаду тяжелых ядер на железо, превращая все объекты звездной массы в холодные сферы из чистого железа. [30]
Изобилие железа на каменистых планетах, таких как Земля, обусловлено его обильным производством во время безудержного синтеза и взрыва сверхновых типа Ia , которые рассеивают железо в космос. [31] [32]

Металлическое или самородное железо редко встречается на поверхности Земли, поскольку оно склонно к окислению. Однако считается, что как внутреннее , так и внешнее ядро Земли , которые вместе составляют 35% массы всей Земли, состоят в основном из сплава железа, возможно, с никелем . Считается, что электрические токи в жидком внешнем ядре являются источником магнитного поля Земли . Считается, что другие планеты земной группы ( Меркурий , Венера и Марс ), а также Луна имеют металлическое ядро, состоящее в основном из железа. Также считается, что астероиды М-типа частично или в основном состоят из металлического сплава железа .
Редкие железные метеориты являются основной формой природного металлического железа на поверхности Земли. Предметы из холоднообработанного метеоритного железа были найдены в различных археологических памятниках, датируемых временем, когда выплавка железа еще не была развита; Сообщается, что инуиты в Гренландии использовали железо из метеорита Кейп-Йорк для изготовления инструментов и охотничьего оружия. [33] Примерно 1 из 20 метеоритов состоит из уникальных железо-никелевых минералов тэнита (35–80% железа) и камасита (90–95% железа). [34] Самородное железо также редко встречается в базальтах, образовавшихся из магмы, вступившей в контакт с богатыми углеродом осадочными породами, в которых фугитивность кислорода снизилась настолько, что железо могло кристаллизоваться. Оно известно как теллурическое железо и описано в нескольких местах, таких как остров Диско в Западной Гренландии, Якутия в России и Бюль в Германии. [35]
Ферропериклаз (Mg,Fe)O , твердый раствор периклаза (MgO) и вюстита (FeO), составляет около 20% объема нижней мантии Земли, что делает его второй по распространенности минеральной фазой в этом регионе. после силикатного перовскита (Mg,Fe)SiO 3 ; он также является основным хозяином железа в нижней мантии. [36] В нижней части переходной зоны мантии реакция γ- (Mg,Fe) 2 [SiO 4 ] ↔ (Mg,Fe)[SiO 3 ] + (Mg,Fe)O превращает γ-оливин в смесь силиката перовскита и ферропериклаза и наоборот. В литературе эту минеральную фазу нижней мантии также часто называют магнезиовюститом. [37] Силикатный перовскит может составлять до 93% нижней мантии, [38] а магниево-железная форма (Mg,Fe)SiO 3 считается наиболее распространенным минералом на Земле, составляя 38% его объем. [39]

Хотя железо является наиболее распространенным элементом на Земле, большая часть этого железа сосредоточена во внутреннем и внешнем ядрах. [40] [41] Доля железа, находящегося в земной коре, составляет лишь около 5% от общей массы земной коры и, таким образом, является лишь четвертым по распространенности элементом в этом слое (после кислорода , кремния и алюминия ). [42]
Большая часть железа в земной коре соединяется с различными другими элементами, образуя множество минералов железа . Важным классом являются минералы оксидов железа , такие как гематит (Fe 2 O 3 ), магнетит (Fe 3 O 4 ) и сидерит (FeCO 3 ), которые являются основными рудами железа . Многие магматические породы также содержат сульфидные минералы пирротин и пентландит . [43] [44] Во время выветривания железо имеет тенденцию выщелачиваться из сульфидных отложений в виде сульфата и из силикатных отложений в виде бикарбоната. Оба они окисляются в водном растворе и осаждаются даже при слегка повышенном pH в виде оксида железа (III) . [45]

Крупные месторождения железа представляют собой полосчатые железные образования , тип горной породы, состоящий из повторяющихся тонких слоев оксидов железа, чередующихся с полосами бедных железом сланцев и кремней . Полосчатые железные образования образовались между 3700 миллионами лет и 1800 миллионами лет назад . [46] [47]
Материалы, содержащие тонкоизмельченные оксиды или оксиды-гидроксиды железа(III), такие как охра , использовались в качестве желтых, красных и коричневых пигментов с доисторических времен. Они также вносят свой вклад в цвет различных горных пород и глин , включая целые геологические образования, такие как Пейнтед-Хиллз в Орегоне и Бунцандштейн («цветной песчаник», британский Бантер ). [48] Через Айзенсандштайн ( юрский «железный песчаник», например, из Донцдорфа в Германии) [49] и камень Бат в Великобритании, соединения железа ответственны за желтоватый цвет многих исторических зданий и скульптур. [50] Пресловутый красный цвет поверхности Марса обусловлен реголитом , богатым оксидом железа . [51]
Значительные количества железа содержатся в сульфидном минерале пирите (FeS 2 ), но из него трудно извлечь железо, и поэтому он не разрабатывается. [52] На самом деле железо настолько распространено, что производство обычно сосредоточено только на рудах с очень большим его содержанием. [53]
Согласно отчету «Запасы металлов в обществе » , подготовленному Международной группой ресурсов , глобальные запасы железа, используемого обществом, составляют 2200 кг на душу населения. Более развитые страны в этом отношении отличаются от менее развитых (7 000–14 000 против 2 000 кг на душу населения). [54]
Наука об океане продемонстрировала роль железа в древних морях как в морской биоте, так и в климате. [55]
Железо демонстрирует характерные химические свойства переходных металлов , а именно способность образовывать переменные степени окисления, различающиеся на одну ступень, а также очень большую координацию и металлоорганическую химию : действительно, именно открытие соединения железа, ферроцена , произвело революцию в последнем. поле в 1950-х годах. [57] Железо иногда считают прототипом всего блока переходных металлов из-за его распространенности и огромной роли, которую оно сыграло в технологическом прогрессе человечества. [58] Его 26 электронов расположены в конфигурации [Ar]3d 6 4s 2 , из которых 3d и 4s электроны относительно близки по энергии, и, таким образом, некоторое количество электронов может быть ионизировано. [16]
Железо образует соединения преимущественно в степенях окисления +2 ( железо(II) , «железо») и +3 ( железо(III) , «железо»). Железо также встречается в более высоких степенях окисления , например, в пурпурном феррате калия (K 2 FeO 4 ), который содержит железо в степени окисления +6. Анион [FeO 4 ] – с железом в степени окисления +7 вместе с пероксо-изомером железа(V) был обнаружен методом инфракрасной спектроскопии при 4 К после соконденсации атомов железа, подвергнутых лазерной абляции, со смесью O 2 /Ар. [59] Железо(IV) является распространенным промежуточным продуктом во многих биохимических реакциях окисления. [60] [61] Многие железоорганические соединения содержат формальные степени окисления +1, 0, -1 или даже -2. Степень окисления и другие свойства связи часто оценивают с помощью метода мессбауэровской спектроскопии . [62] Многие соединения смешанной валентности содержат как центры железа (II), так и железа (III), такие как магнетит и берлинская лазурь ( Fe 4 (Fe[CN] 6 ) 3 ). [61] Последний используется в чертежах как традиционный «синий» . [63]
Железо является первым из переходных металлов, который не может достичь степени группового окисления +8, хотя его более тяжелые родственные соединения рутений и осмий могут, причем рутению это удается с большей трудностью, чем осмию. [10] Рутений проявляет водную катионную химию в низких степенях окисления, аналогичных железу, но осмий этого не делает, отдавая предпочтение высоким степеням окисления, в которых он образует анионные комплексы. [10] Во второй половине серии 3d-перехода вертикальные сходства вниз по группам конкурируют с горизонтальными сходствами железа с его соседями кобальтом и никелем в периодической таблице, которые также являются ферромагнитными при комнатной температуре и имеют схожий химический состав. Таким образом, железо, кобальт и никель иногда объединяют в триаду железа . [58]
В отличие от многих других металлов железо не образует амальгамы с ртутью . В результате ртуть продается в стандартных железных колбах емкостью 76 фунтов (34 кг). [64]
Железо, безусловно, является наиболее реакционноспособным элементом в своей группе; в тонкоизмельченном состоянии он пирофорен и легко растворяется в разбавленных кислотах с образованием Fe 2+ . Однако он не реагирует с концентрированной азотной кислотой и другими кислотами-окислителями из-за образования непроницаемого оксидного слоя, который, тем не менее, может реагировать с соляной кислотой . [10] Железо высокой чистоты, называемое электролитическим железом , считается устойчивым к ржавчине благодаря своему оксидному слою.
Железо образует различные оксидные и гидроксидные соединения ; наиболее распространенными являются оксид железа(II,III) (Fe 3 O 4 ) и оксид железа (III) (Fe 2 O 3 ). Оксид железа(II) также существует, хотя он нестабилен при комнатной температуре. Несмотря на названия, на самом деле все они представляют собой нестехиометрические соединения , состав которых может различаться. [65] Эти оксиды являются основными рудами для производства железа (см. Блумеры и доменные печи). Они также используются в производстве ферритов , полезных магнитных носителей информации в компьютерах и пигментов. Самый известный сульфид — железный пирит (FeS 2 ), также известный как «золото дураков» из-за его золотого блеска. [61] Это не соединение железа(IV), а на самом деле полисульфид железа(II) , содержащий Fe 2+ и S.2−
2ионы в искаженной структуре хлорида натрия . [65]

_chloride_hexahydrate.jpg/440px-Iron(III)_chloride_hexahydrate.jpg)
Бинарные галогениды железа и железа хорошо известны. Галогениды железа обычно возникают в результате обработки металлического железа соответствующей галоидоводородной кислотой с образованием соответствующих гидратированных солей. [61]
Железо реагирует с фтором, хлором и бромом с образованием соответствующих галогенидов железа, наиболее распространенным из которых является хлорид железа . [66]
Исключением является йодид железа , термодинамически нестабильный из-за окислительной способности Fe 3+ и высокой восстановительной способности I − : [66]
Йодид железа, черное твердое вещество, нестабилен в обычных условиях, но может быть получен реакцией пентакарбонила железа с йодом и окисью углерода в присутствии гексана и света при температуре -20 °C, без кислорода и воды. . [66] Известно, что комплексы йодистого железа с некоторыми мягкими основаниями являются устойчивыми соединениями. [67] [68]

Стандартные потенциалы восстановления в кислом водном растворе для некоторых распространенных ионов железа приведены ниже: [10]
Красно-фиолетовый тетраэдрический ферратный анион (VI) является настолько сильным окислителем, что окисляет аммиак до азота (N 2 ) и воду до кислорода: [66]
Бледно-фиолетовый гексаводокомплекс [ Fe(H 2 O) 6 ] 3+ представляет собой кислоту, которая при pH выше 0 полностью гидролизуется: [69]
-sulfate-heptahydrate-sample.jpg/440px-Iron(II)-sulfate-heptahydrate-sample.jpg)
При повышении pH выше 0 образуются вышеуказанные гидролизованные соединения желтого цвета, а при повышении pH выше 2–3 из раствора выпадает в осадок красновато-коричневый водный оксид железа (III) . Хотя Fe 3+ имеет конфигурацию ad 5 , его спектр поглощения не похож на спектр поглощения Mn 2+ с его слабыми спин-запрещенными d–d-зонами, поскольку Fe 3+ имеет более высокий положительный заряд и обладает большей поляризацией, что снижает энергию его поглощение с переносом заряда от лиганда к металлу . Таким образом, все вышеперечисленные комплексы, за единственным исключением гексаво-иона, довольно сильно окрашены, и даже он имеет спектр, в котором преобладает перенос заряда в ближней ультрафиолетовой области. [69] С другой стороны, бледно-зеленый гексаво-ион железа(II) [Fe(H 2 O) 6 ] 2+ не подвергается заметному гидролизу. Диоксид углерода не выделяется при добавлении карбонат- анионов, что вместо этого приводит к выпадению в осадок белого карбоната железа (II) . В избытке углекислого газа образуется малорастворимый бикарбонат, который обычно встречается в грунтовых водах, но быстро окисляется на воздухе с образованием оксида железа (III) , который является причиной коричневых отложений, присутствующих в значительном количестве потоков. [70]
Благодаря своему электронному строению железо имеет очень большую координационную и металлоорганическую химию.

Известны многие координационные соединения железа. Типичным шестикоординационным анионом является гексахлорферрат(III), [FeCl 6 ] 3- , обнаруженный в смешанной соли тетракис(метиламмоний) гексахлорферрат(III) хлорид . [71] [72] Комплексы с несколькими бидентатными лигандами имеют геометрические изомеры . Например, комплекс транс - хлоргидридобис(бис-1,2-(дифенилфосфино)этан)железа(II) используется в качестве исходного материала для соединений с фрагментом Fe( dppe ) 2 . [73] [74] Ион ферриоксалата с тремя оксалатными лигандами демонстрирует спиральную хиральность с двумя неперекрывающимися геометриями, обозначенными Λ (лямбда) для левой винтовой оси и Δ (дельта) для правой винтовой оси, в соответствии с с конвенциями ИЮПАК. [69] Ферриоксалат калия используется в химической актинометрии и вместе с его натриевой солью подвергается фотовосстановлению , применяемому в фотографических процессах старого образца. Дигидрат оксалата железа (II) имеет полимерную структуру с копланарными ионами оксалата, соединяющими центры железа с кристаллизационной водой, образующей шапки каждого октаэдра, как показано ниже. [75]

iron(III)_chloride.jpg/440px-Pentaaqua(thiocyanato)iron(III)_chloride.jpg)
Комплексы железа(III) очень похожи на комплексы хрома (III), за исключением того, что железо(III) предпочитает O -донорные лиганды вместо N -донорных. Последние, как правило, более нестабильны, чем комплексы железа(II), и часто диссоциируют в воде. Многие комплексы Fe-O имеют интенсивный цвет и используются в качестве тестов на фенолы или енолы . Например, в тесте с хлоридом железа , используемом для определения присутствия фенолов, хлорид железа (III) реагирует с фенолом с образованием темно-фиолетового комплекса: [69]
Среди галогенидных и псевдогалогенидных комплексов наиболее устойчивы фторокомплексы железа(III), причем наиболее устойчив в водном растворе бесцветный [FeF 5 (H 2 O)] 2- . Хлоркомплексы менее стабильны и склонны к тетраэдрической координации, как в [FeCl 4 ] - ; [FeBr 4 ] - и [FeI 4 ] - легко восстанавливаются до железа(II). Тиоцианат является распространенным тестом на наличие железа(III), поскольку он образует кроваво-красный [Fe(SCN)(H 2 O) 5 ] 2+ . Как и марганец(II), большинство комплексов железа(III) являются высокоспиновыми, за исключением тех, у которых лиганды занимают высокие позиции в спектрохимическом ряду, такие как цианид . Примером низкоспинового комплекса железа(III) является [Fe(CN) 6 ] 3- . Железо демонстрирует большое разнообразие электронных спиновых состояний , включая все возможные значения спинового квантового числа для элемента d-блока от 0 (диамагнитный) до 5 ⁄ 2 (5 неспаренных электронов). Эта величина всегда равна половине числа неспаренных электронов. Комплексы с нулевым или двумя неспаренными электронами считаются низкоспиновыми, а с четырьмя или пятью — высокоспиновыми. [65]
Комплексы железа(II) менее стабильны, чем комплексы железа(III), но предпочтение O -донорных лигандов менее выражено, так что, например, известно [Fe(NH 3 ) 6 ] 2+ , тогда как [Fe(NH 3 ) 6 ] 3+ нет. Они имеют тенденцию к окислению до железа (III), но это можно смягчить за счет низкого pH и использования определенных лигандов. [70]

Железоорганическая химия — это изучение металлоорганических соединений железа, в которых атомы углерода ковалентно связаны с атомом металла. Они многочисленны и разнообразны, включая цианидные комплексы , карбонильные комплексы , сэндвич- и полусэндвичевые соединения .

Берлинская лазурь или «ферроцианид железа», Fe 4 [Fe(CN) 6 ] 3 , представляет собой старый и хорошо известный комплекс цианида железа, широко используемый в качестве пигмента и в ряде других применений. Его образование можно использовать в качестве простого химического теста для различения водных растворов Fe 2+ и Fe 3+ , поскольку они реагируют (соответственно) с феррицианидом калия и ферроцианидом калия с образованием берлинской лазури. [61]
Другим старым примером железоорганического соединения является пентакарбонил железа Fe(CO) 5 , в котором нейтральный атом железа связан с атомами углерода пяти молекул монооксида углерода . Соединение можно использовать для получения порошка карбонильного железа , высокореактивной формы металлического железа. Термолиз пентакарбонила железа дает додекакарбонил трижелеза Fe 3 ( CO) 12 , комплекс с кластером из трех атомов железа в ядре. Реактив Коллмана, тетракарбонилферрат динатрия , является полезным реагентом в органической химии; он содержит железо в степени окисления -2. Димер дикарбонила циклопентадиенилирона содержит железо в редкой степени окисления +1. [76]
Вехой в этой области стало открытие в 1951 году удивительно стабильного сэндвич-соединения ферроцена Fe(C 5 H 5 ) 2 Паусоном и Кили [77] и независимо Миллером и его коллегами [78] , чья удивительная молекулярная структура была определена только год спустя Вудворд и Уилкинсон [79] и Фишер . [80] Ферроцен по-прежнему остается одним из наиболее важных инструментов и моделей в этом классе. [81]
В качестве катализаторов используются железоцентрированные металлоорганические соединения . Комплекс Кнёлкера , например, является катализатором гидрирования кетонов . [82]
Наиболее широко в промышленности производятся соединения железа: сульфат железа(II) (FeSO 4 ·7 H 2 O ) и хлорид железа(III) (FeCl 3 ). Первый является одним из наиболее доступных источников железа(II), но менее устойчив к воздушному окислению, чем соль Мора ( (NH 4 ) 2 Fe(SO 4 ) 2 ·6H 2 O ). Соединения железа(II) имеют тенденцию окисляться на воздухе до соединений железа(III). [61]
Железо — один из элементов, несомненно известных древнему миру. [83] Это создавалось на протяжении тысячелетий. Однако железные артефакты большого возраста встречаются гораздо реже, чем предметы из золота или серебра, из-за легкости, с которой железо корродирует. [84] Технология развивалась медленно, и даже после открытия плавки железа потребовалось много столетий, чтобы железо заменило бронзу в качестве металла для инструментов и оружия.

Бусы, изготовленные из метеоритного железа в 3500 г. до н. э. или ранее, были найдены в Герце (Египет) Г. А. Уэйнрайтом . [85] Бусины содержат 7,5% никеля, что является признаком метеоритного происхождения, поскольку железо, обнаруженное в земной коре, обычно содержит лишь незначительные примеси никеля.
Метеоритное железо высоко ценилось из-за своего происхождения на небесах и часто использовалось для ковки оружия и инструментов. [85] Например, в гробнице Тутанхамона был найден кинжал , сделанный из метеоритного железа , содержащий такие же пропорции железа, кобальта и никеля, что и метеорит, обнаруженный в этом районе, отложенный древним метеоритным дождем. [86] [87] [88] Предметы, которые, вероятно, были сделаны египтянами из железа, датируются периодом с 3000 по 2500 год до нашей эры. [84]
Метеоритное железо сравнительно мягкое и пластичное, его легко ковать в холодном состоянии , но оно может стать хрупким при нагревании из-за содержания никеля . [89]

Первое производство железа началось в эпоху средней бронзы , но прошло несколько столетий, прежде чем железо вытеснило бронзу. Образцы выплавленного железа из Асмара , Месопотамии и базара Талль-Чагар на севере Сирии были изготовлены где-то между 3000 и 2700 годами до нашей эры. [90] Хетты основали империю в северо-центральной Анатолии около 1600 г. до н.э. Похоже, они первыми поняли, как производить железо из руд, и высоко ценят это в своем обществе. [91] Хетты начали выплавлять железо между 1500 и 1200 годами до нашей эры, и эта практика распространилась на остальную часть Ближнего Востока после падения их империи в 1180 году до нашей эры . [90] Последующий период называется железным веком .
Артефакты выплавленного железа обнаружены в Индии , датируемые 1800–1200 гг. до н.э. [92] и в Леванте примерно с 1500 г. до н.э. (что позволяет предположить, что плавка осуществлялась в Анатолии или на Кавказе ). [93] [94] Предполагаемые ссылки (сравните историю металлургии в Южной Азии ) на железо в индийских Ведах использовались для утверждений об очень раннем использовании железа в Индии, соответственно, для датировки текстов как таковых. Термин « айас» (металл) в Ригведе относится к меди, тогда как железо, которое называется шьяма-аяс , буквально «черная медь», впервые упоминается в постригведической Атхарваведе . [95]
Некоторые археологические данные свидетельствуют о том, что железо выплавляли в Зимбабве и Юго-Восточной Африке еще в восьмом веке до нашей эры. [96] Обработка железа была завезена в Грецию в конце 11 века до нашей эры, откуда она быстро распространилась по всей Европе. [97]

Распространение обработки железа в Центральной и Западной Европе связано с кельтской экспансией. По словам Плиния Старшего , использование железа было обычным явлением в римскую эпоху. [85] На землях того, что сейчас считается Китаем, железо появляется примерно в 700–500 гг. до н.э. [98] Выплавка железа, возможно, была завезена в Китай через Центральную Азию. [99] Самые ранние свидетельства использования доменной печи в Китае относятся к 1 веку нашей эры, [100] а вагранки использовались еще в период Воюющих царств (403–221 до н.э.). [101] Использование доменной и ваграночной печи оставалось широко распространенным во времена династий Тан и Сун . [102]
Во время промышленной революции в Великобритании Генри Корт начал перерабатывать чугун из чугуна в кованое (или прутковое железо), используя инновационные производственные системы. В 1783 году он запатентовал метод очистки железной руды. Позже он был улучшен другими, в том числе Джозефом Холлом . [103]
Чугун был впервые произведен в Китае в V веке до нашей эры, [104] но почти не появлялся в Европе до средневекового периода. [105] [106] Самые ранние чугунные артефакты были обнаружены археологами на территории современного округа Лухэ провинции Цзянсу в Китае. Чугун использовался в древнем Китае для войны, сельского хозяйства и архитектуры. [107] В средневековый период в Европе были найдены средства производства кованого железа из чугуна (в данном контексте известного как чугун ) с использованием кузниц для украшения . Для всех этих процессов в качестве топлива требовался древесный уголь . [108]

Средневековые доменные печи имели высоту около 10 футов (3,0 м) и были сделаны из огнеупорного кирпича; принудительная подача воздуха обычно обеспечивалась с помощью сильфонов с ручным управлением. [106] Современные доменные печи стали намного больше: их горны составляют четырнадцать метров в диаметре, что позволяет им производить тысячи тонн железа каждый день, но по сути они работают почти так же, как и в средневековые времена. [108]
В 1709 году Авраам Дарби I основал коксовую доменную печь для производства чугуна, заменив древесный уголь, хотя и продолжал использовать доменные печи. Последующая доступность недорогого железа стала одним из факторов, приведших к промышленной революции . К концу XVIII века чугун стал заменять для определенных целей кованое железо, поскольку оно было дешевле. Содержание углерода в железе не считалось причиной различий в свойствах кованого железа, чугуна и стали до 18 века. [90]
Поскольку железо становилось дешевле и его было больше, оно также стало основным конструкционным материалом после строительства первого инновационного железного моста в 1778 году. Этот мост до сих пор стоит как памятник роли, которую железо сыграло в промышленной революции. После этого железо стали использовать в рельсах, лодках, кораблях, акведуках и зданиях, а также в железных цилиндрах паровых двигателей . [108] Железные дороги сыграли центральную роль в формировании современности и идей прогресса [109] и в различных языках железные дороги называются железной дорогой (например, французский chemin defer , немецкий Eisenbahn , турецкий demiryolu , русский железная дорога , китайский, японский и корейский鐵道, вьетнамский đường sắt ).
Сталь (с меньшим содержанием углерода, чем в чугуне, но с большим, чем в кованом железе) впервые была произведена в древности с использованием блюмера . К 1000 году до нашей эры кузнецы в Луристане на западе Персии производили хорошую сталь. [90] Затем около 300 г. до н. э. и 500 г. н. э. соответственно были разработаны улучшенные версии: сталь Wootz в Индии и дамасская сталь . Эти методы были специализированными, поэтому сталь не стала основным товаром до 1850-х годов. [110]
Новые методы его производства путем цементации железных прутков в процессе цементации были разработаны в 17 веке. Во время промышленной революции были разработаны новые методы производства пруткового железа без использования древесного угля, которые позже были применены для производства стали. В конце 1850-х годов Генри Бессемер изобрел новый процесс производства стали, включающий продувку воздухом расплавленного чугуна для производства мягкой стали. Это сделало сталь намного более экономичной, в результате чего кованое железо больше не производилось в больших количествах. [111]
В 1774 году Антуан Лавуазье использовал реакцию водяного пара с металлическим железом внутри раскаленной железной трубки для получения водорода в своих экспериментах, которые привели к демонстрации сохранения массы , что сыграло важную роль в превращении химии из качественной науки в количественную. [112]
.jpg/440px-Eisernes_Kreuz_(1914).jpg)
Железо играет определенную роль в мифологии и нашло различное использование в качестве метафоры и в фольклоре . Греческий поэт Гесиод в « Трудах и днях» (строки 109–201) перечисляет разные возрасты человека, названные в честь таких металлов, как золото, серебро, бронза и железо , чтобы объяснить последовательные эпохи человечества. [113] Железный век был тесно связан с Римом, и в «Метаморфозах» Овидия
Добродетели в отчаянии покинули землю; и порочность человека становится всеобщей и полной. Тогда твердая сталь добилась успеха.
- Овидий, Метаморфозы , Книга I, Железный век, строка 160 и далее.
Пример важности символической роли железа можно найти в Германской кампании 1813 года . Тогда Фридрих Вильгельм III заказал первый Железный крест в качестве военной награды. Пик производства железных украшений в Берлине пришелся на период с 1813 по 1815 год, когда прусская королевская семья призвала граждан жертвовать золотые и серебряные украшения на военные нужды. Надпись Ich gab Gold für Eisen («Я отдал золото за железо») также использовалась в более поздних военных действиях. [114]

Для некоторых ограниченных целей, когда это необходимо, чистое железо производится в лаборатории в небольших количествах путем восстановления чистого оксида или гидроксида водородом или образования пентакарбонила железа и нагревания его до 250 ° C, чтобы оно разложилось с образованием чистого порошка железа. . [45] Другой метод — электролиз хлорида железа на железном катоде. [115]
В настоящее время промышленное производство чугуна или стали состоит из двух основных этапов. На первом этапе железная руда восстанавливается коксом в доменной печи , а расплавленный металл отделяется от грубых примесей, таких как силикатные минералы . На этом этапе получается сплав — чугун , который содержит относительно большое количество углерода. На втором этапе количество углерода в чугуне снижается за счет окисления, в результате чего получается кованое железо, сталь или чугун. [117] На этом этапе могут быть добавлены другие металлы для получения легированных сталей .
Доменную печь загружают железными рудами, обычно гематитом Fe 2 O 3 или магнетитом Fe 3 O 4 , а также коксом ( углем , отдельно обожженным для удаления летучих компонентов) и флюсом ( известняком или доломитом ). Через смесь продувают «порывы» воздуха, предварительно нагретого до 900 °C (иногда с обогащением кислородом), в количестве, достаточном для превращения углерода в окись углерода : [117]
Эта реакция повышает температуру примерно до 2000 °C. Оксид углерода восстанавливает железную руду до металлического железа: [117]
Некоторое количество железа в высокотемпературной нижней части печи вступает в реакцию непосредственно с коксом: [117]
Флюс удаляет из руды кремнистые минералы, которые в противном случае засорили бы печь: тепло печи разлагает карбонаты до оксида кальция , который реагирует с любым избытком кремнезема с образованием шлака , состоящего из силиката кальция CaSiO 3 или других продуктов. При температуре печи металл и шлак расплавлены. Они собираются внизу в виде двух несмешивающихся слоев жидкости (со шлаком сверху), которые затем легко разделяются. [117] Шлак можно использовать в качестве материала при дорожном строительстве или для улучшения бедных минералами почв в сельском хозяйстве . [106]
Таким образом, производство стали остается одним из крупнейших промышленных источников выбросов CO 2 в мире. [118]
Чугун, произведенный доменным способом, содержит до 4–5% углерода (по массе) с небольшим количеством других примесей, таких как сера, магний, фосфор и марганец. Высокий уровень углерода делает его относительно слабым и хрупким. Уменьшение количества углерода до 0,002–2,1% дает сталь , которая может быть до 1000 раз тверже чистого железа. Затем с помощью холодной обработки , горячей прокатки , ковки , механической обработки и т. д. можно изготавливать самые разнообразные стальные изделия. Удаление примесей из чугуна, но оставление 2–4% углерода, приводит к получению чугуна , который литейные заводы отливают в изделия. такие как печи, трубы, радиаторы, фонарные столбы и рельсы. [117]
Стальные изделия часто подвергаются различным термическим обработкам после того, как им придана форма. Отжиг заключается в нагреве их до 700–800 °С в течение нескольких часов и последующем постепенном охлаждении. Это делает сталь мягче и удобнее в обработке. [120]
Из соображений экологии были разработаны альтернативные методы обработки железа. « Прямое восстановление железа » превращает железную руду в кусок железа, называемый «губчатым» железом или «прямым» железом, который подходит для производства стали. [106] Процесс прямого восстановления включает две основные реакции:
Природный газ частично окисляется (с помощью тепла и катализатора): [106]
Затем железную руду обрабатывают этими газами в печи, получая твердое губчатое железо: [106]
Кремнезем удаляют добавлением известнякового флюса, как описано выше. [106]
При воспламенении смеси алюминиевого порошка и оксида железа в результате термитной реакции образуется металлическое железо :
Альтернативно, чугун может быть превращен в сталь (с содержанием углерода примерно до 2%) или кованое железо (технически чистое железо). Для этого использовались различные процессы, в том числе кузницы , пудлинговые печи, бессемеровские конвертеры , мартеновские печи , кислородные печи и электродуговые печи . Во всех случаях цель состоит в том, чтобы окислить часть или весь углерод вместе с другими примесями. С другой стороны, для изготовления легированных сталей можно добавлять и другие металлы. [108]
Электролиз расплавленного оксида (MOE) использует электролиз расплавленного оксида железа для получения металлического железа. Он изучен в лабораторных экспериментах и предложен как метод промышленного производства железа, не имеющий прямых выбросов углекислого газа. В нем используется жидкий железный катод, анод, изготовленный из сплава хрома, алюминия и железа [121] , а электролит представляет собой смесь расплавленных оксидов металлов, в которых растворена железная руда. Ток поддерживает электролит в расплавленном состоянии и восстанавливает оксид железа. Помимо жидкого железа производится газообразный кислород. Единственные выбросы углекислого газа происходят от электроэнергии, вырабатываемой из ископаемого топлива и используемой для нагрева и восстановления металла. [122] [123] [124]
Железо является наиболее широко используемым из всех металлов, на него приходится более 90% мирового производства металлов. Его низкая стоимость и высокая прочность часто делают его предпочтительным материалом для выдерживания напряжений или передачи сил, например, при строительстве машин и станков , рельсов , автомобилей , корпусов кораблей , бетонных арматурных стержней и несущих конструкций зданий. Поскольку чистое железо довольно мягкое, его чаще всего комбинируют с легирующими элементами для получения стали. [127]
Механические свойства железа и его сплавов чрезвычайно важны для их структурного применения. Эти свойства можно оценить различными способами, включая тест Бринелля , тест Роквелла и тест твердости по Виккерсу .
Свойства чистого железа часто используются для калибровки измерений или сравнения результатов испытаний. [126] [128] Однако на механические свойства железа существенно влияет чистота образца: чистые монокристаллы железа на самом деле мягче алюминия, [125] а самое чистое промышленно производимое железо (99,99%) имеет твердость 20–30 Бринелля. [129] Чистое железо (99,9%~99,999%), особенно называемое электролитическим железом , производится в промышленности путем электролитического рафинирования .
Увеличение содержания углерода приведет к значительному увеличению твердости и прочности железа. Максимальная твердость 65 Rc достигается при содержании углерода 0,6%, хотя сплав имеет низкую прочность на разрыв. [130] Из-за мягкости железа с ним гораздо легче работать, чем с его более тяжелыми родственниками рутением и осмием . [16]

α-Железо — довольно мягкий металл, способный растворять лишь небольшую концентрацию углерода (не более 0,021% по массе при 910 °С). [131] Аустенит (γ-железо) также мягкий и металлический, но может растворять значительно больше углерода (до 2,04% по массе при 1146 °C). Эта форма железа используется в качестве нержавеющей стали, используемой для изготовления столовых приборов, а также оборудования для больниц и предприятий общественного питания. [20]
Коммерчески доступное железо классифицируется по чистоте и обилию добавок. Чушковый чугун содержит 3,5–4,5% углерода [132] и содержит различное количество примесей, таких как сера , кремний и фосфор . Чугун – это не товарный продукт, а промежуточный этап производства чугуна и стали. Уменьшение примесей в чугуне, которые отрицательно влияют на свойства материала, таких как сера и фосфор, дает чугун, содержащий 2–4% углерода, 1–6% кремния и небольшое количество марганца . [117] Чушковый чугун имеет температуру плавления в диапазоне 1420–1470 К, что ниже, чем у любого из двух его основных компонентов, и делает его первым продуктом, который плавится при совместном нагревании углерода и железа. [10] Его механические свойства сильно различаются и зависят от формы углерода в сплаве. [16]
«Белые» чугуны содержат углерод в виде цементита , или карбида железа (Fe 3 C). [16] Это твердое, хрупкое соединение доминирует в механических свойствах белого чугуна, делая его твердым, но неустойчивым к ударам. Сломанная поверхность белого чугуна полна мелких граней сломанного карбида железа, очень бледного, серебристого, блестящего материала, отсюда и такое название. Медленное охлаждение смеси железа с 0,8% углерода ниже 723 °C до комнатной температуры приводит к образованию отдельных чередующихся слоев цементита и α-железа, которое является мягким и податливым и по своему внешнему виду называется перлитом . С другой стороны, быстрое охлаждение не оставляет времени для такого разделения и создает твердый и хрупкий мартенсит . Затем сталь можно отпустить путем повторного нагрева до промежуточной температуры, изменяя пропорции перлита и мартенсита. Конечный продукт с содержанием углерода ниже 0,8% представляет собой смесь перлита и αFe, а с содержанием углерода выше 0,8% представляет собой смесь перлита и цементита. [16]
В сером чугуне углерод существует в виде отдельных мелких чешуек графита , а также делает материал хрупким из-за чешуек графита с острыми краями, которые создают места концентрации напряжений внутри материала. [133] Новый вариант серого чугуна, называемый ковким чугуном , специально обрабатывается небольшими количествами магния, чтобы изменить форму графита на сфероиды или узелки, уменьшая концентрацию напряжений и значительно увеличивая ударную вязкость и прочность материала. . [133]
Кованое железо содержит менее 0,25% углерода, но большое количество шлака , придающего ему волокнистые характеристики. [132] Кованое железо более устойчиво к коррозии, чем сталь. Она была почти полностью заменена мягкой сталью , которая корродирует легче, чем кованое железо, но дешевле и более широко доступна. Углеродистая сталь содержит 2,0% углерода или менее [134] с небольшими количествами марганца , серы , фосфора и кремния. Легированные стали содержат различное количество углерода, а также других металлов, таких как хром , ванадий , молибден , никель, вольфрам и т. д. Содержание легированных сталей повышает их стоимость, поэтому они обычно используются только для специальных целей. Однако одной из распространенных легированных сталей является нержавеющая сталь . Последние разработки в черной металлургии привели к появлению растущего ассортимента микролегированных сталей, также называемых « HSLA » или высокопрочных низколегированных сталей, содержащих небольшие добавки для обеспечения высокой прочности и часто впечатляющей ударной вязкости при минимальных затратах. [134] [135] [136]
Сплавы с элементным составом высокой чистоты (например, сплавы электролитического железа ) обладают особыми улучшенными свойствами, такими как пластичность , предел прочности , ударная вязкость , усталостная прочность , термостойкость и коррозионная стойкость.
Помимо традиционных применений, железо также используется для защиты от ионизирующего излучения. Хотя он легче другого традиционного защитного материала, свинца , он намного прочнее механически. [137]
Основным недостатком железа и стали является то, что чистое железо и большинство его сплавов сильно страдают от ржавчины, если не защищены каким-либо образом, а затраты на это составляют более 1% мировой экономики. [138] Покраска , гальванизация , пассивация , пластиковое покрытие и воронение используются для защиты железа от ржавчины путем исключения воды и кислорода или путем катодной защиты . Механизм ржавления железа таков: [138]
Электролитом обычно является сульфат железа (II) в городских районах (образующийся, когда атмосферный диоксид серы разъедает железо), и частицы соли в атмосфере в приморских районах. [138]
Поскольку железо недорогое и нетоксичное, много усилий было направлено на разработку катализаторов и реагентов на основе железа . Однако железо менее распространено в качестве катализатора в коммерческих процессах, чем более дорогие металлы. [139] В биологии железосодержащие ферменты широко распространены. [140]
Железные катализаторы традиционно используются в процессе Габера-Боша для производства аммиака и в процессе Фишера-Тропша для конверсии окиси углерода в углеводороды для топлива и смазочных материалов. [141] Порошок железа в кислой среде используется при восстановлении Бешана , превращении нитробензола в анилин . [142]
Оксид железа (III), смешанный с алюминиевым порошком, может воспламеняться, вызывая термитную реакцию , которая используется при сварке крупных железных деталей (например, рельсов ) и очистке руд. Оксид и оксигидроксид железа (III) используются в качестве красноватых и охристых пигментов .
Хлорид железа(III) находит применение при очистке воды и сточных вод , при крашении ткани, в качестве красителя в красках, в качестве добавки к кормам для животных и в качестве травителя меди при производстве печатных плат . [143] Его также можно растворить в спирте для получения настойки железа, которая используется в качестве лекарства для остановки кровотечения у канареек . [144]
Сульфат железа (II) используется в качестве предшественника других соединений железа. Он также используется для снижения содержания хромата в цементе. Его используют для обогащения продуктов питания и лечения железодефицитной анемии . Сульфат железа (III) используется для осаждения мельчайших частиц сточных вод в резервуарной воде. Хлорид железа(II) используется как восстановитель-флокулянт, при образовании комплексов железа и магнитных оксидов железа, а также как восстановитель в органическом синтезе. [143]
Нитропруссид натрия — препарат, используемый как сосудорасширяющее средство . Он включен в Список основных лекарственных средств Всемирной организации здравоохранения . [145]
Железо необходимо для жизни. [9] [146] [147] Железо -серные кластеры широко распространены и включают нитрогеназу , ферменты, ответственные за биологическую фиксацию азота . Железосодержащие белки участвуют в транспортировке, хранении и использовании кислорода. [9] Белки железа участвуют в переносе электронов . [148]

Примеры железосодержащих белков у высших организмов включают гемоглобин, цитохром (см. Высоковалентное железо ) и каталазу . [9] [149] Среднестатистический взрослый человек содержит около 0,005% массы тела железа, или около четырех граммов, из которых три четверти приходится на гемоглобин — уровень, который остается постоянным, несмотря на то, что каждый день усваивается всего около одного миллиграмма железа . 148], потому что организм человека перерабатывает свой гемоглобин на содержание железа. [150]
Росту микробов может способствовать окисление железа (II) или восстановление железа (III). [151]
Приобретение железа представляет собой проблему для аэробных организмов, поскольку трехвалентное железо плохо растворимо при нейтральном pH. Таким образом, эти организмы разработали способы поглощения железа в виде комплексов, иногда поглощая двухвалентное железо, прежде чем окислить его обратно до трехвалентного железа. [9] В частности, бактерии развили очень высокоаффинные изолирующие агенты, называемые сидерофорами . [152] [153] [154]
После поступления в клетки человека запасы железа точно регулируются. [9] [155] Основным компонентом этой регуляции является белок трансферрин , который связывает ионы железа, всасываемые из двенадцатиперстной кишки , и переносит их в кровь к клеткам. [9] [156] Трансферрин содержит Fe 3+ в середине искаженного октаэдра, связанный с одним азотом, тремя атомами кислорода и хелатирующим карбонат- анионом, захватывающим ион Fe 3+ : он имеет настолько высокую константу стабильности , что очень эффективен при поглощении ионов Fe 3+ даже из самых стабильных комплексов. В костном мозге трансферрин восстанавливается с Fe 3+ до Fe 2+ и сохраняется в виде ферритина для включения в гемоглобин. [148]
Наиболее широко известными и изученными бионеорганическими соединениями железа (молекулами биологического железа) являются гем-белки : примерами являются гемоглобин , миоглобин и цитохром Р450 . [9] Эти соединения участвуют в транспортировке газов, построении ферментов и переносе электронов . [148] Металлопротеины представляют собой группу белков с кофакторами ионов металлов . Некоторыми примерами металлопротеинов железа являются ферритин и рубредоксин . [148] Многие ферменты, жизненно важные для жизни, содержат железо, например, каталаза , [157] липоксигеназы , [158] и IRE-BP . [159]
Гемоглобин — это переносчик кислорода, который встречается в эритроцитах и придает их цвет, транспортируя кислород по артериям из легких в мышцы, где он переносится в миоглобин , который хранит его до тех пор, пока он не понадобится для метаболического окисления глюкозы , выработки энергии. . [9] Здесь гемоглобин связывается с углекислым газом , образующимся при окислении глюкозы, который транспортируется гемоглобином по венам (преимущественно в виде анионов бикарбоната ) обратно в легкие, где выдыхается. [148] В гемоглобине железо находится в одной из четырех гемовых групп и имеет шесть возможных координационных центров; четыре заняты атомами азота в порфириновом кольце, пятый — имидазольным азотом в гистидиновом остатке одной из белковых цепей, присоединенных к гемовой группе, а шестой зарезервирован для молекулы кислорода, с которой он может обратимо связываться. [148] Когда гемоглобин не связан с кислородом (и тогда его называют дезоксигемоглобином), ион Fe 2+ в центре гемовой группы (во внутренней части гидрофобного белка) находится в высокоспиновой конфигурации . Таким образом, он слишком велик, чтобы поместиться внутри порфиринового кольца, которое вместо этого изгибается в купол с ионом Fe 2+ примерно в 55 пикометрах над ним. В этой конфигурации шестой координационный сайт, зарезервированный для кислорода, блокируется другим остатком гистидина. [148]
Когда дезоксигемоглобин захватывает молекулу кислорода, этот остаток гистидина удаляется и возвращается, как только кислород надежно присоединяется, образуя с ним водородную связь . Это приводит к переключению иона Fe 2+ в низкоспиновую конфигурацию, что приводит к уменьшению ионного радиуса на 20%, так что теперь он может вписаться в порфириновое кольцо, которое становится плоским. [148] Кроме того, эта водородная связь приводит к наклону молекулы кислорода, в результате чего валентный угол Fe-O-O составляет около 120 °, что позволяет избежать образования мостиков Fe-O-Fe или Fe-O 2 -Fe, которые приведет к переносу электронов, окислению Fe 2+ до Fe 3+ и разрушению гемоглобина. Это приводит к перемещению всех белковых цепей, что приводит к тому, что другие субъединицы гемоглобина меняют форму на форму с большим сродством к кислороду. Таким образом, когда дезоксигемоглобин поглощает кислород, его сродство к большему количеству кислорода увеличивается, и наоборот. [148] Миоглобин, с другой стороны, содержит только одну гемовую группу и, следовательно, этот кооперативный эффект не может произойти. Таким образом, хотя гемоглобин почти насыщен кислородом при высоких парциальных давлениях кислорода, обнаруженных в легких, его сродство к кислороду намного ниже, чем у миоглобина, который насыщает кислород даже при низких парциальных давлениях кислорода, обнаруженного в мышечной ткани. [148] Как описано в эффекте Бора (названном в честь Кристиана Бора , отца Нильса Бора ), сродство гемоглобина к кислороду уменьшается в присутствии углекислого газа. [148]

Угарный газ и трифторид фосфора ядовиты для человека, поскольку они связываются с гемоглобином так же, как кислород, но с гораздо большей силой, так что кислород больше не может транспортироваться по организму. Гемоглобин, связанный с окисью углерода, известен как карбоксигемоглобин . Этот эффект также играет незначительную роль в токсичности цианида , но основным эффектом является его вмешательство в правильное функционирование белка транспорта электронов цитохрома а . [148] Белки цитохрома также включают гем-группы и участвуют в метаболическом окислении глюкозы кислородом. Шестое координационное место тогда занимает либо другой азот имидазола, либо сера метионина , так что эти белки в значительной степени инертны по отношению к кислороду - за исключением цитохрома а, который напрямую связывается с кислородом и, таким образом, очень легко отравляется цианидом. [148] Здесь происходит перенос электрона, поскольку железо остается в низкоспиновом состоянии, но меняется между степенями окисления +2 и +3. Поскольку потенциал восстановления на каждом этапе немного больше, чем на предыдущем, энергия высвобождается шаг за шагом и, таким образом, может быть сохранена в аденозинтрифосфате . Цитохром а немного отличается, так как он находится на митохондриальной мембране, напрямую связывается с кислородом и переносит как протоны, так и электроны следующим образом: [148]
Хотя гем-белки являются наиболее важным классом железосодержащих белков, железо-серные белки также очень важны, поскольку участвуют в переносе электронов, что возможно, поскольку железо может стабильно существовать как в +2, так и в +3 степени окисления. Они имеют один, два, четыре или восемь атомов железа, каждый из которых примерно тетраэдрически координирован с четырьмя атомами серы; из-за этой тетраэдрической координации они всегда имеют высокоспиновое железо. Простейшим из таких соединений является рубредоксин , у которого только один атом железа координирован с четырьмя атомами серы от остатков цистеина в окружающих пептидных цепях. Другим важным классом железо-серных белков являются ферредоксины , которые имеют несколько атомов железа. Трансферрин не принадлежит ни к одному из этих классов. [148]
Способность морских мидий удерживаться на камнях в океане обеспечивается использованием металлоорганических связей на основе железа в их богатых белком кутикулах . Судя по синтетическим аналогам, присутствие железа в этих структурах увеличило модуль упругости в 770 раз, прочность на разрыв в 58 раз и ударную вязкость в 92 раза. Уровень стресса, необходимый для их необратимого повреждения, увеличился в 76 раз. [161]
Железо широко распространено, но особенно богатые источники диетического железа включают красное мясо , устрицы , бобы , птицу , рыбу , листовые овощи , кресс-салат , тофу и патоку . [9] Хлеб и сухие завтраки иногда специально обогащают железом. [9] [162]
Железо, содержащееся в пищевых добавках, часто встречается в виде фумарата железа (II) , хотя сульфат железа (II) дешевле и усваивается одинаково хорошо. [143] Элементарное железо, или восстановленное железо, несмотря на то, что эффективность его поглощения составляет всего от одной до двух третей (по сравнению с сульфатом железа), [163] часто добавляют в такие продукты, как хлопья для завтрака или обогащенную пшеничную муку. Железо наиболее доступно организму в виде хелатного соединения с аминокислотами [164] , а также доступно для использования в качестве обычной добавки железа . Глицин , самая дешевая аминокислота, чаще всего используется для производства добавок глицината железа. [165]
Институт медицины США (МОМ) обновил расчетные средние потребности (EAR) и рекомендуемые диетические нормы (RDA) для железа в 2001 году. [9] Текущая EAR для железа для женщин в возрасте 14–18 лет составляет 7,9 мг/день, 8,1 мг/сут. день для детей в возрасте 19–50 лет и 5,0 мг/день в последующий период (после менопаузы). Для мужчин EAR составляет 6,0 мг/день в возрасте от 19 лет и старше. Рекомендуемая суточная доза составляет 15,0 мг/день для женщин в возрасте 15–18 лет, 18,0 мг/день для женщин в возрасте 19–50 лет и 8,0 мг/день в дальнейшем. Мужчинам: 8,0 мг/день в возрасте от 19 лет и старше. RDA выше, чем EAR, чтобы определить суммы, которые будут охватывать людей с потребностями выше среднего. Рекомендуемая суточная доза при беременности составляет 27 мг/день, а при лактации – 9 мг/день. [9] Детям в возрасте 1–3 лет 7 мг/день, 10 мг/день для детей 4–8 лет и 8 мг/день для детей 9–13 лет. Что касается безопасности, МОМ также устанавливает допустимые верхние уровни потребления (UL) для витаминов и минералов, когда доказательства достаточны. В случае железа UL устанавливается на уровне 45 мг/день. В совокупности EAR, RDA и UL называются эталонными диетическими нормами потребления . [166]
Европейское управление по безопасности пищевых продуктов (EFSA) называет совокупный набор информации эталонными диетическими значениями, с эталонным потреблением для населения (PRI) вместо RDA и средней потребностью вместо EAR. AI и UL определены так же, как и в США. Для женщин PRI составляет 13 мг/день в возрасте 15–17 лет, 16 мг/день для женщин в возрасте 18 лет и старше в пременопаузе и 11 мг/день в постменопаузе. При беременности и лактации — 16 мг/сут. Для мужчин PRI составляет 11 мг/день в возрасте от 15 лет и старше. Для детей в возрасте от 1 до 14 лет доза PRI увеличивается с 7 до 11 мг/день. PRI выше, чем RDA в США, за исключением беременности. [167] EFSA рассмотрело тот же вопрос безопасности, но не установило UL. [168]
Младенцам могут потребоваться добавки железа, если их кормят коровьим молоком из бутылочки. [169] Частые доноры крови подвергаются риску низкого уровня железа, и им часто рекомендуется дополнять потребление железа. [170]
Для целей маркировки пищевых продуктов и пищевых добавок в США количество в порции выражается в процентах от дневной нормы (% ДВ). Для целей маркировки железа 100% дневной нормы составляло 18 мг и по состоянию на 27 мая 2016 г. [обновлять]оставалось неизменным на уровне 18 мг. [171] [172] Таблица старых и новых дневных норм для взрослых представлена в разделе «Справочная суточная норма» .
Дефицит железа является наиболее распространенным дефицитом питания в мире. [9] [173] [174] [175] Когда потеря железа не компенсируется адекватно адекватным потреблением железа с пищей, возникает состояние латентного дефицита железа , которое со временем приводит к железодефицитной анемии , если его не лечить, что характеризуется недостаточным количеством эритроцитов и недостаточным количеством гемоглобина. [176] Наиболее восприимчивы к заболеванию дети, женщины в пременопаузе (женщины детородного возраста) и люди с неправильным питанием. В большинстве случаев железодефицитная анемия протекает в легкой форме, но если ее не лечить, она может вызвать такие проблемы, как учащенное или нерегулярное сердцебиение, осложнения во время беременности и задержку роста у младенцев и детей. [177]
Мозг устойчив к острому дефициту железа из-за медленного транспорта железа через гематоэнцефалический барьер. [178] Резкие колебания уровня железа (отмеченные уровнем ферритина в сыворотке) не отражают состояние железа в мозге, но предполагается, что длительный дефицит железа в питании приводит к снижению концентрации железа в мозге с течением времени. [179] [180] В мозге железо играет роль в транспортировке кислорода, синтезе миелина, митохондриальном дыхании, а также в качестве кофактора синтеза и метаболизма нейромедиаторов. [181] Животные модели пищевого дефицита железа сообщают о биомолекулярных изменениях, напоминающих те, которые наблюдаются при болезни Паркинсона и Хантингтона. [182] [183] Однако возрастное накопление железа в мозге также связано с развитием болезни Паркинсона. [184]
Поглощение железа жестко регулируется организмом человека, у которого нет регулируемых физиологических способов выведения железа. Лишь небольшое количество железа теряется ежедневно из-за отслаивания эпителиальных клеток слизистых оболочек и кожи, поэтому контроль уровня железа в первую очередь достигается за счет регулирования его поглощения. [185] У некоторых людей регуляция поглощения железа нарушается в результате генетического дефекта , который картируется в области гена HLA-H на хромосоме 6 и приводит к аномально низким уровням гепсидина , ключевого регулятора поступления железа в организм. Система кровообращения млекопитающих. [186] У этих людей чрезмерное потребление железа может привести к расстройствам, связанным с перегрузкой железом , известным в медицине как гемохроматоз . [9] Многие люди имеют недиагностированную генетическую предрасположенность к перегрузке железом и не знают о семейном анамнезе этой проблемы. По этой причине людям не следует принимать добавки железа, если они не страдают дефицитом железа и не проконсультировались с врачом. По оценкам, гемохроматоз является причиной 0,3–0,8% всех метаболических заболеваний европеоидов. [187]
Передозировка проглоченного железа может вызвать чрезмерный уровень свободного железа в крови. Высокий уровень свободного двухвалентного железа в крови реагирует с пероксидами, образуя высокореактивные свободные радикалы , которые могут повредить ДНК , белки , липиды и другие клеточные компоненты. Токсичность железа возникает, когда клетка содержит свободное железо, что обычно происходит, когда уровень железа превышает доступность трансферрина для связывания железа. Повреждение клеток желудочно-кишечного тракта также может помешать им регулировать всасывание железа, что приводит к дальнейшему повышению его уровня в крови. Железо обычно повреждает клетки сердца , печени и других органов, вызывая побочные эффекты, включая кому , метаболический ацидоз , шок , печеночную недостаточность , коагулопатию , долговременное повреждение органов и даже смерть. [188] Люди испытывают токсичность железа, когда содержание железа превышает 20 миллиграммов на каждый килограмм массы тела; Смертельной дозой считается 60 миллиграмм на килограмм . [189] Чрезмерное потребление железа, часто являющееся результатом употребления детьми большого количества таблеток сульфата железа, предназначенных для употребления взрослыми, является одной из наиболее распространенных токсикологических причин смерти детей в возрасте до шести лет. [189] Эталонная диетическая доза (DRI) устанавливает допустимый верхний уровень потребления (UL) для взрослых на уровне 45 мг/день. Для детей до четырнадцати лет UL составляет 40 мг/день. [190]
Медицинское лечение токсичности железа сложно и может включать использование специального хелатирующего агента, называемого дефероксамином , для связывания и выведения избытка железа из организма. [188] [191] [192]
Некоторые исследования показали, что низкие уровни таламического железа могут играть роль в патофизиологии СДВГ . [193] Некоторые исследователи обнаружили, что добавки железа могут быть эффективными, особенно при невнимательном подтипе расстройства. [194]
Некоторые исследователи в 2000-х годах предположили связь между низким уровнем железа в крови и СДВГ. Исследование 2012 года не обнаружило такой корреляции. [195]
Роль железа в защите от рака можно охарактеризовать как «палка о двух концах» из-за его повсеместного присутствия в непатологических процессах. [196] У людей, проходящих химиотерапию, может развиться дефицит железа и анемия , при которой для восстановления уровня железа используется внутривенная терапия железом . [197] Перегрузка железом, которая может возникнуть из-за высокого потребления красного мяса, [9] может инициировать рост опухоли и повысить предрасположенность к возникновению рака, [197] особенно колоректального рака . [9]
Железо играет важную роль в морских системах и может выступать в качестве питательного вещества, ограничивающего планктонную активность. [198] Из-за этого слишком сильное снижение содержания железа может привести к снижению скорости роста фитопланктонных организмов, таких как диатомовые водоросли. [199] Железо также может окисляться морскими микробами в условиях с высоким содержанием железа и низким содержанием кислорода. [200]
Железо может попадать в морские системы через прилегающие реки и непосредственно из атмосферы. Когда железо попадает в океан, оно может распределяться по толще воды посредством смешивания океана и переработки на клеточном уровне. [201] В Арктике морской лед играет важную роль в хранении и распределении железа в океане, истощая океаническое железо при замерзании зимой и выпуская его обратно в воду при оттаивании летом. [202] Цикл железа может изменять форму железа от водной к форме частиц, изменяя доступность железа для первичных производителей. [203] Увеличение количества света и тепла увеличивает количество железа, которое находится в формах, пригодных для использования первичными производителями. [204]
состав лезвия из железа, никеля и кобальта примерно соответствовал составу метеорита, упавшего в северном Египте. Результат «убедительно предполагает внеземное происхождение».
Самая ранняя доменная печь, обнаруженная в Китае примерно в первом веке нашей эры.