Молекулярная биология / məˈlɛkjʊlər / — раздел биологии , который стремится понять молекулярную основу биологической активности в клетках и между клетками , включая биомолекулярный синтез, модификацию , механизмы и взаимодействия. [ 1 ] [ 2] [ 3 ]
Хотя клетки и другие микроскопические структуры наблюдались в живых организмах еще в XVIII веке, детальное понимание механизмов и взаимодействий, управляющих их поведением, появилось только в XX веке, когда технологии, используемые в физике и химии, достаточно продвинулись, чтобы позволить их применение в биологических науках. Термин «молекулярная биология» был впервые использован в 1945 году английским физиком Уильямом Эстбери , который описал его как подход, сосредоточенный на выявлении основ биологических явлений, т. е. раскрытии физических и химических структур и свойств биологических молекул, а также их взаимодействия с другими молекулами и того, как эти взаимодействия объясняют наблюдения так называемой классической биологии, которая вместо этого изучает биологические процессы в более крупных масштабах и на более высоких уровнях организации. [4] В 1953 году Фрэнсис Крик , Джеймс Уотсон , Розалинд Франклин и их коллеги из Медицинского исследовательского совета Кавендишской лаборатории первыми описали модель двойной спирали для химической структуры дезоксирибонуклеиновой кислоты (ДНК), что часто считается знаковым событием для зарождающейся области, поскольку она обеспечила физико-химическую основу для понимания ранее туманной идеи нуклеиновых кислот как первичной субстанции биологической наследственности. Они предложили эту структуру на основе предыдущих исследований, проведенных Франклином, которые были переданы им Морисом Уилкинсом и Максом Перуцем . [5] Их работа привела к открытию ДНК в других микроорганизмах, растениях и животных. [6]
Область молекулярной биологии включает в себя методы, которые позволяют ученым изучать молекулярные процессы. [7] Эти методы используются для эффективного нацеливания новых лекарств, диагностики заболеваний и лучшего понимания физиологии клеток. [8] Некоторые клинические исследования и медицинские методы лечения, возникающие из молекулярной биологии, охватываются генной терапией , тогда как использование молекулярной биологии или молекулярной клеточной биологии в медицине теперь называется молекулярной медициной . [ требуется ссылка ]


Молекулярная биология находится на стыке биохимии и генетики ; по мере того, как эти научные дисциплины возникали и развивались в 20 веке, стало ясно, что они обе стремились определить молекулярные механизмы, лежащие в основе жизненно важных клеточных функций. [9] [10] Достижения в молекулярной биологии были тесно связаны с разработкой новых технологий и их оптимизацией. [11] Молекулярная биология была прояснена работами многих ученых, и, таким образом, история этой области зависит от понимания этих ученых и их экспериментов. [ необходима цитата ]
Область генетики возникла из попыток понять набор правил, лежащих в основе воспроизводства и наследственности , а также природу гипотетических единиц наследственности, известных как гены . Грегор Мендель был пионером этой работы в 1866 году, когда он впервые описал законы наследования, которые он наблюдал в своих исследованиях скрещивания растений гороха. [12] Одним из таких законов генетического наследования является закон сегрегации , который гласит, что диплоидные особи с двумя аллелями для определенного гена передадут один из этих аллелей своему потомству. [13] Благодаря его критической работе, изучение генетического наследования обычно называют менделевской генетикой . [14]
Важной вехой в молекулярной биологии стало открытие структуры ДНК . Эта работа началась в 1869 году Фридрихом Мишером , швейцарским биохимиком, который первым предложил структуру, названную нуклеином , которая, как мы теперь знаем, является (дезоксирибонуклеиновой кислотой) или ДНК. [15] Он открыл это уникальное вещество, изучая компоненты гнойных повязок и отмечая уникальные свойства «фосфорсодержащих веществ». [16] Другим заметным участником модели ДНК был Фебус Левин , который предложил «полинуклеотидную модель» ДНК в 1919 году в результате своих биохимических экспериментов на дрожжах. [17] В 1950 году Эрвин Чаргафф расширил работу Левена и выяснил несколько важнейших свойств нуклеиновых кислот: во-первых, последовательность нуклеиновых кислот различается у разных видов. [18] Во-вторых, общая концентрация пуринов (аденина и гуанина) всегда равна общей концентрации пиримидинов (цистеина и тимина). [15] Теперь это известно как правило Чаргаффа. В 1953 году Джеймс Уотсон и Фрэнсис Крик опубликовали двойную спиральную структуру ДНК, [19] основанную на работе по рентгеновской кристаллографии, выполненной Розалинд Франклин , которую им передали Морис Уилкинс и Макс Перуц . [5] Уотсон и Крик описали структуру ДНК и высказали предположение о значении этой уникальной структуры для возможных механизмов репликации ДНК. [19] Уотсон и Крик были удостоены Нобелевской премии по физиологии и медицине в 1962 году вместе с Уилкинсом за предложение модели структуры ДНК. [6]
В 1961 году было продемонстрировано, что когда ген кодирует белок , три последовательных основания ДНК гена определяют каждую последующую аминокислоту белка. [20] Таким образом, генетический код представляет собой триплетный код, где каждый триплет (называемый кодоном ) определяет определенную аминокислоту. Кроме того, было показано, что кодоны не перекрываются друг с другом в последовательности ДНК, кодирующей белок, и что каждая последовательность считывается с фиксированной начальной точки. В течение 1962–1964 годов, благодаря использованию условных летальных мутантов бактериального вируса, [21] были достигнуты фундаментальные успехи в нашем понимании функций и взаимодействий белков, используемых в механизмах репликации ДНК , репарации ДНК , рекомбинации ДНК и в сборке молекулярных структур. [22]

В 1928 году Фредерик Гриффит столкнулся со свойством вирулентности у пневмококковых бактерий, которое убивало лабораторных крыс. Согласно распространенному в то время мнению Менделя, перенос генов мог происходить только от родительских к дочерним клеткам. Гриффит выдвинул другую теорию, утверждая, что перенос генов, происходящий в члене одного поколения, известен как горизонтальный перенос генов (ГПГ). Это явление теперь называется генетической трансформацией. [23]
Эксперимент Гриффита был посвящен бактериям пневмококка, которые имели два разных штамма: один вирулентный и гладкий, а другой авирулентный и шероховатый. Гладкий штамм имел блестящий вид из-за наличия определенного типа полисахарида – полимерной капсулы глюкозы и глюкуроновой кислоты. Из-за этого полисахаридного слоя бактерий иммунная система хозяина не может распознать бактерии, и они убивают хозяина. Другой, авирулентный, шероховатый штамм не имеет этой полисахаридной капсулы и имеет тусклый, шероховатый вид. [ необходима цитата ]
Известно, что наличие или отсутствие капсулы в штамме определяется генетически. Гладкие и шероховатые штаммы встречаются в нескольких различных типах, таких как SI, S-II, S-III и т. д. и RI, R-II, R-III и т. д. соответственно. Все эти подтипы бактерий S и R отличаются друг от друга по типу антигена, который они производят. [6]
Эксперимент Эвери–Маклеода–Маккарти был знаменательным исследованием, проведенным в 1944 году, которое продемонстрировало, что ДНК, а не белок, как считалось ранее, несет генетическую информацию в бактериях. Освальд Эвери , Колин Манро Маклеод и Маклин Маккарти использовали экстракт из штамма пневмококка , который мог вызывать пневмонию у мышей. Они показали, что генетическую трансформацию в бактериях можно осуществить, вводя им очищенную ДНК из экстракта. Они обнаружили, что при переваривании ДНК в экстракте ДНКазой трансформация безвредных бактерий в вирулентные терялась. Это предоставило веские доказательства того, что ДНК является генетическим материалом, что бросило вызов преобладающему мнению о том, что за это ответственны белки. Это заложило основу для последующего открытия его структуры Уотсоном и Криком.

Подтверждение того, что ДНК является генетическим материалом, который является причиной инфекции, пришло из эксперимента Херши–Чейза . Они использовали E.coli и бактериофаг для эксперимента. Этот эксперимент также известен как эксперимент с блендером, поскольку кухонный блендер использовался в качестве основного прибора. Альфред Херши и Марта Чейз продемонстрировали, что ДНК, введенная фаговой частицей в бактерию, содержит всю информацию, необходимую для синтеза потомственных фаговых частиц. Они использовали радиоактивность, чтобы пометить белковую оболочку бактериофага радиоактивной серой, а ДНК — радиоактивным фосфором в двух разных пробирках соответственно. После смешивания бактериофага и E.coli в пробирке начинается инкубационный период, в течение которого фаг трансформирует генетический материал в клетках E.coli . Затем смесь смешивают или встряхивают, что отделяет фаг от клеток E.coli . Вся смесь центрифугируется, и осадок, содержащий клетки E.coli , проверяется, а супернатант выбрасывается. Клетки E.coli обнаружили радиоактивный фосфор, что указывало на то, что трансформированный материал представлял собой ДНК, а не белковую оболочку.
Трансформированная ДНК прикрепляется к ДНК E.coli , и радиоактивность наблюдается только на ДНК бактериофага. Эта мутировавшая ДНК может передаваться следующему поколению, и возникла теория трансдукции. Трансдукция — это процесс, в котором бактериальная ДНК переносит фрагмент бактериофагов и передает его следующему поколению. Это также тип горизонтального переноса генов. [6]

Эксперимент Мезельсона-Шталя был знаковым экспериментом в молекулярной биологии, который предоставил доказательства полуконсервативной репликации ДНК. Проведенный в 1958 году Мэтью Мезельсоном и Франклином Шталем , эксперимент включал выращивание бактерий E. coli в среде, содержащей тяжелый изотоп азота ( 15 N), в течение нескольких поколений. Это привело к тому, что вся вновь синтезированная бактериальная ДНК была включена в тяжелый изотоп.
После того, как бактерии реплицировались в среде, содержащей нормальный азот ( 14 N), в различные моменты времени были взяты образцы. Затем эти образцы были подвергнуты центрифугированию в градиенте плотности, которое разделило молекулы ДНК на основе их плотности.
Результаты показали, что после одного поколения репликации в среде 14 N ДНК образовала полосу промежуточной плотности между плотностью чистой ДНК 15 N и чистой ДНК 14 N. Это подтвердило полуконсервативную репликацию ДНК, предложенную Уотсоном и Криком, где каждая нить родительской молекулы ДНК служит матрицей для синтеза новой комплементарной нити, в результате чего образуются две дочерние молекулы ДНК, каждая из которых состоит из одной родительской и одной вновь синтезированной нити.
Эксперимент Мезельсона-Шталя предоставил убедительные доказательства полуконсервативной репликации ДНК, которая имеет основополагающее значение для понимания генетики и молекулярной биологии.
В начале 2020-х годов молекулярная биология вступила в золотой век, определяемый как вертикальным, так и горизонтальным техническим развитием. Вертикально новые технологии позволяют осуществлять мониторинг биологических процессов в реальном времени на атомном уровне. [24] Сегодня молекулярные биологи имеют доступ к все более доступным данным секвенирования на все более высоких глубинах, что облегчает разработку новых методов генетической манипуляции в новых немодельных организмах. Аналогичным образом, синтетические молекулярные биологи будут стимулировать промышленное производство малых и макромолекул путем внедрения экзогенных метаболических путей в различные прокариотические и эукариотические клеточные линии. [25]
Горизонтально данные секвенирования становятся более доступными и используются во многих различных научных областях. Это будет стимулировать развитие отраслей в развивающихся странах и увеличит доступность для отдельных исследователей. Аналогично, эксперименты по редактированию генов CRISPR-Cas9 теперь могут быть задуманы и реализованы отдельными лицами менее чем за 10 000 долларов в новых организмах, что будет стимулировать развитие промышленных и медицинских приложений. [26]

Следующий список описывает точку зрения на междисциплинарные отношения между молекулярной биологией и другими смежными областями. [27]
В то время как исследователи практикуют методы, специфичные для молекулярной биологии, их обычно объединяют с методами из генетики и биохимии . Большая часть молекулярной биологии является количественной, и в последнее время значительный объем работы был проделан с использованием методов компьютерной науки, таких как биоинформатика и вычислительная биология . Молекулярная генетика , изучение структуры и функции генов, является одним из самых известных подразделов молекулярной биологии с начала 2000-х годов. Другие отрасли биологии получают информацию от молекулярной биологии, либо путем непосредственного изучения взаимодействий молекул как таковых, например, в клеточной биологии и биологии развития , либо косвенно, когда молекулярные методы используются для выведения исторических атрибутов популяций или видов , как в областях эволюционной биологии, таких как популяционная генетика и филогенетика . Существует также давняя традиция изучения биомолекул «с нуля», или молекулярно, в биофизике . [30]

Молекулярное клонирование используется для выделения и последующего переноса интересующей последовательности ДНК в плазмидный вектор. [31] Эта технология рекомбинантной ДНК была впервые разработана в 1960-х годах. [32] В этой технике последовательность ДНК , кодирующая интересующий белок, клонируется с использованием полимеразной цепной реакции (ПЦР) и/или ферментов рестрикции в плазмиду ( вектор экспрессии ). Плазмидный вектор обычно имеет по крайней мере 3 отличительные особенности: начало репликации, сайт множественного клонирования (MCS) и селективный маркер (обычно устойчивость к антибиотикам ). Кроме того, выше MCS находятся промоторные области и сайт начала транскрипции , которые регулируют экспрессию клонированного гена.
Эта плазмида может быть вставлена как в бактериальные, так и в животные клетки. Введение ДНК в бактериальные клетки может быть осуществлено путем трансформации посредством поглощения голой ДНК, конъюгации посредством межклеточного контакта или путем трансдукции посредством вирусного вектора. Введение ДНК в эукариотические клетки, такие как клетки животных, физическими или химическими средствами называется трансфекцией . Доступно несколько различных методов трансфекции, таких как трансфекция фосфатом кальция, электропорация , микроинъекция и трансфекция липосомами . Плазмида может быть интегрирована в геном , что приводит к стабильной трансфекции, или может оставаться независимой от генома и временно экспрессироваться, что называется транзитной трансфекцией. [33] [34]
ДНК, кодирующая интересующий белок, теперь находится внутри клетки, и белок теперь может быть экспрессирован. Разнообразные системы, такие как индуцируемые промоторы и специфические клеточные сигнальные факторы, доступны для помощи в экспрессии интересующего белка на высоких уровнях. Затем большие количества белка могут быть извлечены из бактериальной или эукариотической клетки. Белок может быть проверен на ферментативную активность в различных ситуациях, белок может быть кристаллизован, чтобы можно было изучить его третичную структуру , или, в фармацевтической промышленности, можно изучить активность новых лекарств против белка. [35]
Полимеразная цепная реакция (ПЦР) — чрезвычайно универсальный метод копирования ДНК. Вкратце, ПЦР позволяет копировать или модифицировать определенную последовательность ДНК заранее определенными способами. Реакция чрезвычайно мощная и в идеальных условиях может амплифицировать одну молекулу ДНК до 1,07 миллиарда молекул менее чем за два часа. ПЦР имеет множество применений, включая изучение экспрессии генов, обнаружение патогенных микроорганизмов, обнаружение генетических мутаций и введение мутаций в ДНК. [36] Метод ПЦР можно использовать для введения участков рестриктаз на концы молекул ДНК или для мутации определенных оснований ДНК, последний метод называется сайт -направленным мутагенезом . ПЦР также можно использовать для определения того, находится ли определенный фрагмент ДНК в библиотеке кДНК . ПЦР имеет много вариаций, таких как ПЦР с обратной транскрипцией ( ОТ-ПЦР ) для амплификации РНК и, в последнее время, количественная ПЦР , которая позволяет проводить количественное измерение молекул ДНК или РНК. [37] [38]
.jpg/440px-Two_percent_Agarose_Gel_in_Borate_Buffer_cast_in_a_Gel_Tray_(Front,_angled).jpg)

Электрофорез в геле — это метод, который разделяет молекулы по их размеру с использованием агарозного или полиакриламидного геля. [39] Этот метод является одним из основных инструментов молекулярной биологии. Основной принцип заключается в том, что фрагменты ДНК можно разделить, пропустив электрический ток через гель — поскольку остов ДНК содержит отрицательно заряженные фосфатные группы, ДНК будет перемещаться через агарозный гель к положительному концу тока. [39] Белки также можно разделить на основе размера с использованием геля SDS-PAGE или на основе размера и их электрического заряда с использованием так называемого 2D-электрофореза в геле . [40]

Анализ Брэдфорда — это метод молекулярной биологии, который позволяет быстро и точно количественно определять молекулы белка, используя уникальные свойства красителя под названием Кумасси бриллиантовый синий G-250. [41] Кумасси синий претерпевает видимое изменение цвета с красновато-коричневого на ярко-синий при связывании с белком. [41] В своем нестабильном катионном состоянии Кумасси синий имеет фоновую длину волны 465 нм и дает красновато-коричневый цвет. [42] Когда Кумасси синий связывается с белком в кислом растворе, фоновая длина волны смещается до 595 нм, и краситель дает ярко-синий цвет. [42] Белки в анализе связывают Кумасси синий примерно за 2 минуты, а комплекс белок-краситель стабилен в течение примерно часа, хотя рекомендуется снимать показания поглощения в течение 5–20 минут после начала реакции. [41] Концентрацию белка в анализе Брэдфорда затем можно измерить с помощью спектрофотометра видимого света , и, следовательно, не требуется сложного оборудования. [42]
Этот метод был разработан в 1975 году Мэрион М. Брэдфорд и позволил проводить значительно более быструю и точную количественную оценку белка по сравнению с предыдущими методами: методом Лоури и биуретовым анализом. [41] В отличие от предыдущих методов, анализ Брэдфорда не подвержен помехам со стороны нескольких небелковых молекул, включая этанол, хлорид натрия и хлорид магния. [41] Однако он подвержен влиянию сильных щелочных буферных агентов, таких как додецилсульфат натрия (SDS). [41]
Термины «нозерн» , «вестерн» и «истерн» произошли от того, что изначально было шуткой молекулярной биологии, которая использовала термин «саузерн» в честь метода, описанного Эдвином Саузерном для гибридизации блоттированной ДНК. Патрисия Томас, разработчик РНК-блота, который затем стал известен как « нозерн»-блот , на самом деле не использовала этот термин. [43]
Названный в честь своего изобретателя, биолога Эдвина Саузерна , Саузерн-блоттинг представляет собой метод зондирования наличия определенной последовательности ДНК в образце ДНК. Образцы ДНК до или после расщепления рестриктазой (рестриктазой) разделяются с помощью гель-электрофореза, а затем переносятся на мембрану путем блоттинга с помощью капиллярного действия . Затем мембрана подвергается воздействию меченого ДНК-зонда, имеющего последовательность оснований, комплементарную последовательности на интересующей ДНК. [44] Саузерн-блоттинг реже используется в лабораторной науке из-за способности других методов, таких как ПЦР , обнаруживать определенные последовательности ДНК из образцов ДНК. Однако эти блоты все еще используются для некоторых приложений, таких как измерение числа копий трансгена у трансгенных мышей или в инженерии линий эмбриональных стволовых клеток с нокаутированным геном . [30]
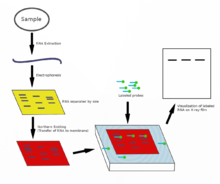
Нозерн-блот используется для изучения наличия специфических молекул РНК в качестве относительного сравнения между набором различных образцов РНК. По сути, это комбинация денатурирующего электрофореза РНК в геле и блота . В этом процессе РНК разделяется на основе размера, а затем переносится на мембрану, которая затем зондируется меченым комплементом интересующей последовательности. Результаты могут быть визуализированы различными способами в зависимости от используемой метки; однако большинство из них приводит к выявлению полос, представляющих размеры РНК, обнаруженной в образце. Интенсивность этих полос связана с количеством целевой РНК в анализируемых образцах. Процедура обычно используется для изучения того, когда и в какой степени происходит экспрессия гена, путем измерения того, сколько этой РНК присутствует в различных образцах, предполагая, что не происходит посттранскрипционной регуляции и что уровни мРНК отражают пропорциональные уровни соответствующего вырабатываемого белка. Это один из самых основных инструментов для определения того, в какое время и при каких условиях определенные гены экспрессируются в живых тканях. [45] [46]
Вестерн-блоттинг — это метод, с помощью которого можно обнаружить определенные белки из смеси белков. [47] Вестерн-блоттинг можно использовать для определения размера изолированных белков, а также для количественной оценки их экспрессии. [48] При вестерн-блоттинге белки сначала разделяются по размеру в тонком геле, зажатом между двумя стеклянными пластинами в методе, известном как SDS-PAGE . Затем белки в геле переносятся на поливинилиденфторидную (ПВДФ), нитроцеллюлозную, нейлоновую или другую опорную мембрану. Затем эту мембрану можно зондировать растворами антител . Антитела, которые специфически связываются с интересующим белком, затем можно визуализировать с помощью различных методов, включая цветные продукты, хемилюминесценцию или авторадиографию . Часто антитела маркируют ферментами. Когда хемилюминесцентный субстрат подвергается воздействию фермента, это позволяет проводить обнаружение. Использование методов вестерн-блоттинга позволяет не только обнаруживать, но и проводить количественный анализ. Аналогичные вестерн-блоттингу методы можно использовать для непосредственного окрашивания определенных белков в живых клетках или срезах тканей . [47] [49]
Метод восточной блоттинга используется для обнаружения посттрансляционной модификации белков. Белки, нанесенные на PVDF или нитроцеллюлозную мембрану, исследуются на предмет модификаций с использованием специфических субстратов. [50]

Микрочип ДНК представляет собой набор пятен, прикрепленных к твердой подложке, например, к предметному стеклу микроскопа , где каждое пятно содержит один или несколько одноцепочечных фрагментов ДНК- олигонуклеотидов . Чипы позволяют наносить большие количества очень маленьких (диаметром 100 микрометров) пятен на одно слайд. Каждое пятно имеет молекулу фрагмента ДНК, которая комплементарна одной последовательности ДНК . Разновидность этой техники позволяет квалифицировать экспрессию генов организма на определенной стадии развития ( профилирование экспрессии ). В этой технике РНК в ткани изолируется и преобразуется в маркированную комплементарную ДНК (кДНК). Затем эта кДНК гибридизуется с фрагментами на матрице, и можно выполнить визуализацию гибридизации. Поскольку можно изготовить несколько матриц с точно таким же положением фрагментов, они особенно полезны для сравнения экспрессии генов двух разных тканей, таких как здоровая и раковая ткань. Кроме того, можно измерить, какие гены экспрессируются и как эта экспрессия меняется со временем или с другими факторами. Существует много разных способов изготовления микрочипов; наиболее распространенными являются кремниевые чипы, предметные стекла микроскопа с пятнами диаметром ~100 микрометров, пользовательские массивы и массивы с более крупными пятнами на пористых мембранах (макромассивы). На одном массиве может быть от 100 пятен до более 10 000. Массивы также могут быть сделаны с молекулами, отличными от ДНК. [51] [52] [53] [54]
Аллель-специфический олигонуклеотид (ASO) — это метод, позволяющий обнаруживать мутации отдельных оснований без необходимости проведения ПЦР или гель-электрофореза. Короткие (длиной 20–25 нуклеотидов) меченые зонды подвергаются воздействию нефрагментированной целевой ДНК, гибридизация происходит с высокой специфичностью из-за короткой длины зондов, и даже изменение одного основания будет препятствовать гибридизации. Затем целевая ДНК промывается, а негибридизованные зонды удаляются. Затем целевая ДНК анализируется на наличие зонда с помощью радиоактивности или флуоресценции. В этом эксперименте, как и в большинстве методов молекулярной биологии, необходимо использовать контроль для обеспечения успешного эксперимента. [55] [56]
В молекулярной биологии процедуры и технологии постоянно развиваются, а старые технологии забрасываются. Например, до появления электрофореза ДНК в геле ( агарозном или полиакриламидном ) размер молекул ДНК обычно определялся по скорости седиментации в градиентах сахарозы , медленной и трудоемкой методике, требующей дорогостоящего оборудования; до появления градиентов сахарозы использовалась вискозиметрия . Помимо их исторического интереса, часто стоит знать о старых технологиях, поскольку иногда это полезно для решения другой новой проблемы, для которой более новая методика не подходит. [57]