Ангиопластика , также известная как баллонная ангиопластика и чрескожная транслюминальная ангиопластика ( ЧТА ), представляет собой минимально инвазивную эндоваскулярную процедуру, используемую для расширения суженных или закупоренных артерий или вен, как правило, для лечения артериального атеросклероза . [1]
Сдутый баллон, прикрепленный к катетеру ( баллонный катетер ), вводится по проволочному проводнику в суженный сосуд и затем надувается до фиксированного размера. [1] Баллон заставляет кровеносный сосуд и окружающую мышечную стенку расширяться, что позволяет улучшить кровоток. [1] Во время баллонирования может быть вставлен стент , чтобы гарантировать, что сосуд остается открытым, а затем баллон сдувается и извлекается. [2] Ангиопластика стала включать в себя все виды сосудистых вмешательств, которые обычно выполняются чрескожно .
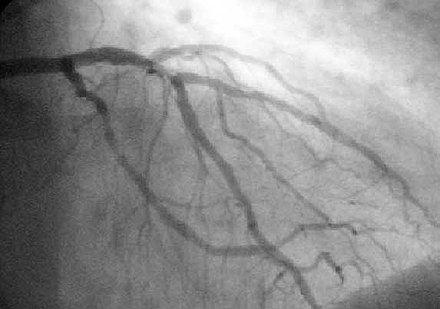
Коронарная ангиопластика — это терапевтическая процедура для лечения стенозированных (суженных) коронарных артерий сердца , обнаруженных при ишемической болезни сердца . [1] Эти стенозированные сегменты коронарных артерий возникают из-за накопления холестериновых бляшек , которые образуются при состоянии, известном как атеросклероз . [3] Чрескожное коронарное вмешательство (ЧКВ), или коронарная ангиопластика со стентированием, — это нехирургическая процедура , используемая для улучшения притока крови к сердцу. [1]
Коронарная ангиопластика показана при заболеваниях коронарных артерий, таких как нестабильная стенокардия , NSTEMI , STEMI и спонтанная перфорация коронарной артерии. [1] Было показано, что ЧКВ при стабильной ишемической болезни сердца значительно облегчает такие симптомы, как стенокардия или боль в груди, тем самым улучшая функциональные ограничения и качество жизни. [4]
Периферическая ангиопластика относится к использованию баллона для открытия кровеносного сосуда за пределами коронарных артерий. Чаще всего это делается для лечения атеросклеротических сужений брюшной полости, ног и почечных артерий, вызванных заболеванием периферических артерий . Часто периферическая ангиопластика используется в сочетании с направляющей проволокой, периферическим стентированием и атерэктомией . [5]
Ангиопластика может использоваться для лечения прогрессирующего заболевания периферических артерий с целью облегчения хромоты или боли в ногах, которая обычно ассоциируется с этим заболеванием. [6]
Исследование шунтирования против ангиопластики при тяжелой ишемии ноги (BASIL) сначала изучало инфраингвинальное шунтирование в сравнении с ангиопластикой у отдельных пациентов с тяжелой ишемией нижних конечностей, которые были кандидатами на любую из этих процедур. Исследование BASIL показало, что ангиопластика была связана с меньшей краткосрочной заболеваемостью по сравнению с шунтированием, однако долгосрочные результаты благоприятствуют шунтированию. [7]
На основании исследования BASIL рекомендации ACCF/AHA рекомендуют баллонную ангиопластику только для пациентов с ожидаемой продолжительностью жизни 2 года или менее или тех, у кого нет аутогенной вены . Для пациентов с ожидаемой продолжительностью жизни более 2 лет или у кого есть аутогенная вена, сначала может быть выполнена операция шунтирования. [8]
Стеноз почечной артерии связан с гипертонией и потерей функции почек . [9] Атеросклеротическая обструкция почечной артерии может быть вылечена с помощью ангиопластики со стентированием почечной артерии или без него. [10] Существует слабая рекомендация по ангиопластике почечной артерии у пациентов со стенозом почечной артерии и мгновенным отеком или застойной сердечной недостаточностью. [10]
Стеноз сонной артерии можно лечить с помощью ангиопластики и каротидного стентирования у пациентов с высоким риском проведения каротидной эндартерэктомии (КЭА). [11] Хотя каротидная эндартерэктомия обычно предпочтительнее стентирования сонной артерии, стентирование показано некоторым пациентам со стенозом, вызванным радиацией, или поражением сонной артерии, не подходящим для хирургического вмешательства. [12]
Ангиопластика используется для лечения венозного стеноза, влияющего на доступ к диализу , при этом баллонная ангиопластика с лекарственным покрытием, как оказалось, имеет лучшую проходимость в течение 6 и 12 месяцев, чем обычная баллонная ангиопластика. [13] Ангиопластика иногда используется для лечения остаточного стеноза подключичной вены после декомпрессионной операции при синдроме грудного выхода . [14] Существует слабая рекомендация по стентированию глубоких вен для лечения обструктивного хронического заболевания вен. [15]
Для ангиопластики требуется сосуд доступа, обычно бедренная или лучевая артерия или бедренная вена , чтобы обеспечить доступ к сосудистой системе для используемых проводов и катетеров . Если сосуд доступа достаточного размера и качества недоступен, ангиопластика противопоказана. Небольшой диаметр сосуда, наличие задней кальцификации, окклюзии, гематомы или более раннее размещение шунтирующего источника могут сделать доступ к сосудистой системе слишком сложным. [ необходима цитата ]
Чрескожная транслюминальная коронарная ангиопластика (ЧТКА) противопоказана пациентам с заболеванием левой коронарной артерии из-за риска спазма левой коронарной артерии во время процедуры. [16] Кроме того, ЧТКА не рекомендуется, если стеноз коронарных артерий составляет менее 70%, так как стеноз ниже этого уровня не считается гемодинамически значимым. [16]



Доступ к сосудистой системе обычно осуществляется чрескожно (через кожу, без большого хирургического разреза). В кровеносный сосуд вводится проводник с помощью техники Сельдингера . [17] Флюороскопическое наведение использует магнитно-резонансную или рентгеновскую флюороскопию и рентгеноконтрастный краситель для направления угловых проводов и катетеров в область тела, подлежащую лечению в режиме реального времени. [18] Конический проводник выбирается для небольшой окклюзии, за ним следуют проводники промежуточного типа для извилистых артерий и трудностей прохождения через чрезвычайно узкие каналы, а жесткие провода для твердых, плотных и тупых окклюзий. [19]
Для лечения сужения кровеносного сосуда через стеноз в сосуде пропускается провод, а баллон на катетере пропускается по проводу и устанавливается в желаемое положение. [20] Позиционирование проверяется с помощью флюороскопии, а баллон надувается водой, смешанной с контрастным веществом, до давления, в 75–500 раз превышающего нормальное кровяное давление (от 6 до 20 атмосфер ), при этом для большинства коронарных ангиопластик требуется менее 10 атмосфер. [21] Также может быть установлен или не установлен стент .
По завершении процедуры баллоны, провода и катетеры удаляются, а место прокола сосуда обрабатывается либо прямым давлением, либо сосудистым окклюдером . [22]
Трансрадиальный артериальный доступ (ТРА) и трансфеморальный артериальный доступ (ТФА) — это два метода чрескожного коронарного вмешательства. [23] ТРА является методом выбора для лечения острого коронарного синдрома (ОКС), поскольку он имеет значительно более низкую частоту кровотечений и сосудистых осложнений по сравнению с подходом ТФА. [23] ТРА также имеет преимущество в плане смертности для пациентов с высоким риском ОКС и пациентов с высоким риском кровотечения. [23] Также было обнаружено, что ТРА обеспечивает улучшение качества жизни, а также снижение расходов и ресурсов здравоохранения. [23]
По сравнению с хирургическим вмешательством ангиопластика является менее рискованным вариантом лечения заболеваний, для которых она применяется, однако существуют уникальные и потенциально опасные риски и осложнения, связанные с ангиопластикой:
Ангиопластика также может быть менее надежным методом лечения атеросклероза и более склонна к рестенозу по сравнению с сосудистым шунтированием или аортокоронарным шунтированием . [28] Лекарственная баллонная ангиопластика имеет значительно меньше рестеноза, поздней потери просвета и реваскуляризации целевого поражения как в краткосрочной, так и в среднесрочной перспективе по сравнению с непокрытой баллонной ангиопластикой при окклюзионной болезни бедренно-подколенной артерии. [29] Хотя ангиопластика бедренно-подколенной артерии с использованием стентов и баллонов, покрытых паклитакселом, значительно снижает частоту рестеноза сосудов и реваскуляризации целевого поражения, также было обнаружено, что она повышает риск смерти. [30]
После ангиопластики большинство пациентов находятся под наблюдением в больнице в течение ночи, но если нет никаких осложнений, пациентов отправляют домой на следующий день. [26]
Место катетера проверяется на наличие кровотечения и отека, а также контролируется частота сердечных сокращений и артериальное давление для выявления позднего разрыва и кровотечения. [26] Протокол после процедуры также включает мониторинг диуреза, сердечных симптомов, боли и других признаков системных проблем. [26] Обычно пациенты получают лекарства, которые расслабляют их, чтобы защитить артерии от спазмов . Пациенты обычно могут ходить в течение двух-шести часов после процедуры и возвращаются к своей обычной жизни на следующей неделе. [31]
Восстановление после ангиопластики заключается в избегании физической активности в течение нескольких дней после процедуры. Пациентам рекомендуется избегать подъема тяжестей и напряженных занятий в течение недели. [32] [33] Пациентам необходимо избегать физических нагрузок или длительных занятий спортом в течение максимум двух недель после деликатной баллонной ангиопластики. [34]
После начальной двухнедельной фазы восстановления большинство пациентов с ангиопластикой могут начать безопасно возвращаться к упражнениям низкого уровня. Рекомендуется градуированная программа упражнений, при которой пациенты изначально выполняют несколько коротких подходов упражнений каждый день, постепенно увеличивая их до одного или двух более длительных подходов упражнений. [35] В качестве меры предосторожности все структурированные упражнения должны быть одобрены кардиологом перед началом. Реабилитация на основе упражнений после чрескожного коронарного вмешательства показала улучшение рецидивирующей стенокардии, общего времени упражнений, снижения сегмента ST и максимальной переносимости упражнений. [36]
Пациентам, у которых в месте введения иглы наблюдается отек, кровотечение или боль, повышается температура , они чувствуют слабость или предобморочное состояние, замечают изменение температуры или цвета кожи в руке или ноге, которая была прооперирована, а также у которых наблюдается одышка или боль в груди, следует немедленно обратиться за медицинской помощью.
Пациентам со стентами обычно назначают двойную антиагрегантную терапию (ДААТ), которая состоит из ингибитора P2Y12 , такого как клопидогрель , который принимается одновременно с ацетилсалициловой кислотой (аспирином). [37] Двойная антиагрегантная терапия (ДААТ) рекомендуется в течение 1 месяца после установки голого металлического стента, в течение 3 месяцев после установки стента с лекарственным покрытием второго поколения и в течение 6–12 месяцев после установки стента с лекарственным покрытием первого поколения . [1] Антиагрегантные свойства ДААТ предназначены для предотвращения образования тромбов, однако они также увеличивают риск кровотечения, поэтому важно учитывать предпочтения каждого пациента, сердечные заболевания и риск кровотечения при определении продолжительности лечения ДААТ. [37] Другим важным соображением является то, что одновременное применение клопидогреля и ингибиторов протонной помпы после коронарной ангиографии связано со значительно более высокими неблагоприятными сердечно-сосудистыми осложнениями, такими как серьезные неблагоприятные сердечно-сосудистые события (MACE), тромбоз стента и инфаркт миокарда. [38]
Ангиопластика была впервые описана американским интервенционным радиологом Чарльзом Доттером в 1964 году. [39] Доттером была заложена основа современной медицины с изобретением ангиопластики и катетерного стента, которые впервые были использованы для лечения заболеваний периферических артерий. 16 января 1964 года Доттером чрескожно была расширена плотная локализованная стеноз субсарториальной артерии у 82-летней женщины с болезненной ишемией ноги и гангреной, которая отказалась от ампутации ноги. После успешной дилатации стеноза с помощью направляющей проволоки и коаксиальных тефлоновых катетеров кровообращение в ее ноге восстановилось. Расширенная артерия оставалась открытой до ее смерти от пневмонии два с половиной года спустя. [40] Чарльз Доттером широко известен как «отец интервенционной радиологии » и был номинирован на Нобелевскую премию по медицине в 1978 году.
Первая чрескожная коронарная ангиопластика у бодрствующего пациента была проведена в Цюрихе немецким кардиологом Андреасом Грюнцигом 16 сентября 1977 года. [41]
Первые чрескожные коронарные ангиопластики в Соединенных Штатах были выполнены в один и тот же день (1 марта 1978 г.) Саймоном Х. Стерцером в больнице Lenox Hill в Нью-Йорке и Ричардом К. Майлером в больнице St. Mary's Hospital в Сан-Франциско. В течение предыдущего года, также в больнице St. Mary's Hospital в Сан-Франциско, Майлер и Грюнциг выполнили дилатации в условиях шунтирования, чтобы проверить концепцию катетера, прежде чем Грюнциг выполнил первую PTCA в своей катетеризационной лаборатории в Цюрихе.
Первоначальной формой ангиопластики была «старая добрая баллонная ангиопластика» (POBA) без стентирования, пока в середине 1980-х годов не были изобретены металлические стенты для предотвращения внезапного закрытия, иногда наблюдаемого при POBA. [1]
Было обнаружено, что голые металлические стенты вызывают внутристентовый рестеноз в результате неоинтимальной гиперплазии и тромбоза стента, что привело к изобретению стентов с лекарственным покрытием и антипролиферативными препаратами для борьбы с внутристеновым рестенозом. [1]
Первая коронарная ангиопластика с использованием стент-системы для доставки лекарств была выполнена Стерцером и Луисом де ла Фуэнте в Аргентинском институте диагностики и лечения [42] в Буэнос-Айресе в 1999 году.
Ингемар Генри Лундквист изобрел баллонный катетер, который теперь используется в большинстве процедур ангиопластики в мире. [43]
Подвид ангиопластики, известный как коронарная ангиопластика с использованием эксимерного лазера (ELCA), использует эксимерные лазеры для удаления небольших объемов ткани, включая нерастягиваемые и непересекаемые поражения, в артерии, чтобы позволить баллону более эффективно вдавливать бляшки в стенки артерии. [44] Такая работа была впервые разработана в 1984 году после более ранней работы в 1980–1983 годах, когда Рангасвами Шринивасан , Сэмюэл Блум и Джеймс Дж. Уинн в исследовательском центре TJ Watson компании IBM наблюдали влияние ультрафиолетового эксимерного лазера на биологические материалы. Заинтригованные, они провели дальнейшее исследование, обнаружив, что лазер делает чистые, точные разрезы, которые идеально подходят для деликатных операций. Это привело к получению фундаментального патента [45] , а Шринивасан, Блюм и Уинн были избраны в Национальный зал славы изобретателей в 2002 году. В 2012 году члены команды были удостоены Национальной медали за технологии и инновации президентом Бараком Обамой за их работу, связанную с эксимерным лазером. [46] Роберт Гинзбург впервые применил ELCA в 1984 году на пациенте с тяжелым стенозом глубокой бедренной артерии и угрозой для конечности. [47]