
Канцерогенез , также называемый онкогенезом или туморогенезом, представляет собой образование рака, при котором нормальные клетки трансформируются в раковые клетки . Этот процесс характеризуется изменениями на клеточном , генетическом и эпигенетическом уровнях и аномальным делением клеток . Деление клеток — это физиологический процесс, который происходит практически во всех тканях и при различных обстоятельствах. Обычно баланс между пролиферацией и запрограммированной гибелью клеток в форме апоптоза поддерживается для обеспечения целостности тканей и органов . Согласно общепринятой теории канцерогенеза, теории соматических мутаций, мутации в ДНК и эпимутации , которые приводят к раку, нарушают эти упорядоченные процессы, вмешиваясь в программирование, регулирующее процессы, нарушая нормальный баланс между пролиферацией и гибелью клеток. [1] [2] [3] [4] [5] Это приводит к неконтролируемому делению клеток и эволюции этих клеток путем естественного отбора в организме. Только определенные мутации приводят к раку, тогда как большинство мутаций — нет. [ необходима ссылка ]
Варианты унаследованных генов могут предрасполагать людей к раку. Кроме того, факторы окружающей среды, такие как канцерогены и радиация, вызывают мутации, которые могут способствовать развитию рака. Наконец, случайные ошибки в нормальной репликации ДНК могут приводить к мутациям, вызывающим рак. [6] Обычно требуется серия из нескольких мутаций в определенных классах генов, прежде чем нормальная клетка трансформируется в раковую клетку . [7] [8] [9] [10] [11] Недавняя комплексная классификация на уровне пациента и количественная оценка событий-драйверов в когортах TCGA показали, что в среднем на опухоль приходится 12 событий-драйверов, из которых 0,6 являются точечными мутациями в онкогенах , 1,5 являются амплификациями онкогенов, 1,2 являются точечными мутациями в супрессорах опухолей , 2,1 являются делециями супрессоров опухолей, 1,5 являются потерями хромосом- драйверов, 1 является приобретением хромосомы -драйвера , 2 являются потерями плеч хромосом -драйверов и 1,5 являются приобретениями плеч хромосом- драйверов . [12] Мутации в генах, которые регулируют деление клеток, апоптоз (гибель клеток) и восстановление ДНК , могут привести к неконтролируемой пролиферации клеток и раку.
Рак по сути является заболеванием регуляции роста тканей. Для того чтобы нормальная клетка трансформировалась в раковую, гены , которые регулируют рост и дифференциацию клеток, должны быть изменены. [13] Генетические и эпигенетические изменения могут происходить на многих уровнях: от приобретения или потери целых хромосом до мутации, затрагивающей один нуклеотид ДНК , или до подавления или активации микроРНК, которая контролирует экспрессию от 100 до 500 генов. [14] [15] Существуют две широкие категории генов, на которые влияют эти изменения. Онкогены могут быть нормальными генами, которые экспрессируются на ненадлежаще высоких уровнях, или измененными генами, которые обладают новыми свойствами. В любом случае экспрессия этих генов способствует злокачественному фенотипу раковых клеток. Гены-супрессоры опухолей — это гены, которые подавляют деление клеток, выживание или другие свойства раковых клеток. Гены-супрессоры опухолей часто отключаются генетическими изменениями, способствующими развитию рака. Наконец, Oncovirinae , вирусы , содержащие онкоген , классифицируются как онкогенные, поскольку они вызывают рост опухолевых тканей у хозяина . Этот процесс также называется вирусной трансформацией . Также считается, что рак вызывается хромосомными аномалиями, как объясняется в хромосомной теории рака . [16]
Существует разнообразная схема классификации различных геномных изменений, которые могут способствовать образованию раковых клеток . Многие из этих изменений являются мутациями или изменениями в нуклеотидной последовательности геномной ДНК. Существует также множество эпигенетических изменений, которые изменяют экспрессию генов или нет. Анеуплоидия , наличие аномального числа хромосом, является одним из геномных изменений, которое не является мутацией и может включать либо приобретение, либо потерю одной или нескольких хромосом из-за ошибок в митозе . Крупномасштабные мутации включают либо делецию , либо дупликацию части хромосомы. Геномная амплификация происходит, когда клетка приобретает много копий (часто 20 или более) небольшой хромосомной области, обычно содержащей один или несколько онкогенов и смежный генетический материал. Транслокация происходит, когда две отдельные хромосомные области становятся аномально слитыми, часто в характерном месте. Известным примером этого является хромосома Филадельфия , или транслокация хромосом 9 и 22, которая происходит при хроническом миелоидном лейкозе и приводит к образованию белка слияния BCR - abl , онкогенной тирозинкиназы . К мелкомасштабным мутациям относятся точечные мутации , делеции и вставки , которые могут возникать в промоторе гена и влиять на его экспрессию , или могут возникать в кодирующей последовательности гена и изменять функцию или стабильность его белкового продукта. Нарушение одного гена может также быть результатом интеграции геномного материала из ДНК-вируса или ретровируса , и такое событие может также приводить к экспрессии вирусных онкогенов в пораженной клетке и ее потомках. [ необходима цитата ]

Повреждение ДНК считается основной причиной рака. [17] В среднем в день на одну клетку человека возникает более 60 000 новых случаев естественного повреждения ДНК из-за эндогенных клеточных процессов (см. статью Повреждение ДНК (естественное) ).
Дополнительное повреждение ДНК может возникнуть из-за воздействия экзогенных агентов. В качестве одного из примеров экзогенного канцерогенного агента табачный дым вызывает повышенное повреждение ДНК, и это повреждение ДНК, вероятно, приводит к увеличению рака легких из-за курения. [18] В других примерах, ультрафиолетовый свет от солнечного излучения вызывает повреждение ДНК, которое важно при меланоме , [19] Инфекция Helicobacter pylori производит высокие уровни активных форм кислорода , которые повреждают ДНК и способствуют раку желудка , [20] а метаболит Aspergillus flavus афлатоксин является повреждающим ДНК агентом, который является причиной рака печени. [21]
Повреждение ДНК также может быть вызвано веществами, вырабатываемыми в организме . Макрофаги и нейтрофилы в воспаленном эпителии толстой кишки являются источником активных форм кислорода, вызывающих повреждение ДНК, которое инициирует возникновение опухолей толстой кишки , [22] а желчные кислоты, в больших количествах присутствующие в толстой кишке людей, употребляющих пищу с высоким содержанием жиров, также вызывают повреждение ДНК и способствуют развитию рака толстой кишки. [23]
Такие экзогенные и эндогенные источники повреждения ДНК указаны в полях в верхней части рисунка в этом разделе. Центральная роль повреждения ДНК в прогрессировании рака указана на втором уровне рисунка. Центральные элементы повреждения ДНК, эпигенетические изменения и недостаточное восстановление ДНК в прогрессировании рака показаны красным цветом.
Дефицит репарации ДНК может привести к накоплению большего количества повреждений ДНК и повышению риска рака. Например, люди с наследственным нарушением в любом из 34 генов репарации ДНК (см. статью Расстройство дефицита репарации ДНК ) подвержены повышенному риску рака, при этом некоторые дефекты вызывают до 100% вероятности рака в течение жизни (например, мутации p53 ). [24] Такие мутации зародышевой линии показаны в рамке слева от рисунка с указанием их вклада в дефицит репарации ДНК. Однако такие мутации зародышевой линии (которые вызывают синдромы высокопенетрантного рака ) являются причиной лишь около одного процента случаев рака. [25]
Большинство видов рака называются ненаследственными или «спорадическими видами рака». Около 30% спорадических видов рака имеют некоторый наследственный компонент, который в настоящее время не определен, в то время как большинство, или 70% спорадических видов рака, не имеют никакого наследственного компонента. [26]
При спорадических видах рака дефицит репарации ДНК иногда возникает из-за мутации в гене репарации ДНК; гораздо чаще сниженная или отсутствующая экспрессия генов репарации ДНК возникает из-за эпигенетических изменений , которые снижают или подавляют экспрессию генов . Это показано на рисунке на 3-м уровне сверху. Например, из 113 случаев колоректального рака, исследованных последовательно, только четыре имели миссенс-мутацию в гене репарации ДНК MGMT , в то время как большинство имели сниженную экспрессию MGMT из-за метилирования промоутерной области MGMT (эпигенетическое изменение). [27]
Когда экспрессия генов репарации ДНК снижается, это вызывает дефицит репарации ДНК. Это показано на рисунке на 4-м уровне сверху. При дефиците репарации ДНК повреждение ДНК сохраняется в клетках на более высоком, чем обычно, уровне (5-й уровень сверху на рисунке); это избыточное повреждение вызывает повышенную частоту мутаций и/или эпимутаций (6-й уровень сверху на рисунке). Экспериментально установлено, что частота мутаций существенно увеличивается в клетках, дефектных в репарации несоответствий ДНК [28] [29] или в гомологичной рекомбинационной репарации (HRR). [30] Хромосомные перестройки и анеуплоидия также увеличиваются в клетках с дефектом HRR [31] Во время репарации двухцепочечных разрывов ДНК или репарации других повреждений ДНК не полностью очищенные участки репарации могут вызывать эпигенетическое подавление генов. [32] [33]
Соматические мутации и эпигенетические изменения, вызванные повреждением ДНК и недостатками в репарации ДНК, накапливаются в дефектах поля . Дефекты поля представляют собой нормально выглядящие ткани с множественными изменениями (обсуждаются в разделе ниже) и являются обычными предшественниками развития неупорядоченного и чрезмерно размножающегося клона ткани при раке. Такие дефекты поля (второй уровень снизу рисунка) могут иметь многочисленные мутации и эпигенетические изменения.
Невозможно определить первоначальную причину большинства конкретных видов рака. В некоторых случаях существует только одна причина: например, вирус HHV-8 вызывает все саркомы Капоши . Однако с помощью методов и информации эпидемиологии рака можно произвести оценку вероятной причины во многих других ситуациях. Например, рак легких имеет несколько причин, включая употребление табака и радоновый газ . Мужчины, которые в настоящее время курят табак, заболевают раком легких в 14 раз чаще, чем мужчины, которые никогда не курили табак: вероятность того, что рак легких у нынешнего курильщика вызван курением, составляет около 93%; существует 7% вероятность того, что рак легких у курильщика был вызван радоновым газом или какой-то другой, нетабачной причиной. [34] Эти статистические корреляции позволили исследователям сделать вывод, что определенные вещества или поведение являются канцерогенными. Табачный дым вызывает повышенное экзогенное повреждение ДНК, и это повреждение ДНК является вероятной причиной рака легких из-за курения. Среди более чем 5000 соединений в табачном дыме генотоксичными ДНК-повреждающими агентами, которые встречаются в самых высоких концентрациях и оказывают самые сильные мутагенные эффекты, являются акролеин , формальдегид , акрилонитрил , 1,3-бутадиен , ацетальдегид , оксид этилена и изопрен . [18]
Используя методы молекулярной биологии , можно охарактеризовать мутации, эпимутации или хромосомные аберрации в опухоли, и быстрый прогресс достигается в области прогнозирования прогноза для определенных онкологических пациентов на основе спектра мутаций. Например, до половины всех опухолей имеют дефектный ген p53. Эта мутация связана с плохим прогнозом, поскольку эти опухолевые клетки с меньшей вероятностью перейдут в апоптоз или запрограммированную клеточную смерть при повреждении терапией. Мутации теломеразы устраняют дополнительные барьеры, увеличивая количество раз, когда клетка может делиться. Другие мутации позволяют опухоли выращивать новые кровеносные сосуды для обеспечения большего количества питательных веществ или метастазировать , распространяясь в другие части тела. Однако после того, как рак образовался, он продолжает развиваться и производить субклоны. В 2012 году сообщалось, что в одном образце рака почки, взятом из девяти различных областей, было обнаружено 40 «повсеместных» мутаций, обнаруженных во всех девяти областях, 59 мутаций, общих для некоторых, но не для всех девяти областей, и 29 «частных» мутаций, обнаруженных только в одной области. [35]
Линии клеток, в которых накапливаются все эти изменения ДНК, трудно проследить, но две недавние линии доказательств предполагают, что нормальные стволовые клетки могут быть клетками происхождения рака. [36] [37] Во-первых, существует высокая положительная корреляция (коэффициент корреляции Спирмена = 0,81; P < 3,5 × 10−8) между риском развития рака в ткани и числом делений нормальных стволовых клеток, происходящих в этой же ткани. Корреляция применялась к 31 типу рака и распространялась на пять порядков величины . [38] Эта корреляция означает, что если нормальные стволовые клетки из ткани делятся один раз, риск рака в этой ткани составляет приблизительно 1X. Если они делятся 1000 раз, риск рака составляет 1000X. А если нормальные стволовые клетки из ткани делятся 100 000 раз, риск рака в этой ткани составляет приблизительно 100 000X. Это убедительно свидетельствует о том, что основным фактором возникновения рака является тот факт, что «нормальные» стволовые клетки делятся, что подразумевает, что рак возникает в нормальных, здоровых стволовых клетках. [37]
Во-вторых, статистика показывает, что большинство случаев рака у людей диагностируется у пожилых людей. Возможным объяснением является то, что рак возникает из-за того, что клетки накапливают повреждения с течением времени. ДНК — единственный клеточный компонент, который может накапливать повреждения на протяжении всей жизни, а стволовые клетки — единственные клетки, которые могут передавать ДНК от зиготы к клеткам в конце жизни. Другие клетки, полученные из стволовых клеток, не сохраняют ДНК с начала жизни до возникновения возможного рака. Это подразумевает, что большинство видов рака возникают из нормальных стволовых клеток. [36] [37]

Термин « полевая канцеризация » впервые был использован в 1953 году для описания области или «поля» эпителия, которое было предварительно обусловлено (в то время) в значительной степени неизвестными процессами, чтобы предрасположить его к развитию рака. [39] С тех пор термины «полевая канцеризация» и «полевой дефект» использовались для описания предраковой ткани, в которой, вероятно, возникнут новые раковые опухоли. [ необходима цитата ]
Дефекты поля были выявлены в связи с раком и играют важную роль в прогрессировании рака. [40] [41] Однако Рубин [42] указал, что «подавляющее большинство исследований в области изучения рака было проведено на четко определенных опухолях in vivo или на дискретных неопластических очагах in vitro. Тем не менее, есть доказательства того, что более 80% соматических мутаций, обнаруженных в человеческих колоректальных опухолях с фенотипом мутатора, происходят до начала терминальной клональной экспансии…» [43] Более половины соматических мутаций, обнаруженных в опухолях, произошли в преднеопластической фазе (в дефекте поля), во время роста, по-видимому, нормальных клеток. Также можно было бы ожидать, что многие из эпигенетических изменений, присутствующих в опухолях, могли произойти в преднеопластических дефектах поля. [44]
В толстой кишке дефект поля, вероятно, возникает в результате естественного отбора мутантной или эпигенетически измененной клетки среди стволовых клеток в основании одной из кишечных крипт на внутренней поверхности толстой кишки. Мутантная или эпигенетически измененная стволовая клетка может заменить другие близлежащие стволовые клетки путем естественного отбора. Это может привести к возникновению участка аномальной ткани. Рисунок в этом разделе включает фотографию свежерезецированного и продольно вскрытого сегмента толстой кишки, показывающего рак толстой кишки и четыре полипа. Под фотографией приведена схематическая диаграмма того, как мог образоваться большой участок мутантных или эпигенетически измененных клеток, показанный большой областью желтого цвета на диаграмме. Внутри этого первого большого участка на диаграмме (большой клон клеток) может произойти вторая такая мутация или эпигенетическое изменение, так что данная стволовая клетка приобретает преимущество по сравнению со своими соседями, и эта измененная стволовая клетка может клонально расширяться, образуя вторичный участок или субклон внутри исходного участка. На схеме это обозначено четырьмя меньшими пятнами разных цветов внутри большой желтой исходной области. Внутри этих новых пятен (субклонов) процесс может повторяться несколько раз, на что указывают еще меньшие пятна внутри четырех вторичных пятен (с еще разными цветами на схеме), которые клонально расширяются, пока не возникнут стволовые клетки, которые генерируют либо небольшие полипы, либо злокачественное новообразование (рак). На фотографии видимый дефект поля в этом сегменте толстой кишки породил четыре полипа (помечены размером полипов, 6 мм, 5 мм и два по 3 мм, и рак около 3 см в поперечнике в самом длинном измерении). Эти новообразования также обозначены (на схеме под фотографией) четырьмя маленькими желтовато-коричневыми кругами (полипы) и большей красной областью (рак). Рак на фотографии возник в слепой кишке толстой кишки, где толстая кишка соединяется с тонкой кишкой (помечено) и где находится аппендикс (помечено). Жир на фотографии находится снаружи наружной стенки толстой кишки. На представленном здесь участке толстой кишки толстая кишка была разрезана продольно, чтобы обнажить ее внутреннюю поверхность и продемонстрировать рак и полипы, находящиеся во внутреннем эпителиальном слое толстой кишки. [ необходима ссылка ]
Если общий процесс, посредством которого возникают спорадические раки толстой кишки, заключается в формировании преднеопластического клона, который распространяется путем естественного отбора, за которым следует формирование внутренних субклонов внутри исходного клона и суб-субклонов внутри них, то рак толстой кишки, как правило, должен быть связан с полями возрастающей аномалии и предшествовать им, отражая последовательность предраковых событий. Самая обширная область аномалии (самая внешняя желтая нерегулярная область на диаграмме) будет отражать самое раннее событие в формировании злокачественной опухоли.
В экспериментальной оценке специфических дефицитов репарации ДНК при раке было также показано, что многие специфические дефициты репарации ДНК возникают в дефектах поля, окружающих эти раковые опухоли. В таблице ниже приведены примеры, для которых было показано, что дефицит репарации ДНК при раке вызван эпигенетическим изменением, и несколько более низкие частоты, с которыми тот же эпигенетически вызванный дефицит репарации ДНК обнаруживался в дефекте поля, окружающем эти раковые опухоли.
Некоторые из небольших полипов в области дефекта, показанные на фотографии открытого сегмента толстой кишки, могут быть относительно доброкачественными новообразованиями. В исследовании 1996 года полипов размером менее 10 мм, обнаруженных во время колоноскопии, и сопровождавшихся повторными колоноскопиями в течение 3 лет, 25% остались неизменными в размере, 35% регрессировали или уменьшились в размере и 40% увеличились в размере. [55]
Известно, что раковые заболевания проявляют нестабильность генома или «мутаторный фенотип». [56] Белок-кодирующая ДНК в ядре составляет около 1,5% от общей геномной ДНК. [57] В этой белок-кодирующей ДНК (называемой экзомом ) средний рак молочной железы или толстой кишки может иметь около 60-70 мутаций, изменяющих белок, из которых около 3 или 4 могут быть «драйверными» мутациями, а остальные могут быть «пассажирскими» мутациями. [44] Однако среднее число мутаций последовательности ДНК во всем геноме (включая некодирующие белок регионы ) в образце ткани рака молочной железы составляет около 20 000. [58] В среднем образце ткани меланомы (меланомы имеют более высокую частоту мутаций экзома ), [44] общее число мутаций последовательности ДНК составляет около 80 000. [59] Эти высокие частоты мутаций в общих нуклеотидных последовательностях в раковых клетках предполагают, что часто раннее изменение в дефекте поля, приводящее к раку (например, желтая область на диаграмме в предыдущем разделе), является дефицитом репарации ДНК. Обнаружено, что большие дефекты поля, окружающие рак толстой кишки (простирающиеся примерно до 10 см с каждой стороны рака) [48] , часто имеют эпигенетические дефекты в двух или трех белках репарации ДНК ( ERCC1 , ERCC4 (XPF) и/или PMS2 ) во всей области дефекта поля. Когда экспрессия генов репарации ДНК снижается, повреждения ДНК накапливаются в клетках с более высокой, чем обычно, скоростью, и это избыточное повреждение вызывает повышенную частоту мутаций и/или эпимутаций. Скорость мутаций сильно возрастает в клетках, дефектных в репарации несоответствий ДНК [28] [29] или в гомологичной рекомбинационной репарации (HRR). [30] Дефицит репарации ДНК сам по себе может привести к накоплению повреждений ДНК, а подверженный ошибкам синтез транслезионных повреждений некоторых поврежденных участков может привести к мутациям. Кроме того, неправильное восстановление этих накопленных повреждений ДНК может привести к эпимутациям. Эти новые мутации и/или эпимутации могут обеспечить пролиферативное преимущество, создавая дефект поля. Хотя мутации/эпимутации в генах репарации ДНК сами по себе не дают селективного преимущества, они могут переноситься в качестве пассажиров в клетках, когда клетка приобретает дополнительную мутацию/эпимутацию, которая действительно обеспечивает пролиферативное преимущество. [ необходима цитата ]
Существует ряд теорий канцерогенеза и лечения рака, которые выходят за рамки основного научного мнения из-за отсутствия научного обоснования, логики или доказательной базы. Эти теории могут использоваться для обоснования различных альтернативных методов лечения рака. Их следует отличать от тех теорий канцерогенеза, которые имеют логическую основу в рамках основной биологии рака и из которых можно сделать условно проверяемые гипотезы. [ необходима цитата ]
Однако несколько альтернативных теорий канцерогенеза основаны на научных данных и все чаще признаются. Некоторые исследователи полагают, что рак может быть вызван анеуплоидией (численными и структурными аномалиями в хромосомах) [60], а не мутациями или эпимутациями. Рак также рассматривался как метаболическое заболевание, при котором клеточный метаболизм кислорода отклоняется от пути, который генерирует энергию ( окислительное фосфорилирование ) на путь, который генерирует активные формы кислорода . [61] Это вызывает переключение энергии с окислительного фосфорилирования на аэробный гликолиз ( эффект Варбурга ) и накопление активных форм кислорода, что приводит к окислительному стрессу («теория окислительного стресса рака»). [61] Другая концепция развития рака основана на воздействии слабых магнитных и электромагнитных полей и их влиянии на окислительный стресс , известном как магнитоканцерогенез. [62]
Ряд авторов подвергли сомнению предположение о том, что рак является результатом последовательных случайных мутаций, как чрезмерно упрощенное, предположив вместо этого, что рак является результатом неспособности организма подавлять врожденную, запрограммированную пролиферативную тенденцию. [63] Связанная теория предполагает, что рак является атавизмом , эволюционным возвратом к более ранней форме многоклеточной жизни . [64] Гены, ответственные за неконтролируемый рост клеток и сотрудничество между раковыми клетками, очень похожи на те, которые позволили первым многоклеточным формам жизни группироваться и процветать. Эти гены все еще существуют в геномах более сложных метазоа , таких как люди, хотя более недавно эволюционировавшие гены держат их под контролем. Когда новые контролирующие гены по какой-либо причине выходят из строя, клетка может вернуться к своему более примитивному программированию и размножаться бесконтрольно. Эта теория является альтернативой представлению о том, что рак начинается с клеток-изгоев, которые подвергаются эволюции внутри организма. Вместо этого они обладают фиксированным числом примитивных генов, которые постепенно активируются, что дает им конечную изменчивость. [65] Другая эволюционная теория возвращает корни рака к происхождению эукариотической (ядросодержащей) клетки путем массивного горизонтального переноса генов , когда геномы заражающих вирусов расщеплялись (и тем самым ослаблялись) хозяином, но их фрагменты интегрировались в геном хозяина в качестве иммунной защиты. Таким образом, рак возникает, когда редкая соматическая мутация рекомбинирует такие фрагменты в функциональный драйвер пролиферации клеток. [66]
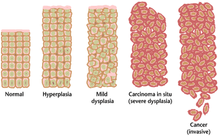
Часто множественные генетические изменения, которые приводят к раку, могут накапливаться в течение многих лет. В течение этого времени биологическое поведение предраковых клеток медленно меняется от свойств нормальных клеток к свойствам, подобным раковым. Предраковая ткань может иметь отличительный вид под микроскопом . Среди отличительных черт предракового поражения - увеличенное количество делящихся клеток , изменение размера и формы ядра , изменение размера и формы клеток , потеря специализированных клеточных особенностей и потеря нормальной организации ткани. Дисплазия - это ненормальный тип чрезмерной пролиферации клеток, характеризующийся потерей нормального расположения ткани и структуры клеток в предраковых клетках. Эти ранние неопластические изменения следует отличать от гиперплазии , обратимого увеличения деления клеток, вызванного внешним стимулом, таким как гормональный дисбаланс или хроническое раздражение. [ необходима цитата ]
Наиболее тяжелые случаи дисплазии называются карциномой in situ . На латыни термин in situ означает «на месте»; карцинома in situ относится к неконтролируемому росту диспластических клеток, которые остаются на своем первоначальном месте и не проявляют инвазии в другие ткани. Карцинома in situ может развиться в инвазивную злокачественную опухоль и обычно удаляется хирургическим путем при обнаружении.
Так же, как популяция животных претерпевает эволюцию , неконтролируемая популяция клеток также может претерпевать «эволюцию». Этот нежелательный процесс называется соматической эволюцией , и именно так возникает рак и со временем становится более злокачественным. [67]
Большинство изменений в клеточном метаболизме, которые позволяют клеткам расти беспорядочно, приводят к гибели клеток. Однако, как только начинается рак, раковые клетки подвергаются процессу естественного отбора : несколько клеток с новыми генетическими изменениями, которые повышают их выживаемость или воспроизводство, размножаются быстрее и вскоре начинают доминировать в растущей опухоли, поскольку клетки с менее благоприятными генетическими изменениями вытесняются. [68] Это тот же механизм, посредством которого патогенные виды, такие как MRSA, могут стать устойчивыми к антибиотикам , и посредством которого ВИЧ может стать устойчивым к лекарствам , и посредством которого болезни растений и насекомые могут стать устойчивыми к пестицидам . Эта эволюция объясняет, почему рецидив рака часто вовлекает клетки, которые приобрели устойчивость к противораковым препаратам или устойчивость к радиотерапии .
В статье Ханахана и Вайнберга 2000 года биологические свойства клеток злокачественных опухолей были обобщены следующим образом: [69]
Выполнение этих многочисленных шагов было бы очень редким событием без:
Эти биологические изменения являются классическими для карцином ; другие злокачественные опухоли могут не нуждаться в достижении всех из них. Например, учитывая, что инвазия тканей и смещение в отдаленные места являются нормальными свойствами лейкоцитов , эти шаги не нужны при развитии лейкемии . Также различные шаги не обязательно представляют собой отдельные мутации. Например, инактивация одного гена, кодирующего белок p53 , вызовет геномную нестабильность, уклонение от апоптоза и повышенный ангиогенез. Кроме того, не все раковые клетки делятся. Скорее, подмножество клеток в опухоли, называемые раковыми стволовыми клетками , реплицируют себя, поскольку они генерируют дифференцированные клетки. [70]
Обычно, как только ткань повреждена или инфицирована, поврежденные клетки вызывают воспаление, стимулируя определенные паттерны активности ферментов и экспрессии генов цитокинов в окружающих клетках. [71] [72] Отдельные кластеры («цитокиновые кластеры») молекул секретируются, которые действуют как медиаторы, вызывая активность последующих каскадов биохимических изменений. [73] Каждый цитокин связывается со специфическими рецепторами на различных типах клеток, и каждый тип клеток в свою очередь реагирует, изменяя активность внутриклеточных путей передачи сигнала в зависимости от рецепторов, которые экспрессирует клетка, и сигнальных молекул, присутствующих внутри клетки. [74] [75] В совокупности этот процесс перепрограммирования вызывает поэтапное изменение фенотипов клеток, что в конечном итоге приведет к восстановлению функции ткани и к восстановлению необходимой структурной целостности. [76] [77] Таким образом, ткань может заживать в зависимости от продуктивной коммуникации между клетками, присутствующими в месте повреждения, и иммунной системой. [78] Одним из ключевых факторов заживления является регуляция экспрессии генов цитокинов, которая позволяет комплементарным группам клеток реагировать на воспалительные медиаторы таким образом, что постепенно вызывает существенные изменения в физиологии тканей. [79] [80] [81] Раковые клетки имеют либо постоянные (генетические), либо обратимые (эпигенетические) изменения в своем геноме, которые частично подавляют их связь с окружающими клетками и с иммунной системой. [82] [83] Раковые клетки не взаимодействуют со своим тканевым микроокружением таким образом, чтобы защитить целостность ткани; вместо этого перемещение и выживание раковых клеток становятся возможными в местах, где они могут нарушить функцию ткани. [84] [85] Раковые клетки выживают, «перестраивая» сигнальные пути, которые обычно защищают ткань от иммунной системы. Это изменение иммунного ответа очевидно и на ранних стадиях злокачественности. [86] [87]
Одним из примеров перестройки функции ткани при раке является активность фактора транскрипции NF-κB . [88] NF-κB активирует экспрессию многочисленных генов, участвующих в переходе между воспалением и регенерацией, которые кодируют цитокины, факторы адгезии и другие молекулы, которые могут изменять судьбу клеток. [89] Это перепрограммирование клеточных фенотипов обычно позволяет развивать полностью функциональную неповрежденную ткань. [90] Активность NF-κB строго контролируется несколькими белками, которые в совокупности гарантируют, что только дискретные кластеры генов индуцируются NF-κB в данной клетке и в данное время. [91] Эта жесткая регуляция обмена сигналами между клетками защищает ткань от чрезмерного воспаления и гарантирует, что различные типы клеток постепенно приобретают дополнительные функции и определенные положения. Нарушение этой взаимной регуляции между генетическим перепрограммированием и взаимодействиями клеток позволяет раковым клеткам давать начало метастазам. Раковые клетки аберрантно реагируют на цитокины и активируют каскады сигналов, которые могут защитить их от иммунной системы. [88] [92]
Роль йода в морской рыбе (богатой йодом) и пресноводной рыбе (с дефицитом йода) до конца не изучена, но сообщается, что пресноводная рыба более восприимчива к инфекционным и, в частности, неопластическим и атеросклеротическим заболеваниям, чем морская рыба. [93] [94] Морские пластиножаберные рыбы, такие как акулы, скаты и т. д., гораздо меньше подвержены раку, чем пресноводные рыбы, и поэтому стимулировали медицинские исследования для лучшего понимания канцерогенеза. [95]
Для того чтобы клетки начали бесконтрольно делиться, гены, регулирующие рост клеток, должны быть разрегулированы. [96] Протоонкогены — это гены, которые способствуют росту клеток и митозу , тогда как гены-супрессоры опухолей препятствуют росту клеток или временно останавливают деление клеток для проведения репарации ДНК . Обычно требуется серия из нескольких мутаций этих генов, прежде чем нормальная клетка трансформируется в раковую . [10] Эту концепцию иногда называют «онкоэволюцией». Мутации этих генов подают сигналы опухолевым клеткам, чтобы начать бесконтрольно делиться. Но неконтролируемое деление клеток, которое характерно для рака, также требует, чтобы делящаяся клетка дублировала все свои клеточные компоненты для создания двух дочерних клеток. Активация аэробного гликолиза ( эффект Варбурга ), которая не обязательно вызвана мутациями в протоонкогенах и генах-супрессорах опухолей, [97] обеспечивает большую часть строительных блоков, необходимых для дублирования клеточных компонентов делящейся клетки и, следовательно, также необходима для канцерогенеза. [61]
Онкогены способствуют росту клеток различными способами. Многие из них могут вырабатывать гормоны , «химического посредника» между клетками, который стимулирует митоз , эффект которого зависит от передачи сигнала принимающей ткани или клеток. Другими словами, когда стимулируется рецептор гормона на клетке-реципиенте, сигнал передается с поверхности клетки к ядру клетки , чтобы повлиять на некоторые изменения в регуляции транскрипции генов на ядерном уровне. Некоторые онкогены являются частью самой системы передачи сигнала или рецепторов сигнала в самих клетках и тканях, таким образом контролируя чувствительность к таким гормонам. Онкогены часто вырабатывают митогены или участвуют в транскрипции ДНК при синтезе белка , что создает белки и ферменты, ответственные за производство продуктов и биохимических веществ, которые клетки используют и с которыми взаимодействуют.
Мутации в протоонкогенах, которые обычно являются покоящимися аналогами онкогенов , могут изменять их экспрессию и функцию, увеличивая количество или активность белка-продукта. Когда это происходит, протоонкогены становятся онкогенами , и этот переход нарушает нормальный баланс регуляции клеточного цикла в клетке, делая возможным неконтролируемый рост. Вероятность рака не может быть снижена путем удаления протоонкогенов из генома , даже если бы это было возможно, поскольку они имеют решающее значение для роста, восстановления и гомеостаза организма. Только когда они мутируют, сигналы для роста становятся чрезмерными.
Одним из первых онкогенов , определенных в исследованиях рака, является онкоген ras . Мутации в семействе протоонкогенов Ras (включая H-Ras, N-Ras и K-Ras) очень распространены и обнаруживаются в 20–30 % всех опухолей человека. [98] Ras был первоначально идентифицирован в геноме вируса саркомы Харви, и исследователи были удивлены тем, что этот ген не только присутствует в геноме человека, но и при лигировании к стимулирующему элементу управления может вызывать рак в культурах клеточных линий. [99] Недавно были предложены новые механизмы, согласно которым трансформация клеток во время канцерогенеза определяется общим порогом сетей онкогенов (таких как сигнализация Ras), а не статусом отдельного онкогена. [100]
Протоонкогены способствуют росту клеток различными способами. Многие из них могут вырабатывать гормоны , «химические посредники» между клетками, которые стимулируют митоз, эффект которого зависит от передачи сигнала принимающей ткани или клеток. Некоторые отвечают за систему передачи сигнала и рецепторы сигнала в самих клетках и тканях, таким образом контролируя чувствительность к таким гормонам. Они часто вырабатывают митогены или участвуют в транскрипции ДНК в синтезе белка , который создает белки и ферменты, ответственные за производство продуктов и биохимических веществ, которые клетки используют и с которыми взаимодействуют.
Мутации в протоонкогенах могут изменять их экспрессию и функцию, увеличивая количество или активность белка-продукта. Когда это происходит, они становятся онкогенами , и, таким образом, у клеток повышается вероятность чрезмерного и неконтролируемого деления. Вероятность рака не может быть снижена путем удаления протоонкогенов из генома , поскольку они имеют решающее значение для роста, восстановления и гомеостаза организма. Только когда они мутируют, сигналы для роста становятся чрезмерными. Важно отметить, что ген, обладающий ролью стимуляции роста, может увеличить канцерогенный потенциал клетки при условии, что все необходимые клеточные механизмы, которые обеспечивают рост, активированы. [101] Это условие также включает инактивацию специфических генов-супрессоров опухолей (см. ниже). Если условие не выполняется, клетка может перестать расти и может начать умирать. Это делает идентификацию стадии и типа раковой клетки , которая растет под контролем данного онкогена, решающей для разработки стратегий лечения.

Гены-супрессоры опухолей кодируют антипролиферативные сигналы и белки, которые подавляют митоз и рост клеток. Как правило, супрессоры опухолей являются факторами транскрипции , которые активируются клеточным стрессом или повреждением ДНК. Часто повреждение ДНК вызывает наличие свободно плавающего генетического материала, а также другие признаки, и запускает ферменты и пути, которые приводят к активации генов-супрессоров опухолей . Функция таких генов заключается в остановке прогрессирования клеточного цикла для выполнения репарации ДНК, предотвращая передачу мутаций дочерним клеткам. Белок p53 , один из наиболее важных изученных генов-супрессоров опухолей, является фактором транскрипции, активируемым многими клеточными стрессорами, включая гипоксию и повреждение ультрафиолетовым излучением .
Несмотря на то, что почти половина всех видов рака, возможно, связана с изменениями в p53, его функция супрессора опухолей изучена недостаточно. p53, очевидно, имеет две функции: одна — ядерная роль как фактор транскрипции, а другая — цитоплазматическая роль в регуляции клеточного цикла, деления клеток и апоптоза.
Эффект Варбурга заключается в преимущественном использовании гликолиза для получения энергии с целью поддержания роста раковых клеток. Было показано, что p53 регулирует переход от дыхательного к гликолитическому пути. [102]
Однако мутация может повредить сам ген-супрессор опухоли или сигнальный путь, который его активирует, «выключая» его. Неизменным следствием этого является то, что репарация ДНК затрудняется или подавляется: повреждения ДНК накапливаются без репарации, что неизбежно приводит к раку.
Мутации генов-супрессоров опухолей, которые происходят в клетках зародышевой линии , передаются потомству и увеличивают вероятность диагностики рака в последующих поколениях. У членов этих семей повышена заболеваемость и снижена латентность множественных опухолей. Типы опухолей типичны для каждого типа мутации гена-супрессора опухолей, при этом некоторые мутации вызывают определенные виды рака, а другие мутации вызывают другие. Способ наследования мутантных супрессоров опухолей заключается в том, что пораженный член наследует дефектную копию от одного родителя и нормальную копию от другого. Например, у людей, которые наследуют один мутантный аллель p53 (и, следовательно, гетерозиготны по мутированному p53 ), могут развиться меланомы и рак поджелудочной железы , известный как синдром Ли-Фраумени . Другие унаследованные синдромы гена-супрессора опухолей включают мутации Rb , связанные с ретинобластомой , и мутации гена APC , связанные с аденополипозным раком толстой кишки . Аденополипозный рак толстой кишки связан с тысячами полипов в толстой кишке в молодом возрасте, что приводит к раку толстой кишки в относительно раннем возрасте. Наконец, наследственные мутации в BRCA1 и BRCA2 приводят к раннему началу рака молочной железы .
В 1971 году было высказано предположение, что развитие рака зависит по крайней мере от двух мутационных событий. В том, что стало известно как гипотеза двух ударов Кнудсона , унаследованная мутация зародышевой линии в гене-супрессоре опухоли может вызвать рак только в том случае, если позже в жизни организма произойдет другое мутационное событие, инактивирующее другой аллель этого гена-супрессора опухоли . [103]
Обычно онкогены являются доминантными , поскольку содержат мутации с усилением функции , в то время как мутировавшие супрессоры опухолей являются рецессивными , поскольку содержат мутации с потерей функции . Каждая клетка имеет две копии одного и того же гена, по одной от каждого родителя, и в большинстве случаев мутации с усилением функции всего в одной копии конкретного протоонкогена достаточно, чтобы сделать этот ген истинным онкогеном. С другой стороны, мутации с потерей функции должны произойти в обеих копиях гена-супрессора опухолей, чтобы сделать этот ген полностью нефункциональным. Однако существуют случаи, в которых одна мутировавшая копия гена- супрессора опухолей может сделать другую, дикую копию, нефункциональной. Это явление называется доминантно-негативным эффектом и наблюдается во многих мутациях p53.
Модель двух ударов Кнудсона недавно была оспорена несколькими исследователями. Инактивация одного аллеля некоторых генов-супрессоров опухолей достаточна для возникновения опухолей. Это явление называется гаплонедостаточностью и было продемонстрировано рядом экспериментальных подходов. Опухоли, вызванные гаплонедостаточностью, обычно имеют более поздний возраст возникновения по сравнению с опухолями, вызванными двух ударным процессом. [104]

В целом, для возникновения рака необходимы мутации в обоих типах генов. Например, мутация, ограниченная одним онкогеном, будет подавлена нормальными генами контроля митоза и супрессорами опухолей, впервые выдвинутыми гипотезой Кнудсона . [8] Мутация только одного гена-супрессора опухолей также не вызовет рак из-за наличия множества « резервных » генов, которые дублируют его функции. Только когда достаточное количество протоонкогенов мутировало в онкогены, а достаточное количество генов-супрессоров опухолей деактивировано или повреждено, сигналы для роста клеток подавляют сигналы для его регулирования, и рост клеток быстро выходит из-под контроля. [10] Часто, поскольку эти гены регулируют процессы, которые предотвращают большую часть повреждения самих генов, скорость мутаций увеличивается по мере того, как человек становится старше, потому что повреждение ДНК образует петлю обратной связи .
Мутация генов-супрессоров опухолей, которые передаются следующему поколению не только клеток, но и их потомков , может привести к увеличению вероятности наследования рака. Члены этих семей имеют повышенную заболеваемость и сниженную латентность множественных опухолей. Способ наследования мутантных супрессоров опухолей заключается в том, что пораженный член наследует дефектную копию от одного родителя и нормальную копию от другого. Поскольку мутации в супрессорах опухолей действуют рецессивно (заметьте, однако, что есть исключения), потеря нормальной копии создает фенотип рака . Например, люди, гетерозиготные по мутациям p53, часто становятся жертвами синдрома Ли-Фраумени , а гетерозиготные по мутациям Rb развивают ретинобластому . Аналогичным образом мутации в гене аденоматозного полипоза толстой кишки связаны с аденополипозным раком толстой кишки , при котором в молодом возрасте в толстой кишке образуются тысячи полипов, тогда как мутации в генах BRCA1 и BRCA2 приводят к раннему началу рака молочной железы .
Новая идея, объявленная в 2011 году, представляет собой экстремальную версию множественных мутаций, называемую ее сторонниками хромотрипсисом . Эта идея, затрагивающая только 2–3% случаев рака, хотя до 25% случаев рака костей, включает катастрофическое разрушение хромосомы на десятки или сотни частей, а затем их неправильное сшивание. Это разрушение, вероятно, происходит, когда хромосомы уплотняются во время нормального деления клеток , но причина разрушения неизвестна. Согласно этой модели, рак возникает в результате одного изолированного события, а не медленного накопления множественных мутаций. [105]
Многие мутагены также являются канцерогенами , но некоторые канцерогены не являются мутагенами. Примерами канцерогенов, которые не являются мутагенами, являются алкоголь и эстроген . Считается, что они способствуют возникновению рака посредством их стимулирующего воздействия на скорость митоза клеток . Более высокая скорость митоза все больше оставляет меньше возможностей для ферментов репарации для восстановления поврежденной ДНК во время репликации ДНК , увеличивая вероятность генетической ошибки. Ошибка, допущенная во время митоза, может привести к получению дочерними клетками неправильного количества хромосом , что приводит к анеуплоидии и может привести к раку.
Helicobacter pylori может вызывать рак желудка . Хотя данные различаются в разных странах, в целом у 1–3 % людей, инфицированных Helicobacter pylori, в течение жизни развивается рак желудка по сравнению с 0,13 % людей, у которых не было инфекции H. pylori . [106] [107] Инфекция H. pylori очень распространена. По оценкам 2002 года, она присутствует в тканях желудка 74 % взрослых среднего возраста в развивающихся странах и 58 % в развитых странах. [108] Поскольку у 1–3 % инфицированных людей может развиться рак желудка, [109] рак желудка, вызванный H. pylori , является третьей по величине причиной смертности от рака в мире по состоянию на 2018 год. [110]
Инфекция H. pylori не вызывает никаких симптомов примерно у 80% инфицированных. [111] Примерно у 75% людей, инфицированных H. pylori , развивается гастрит . [112] Таким образом, обычным последствием инфекции H. pylori является хронический бессимптомный гастрит. [113] Из-за обычного отсутствия симптомов, когда рак желудка наконец диагностируется, он часто находится на довольно поздней стадии. Более половины пациентов с раком желудка имеют метастазы в лимфатических узлах, когда им первоначально ставят диагноз. [114]
Гастрит, вызванный H. pylori , сопровождается воспалением , характеризующимся инфильтрацией нейтрофилов и макрофагов в эпителий желудка, что способствует накоплению провоспалительных цитокинов и активных форм кислорода / активных форм азота (ROS/RNS). [115] Значительное присутствие ROS/RNS вызывает повреждение ДНК, включая 8-оксо-2'-дезоксигуанозин (8-OHdG). [115] Если инфицирующие H. pylori несут цитотоксический ген cagA (присутствует примерно у 60% западных изолятов и более высокого процента азиатских изолятов), они могут увеличить уровень 8-OHdG в клетках желудка в 8 раз, в то время как если H. pylori не несут ген cagA, увеличение 8-OHdG составляет примерно 4 раза. [116] Помимо окислительного повреждения ДНК 8-OHdG, инфекция H. pylori вызывает другие характерные повреждения ДНК, включая двухцепочечные разрывы ДНК. [117]
H. pylori также вызывает множество эпигенетических изменений, связанных с развитием рака. [118] [119] Эти эпигенетические изменения обусловлены метилированием CpG-сайтов в промоторах генов, вызванным H. pylori [118] , и измененной экспрессией множества микроРНК , вызванной H. pylori . [119]
Как было рассмотрено Сантосом и Рибейро [120], инфекция H. pylori связана с эпигенетически сниженной эффективностью механизма репарации ДНК, что способствует накоплению мутаций и геномной нестабильности, а также желудочному канцерогенезу. В частности, Раза и др. [121] показали, что экспрессия двух белков репарации ДНК, ERCC1 и PMS2 , была значительно снижена, как только инфекция H. pylori прогрессировала и стала причиной диспепсии . Диспепсия возникает примерно у 20% инфицированных людей. [122] Кроме того, как было рассмотрено Раза и др. [121] , человеческая желудочная инфекция H. pylori вызывает эпигенетически сниженную экспрессию белков репарации ДНК MLH1 , MGMT и MRE11 . Сниженная репарация ДНК при наличии повышенного повреждения ДНК увеличивает канцерогенные мутации и, вероятно, является значимой причиной канцерогенеза H. pylori .
Другие бактерии также могут играть роль в канцерогенезе. Контроль контрольных точек клеточного цикла и апоптоза p53 подавляется бактерией микоплазмы , [123] позволяя клеткам с повреждением ДНК « проходить апоптотический красный свет» и продолжать клеточный цикл.
Кроме того, многие виды рака возникают из-за вирусной инфекции ; это особенно актуально для животных, таких как птицы , но в меньшей степени для людей . 12% случаев рака у людей можно отнести к вирусной инфекции. [124] Способ возникновения опухолей, вызванных вирусами, можно разделить на два: остро трансформирующиеся и медленно трансформирующиеся . В остро трансформирующихся вирусах вирусные частицы несут ген, который кодирует сверхактивный онкоген, называемый вирусным онкогеном (v-onc), и инфицированная клетка трансформируется, как только v-onc экспрессируется. Напротив, в медленно трансформирующихся вирусах геном вируса вставляется, особенно потому, что вставка вирусного генома является обязательной частью ретровирусов , рядом с протоонкогеном в геноме хозяина. Вирусный промотор или другие элементы регуляции транскрипции, в свою очередь, вызывают сверхэкспрессию этого протоонкогена, что, в свою очередь, вызывает неконтролируемую клеточную пролиферацию. Поскольку вставка вирусного генома неспецифична для протоонкогенов, а вероятность вставки вблизи этого протоонкогена низка, медленно трансформирующиеся вирусы имеют очень длительный латентный период развития опухоли по сравнению с остро трансформирующимся вирусом, который уже несет вирусный онкоген.
Вирусы, которые, как известно, вызывают рак, такие как ВПЧ ( рак шейки матки ), гепатит В ( рак печени ) и ВЭБ (тип лимфомы ), являются ДНК-вирусами. Считается, что когда вирус заражает клетку, он вставляет часть своей собственной ДНК рядом с генами роста клетки, вызывая деление клетки. Группа измененных клеток, которые образуются при первом делении клетки, имеет одинаковую вирусную ДНК рядом с генами роста клетки. Группа измененных клеток теперь является особой, потому что один из нормальных контролей роста был утрачен.
В зависимости от их расположения, клетки могут быть повреждены радиацией, химикатами сигаретного дыма и воспалением от бактериальной инфекции или других вирусов. У каждой клетки есть шанс быть поврежденной. Клетки часто умирают, если они повреждены, из-за сбоя жизненно важного процесса или иммунной системы, однако иногда повреждение выбивает один ген рака. У старого человека есть тысячи, десятки тысяч или сотни тысяч выбитых клеток. Вероятность того, что любая из них сформирует рак, очень мала. [ необходима цитата ]
Когда повреждение происходит в любой области измененных клеток, происходит что-то другое. Каждая из клеток имеет потенциал для роста. Измененные клетки будут делиться быстрее, когда область повреждена физическими, химическими или вирусными агентами. Был создан порочный круг : повреждение области приведет к тому, что измененные клетки начнут делиться, что увеличит вероятность того, что они испытают нокауты.
Эта модель канцерогенеза популярна, потому что она объясняет, почему рак растет. Можно было бы ожидать, что клетки, поврежденные радиацией, умрут или, по крайней мере, будут в худшем состоянии, потому что у них меньше работающих генов; вирусы увеличивают количество работающих генов.
Одна из мыслей заключается в том, что мы можем оказаться с тысячами вакцин для предотвращения каждого вируса, который может изменить наши клетки. Вирусы могут оказывать разное воздействие на разные части тела. Возможно, можно предотвратить ряд различных видов рака путем иммунизации против одного вирусного агента. Вероятно, что ВПЧ, например, играет роль в раке слизистых оболочек рта.
Известно, что некоторые паразитические черви являются канцерогенными. [125] К ним относятся:
Эпигенетика — это изучение регуляции экспрессии генов посредством химических, немутационных изменений в структуре ДНК. Теория эпигенетики в патогенезе рака заключается в том, что немутационные изменения ДНК могут приводить к изменениям в экспрессии генов. Обычно онкогены молчат, например, из-за метилирования ДНК . Потеря этого метилирования может вызвать аберрантную экспрессию онкогенов , что приводит к патогенезу рака. Известные механизмы эпигенетических изменений включают метилирование ДНК и метилирование или ацетилирование гистоновых белков, связанных с хромосомной ДНК в определенных местах. Классы лекарств, известные как ингибиторы HDAC и ингибиторы ДНК-метилтрансферазы , могут повторно регулировать эпигенетическую сигнализацию в раковой клетке .
Эпимутации включают метилирование или деметилирование CpG-островков промоторных областей генов, что приводит к репрессии или дерепрессии, соответственно, экспрессии генов. [127] [128] [129] Эпимутации также могут происходить путем ацетилирования, метилирования, фосфорилирования или других изменений гистонов, создавая гистоновый код , который репрессирует или активирует экспрессию генов, и такие эпимутации гистонов могут быть важными эпигенетическими факторами при раке. [130] [131] Кроме того, канцерогенная эпимутация может происходить из-за изменений в архитектуре хромосом, вызванных такими белками, как HMGA2 . [132] Еще одним источником эпимутации является повышенная или пониженная экспрессия микроРНК (miRNA). Например, дополнительная экспрессия miR-137 может вызвать подавление экспрессии 491 гена, а miR-137 эпигенетически подавляется в 32% случаев колоректального рака> [15]
Новый способ рассмотрения канцерогенеза возникает благодаря интеграции идей биологии развития в онкологию . Гипотеза раковых стволовых клеток предполагает, что различные виды клеток в гетерогенной опухоли возникают из одной клетки, называемой раковой стволовой клеткой. Раковые стволовые клетки могут возникать в результате трансформации взрослых стволовых клеток или дифференцированных клеток в организме. Эти клетки сохраняются как субкомпонент опухоли и сохраняют ключевые свойства стволовых клеток. Они дают начало различным клеткам, способны к самообновлению и гомеостатическому контролю. [133] Кроме того, рецидив рака и появление метастазов также приписываются этим клеткам. Гипотеза раковых стволовых клеток не противоречит более ранним концепциям канцерогенеза. Гипотеза раковых стволовых клеток была предложенным механизмом, который способствует гетерогенности опухоли .
В то время как генетические и эпигенетические изменения в генах-супрессорах опухолей и онкогенах изменяют поведение клеток, эти изменения, в конечном итоге, приводят к раку из-за их воздействия на популяцию неопластических клеток и их микроокружение. [67] Мутантные клетки в новообразованиях конкурируют за пространство и ресурсы. Таким образом, клон с мутацией в гене-супрессоре опухолей или онкогене будет расширяться в новообразовании только в том случае, если эта мутация даст клону конкурентное преимущество перед другими клонами и нормальными клетками в его микроокружении. [134] Таким образом, процесс канцерогенеза формально является процессом дарвиновской эволюции , известным как соматическая или клональная эволюция . [68] Кроме того, в свете дарвиновских механизмов канцерогенеза было высказано предположение, что различные формы рака можно отнести к категориям пубертатных и геронтологических. В настоящее время проводятся антропологические исследования рака как естественного эволюционного процесса, посредством которого естественный отбор уничтожает экологически неполноценные фенотипы, поддерживая другие. Согласно этой теории, рак бывает двух отдельных типов: от рождения до конца полового созревания (приблизительно 20 лет) телеологически склонный к поддерживающей групповой динамике, и от середины жизни до смерти (приблизительно 40+ лет) телеологически склонный от перенаселенной групповой динамики. [ необходима цитата ]
{{cite journal}}: CS1 maint: DOI неактивен по состоянию на октябрь 2024 г. ( ссылка )