Псорален (также называемый псораленом ) является родительским соединением в семействе природных органических соединений, известных как линейные фуранокумарины . Он структурно связан с кумарином путем добавления конденсированного фуранового кольца и может рассматриваться как производное умбеллиферона . Псорален встречается в природе в семенах Psoralea corylifolia , а также в обычном инжире , сельдерее , петрушке , атласном дереве Вест-Индии и во всех цитрусовых . Он широко используется в лечении PUVA (псорален + UVA ) псориаза , экземы , витилиго и кожной Т-клеточной лимфомы ; эти применения обычно осуществляются с помощью таких лекарств, как Метоксален . Многие фуранокумарины чрезвычайно токсичны для рыб, и некоторые из них попадают в ручьи в Индонезии для ловли рыбы. [1]
Псорален является мутагеном и используется для этой цели в молекулярно-биологических исследованиях. Псорален интеркалирует в ДНК и при воздействии ультрафиолетового (UVA) излучения может образовывать моноаддукты и ковалентные межцепочечные сшивки (ICL) с тиминами, преимущественно на участках 5'-TpA в геноме, вызывая апоптоз . Псорален плюс UVA (PUVA) терапия может использоваться для лечения гиперпролиферативных заболеваний кожи, таких как псориаз и некоторые виды рака кожи . [2] К сожалению, само по себе лечение PUVA приводит к более высокому риску рака кожи. [3]
Важное применение псоралена — PUVA-терапия кожных проблем, таких как псориаз и, в меньшей степени, экзема и витилиго . Это позволяет использовать высокую поглощаемость УФ-излучения псораленом. Сначала псорален наносится для сенсибилизации кожи, затем применяется УФА-излучение для лечения заболевания. Псоралены также используются в фотоферезе , где они смешиваются с извлеченными лейкоцитами перед применением УФ-излучения.
Несмотря на фотоканцерогенные свойства псоралена, [4] [5] он использовался в качестве активатора загара в солнцезащитных кремах до 1996 года. [6] Псоралены используются в ускорителях загара, поскольку псорален повышает чувствительность кожи к свету. У некоторых пациентов наблюдалась серьезная потеря кожи после принятия солнечных ванн с активаторами загара, содержащими псорален. [7] Пациенты с более светлым цветом кожи страдают в четыре раза больше от свойств псораленов, вызывающих меланому, чем пациенты с более темной кожей. [6] Краткосрочные побочные эффекты псораленов включают тошноту, рвоту, эритрему, зуд, ксероз, боль в коже из-за фототоксического повреждения дермального нерва и могут вызывать злокачественные новообразования кожи и половых органов. [8]
Дополнительное применение оптимизированных псораленов — инактивация патогенов в продуктах крови. Синтетический аминопсорален, амотосален HCl, был разработан для инактивации инфекционных патогенов (бактерий, вирусов, простейших) в тромбоцитах и плазменных компонентах крови, подготовленных для трансфузионной поддержки пациентов. До клинического использования обработанные амотосаленом тромбоциты были протестированы и признаны неканцерогенными при использовании установленной модели мышей с нокаутом p53 . [9] В настоящее время эта технология используется в плановом порядке в некоторых европейских центрах крови и недавно была одобрена в США. [10] [11] [12] [13]
Псорален интеркалирует в двойную спираль ДНК, где он идеально расположен для образования одного или нескольких аддуктов с соседними пиримидиновыми основаниями, преимущественно тимином, при возбуждении ультрафиолетовым фотоном.
Несколько физико-химических методов были использованы для получения констант связывания для взаимодействий псоралена с ДНК. Классически, две камеры псоралена и буферизованного раствора ДНК разделены полупроницаемой мембраной ; сродство псоралена к ДНК напрямую связано с концентрацией псоралена в камере ДНК после равновесия. Растворимость в воде важна по двум причинам: фармакокинетика , связанная с растворимостью препарата в крови и требующая использования органических растворителей (например, ДМСО ). Псоралены также могут быть активированы облучением длинноволновым УФ-светом. В то время как свет диапазона UVA является клиническим стандартом, исследования, показывающие, что УФ-B более эффективен при образовании фотоаддуктов, предполагают, что его использование может привести к более высокой эффективности и сокращению времени лечения. [14]
Фотохимически реактивными участками в псораленах являются двойные связи углерод-углерод, подобные алкенам, в фурановом кольце (пятичленном кольце) и пироновом кольце (шестичленном кольце). При соответствующей интеркалации рядом с пиримидиновым основанием реакция четырехцентрового фотоциклоприсоединения может привести к образованию одного из двух моноаддуктов циклобутильного типа. Обычно моноаддукты фурановой стороны образуются в более высокой пропорции. Фурановый моноаддукт может поглощать второй фотон UVA, что приводит ко второму четырехцентровому фотоциклоприсоединению на пироновом конце молекулы и, следовательно, к образованию диаддукта или поперечной связи. Пироновые моноаддукты не поглощают в диапазоне UVA и, следовательно, не могут образовывать поперечные связи при дальнейшем облучении UVA. [15]
Еще одной важной особенностью этого класса соединений является их способность генерировать синглетный кислород , хотя этот процесс находится в прямой конкуренции с образованием аддуктов и может быть альтернативным путем рассеивания энергии возбужденного состояния.
Исследования псоралена исторически были сосредоточены на взаимодействии с ДНК и РНК (в частности, на образовании ICL). Однако было также показано, что псорален блокирует сигнализацию рецептора ErbB2 , который сверхэкспрессируется при некоторых агрессивных типах рака молочной железы. [16] Синтетическое производное бергаптена , 5-(4-феноксибутокси)псорален, показывает многообещающие результаты в качестве иммунодепрессанта, ингибируя специфический калиевый канал . Его структура предотвращает интеркаляцию в ДНК, и он очень слабо производит синглетный кислород, что значительно снижает нежелательную токсичность и мутагенность in vivo . Это имеет значение для лечения различных аутоиммунных заболеваний (например, рассеянного склероза , диабета 1 типа и ревматоидного артрита ). [17] Хотя модификация клеточной поверхности и блокирование ионных каналов являются двумя недавно открытыми механизмами действия, еще предстоит провести много исследований.
Большинство фуранокумаринов можно рассматривать как производные псоралена или ангелицина . Псорален и его производные часто называют линейными фуранокумаринами , так называемыми, поскольку они демонстрируют линейную химическую структуру. Важные линейные фуранокумарины включают ксантотоксин (также называемый метоксаленом ), бергаптен , императорин и нодакенетин .

Структура псоралена была первоначально выведена путем идентификации продуктов его реакций распада. Он демонстрирует обычные реакции лактона кумарина , такие как раскрытие кольца щелочью с образованием кумариновой кислоты или производного кумариновой кислоты . Перманганат калия вызывает окисление фуранового кольца, в то время как другие методы окисления производят фуран-2,3-карбоновую кислоту.
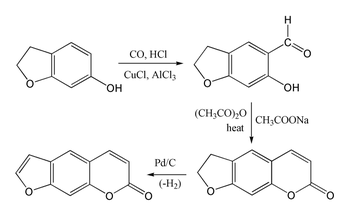
Псорален трудно синтезировать, поскольку умбеллиферон подвергается замещению в 8-м положении, а не в желаемом 6-м положении. Бензофуран реагирует преимущественно в фурановом кольце, а не в бензольном кольце. Однако 7-гидроксипроизводное 2,3-дигидробензофурана (также называемое кумараном) подвергается замещению в желаемом 6-м положении, что позволяет осуществить следующий синтез кумариновой системы через реакцию Гаттермана-Коха с последующей конденсацией Перкина с использованием уксусного ангидрида . Затем синтез завершается дегидрированием пятичленного кольца для получения фуранового кольца.
Псорален происходит из кумаринов в шикиматном пути; его биосинтез показан на рисунке ниже. Ароматическое кольцо в 6 активируется в орто-положении к гидроксильной группе и алкилируется 5, алкилирующим агентом . Диметилаллильная группа в 7 затем подвергается циклизации с фенольной группой, давая 8. Это превращение катализируется цитохром P-450-зависимой монооксигеназой17 (псорален 5-монооксигеназа), кофакторами ( НАДФН ) и молекулярным кислородом. [18]
Биосинтетический путь, в котором образуется псорален, показан на рисунке ниже. Второй P-450 -зависимый монооксигеназный фермент ( псораленсинтаза ) затем расщепляет 10 (в форме 11) от 8, чтобы получить 1. Этот путь не включает в себя какой-либо гидроксилированный промежуточный продукт, и расщепление, как постулируется, инициируется радикальной реакцией . [18]

Ficus carica (инжир) является, вероятно, самым распространенным источником псораленов. Они также встречаются в небольших количествах в Ammi visnaga (биснага), Pastinaca sativa (пастернак), Petroselinum crispum ( петрушка ), Levisticum officinale (любисток), Foeniculum vulgare (фрукты, т. е. семена фенхеля), Daucus carota (морковь), Psoralea corylifolia (бабчи), Apium graveolens (сельдерей), бергамотовое масло ( бергаптен , бергамоттин ). [19]
Лечение PUVA приводит к образованию как межцепочечных сшивок ДНК (ICL), так и моноаддуктов. ICL, вводимые псораленом, являются высокогенотоксичными для активно реплицирующихся клеток. Ковалентная связь препятствует прогрессированию репликативной вилки . Таким образом, необходимо расцепить ICL, прежде чем репликация сможет возобновиться. Начальные этапы восстановления обычно включают надрезы в одной родительской цепи по обе стороны от сшивки. [20] Впоследствии восстановление повреждения может происходить с помощью точного или неточного процесса.
Точный процесс восстановления сшивок — гомологичная рекомбинационная репарация (HRR). Она включает замену поврежденной информации с использованием неповрежденной информации из другой гомологичной хромосомы в той же клетке. Клетки Escherichia coli с дефицитом HRR очень чувствительны к PUVA по сравнению с клетками дикого типа. [21] HRR, по-видимому, эффективен. В E. coli , даже если одной или двух невосстановленных сшивок достаточно для инактивации клетки, клетка дикого типа может восстановить и, следовательно, восстановить от 53 до 71 сшивок псоралена. [21] В дрожжах Saccharomyces cerevisiae HRR является основным путем для точного удаления сшивок псоралена. [22] В дрожжах дикого типа события рекомбинации, связанные с удалением сшивок с помощью HRR, в основном являются событиями некроссоверной генной конверсии . Сшивки псоралена в вирусной ДНК также, по-видимому, удаляются в процессе рекомбинационной репарации, как это происходит в клетках, инфицированных вирусом SV40 [23] , и в клетках, инфицированных вирусом простого герпеса [24] .
Один неточный процесс восстановления сшивок псоралена, по-видимому, использует ДНК-полимеразу для заполнения пробела, образованного в цепи с двумя надрезами. Этот процесс неточен, поскольку комплементарная неразрезанная цепь все еще сохраняет часть сшивки и, таким образом, не может служить адекватной матрицей для точного синтеза восстановления. Неточный синтез восстановления может вызвать мутацию . Моноаддукты псоралена в цепи ДНК-матрицы также могут вызывать неточный обход репликации ( синтез транслезии ), который может привести к мутации. Было обнаружено, что в фаге T4 увеличение мутации, наблюдаемое после лечения PUVA, отражает синтез транслезии ДНК-полимеразой дикого типа, вероятно, из-за несовершенной возможности считывания корректуры.
Псоралены могут обратимо сшивать двойные спирали нуклеиновых кислот, и поэтому широко используются для анализа взаимодействий и структур как ДНК, так и РНК. [25] [26]